L'equilibrio chimico
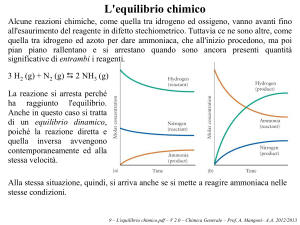
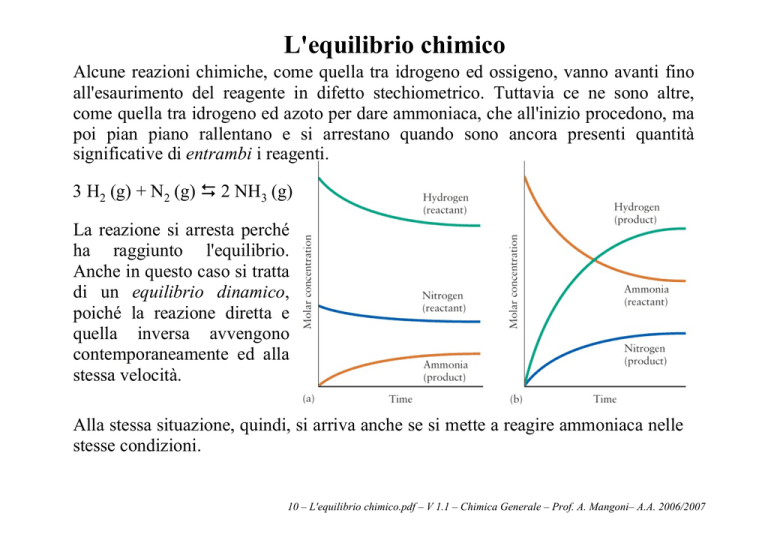
Alcune reazioni chimiche, come quella tra idrogeno ed ossigeno, vanno avanti fino
all'esaurimento del reagente in difetto stechiometrico. Tuttavia ce ne sono altre,
come quella tra idrogeno ed azoto per dare ammoniaca, che all'inizio procedono, ma
poi pian piano rallentano e si arrestano quando sono ancora presenti quantità
significative di entrambi i reagenti.
3 H2 (g) + N2 (g) ' 2 NH3 (g)
La reazione si arresta perché
ha raggiunto l'equilibrio.
Anche in questo caso si tratta
di un equilibrio dinamico,
poiché la reazione diretta e
quella inversa avvengono
contemporaneamente ed alla
stessa velocità.
Alla stessa situazione, quindi, si arriva anche se si mette a reagire ammoniaca nelle
stesse condizioni.
10 – L'equilibrio chimico.pdf – V 1.1 – Chimica Generale – Prof. A. Mangoni– A.A. 2006/2007
La legge di azione di massa e Kc
Anche se per una certa reazione chimica all'equilibrio sono possibili molte
composizioni diverse, esiste una equazione, detta legge di azione di massa, che è
sempre verificata quando il sistema è all'equilibrio.
Se consideriamo una generica reazione chimica in cui a moli del prodotto A e b moli
del prodotto B si trasformano in c moli del prodotto C e d moli del prodotto D:
aA+bB'cC+dD
possiamo definire il quoziente di reazione Q, come rapporto tra il prodotto delle
concentrazioni dei prodotti (ognuna elevata al suo coefficiente stechiometrico) ed il
prodotto tra dei reagenti (ognuna elevata al suo coefficiente stechiometrico). Se
indichiamo con [A] la concentrazione molare di A, possiamo scrivere:
[C ]c [ D]d
Q=
[ A]a [ B ]b
La legge di azione di massa dice che, se la reazione è all'equilibrio, si osserva che il
quoziente di reazione è sempre lo stesso, indipendentemente dalle concentrazioni dei
prodotti e dei reagenti. Questa costante è detta costante di equilibrio, ed indicata con
il simbolo Kc (l'indice c indica che stiamo usando le concentrazioni per descrivere la
composizione del sistema). Si ha quindi:
[C ]c [ D]d
Kc =
[ A]a [ B ]b
10 – L'equilibrio chimico.pdf – V 1.1 – Chimica Generale – Prof. A. Mangoni– A.A. 2006/2007
La costante Kp
Per equilibri in fase gassosa, la composizione della miscela all'equilibro di solito si
esprime in termini di pressioni parziali dei vari gas, invece che di concentrazioni
molari.
Poiché le pressioni parziali sono proporzionali al numero di moli, mentre il volume
del recipiente è costante, anche un quoziente di reazione del tipo:
Q=
c
d
a
b
pC p D
pA pB
è costante, ma il valore numerico della costante è diverso. In questo caso la costante
di equilibrio prende il nome di Kp:
Kp =
c
d
a
b
pC pD
pA pB
10 – L'equilibrio chimico.pdf – V 1.1 – Chimica Generale – Prof. A. Mangoni– A.A. 2006/2007
La costante di equilibrio termodinamica K
Se alcuni dei reagenti e prodotti sono in soluzione, e altri sono gas, conviene usare la
costante di equilibrio termodinamica, che si indica semplicemente con K.
Nell’espressione di K, per le sostanze in soluzione si indica la concentrazione
molare, e per le sostanze gassose la pressione parziale.
Per esempio per una reazione del tipo:
a A (g) + b B (aq) ' c C (aq) + d D (g)
la costante termodinamica K si scrive:
K =
[C]c pD
d
a
pA [B]b
Riassumendo
Kc: si usano sempre le concentrazioni
Kp: si usano sempre le pressioni parziali
K: si usano le concentrazioni delle specie in soluzione e le pressioni parziali per i gas.
In tutti i casi:
i prodotti vanno sopra la linea di frazione ed i reagenti sotto la linea di frazione
Ogni concentrazione (o pressione parziale) è elevata al coefficiente stechiometrico
della sostanza a cui si riferisce
10 – L'equilibrio chimico.pdf – V 1.1 – Chimica Generale – Prof. A. Mangoni– A.A. 2006/2007
Il significato della costante di equilibrio
La costante di equilibrio non dipende dalla concentrazione dei vari reagenti, ma varia
(anche di molto) con la temperatura.
Il valore della costante di equilibrio può variare moltissimo. In generale, quanto più
un equilibrio è spostato verso i prodotti, tanto più è grande la costante di equilibrio,
quanto più un equilibrio è spostato verso i reagenti, tanto più è piccola la costante di
equilibrio.
Per esempio, la reazione di formazione dell'acqua:
[ H 2 O ]2
Kc =
2 H2 + O2 ' 2 H2O
[ H 2 ]2 [ O 2 ]
ha una Kc maggiore di 1080. Ecco perché la reazione va avanti fino a che le
concentrazioni di H2 e/o O2 sono così basse da essere trascurabili.
È importante però notare che il valore numerico della costante di equilibrio dipende
dal modo in cui scriviamo la reazione. Per esempio, se scriviamo:
3 H2 + N2 ' 2 NH3
mentre se scriviamo:
6 H2 + 2 N2 ' 4 NH3
[ NH 3 ]2
Kc =
[H 2 ]3 [ N 2 ]
[ NH 3 ]4
Kc =
[H 2 ]6 [ N 2 ]2
cioè la costante di equilibrio è il quadrato della precedente.
10 – L'equilibrio chimico.pdf – V 1.1 – Chimica Generale – Prof. A. Mangoni– A.A. 2006/2007
Il significato della costante di equilibrio
Se una reazione è la somma di due reazioni, di cui conosciamo la costante di
equilibrio, qual è la costante di equilibrio della reazione totale?
Consideriamo la reazione (effettuata ad alta T, con reagenti e prodotti in fase gassosa):
Ktot
2 P (g) + 5 Cl2 (g) → 2 PCl5 (g)
che può essere considerata la somma di:
K1
2 P (g) + 3 Cl2 (g) → 2 PCl3 (g)
2×
PCl3 (g) + Cl2 (g) → PCl5 (g)
K2
La Ktot è:
2
K tot
2
2
⎛
⎞
[
PCl
]
[
PCl
]
[
PCl
]
5
3
5
⎜
⎟
= K1 ⋅ ( K 2 ) 2 =
⋅
=
[P]2 [Cl 2 ]3 ⎜⎝ [PCl 3 ] [Cl 2 ] ⎟⎠ [P]2 [Cl 2 ]5
cioè: la costante di equilibrio di una reazione che è la somma di due reazioni è pari al
prodotto delle costanti delle due reazioni.
Una ovvia, ma importante, osservazione è che la costante di equilibrio di una
reazione inversa è il reciproco della cotante di equilibrio della reazione diretta.
2
[
NH
]
3
3 H2 + N2 ' 2 NH3
K dir =
[H 2 ]3 [ N 2 ]
La costante della reazione inversa è:
[H 2 ]3 [ N 2 ]
2 NH3 + ' 3 H2 + N2
−1
K inv =
=
K
dir
perché abbiamo scambiato i reagenti con i prodotti.
[ NH 3 ]2
10 – L'equilibrio chimico.pdf – V 1.1 – Chimica Generale – Prof. A. Mangoni– A.A. 2006/2007
Equilibri eterogenei
Finora abbiamo considerato equilibri in cui tutti i reagenti erano nella stessa fase,
cioè equilibri omogenei.
D'altra parte esistono anche equilibri eterogenei, in cui uno dei reagenti o dei
prodotti è un solido o un liquido insolubile, e quindi forma una fase a sé. In questi
casi, la "concentrazione" del solido insolubile è costante, e può essere inglobata nella
costante di equilibrio: questo significa che il solido insolubile non compare nel
quoziente di reazione.
Se per esempio consideriamo l'equilibrio di dissoluzione di un sale poco solubile,
come Ca(OH)2:
Ca(OH)2 (s)' Ca2+ (aq) + 2 OH– (aq)
la costante di equilibrio è:
Kc = [Ca2+][OH–]2
cioè: i solidi e liquidi puri non compaiono nella espressione della Kc (e delle altre K)
Un'altra specie che non compare nella espressione della Kc è il solvente di una
soluzione diluita, nel caso in cui esso partecipi alla reazione. Questo perché la
concentrazione del solvente è di gran lunga maggiore di quella di tutti gli altri
reagenti, e rimane più o meno costante, per cui può essere inglobata nella Kc.
Per esempio per
HF (aq) + H2O (l) ' H3O+ (aq) + F– (aq)
[F − ][H 3O + ]
Kc =
la costante di equilibrio è:
[HF]
10 – L'equilibrio chimico.pdf – V 1.1 – Chimica Generale – Prof. A. Mangoni– A.A. 2006/2007
Uso della legge di azione di massa
La legge di azione di massa mette in relazione le concentrazioni di reagenti e
prodotti se il sistema è all'equilibrio.
L'uso più ovvio che si può fare della legge di azione di massa è di trovare la
concentrazione di un reagente o di un prodotto, se sono note le concentrazioni delle
altre specie all'equilibrio (e, lo ripetiamo, se è noto che il sistema è all'equilibrio).
Per esempio la reazione
N2 (g) + O2 (g) ' 2 NO (g) ha Kc = 3,4·10–21 a 800K.
Qual è la concentrazione di equilibrio di NO se la concentrazione molare di N2 è
3.75·10–2 M e quella di O2 = 1.25·10–2 M?
Visto che il sistema è all'equilibrio, è sufficiente applicare la legge di azione di
massa:
[ NO]2
Kc =
[ NO]2 = K c [ N 2 ][O 2 ]
[ NO] = K c [ N 2 ][O 2 ]
[ N 2 ][O 2 ]
Sostituendo i dati numerici si ha:
[NO] = 3.4 ⋅10 −21 ⋅ 3.75·10 –2 M ⋅1.25·10 –2 M = 1.594·10 –24 M 2 = 1.3·10 –12 M
La concentrazione di NO all'equilibrio è bassissima, come ci aspettavamo dal fatto
che la costante di equilibrio è molto piccola.
10 – L'equilibrio chimico.pdf – V 1.1 – Chimica Generale – Prof. A. Mangoni– A.A. 2006/2007
Uso della legge di azione di massa
La legge di azione di massa può anche essere usata per stabilire se il sistema è in
equilibrio, e in che direzione si muove un sistema non all'equilibrio.
Infatti se quoziente di reazione è uguale alla costante di equilibrio (Q = Kc) il sistema
è all'equilibrio;
se quoziente di reazione è minore della costante di equilibrio (Q < Kc) la reazione
procede verso i prodotti;
se quoziente di reazione è maggiore della costante di equilibrio (Q > Kc) la reazione
procede verso i reagenti.
Per esempio a 500 K si ha una miscela di H2, N2 e NH3 con [H2] = 3.0·10–3 M, [N2] =
1.0·10–3 M e [NH3] = 2.0·10–3 M. A questa temperatura si ha Kc = 68 M–2. Come
procede la reazione?
La reazione è:
3 H2 + N2 ' 2 NH3
Il quoziente di reazione è:
[ NH 3 ]2
(2.00 ⋅10 −2 M ) 2
5
−2
Q=
=
=
5
.
9
⋅
10
M
[H 2 ]3 [ N 2 ] (3.00 ⋅10 − 2 M ) 3 (1.00 ⋅10 − 2 M )
Il quoziente di reazione è molto maggiore di Kc e quindi la reazione va verso i
reagenti, e parte dell'ammoniaca si decompone per dare idrogeno ed azoto.
10 – L'equilibrio chimico.pdf – V 1.1 – Chimica Generale – Prof. A. Mangoni– A.A. 2006/2007
Problemi con più incognite
In molti casi ricavare le concentrazioni all'equilibrio è meno semplice, poiché non
sono note le concentrazioni di più di una delle specie coinvolte nella reazione.
Per esempio consideriamo la reazione di decomposizione di PCl5:
a 250 °C Kc = 1.8
PCl5 ' PCl3 + Cl2
Supponiamo di introdurre nel recipiente di reazione soltanto PCl5, con una
concentrazione iniziale (non concentrazione all'equilibrio!) di [PCl5] = 0,300 M.
All'equilibrio, parte di PCl5 si sarà decomposta in PCl3 e Cl2, ma non sappiamo
quanta, per cui non conosciamo nessuna delle concentrazioni all'equilibrio: [PCl5],
[PCl3] e [Cl2]. La legge di azione di massa:
[PCl 3 ][Cl 2 ]
Kc =
[PCl5 ]
non permette da sola di risolvere il problema, perché ci sono tre incognite (le tra
concentrazioni) e una sola equazione.
In realtà, le concentrazioni dei vari reagenti (o ancora meglio, le variazioni delle
concentrazioni dei reagenti) sono legate dai coefficienti stechiometrici: per ogni
mole di PCl5 che si consuma, si forma una mole di PCl3 ed una mole di Cl2.
Abbiamo quindi due equazioni in più (le relazioni stechiometriche) che ci
permettono di risolvere il problema.
10 – L'equilibrio chimico.pdf – V 1.1 – Chimica Generale – Prof. A. Mangoni– A.A. 2006/2007
Problemi con più incognite
In pratica si opera in questo modo. Innanzitutto si stabilisce in che direzione va la
reazione. Qui ovviamente va verso i prodotti, perché non abbiamo prodotti.
Non sappiamo di quanto diminuisce la concentrazione di PCl5, e questa diminuzione
è proprio la nostra incognita. Chiamiamo x la variazione di concentrazione di PCl5.
[PCl5]
[PCl3]
[Cl2]
All'inizio le concentrazioni sono:
0.300 M
0
0
Le variazioni che si hanno sono:
–x
+x
+x
Per cui all'equilibrio le concentrazioni sono:
0.300 – x
x
x
A questo punto si può scrivere la legge di azione di massa:
Kc =
[PCl 3 ][Cl 2 ]
[PCl5 ]
1.8 =
x⋅ x
0.300 − x
x 2 = 1.8 ⋅ (0.300 − x )
x 2 + 1.8 ⋅ x − 0.540 = 0
Questa è una equazione di secondo grado (che vale solo per questo esercizio!) che
può essere risolta e dà
x = 0.262
[PCl3] = 0.262
[Cl2] = 0.262
Per cui:
[PCl5]= 0.038
Questo procedimento è del tutto generale è può essere usato per tutti gli esercizi
sull'equilibrio. Però spesso le equazioni che si ottengono sono di terzo, quarto,
quinto,ecc. grado, e non sono facili da risolvere analiticamente (anche se i computer
le possono facilmente risolvere numericamente).
Per questo, quando è possibile, si usano delle approssimazioni.
10 – L'equilibrio chimico.pdf – V 1.1 – Chimica Generale – Prof. A. Mangoni– A.A. 2006/2007
Metodi approssimati
Consideriamo ancora la reazione tra idrogeno ed azoto:
3 H2 + N2 ' 2 NH3
Kc = 0.11
Supponiamo di introdurre nel recipiente concentrazioni [H2] = 0,020 M e [N2] =
0,010 M. Qual è la concentrazione di ammoniaca all'equilibrio?
In questo caso chiamiamo x la diminuzione di concentrazione di azoto (scegliamo
l'azoto perché ha coefficiente stechiometrico 1)
[N2]
[NH3]
[H2]
All'inizio le concentrazioni sono:
0.020 M
0.010 M
0
Le variazioni che si hanno sono:
–3x
–x
+2x
Per cui all'equilibrio le concentrazioni sono:
0.020 – 3x 0.010 – x
2x
La legge di azione di massa è in questo caso:
[NH 3 ]2
(2 x )2
=
Kc =
3
[H 2 ] [N 2 ] (0.020 − 3x )3 (0.010 − x )
che in questo caso è un'equazione di quarto grado. Però la costante di reazione è
piccola, e possiamo supporre che la quantità di ammoniaca che si forma sia piccoli.
Quindi possiamo supporre che l'incognita x sia trascurabile rispetto alle quantità
iniziali di idrogeno ed azoto.
Le concentrazioni approssimate sono:
0.020
0.010
2x
10 – L'equilibrio chimico.pdf – V 1.1 – Chimica Generale – Prof. A. Mangoni– A.A. 2006/2007
Metodi approssimati
[H2]
[N2]
Le concentrazioni approssimate sono:
0.020
0.010
e la legge di azione di massa diventa molto più semplice:
[NH 3 ]2
(2 x ) 2
2
3
=
Kc =
4
x
=
0
.
11
⋅
(0.020)
(0.010)
3
3
[H 2 ] [N 2 ] (0.020) (0.010)
[NH3]
2x
x = 4.69 ⋅10−5
Le concentrazioni all'equilibrio sono:
[H2] = 0.020–3·4.69·10–5=0.020; [N2] = 0.010–4.69·10–5=0.010; [NH3] = 9.38·10–5
Si vede che effettivamente le variazioni di concentrazione di idrogeno ed azoto sono
trascurabili.
Ogni volta che si utilizza una approssimazione di questo tipo, bisogna giustificare
il perché, e controllare alla fine dell'esercizio che la approssimazione fatta sia
giusta.
In generale, in una somma e in una differenza una grandezza può essere considerata
trascurabile se è al massimo il 5% dell'altra.
10 – L'equilibrio chimico.pdf – V 1.1 – Chimica Generale – Prof. A. Mangoni– A.A. 2006/2007
Equilibri chimici e principio di Le Chatelier
Cosa succede se abbiamo una reazione all'equilibrio, ed aggiungiamo un reagente?
Una risposta ci viene dal principio di Le Chatelier: il sistema tende ad opporsi
all'aumento di concentrazione di un reagente, e quindi dei reagenti si trasformano in
prodotti: l'equilibrio si sposta verso i prodotti. Detto in altro modo, se aggiungiamo
un reagente Q diventa minore di Kc e la reazione si muove quindi verso i prodotti.
Analogamente, se aggiungiamo un prodotto,
l'equilibrio si sposta verso i reagenti.
Se invece il prodotto è rimosso, l'equilibrio si
sposta verso i prodotti.
Questo ci fornisce un metodo per portare a
completamento le reazioni di equilibrio: se è
possibile allontanare uno dei prodotti man
mano che si forma (per distillazione,
precipitazione, e così via) allora la reazione si
sposterà sempre di più verso i prodotti, fino al
(quasi) totale completamento.
10 – L'equilibrio chimico.pdf – V 1.1 – Chimica Generale – Prof. A. Mangoni– A.A. 2006/2007
L'influenza della pressione
Il principio di Le Chatelier ci permette di prevedere anche l'influenza della pressione
sull'equilibrio. La pressione è importante se la reazione porta a variazioni di volume
della miscela, quindi (a) se la reazione è in fase gassosa e (b) se si ha variazione del
numero totale di moli dei reagenti e di quello dei prodotti.
A queste condizioni, il principio di Le Chatelier ci permette di prevedere che se la
reazione comporta una diminuzione del numero di moli, un aumento di pressione
favorisce i prodotti.
Infatti il sistema tende ad opporsi all'aumento di pressione, e può fare questo
diminuendo il numero di moli totale, cioè trasformando i reagenti in prodotti.
Per esempio nella reazione tra azoto e idrogeno:
3 H2 + N2 ' 2 NH3
Δn = –2, per cui per ottenere una buona resa di ammoniaca si utilizzano impianti in
cui la pressione è molto elevata (circa 250 atm).
10 – L'equilibrio chimico.pdf – V 1.1 – Chimica Generale – Prof. A. Mangoni– A.A. 2006/2007
L'influenza della temperatura
Ogni volta che abbiamo fornito una costante di equilibrio, abbiamo specificato la
temperatura. Infatti la costante di equilibrio dipende fortemente dalla temperatura.
Come varia la costante di equilibrio con la temperatura? Dipende dalla entalpia di
reazione ΔH, cioè da se la reazione è esotermica (ΔH < 0) o endotermica (ΔH > 0).
Per una reazione esotermica, la costante di equilibrio diminuisce all'aumentare
della temperatura.
Per una reazione endotermica, la costante di equilibrio aumenta all'aumentare
della temperatura.
Infatti, se aumentiamo la temperatura, l'equilibrio si sposta in maniera da ridurla, e
questo è possibile se viene assorbito calore; per una reazione esotermica, questo
significa che i prodotti vengono trasformati in reagenti, ossia l'equilibrio si sposta
verso i reagenti e la costante di equilibrio diminuisce.
In termini termodinamici, una reazione è all'equilibrio se
ΔG = 0
scomponendo l'energia libera nei suoi componenti si ha
ΔH – T ΔS = 0
In una reazione esotermica, ΔH < 0 e quindi (–T·ΔS) > 0; se la temperatura sale,
aumenta l'importanza di questo termine, e ΔG diventa > 0: la reazione si muove
verso i reagenti.
10 – L'equilibrio chimico.pdf – V 1.1 – Chimica Generale – Prof. A. Mangoni– A.A. 2006/2007
Costante di equilibrio e grandezze termodinamiche
Abbiamo già detto che in una reazione chimica si ha equilibrio quando la variazione
di energia libera in seguito alla reazione è nulla:
ΔG = 0
Il ΔG di una reazione dipende dalla concentrazione dei reagenti (altrimenti non
potrebbe mai essere < 0 all'inizio, quando la reazione procede, e diventare 0
all'equilibrio).
Abbiamo anche detto che per ogni reazione può essere calcolato il ΔG°, riferito alle
condizioni standard di ogni reagente, che ci dice se la reazione è spontanea o no.
Che relazione c'è tra il ΔG ed il ΔG°? Si può dimostrare che:
ΔG = ΔG° + RT lnQ
All'equilibrio, ΔG = 0 e Q = K, per cui questa relazione diventa:
ΔG° = – RT lnK
Questa equazione dimostra che, quanto più diminuisce l'energia libera standard in
una reazione, tanto maggiore è la costante di equilibrio della reazione.
L'equazione può essere usata per calcolare un costante di equilibrio da dati
termodinamici.
La K che si ottiene da questi calcoli si riferisce ad un quoziente di reazione in cui
appaiono le concentrazioni molari delle specie in soluzione, e le pressioni parziali
delle specie gassose.
10 – L'equilibrio chimico.pdf – V 1.1 – Chimica Generale – Prof. A. Mangoni– A.A. 2006/2007