EMA/394725/2015
EMEA/H/C/000943
Riassunto destinato al pubblico
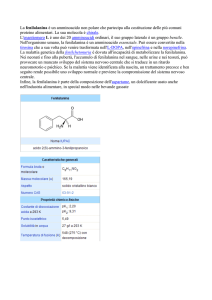
Kuvan
sapropterina dicloridrato
Questo è il riassunto della relazione pubblica europea di valutazione (EPAR) per Kuvan. Illustra il modo
in cui il comitato per i medicinali per uso umano (CHMP) ha valutato il medicinale ed è giunto a
formulare un parere favorevole al rilascio dell’autorizzazione all’immissione in commercio nonché le
raccomandazioni sulle condizioni d’uso di Kuvan.
Che cos’è Kuvan?
Kuvan è un medicinale contenente il principio attivo sapropterina dicloridrato. È disponibile in
compresse solubili (da 100 mg).
Per che cosa si usa Kuvan?
Kuvan è utilizzato per il trattamento di alti livelli di fenilalanina nel sangue in adulti e bambini di tutte
le età che presentano i disturbi genetici fenilchetonuria (PKU) o carenza di tetraidrobiopterina (BH4).
I pazienti con questi disturbi non possono elaborare l'amminoacido fenilalanina dalle proteine
alimentari, e di conseguenza l'amminoacido si accumula nel sangue a livelli più elevati del normale,
causando problemi nel sistema nervoso.
Poiché il numero di pazienti affetti da condizioni che causano elevati livelli di fenilalanina è basso,
queste sono considerate rare e Kuvan è stato qualificato come “medicinale orfano” (ossia un
medicinale usato nelle malattie rare) l'8 giugno 2004.
Il medicinale può essere ottenuto soltanto con prescrizione medica.
Come si usa Kuvan?
La terapia con Kuvan deve essere avviata e tenuta sotto controllo da un medico esperto nel
trattamento della PKU e della carenza di BH4. È importante che i pazienti continuino con una dieta
povera in fenilalanina e proteine quando assumono Kuvan, e l'assunzione di fenilalanina e proteine
30 Churchill Place ● Canary Wharf ● London E14 5EU ● United Kingdom
Telephone +44 (0)20 3660 6000 Facsimile +44 (0)20 3660 5555
Send a question via our website www.ema.europa.eu/contact
An agency of the European
Union
© European Medicines Agency, 2015. Reproduction is authorised provided the source is acknowledged.
deve essere monitorata e adeguata per assicurare che i livelli di fenilalanina nel sangue e l'equilibrio
nutrizionale siano controllati. Kuvan è indicato per l’impiego a lungo termine.
La dose di Kuvan dipende dal peso del paziente. Kuvan deve essere assunto in concomitanza di un
pasto ogni giorno alla stessa ora, di preferenza al mattino. Le compresse vanno sciolte in acqua prima
che il paziente beva la soluzione. Per alcuni pazienti con carenza di BH4, potrebbe essere necessario
ripartire il dosaggio su due o tre assunzioni nell’arco della giornata, per ottenere l'effetto migliore.
Per risposta soddisfacente s’intende una riduzione dei livelli di fenilalanina nel sangue di almeno il 30%
oppure ad un livello stabilito dal medico. Se trascorso un mese si ottiene questo risultato, il paziente
viene classificato come “responsivo” e può proseguire nell’assunzione di Kuvan.
Come agisce Kuvan?
Gli alti livelli di fenilalanina nel sangue dipendono da un problema di conversione della fenilalanina in
tirosina da parte dell’enzima “fenilalanina idrossilasi”. I pazienti con PKU hanno una versione difettosa
dell’enzima e i pazienti con carenza di BH4 hanno bassi livelli di BH4, un “cofattore” che serve
all’enzima per funzionare correttamente.
Il principio attivo di Kuvan, sapropterina dicloridrato, è una copia sintetica del BH4. Nella PKU, agisce
potenziando l’attività dell’enzima difettoso, mentre nella carenza di BH4 sostituisce il cofattore
mancante. Queste azioni contribuiscono a ripristinare la capacità dell’enzima di convertire la
fenilalanina in tirosina, riducendo i livelli di fenilalanina nel sangue.
Quali studi sono stati effettuati su Kuvan?
Nel trattamento con PKU, uno studio principale ha confrontato le riduzioni nella fenilalanina nel sangue
in 88 pazienti trattati con Kuvan o placebo (un trattamento fittizio). Due ulteriori studi effettuati in 101
pazienti hanno esaminato i livelli di efficacia di Kuvan nel permettere ai pazienti di consumare alimenti
contenenti fenilalanina mantenendo allo stesso tempo la fenilalanina nel sangue a livelli obiettivo
(ovverosia tolleranza alla fenilalanina).
Per il trattamento della carenza di BH4, una condizione che si verifica assai raramente, la ditta ha
presentato i risultati di tre studi tratti dalla letteratura pubblicata in cui alcuni pazienti sono stati
trattati con sapropterina per una media di 15,5 mesi.
Gli studi con Kuvan hanno coinvolto adulti e bambini di tutte le età
Quali benefici ha mostrato Kuvan nel corso degli studi?
Kuvan è stato più efficace rispetto al placebo nel ridurre i livelli di fenilalanina nei pazienti affetti da
PKU, ottenendo una riduzione di 236 micromoli per litro dopo 6 settimane rispetto a un incremento di 3
micromoli per litro riscontrato con il placebo.
In aggiunta, Kuvan ha consentito ai pazienti affetti da PKU non soggetti a regime dietetico
d'incrementare l'assunzione giornaliera di fenilalanina di 17,5 mg per kg di peso corporeo dopo 10
settimane rispetto ai 3,3 mg/kg con il placebo. Quando Kuvan abbinato al regime dietetico è stato
confrontato con il regime dietetico da solo, l'assunzione media giornaliera di fenilalanina tollerata dopo
26 settimane era di 81 mg/kg nel gruppo trattato con Kuvan e di 50 mg/kg nel gruppo soggetto
esclusivamente al regime dietetico.
Negli studi sui pazienti con carenza di BH4, questi ultimi mostravano un miglioramento dei livelli di
fenilalanina nel sangue e di altri indicatori della malattia quando assumevano sapropterina dicloridrato.
Qual è il rischio associato a Kuvan?
Gli effetti indesiderati più comuni di Kuvan (osservato in più di un paziente su 10) sono mal di testa e
rinorrea (naso che cola). Per l’elenco completo degli effetti indesiderati rilevati con Kuvan, vedere il
foglio illustrativo.
Perché è stato approvato Kuvan?
Il CHMP ha deciso che i benefici di Kuvan sono superiori ai suoi rischi e ha raccomandato il rilascio
dell’autorizzazione all’immissione in commercio per il medicinale.
Quali sono le misure prese per garantire l’uso sicuro ed efficace di Kuvan?
È stato elaborato un piano di gestione dei rischi per garantire che Kuvan sia usato nel modo più sicuro
possibile. In base a tale piano, al riassunto delle caratteristiche del prodotto e al foglio illustrativo di
Kuvan sono state aggiunte le informazioni relative alla sicurezza, ivi comprese le opportune precauzioni
che gli operatori sanitari e i pazienti devono prendere.
Altre informazioni su Kuvan
Il 2 dicembre 2008 la Commissione europea ha rilasciato un’autorizzazione all’immissione in
commercio per Kuvan, valida in tutta l’Unione europea.
Il riassunto del parere del comitato per i medicinali orfani relativo a Kuvan è disponibile sul sito web
dell’Agenzia: ema.europa.eu/Find medicine/Human medicines/Rare disease designation.
Per la versione completa dell’EPAR di Kuvan, consultare il sito web dell’Agenzia: ema.europa.eu/Find
medicine/Human medicines/European Public Assessment Reports. Per maggiori informazioni sulla
terapia con Kuvan, leggere il foglio illustrativo (accluso all’EPAR) oppure consultare il medico o il
farmacista.
Ultimo aggiornamento di questo riassunto: 06-2015.