Fisica II- Chimica
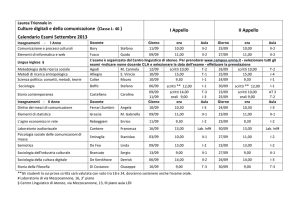
Tabella periodica degli elementi
Perchè ha questa forma ?
Ovvero, esiste una regola per l’ordinamento dei singoli atomi ?
Le proprietà dei materiali hanno una relazione con la tabella ?
L’applicazione dei modelli quantistici ha fornito le risposte !
Fisica II- Chimica
Evidenze sperimentali: Elettroni
• Raggi Catodici
• J.J.Thomson
– esperimento e/m
Fisica II- Chimica
Esperimento di Millikan della goccia d’olio
• Misura carica elettrone
or X-ray
Fisica II- Chimica
Modello atomico di Thomson
Fisica II- Chimica
Esperimento di Rutherford
Diffusione di atomi di He++ (particelle alfa) da una lamina d’oro. La maggior
parte la attraversano indisturbati, alcuni (pochi) vengono retrodiffusi !
Ipotesi: l’atomo è per la maggior parte spazio vuoto con un piccolo (r = 10-15 m)
nucleo carico positivamente circondato da una nuvola di elettroni (r = 10-10 m)
Fisica II- Chimica
Modello Atomico di Rutherford
grandi angoli diffusione
atomo nucleare
• L’atomo nucleare non è stabile
(classicamente)
• Gli elettroni dovrebbero irraggiare
(acc. centripeta) perdendo energia e
con un moto a spirale decadere sul
nucleo !!!
Necessità teoria quantistica
Gli elettroni devono orbitare intorno al nucleo con energie
costanti e discrete (quantizzate) !
Fisica II- Chimica
Spettri di Emissione
• Applichiamo una d.d.p ad un gas a bassa pressione (scarica elettrica)
• Il gas emette una luce caratteristica (dipende dal tipo di gas)
• L’analisi spettroscopica mostra una serie di righe luminose discrete
Serie
Balmer
Serie
Lyman
Spettro
Assorbimento
Fisica II- Chimica
Spettro di Emissione dell’Idrogeno
• Le lunghezze d’onda delle righe spettrali dell’idrogeno sono date da
RH è la costante di Rydberg
RH = 1.0973732 x 107 m-1
ni è un intero, n = 1, 2, 3, …
Le diverse righe spettrali corrispondono a differenti valori di ni
Fisica II- Chimica
Righe spettrali dell’idrogeno
• La serie di Balmer presenta
righe le cui lunghezze d’onda
sono date dall’equazione
• Esempi di righe spettrali
– n = 3, l = 656.3 nm
– n = 4, l = 486.1 nm
Fisica II- Chimica
Spettri a righe
Gli elementi emettono un insieme discreto di lunghezze
d’onda che vengono viste come righe in uno spettroscopio.
(esperimenti in cui luce proveniente da sorgenti atomiche è
fatta passare attraverso un prisma).
Le misure effettuate nel caso dell’idrogeno seguono la
relazione:
R = 1.097 x 107 /m
serie di Lyman
n=3
n=2
Usando E=hc/l
E=-3.4 eV
Gli elettroni “saltano” tra livelli di
energia quantizzati.
Fisica II- Chimica
E=-13.6 eV
n=1
Modello di Bohr
• Modello planetario
(elettroni orbitano intorno al nucleo, ma
non irradiano energia)
• La forza di attrazione Coulombiana produce
l’accelerazione centripeta.
– Ciò definisce l’energia (raggio) di ciascuna orbita permessa.
• Le righe spettrali ci dicono quali raggi orbitali
sono permessi.
– Il calcolo mostra che questo è equivalente a “quantizzare” il
momento angolare L = mvr = n h / 2p
Fisica II- Chimica
Modello di Bohr:
assorbimento ed emissione di fotoni
• Ciascun elettrone che orbita intorno al nucleo
possiede una specifica energia En=-13.6/n2
• Un fotone viene emesso quando un elettrone
“salta” da un’orbita ad alta energia ad una a più
bassa energia.
Ei – Ef = h f
• Per converso, un fotone viene assorbito quando un
elettrone “salta” da un’orbita ad bassa energia ad
una a più alta energia.
Ef – Ei = h f
Fisica II- Chimica
Dualismo Onda-Particella di DeBroglie
• Orbite intese come onde stazionarie
Fisica II- Chimica
Dualismo Onda-Particella di DeBroglie
Fisica II- Chimica
Calcolo di Bohr
Moto circolare
Energia totale
Quantizzazione del
momento angolare :
Fisica II- Chimica
Calcolo di Bohr
Usando
in
raggio di Bohr
Sostituendo per rn in
Notare che E (quantizzata)
dipende da Z2 e non da Z !!!
Fisica II- Chimica
Risultati/Limiti del Modello di Bohr
• Bohr ottiene i corretti valori di energia dei livelli
ed anche del raggio dell’atomo di idrogeno.
• Spiega lo spettro (emiss./assorb.) dell’idrogeno
• Tuttavia, non funziona per atomi a più elettroni
– Nemmeno per He con “solo” 2 elettroni
• Il modello di Bohr viola il principio di
indeterminazione di Heisenberg?
» Sì
» No
Il modello di Bohr è semi-classico, non si possono
specificare contemporaneamente il raggio e
l’energia
Fisica II- Chimica
Classificazione elementi (Raggi X)
Legge di Moseley
Fisica II- Chimica
Teoria di Schrödinger
Funzione d’onda - Probabilità
Fisica II- Chimica
Quiz
• Quale dei due disegni è più corretto ?
– Sinistro
– Destro
Fisica II- Chimica
Equazione di Schrödinger
• Tale eq. differenziale ha, in meccanica quantistica, la stessa funzione
svolta dalla II legge della dinamica (F=ma) nella meccanica classica
• Noto U e Y si ricava E l’energia, cioè lo stato dinamico del sistema.
Fisica II- Chimica
Atomo di Idrogeno (teoria di Schrödinger)
• Il problema è di tipo tridimensionale, U non è costante ma dipende solo
dalla coordinata radiale r (richiede l’uso di coordinate sferiche).
• Risolvendo si ottengono i valori dell’energia degli stati permessi per
l’atomo di idrogeno
• n = numero quantico principale
• L’imposizione delle condizioni al contorno conduce a due nuovi numeri
quantici: ℓ numero quantico orbitale, mℓ numero quantico magnetico
orbitale.
Fisica II- Chimica
Regole Quantiche
La soluzione dell’eq. di Schrodinger per l’atomo di idrogeno
determina queste regole.
Fisica II- Chimica
Visualizzazione di effetti quantistici
Microscopia a scansione ad effetto tunnel
(Binnig e Rohrer, premio Nobel in Fisica
1985)
Fisica II - Chimica
Visualizzazione di effetti quantistici
1
2
3
4
atomi di Fe su superficie
di Cu cristallino
Fisica II - Chimica
Visualizzazione di effetti quantistici
Fisica II - Chimica
Effetto Zeeman
Effetto di un campo magnetico sui livelli elettronici
Fisica II- Chimica
Effetto Zeeman
Le righe spettrali si separano quando gli atomi sono soggetti ad un
campo magnetico. La separazione tra le righe è proporzionale
all’intensità del campo.
Alcune non si separano, altre si
dividono in 3, altre ancora in 5 !
Fisica II- Chimica
La proporzionalità tra
la separazione e B
implica l’interazione con
una carica in moto:
Momento angolare.
Effetto Zeeman - Momento Angolare
Fisica II- Chimica
Spin Elettronico
• Lo spin elettronico è un secondo tipo di momento angolare nell’atomo.
• Lo spin, detto momento angolare intrinseco, ha un momento magnetico
associato con esso.
• Questo momento magnetico interagisce col campo magnetico atomico e
dà un contributo all’energia dell’elettrone.
atomi Ag
Fisica II- Chimica
Spin Elettronico
Stern e Gerlach: campo magnetico disuniforme
Una possibile (ma
sbagliata) visualizzazione
del fenomeno è pensare
l’elettrone rotante su se
stesso (trottola spin)
Fisica II- Chimica
Spin Elettronico: quantizzazione
Fisica II- Chimica
In definitiva:
Numeri Quantici
Ciascun elettrone nell’atomo è identificato da 4 numeri quantici
n = Numero quantico principale (1, 2, 3, …)
•
Determina l’energia (Bohr)
l = Numero quantico orbitale (0, 1, 2, … n-1)
•
•
Determina il momento angolare
sempre vero !
l <n
ml = Numero quantico magnetico (-l , … 0, … l )
• Componente di l
• | ml | l
sempre vero !
ms = Numero quantico di spin (-½ , +½)
Fisica II- Chimica
•
“Spin Su” o “Spin Giù”
Nomenclatura
“Shells”
(strati)
“Subshells”
(sottostrati)
l =0 “stato s”
n=1 “K shell”
l =1
l =2
l =3
l =4
n=2 “L shell”
n=3 “M shell”
n=4 “N shell”
n=5 “O shell”
“stato p”
“stato d”
“stato f”
“stato g”
1 elettrone nello stato fondamentale dell’idrogeno:
n=1, l =0 si scrive come: 1s1
n=1
Fisica II- Chimica
l =0
1 elettrone
Numeri Quantici
Quanti stati elettronici unici esistono per n=2 ?
l = 0 : 2s2
ml = 0 : ms = ½ , -½
2 stati
l = 1 : 2p6
ml = +1: ms = ½ , -½
ml = 0: ms = ½ , -½
ml = -1: ms = ½ , -½
2 stati
2 stati
2 stati
Vi sono un totale di 8 stati con n=2
Fisica II- Chimica
Principio di Esclusione di Pauli
In un atomo a molti elettroni non possono esistere
due elettroni con lo stesso insieme di numeri
quantici (n, l, ml, ms).
Questa è la spiegazione della
tabella periodica !
Fisica II- Chimica
Configurazioni Elettroniche
Atomo
Configurazione
H
1s1
He
1s2
Li
1s22s1
Be
1s22s2
B
1s22s22p1
shell 1s piena (n=1 shell piena, gas
nobile)
shell 2s piena
etc
Ne
1s22s22p6 2p shell piena (n=2 shell piena,
gas nobile)
shells s ospitano fino a 2 elettroni
Fisica II- Chimica
shells p ospitano fino a 6 elettroni
Sequenza degli Strati (Shell)
Sequenza delle shell: 1s,2s,2p,3s,3p,4s,3d,4p…..
gli elettroni 4s sono più
vicini al nucleo dei 3d
19 20 21 22 23 24 25 26 27 28 29 30
K Ca Sc Ti V Cr Mn Fe Co Ni Cu Zn
4s
3d
4p
Nella shell 3d inseriamo elettroni nello stato l = 2; tutti gli atomi
con circa metà riempimento sono fortemente magnetici.
Momento
angolare
Fisica II- Chimica
Spira percorsa
da corrente
Grandi
momenti
magnetici
Sodio
(Na)
1s22s22p6 3s1
Na
Singolo elettrone
esterno
core tipo Neon
Molte righe spettrali del Na sono dovute
alle transizioni dell’elettrone esterno
La riga gialla della scarica in vapori di
Na è dovuta a
3p
Fisica II- Chimica
3s
Sodio
(Na)
La riga gialla della scarica in vapori di
Na è dovuta a
3p
Fisica II- Chimica
3s
Energia di ionizzazione degli elementi
Fisica II- Chimica
Tabella periodica degli elementi
Fisica II- Chimica