Nobel nel 1974
JAMIESON
e
PALADE
Incubazione “PULSE-CHASE” di pezzi di tessuto pancreatico in solux.
contenente AA radioattivi. Gli AA venivano assimilati e incorporati
a
James
George
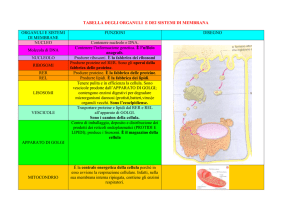
Reticolo endoplasmatico liscio (SER)
CELLULE DI LEYDIG
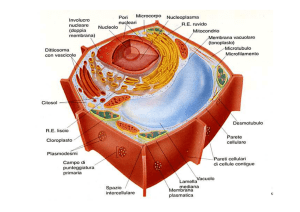
Il Reticolo Endoplasmatico
Liscio svolge funzioni diverse:
•
EPATOCITI
Sintesi Lipidica (Fosfolipidi e Colesterolo)
[produzione di acidi grassi - ormoni
steroidei (nelle gonadi e nel surrene)].
La fosfatidilcolina è il principale fosfolipide
sintetizzato nel SER attraverso 3 tappe
catalizzate da enzimi specifici: AciltransferasiÆ condensa l’acido grasso+ il
glicerolo monofosfato per formare l’acido
fosfatidico che reagisce come substrato per
l’enzima successivo e così via.
La BIOSINTESI LIPIDICA è ASIMMETRICA (monostrato)
Il riequilibrio avviene attraverso FLIP-FLOP (in parte) ma è
sicuramente dovuto ad una specifica proteina di trasporto
(lo spostamento è 100.000 volte+rapido del FLIP FLOP)
Reticolo endoplasmatico liscio
•
Detossificazione nel fegato (barbiturici-etanolo) mediante enzimi che trasferiscono
O2 (OSSIGENASI) (P450s), il benzo[α]pirene (carne alla griglia) è inoffensivo, in
seguito ad enzimi detossificanti viene convertito in un potente carcinogeno.
•
Sequestro di ioni Ca++ all’interno delle cisterne. Il suo rilascio viene regolato in
particolari circostanze (nel tessuto muscolare, una porzione speciale del SER
[reticolo sarcoplasmatico], contrazione delle cellule muscolari).
•
Metabolismo dei carboidrati (Accumulo di glicogeno negli epatociti).
Il Citocromo P450 è una proteina che utilizza gli e- ricevuti da NADPH per aggiungere gruppi –OH agli
idrocarburi non idrosolubili e potenzialmente dannosi (DETOSSIFICAZIONE), rendendoli + idrosolubili
in modo da allontanarli.
1
Reticolo Endoplasmatico Rugoso
I ribosomi liberi e quelli legati al RER producono
proteine con destinazione differente
Ribosomi liberi
Ribosomi associati al
reticolo endoplasmatico
GLICOSILAZIONE (RER)
•
•
•
•
•
Citoplasma
Nucleo
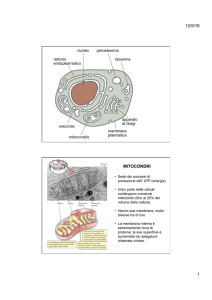
Mitocondri
Perossisomi
Proteine di membrane e proteine
secretorie
Si
li
tt
3f i
I monosaccaridi si legano a
nucleosidi di-fosfato UDP o
GDP che si legano a loro
volta ad un VETTORE
LIPIDICO presente nella
membrana
del
reticolo
(DOLICOL-FOSFATO).
Per successiva inversione del
dolicolo
l’oligosaccaride
viene trasferito nel versante
luminale.
mRNA codificante per una proteina citosolica che resta
libera nel citosol
Poliribosoma libero nel citosol
Subunità ribosomiche libere nel citosol
(Comuni)
mRNA codificante una proteina
destinata al RER
Sequenza
segnale per il
RER
Poliribosoma legato al RER da catene
polipeptidiche in allungamento e in traslocazione
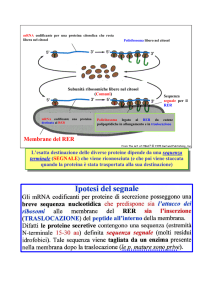
Membrane del RER
L’esatta destinazione delle diverse proteine dipende da una sequenza
terminale (SEGNALE) che viene riconosciuta (e che poi viene staccata
quando la proteina è stata trasportata alla sua destinazione)
SRP
S
l
S
segnalasi
SRP: regione 1) lega il ribosoma e ferma la sintesi proteica; 2) lega il peptide segnale; 3)
lega il recettore della SRP sulla membrana dell’ER. Contiene anche un sito che lega GTP.
Traslocazione nell’ER delle proteine di secrezione o di membrana
La particella di riconoscimento del segnale (SRP) fa la spola fra la membrana dell’ER e il citosol.
L’SRP riconosce il peptide segnale sulla proteina di nuova sintesi appena emerge dal ribosoma, ci si lega e
causa una pausa nella sintesi proteica, che permette al ribosoma di ancorarsi sulla membrana dell’ER.
Dirige il peptide ad un recettore SRP specifico, che insieme ad un traslocatore proteico trasferisce la
catena in crescita attraverso la membrana (cotraduzionale).
Occorre idrolisi di ATP per la traslocazione. L’energia della sintesi proteica può essere usata per forzare
la catena nel canale formato dal traslocatore nella membrana dell’ER.
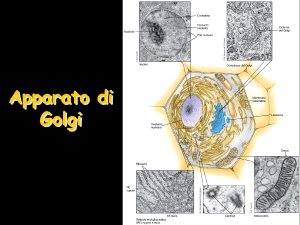
•Costituito
da una o più
pile di cisterne
appiattite
•La
parte marginale delle
cisterne è più dilatata
ed è circondata da
vescicole.
•Ogni
pila di cisterne
presenta una faccia cis
(lato d’entrata) convessa
i i
l RER
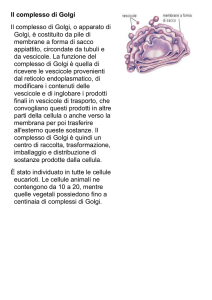
L’apparato del Golgi
Molte vescicole dopo aver lasciato il RER
migrano verso l’ Apparato del Golgi
Principali funzioni:
Vigile e
postino
1. Gli enzimi del Golgi portano a maturazione alcune
proteine (i precursori vengono convertiti in forme
attive: INSULINA, GLUCACONE).
2. Presenza di una pompa H+-ATPasi che abbassa il pH interno
delle cisterne della faccia trans (lisosomi).
3. Dirige il TRAFFICO di macromolecole nella cellula.
4. E’ sede di sintesi dei polisaccaridi complessi
GLICOSILAZIONE POST-TRADUZIONALE
Il passaggio nel GOLGI determina modificazione dei carboidrati
precedentemente aggiunti nel RER. Si modifica l’oligosaccaride
legato all’ASPARAGINA (aggiunto cotraduzionalmente) grazie a
degli enzimi specifici: le “GALATTOSILTRANSFERASI” e le
“MANNOSIDASI”. 3 tipi di galattosiltransferasi agiscono in
successione
aggiungendo
3
monosaccaridi
terminali:
N-ACETILGLUCOSAMMINA-GALATTOSIO-ACIDO SIALICO*
*unico monosaccaride a possedere una carica elettrica negativa,
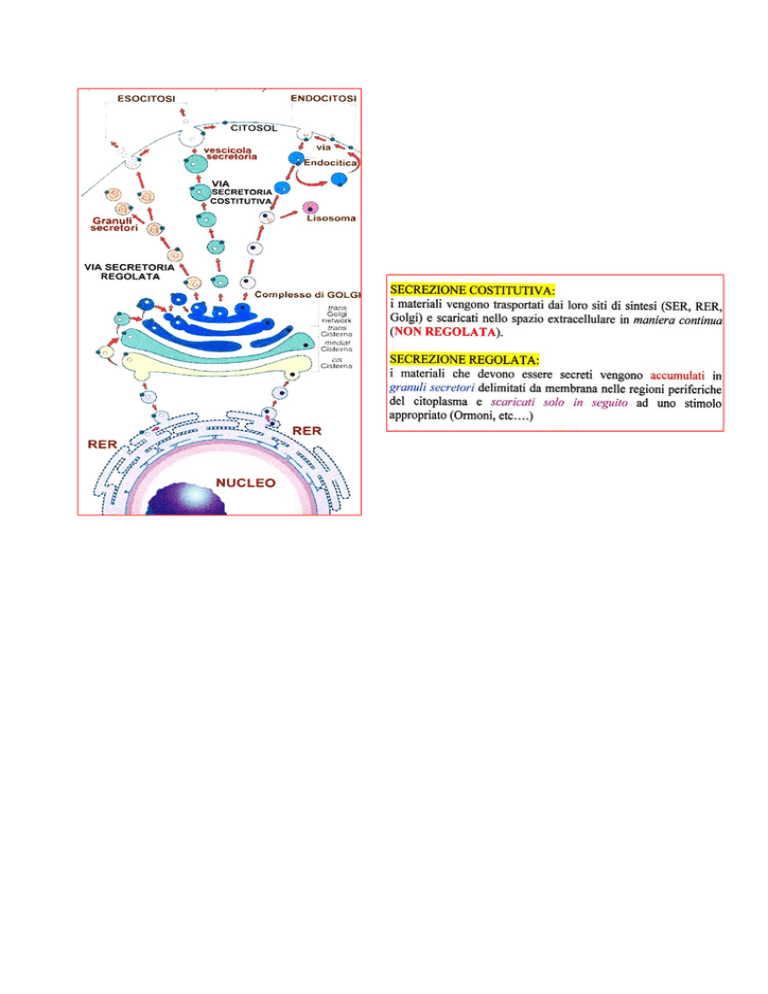
Il TGN (trans Golgi Network) è fonte di 2 tipi di vescicole:
1. Vescicole “non selettive” (non ricoperte da Clatrina ma da COP) che trasportano
materiali (collagene, fibronectina etc..) e che sono continuamente secrete dalla
cellula. SECREZIONE COSTITUTIVA
2.
Vescicole “selettive” (ricoperte da Clatrina non da COP) che trasportano materiali
specifici in maniera regolata. SECREZIONE REGOLATA
AP-2
Endocitosi
CLATRINA
AP-1
Esocitosi
Anterogrado
AssemblaggioÆARF+GTP
DisassemblaggioÆARF+GDP
Retrogrado
Segnale posto all’estremità C-Terminale che trattiene le proteine nel RER (es.
Chaperonine per il, folding delle proteine). Eliminando il segnale le proteine vengono
secrete, inserendo KDEL alle proteine di secrezione queste restano nel RER.
Usando BREFELDINA A
un composto fungino, viene
inibito il movimento
anterogrado. Questo porta
alla lenta scomparsa del
GOLGI perché le sue
membrane tornano al RER
grazie al movimento
retrogrado (essendo
impedito il traffico di
membrana inverso dal
RER ÆGolgi)
Recettori KDEL
Movimento anterogrado
INIBIZIONE
Brefeldina A
COP I
Vescicole rivestite
COP II
Movimento retrogrado
Vescicole rivestite
COP I
Proteine del RER
LISOSOMI
Pompe H+
Le idrolasi lisosomiali sono caratterizzate dalla presenza di un gruppo specifico, il mannosio6-fosfato (M6P), che serve a farle riconoscere da un recettore specifico presente sul transGolgi.
L’M6P è aggiunto agli oligosaccaridi legati all’asparagina, nel reticolo cis del Golgi.
Il recettore è una proteina transmembrana localizzata sul trans Golgi. L’unione con l’idrolasi
inizia la formazione di vescicole e si verifica a pH 7. Le idrolasi si dissociano dai recettori negli
endosomi tardivi a pH più bassi.
I recettori sono riciclati verso il trans Golgi