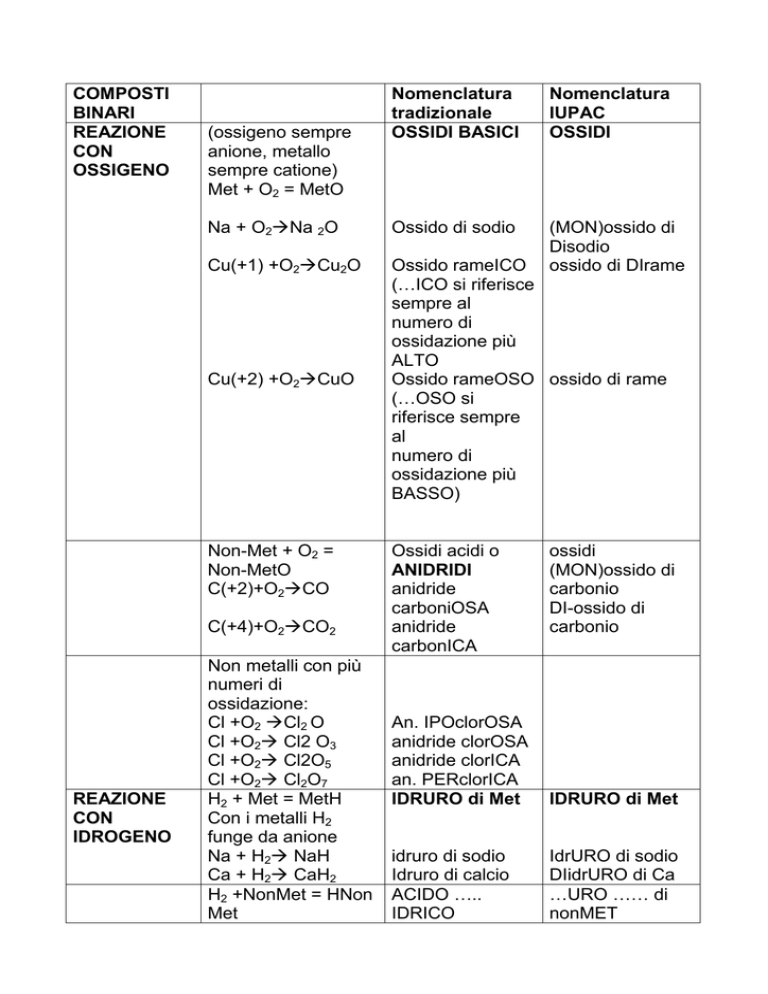
COMPOSTI
BINARI
REAZIONE
CON
OSSIGENO
Nomenclatura
tradizionale
OSSIDI BASICI
Nomenclatura
IUPAC
OSSIDI
Na + O2Na 2O
Ossido di sodio
Cu(+1) +O2Cu2O
(MON)ossido di
Disodio
ossido di DIrame
Ossido rameICO
(…ICO si riferisce
sempre al
numero di
ossidazione più
ALTO
Ossido rameOSO ossido di rame
(…OSO si
riferisce sempre
al
numero di
ossidazione più
BASSO)
(ossigeno sempre
anione, metallo
sempre catione)
Met + O2 = MetO
Cu(+2) +O2CuO
Non-Met + O2 =
Non-MetO
C(+2)+O2CO
C(+4)+O2CO2
REAZIONE
CON
IDROGENO
Non metalli con più
numeri di
ossidazione:
Cl +O2 Cl2 O
Cl +O2 Cl2 O3
Cl +O2 Cl2O5
Cl +O2 Cl2O7
H2 + Met = MetH
Con i metalli H2
funge da anione
Na + H2 NaH
Ca + H2 CaH2
H2 +NonMet = HNon
Met
Ossidi acidi o
ANIDRIDI
anidride
carboniOSA
anidride
carbonICA
ossidi
(MON)ossido di
carbonio
DI-ossido di
carbonio
An. IPOclorOSA
anidride clorOSA
anidride clorICA
an. PERclorICA
IDRURO di Met
IDRURO di Met
idruro di sodio
Idruro di calcio
ACIDO …..
IDRICO
IdrURO di sodio
DIidrURO di Ca
…URO …… di
nonMET
SALI BINARI
(Sostituzione
dell’idrogeno
dell’acido con
un metallo)
= Met NonMet
ECCEZIONI
Con i non metalli H2
funge da catione
H2 + Cl2 HCl
H2 + S H2S
HCl +Na Na Cl
H2S+ Fe(+3) Fe2S3
Acido clorIDRICO ClorURO di
idrogeno
Acido solfIDRICO SolfURO di DIidrogeno
Cloruro di sodio
ClorURO di sodio
Solfuro ferrICO
TRIsolfURO di
DI-ferro
H2S+ Fe(+2) FeS
Solfuro ferrOSO
Ossidi di Azoto
(sono 5)
N2 (+1)+ O2 N2O
NOMI D’USO
N2 (+4)+ O2 NO2
PROTOSSIDO DI Ossido di DIazoto
AZOTO
Ossido di azoto
OSSIDO DI
DIossido di azoto
AZOTO
IPOAZOTIDE
Si comportano come
anidridi:
N2(+3)+ O2 N2O3
Anidride nitrOSA
N2(+5)+ O2 N2O5
Anidride nitrICA
N2 (+2)+ O2 NO
COMPOSTI
TERNARI
SolfURO di ferro
Cianuri
Sono considerati
composti binari
perché il gruppo -CN
viene
considerato unito
HCN
Acido
cianIDRICO
IDROSSIDI
(metallo+ione
poliatomico che
presenta carica
residua –OH- )
Met + H2O MetOH
TRIossido di
Diazoto
PENTossido di
DI-azoto
CianURO di
idrogeno
Reazione di sintesi
Idrossido di sodio Idrossido di sodio
Na2O+H2O
Na(OH)
DIidrossido di
FeO+ H2OFe(OH)2 Idrossido
ferro
ferrOSO
Fe2O3+H2OFe(OH) Idrossido ferrICO
OSSIACIDI
NonMetO + H2O=
ossiacidi
H, non-Met, O
CO + H2O H2CO2
CO2 + H2O H2CO3
SALI
(Sostituzione
dell’idrogeno
dell’acido con un
metallo)
H2CO3 +Na H2
TRIidrossido di
ferro
Derivano il nome
Conservano il
nome
dall’anione
dell’anidride
Hanno SEMPRE
Si scrive prima H, desinenza ICO
Il nome
poi il NonMet
dell’anione deriva
e infine O.
dalla radice del
Gli indici
non metallo con il
corrispondono
alla
proprio n.o. tra
somma degli
parentesi,
indici dei reagenti attribuendogli
desinenza ATO e
precisando il
numero di atomi
di ossigeno che
contiene
Acido
Acido
DIossocarbonico
carboniOSO
(II)
Acido carbonICO Ac.
Triossocarbonico
(IV)
I Sali risultano
dalla
combinazione di
un catione con
l’anione dell’acido
da cui derivano. Il
nome dei Sali
rispecchia quindi
quello
dell’anione; se il
catione metallico
ha più di un n.o.
bisogna
precisarlo tra
parentesi
HANNO
SEMPRE
DESINENZA
ATO
Triossocarbonato
CarbonATO di
+Na2CO3
H2SO3 +Na H2
+Na2SO3
SALI DEGLI ACIDI
POLIPROTICI
H2SO4 +Mg(+2) H2 +MgSO4
Mg sostituisce due
atomi di H
H2SO4 +Na(+1) H2 +NaHSO4
NaHSO4+Na(+) H2
+Na2SO4
Na sostituisce prima
un atomo di H e
poi l’altro.
In questo modo si
ottengono due
SALI diversi
sodio
(l’acido era acido
carbonICO)
SolfITO di sodio
(l’acido era acido
solforOSO)
Anidride fosforica
P2O5+ H2OHPO3
Triossosolfato
(IV) di sodio
NaHSO4 è un
sale acido perché
conserva un
atomo di H
Si può chiamare
in 3 modi:
- Idrogeno solfato Idrogeno solfato
di sodio
(VI) di sodio
- solfato acido di
sodio
-bisolfato di sodio
solfato di sodio
ECCEZIONI
ACIDI POLIPROTICI
(le anidridi di alcuni
elementi
possono dare più di
un acido a
seconda del numero
di molecole di
acqua con cui
reagiscono)
Fosforo
Anidride fosforosa
P2O3+ H2O
(H2P2O4) HPO2
P2O3+ 2 H2O
H4P2O5
P2O3+3 H2O
(H6P2O6) H3PO3
(IV) di sodio
Acido META
fosforOSO
Acido PIRO
fosforOSO
Acido ORTO
fosforOSO
Acido META
P2O5+2 H2OH2PO3
P2O5+3 H2OHPO4
Boro
Anidride borica
B2O3 + H2O
(H2B2O4) HBO2
B2O3 +3 H2O
(H6B2O4) H3BO2
fosforICO
Acido PIRO
fosforICO
Acido ORTO
fosforICO
Acido META
borICO
Acido ORTO
borICO
Silicio
Silice o anidride
silicica
SiO2 + H2O H2SiO2 Acido META
silicICO
Acido ORTO
SiO2 + 2 H2O
silicICO
H2SiO2












