Capitolo 18
Risposte a Domande interne al capitolo
18.1
(p. 548)
a. La Piruvato chinasi catalizza il trasferimento di un gruppo fosfato dal fosfoenolpiruvato all’adenosina
difosfato.
b. L’alanina transaminasi catalizza il trasferimento di un gruppo amminico dall’alanina all’αchetoglutarato, con produzione di piruvato e glutammato.
c. La Trioso fosfato isomerasi catalizza l’isomerizzazione del chetone diidrossiacetone fosfato
all’aldeide gliceraldeide-3-fosfato.
d. La Piruvato deidrogenasi catalizza l’ossidazione e decarbossilazione del piruvato, producendo acetil
coenzima A e CO2.
18.2 (p. 548)
a.
La Fosfofruttochinasi catalizza il trasferimento di un gruppo fosforile da ATP al fruttosio-6-fosfato:
O~ P
H2C
O~ P
O~ P
CH2OH ATP
O
H
ADP
H2 C
CH2
O
OH
H
OH
Phosphofructokinase
H
H
H
H
HO
H
H
HO
Fructose-1,6-bisphosphate
Fructose-6-phosphate
b. La lipasi catalizza l’idrolisi del legame estere tra glicerolo e un acido grasso.
H
H
O
H
C
O
H
C
OH
C
C
C
OH
H
C
OH
H
C
OH
O
+ HO
C
(CH2)14CH3
Lipase
+ H 2O
H
H
(CH2)14CH3
OH
H
H
Monoglyceride
Glycerol
Water
Fatty acid
c. L’aceto acetato decarbossilasi catalizza la rimozione di un gruppo carbossilico da acetoacetato,
producendo acetone e anidride carbonica:
-
O
O
H
O
C
C
C
O
Acetoacetate
decarboxylase
CH3
H3 C
C
CH3
+ CO2
H
Acetoacetate
Acetone
Carbon dioxide
d. La succinato deidrogenasi catalizza l’ossidazione da succinato a fumarato. Il coenzima FAD è
ridotto in questa reazione, producendo FADH2.
COO-
FAD
COO-
FADH2
CH2
C
CH2
18.3
Succinate
H
dehydrogenase
H
C
COO-
COO-
Succinate
Fumarate
(p. 548)
a. saccarosio
b. piruvato
c. succinato
18.4
(p. 548)
a.
La
saccarasi
catalizza
l’idrolisi
b.
La
piruvato
decarbossilasi
del
rimuove
saccarosio
un
gruppo
in
glucosio
carbossilico
e
fruttosio.
dal
piruvato.
c. La succinato deidrogenasi ossida succinato.
18.5
(p. 555)
Il modello ad adattamento indotto presuppone che l’enzima sia flessibile. L’enzima e il substrato
sono in grado di cambiare forma per formare il complesso enzima-substrato. Il modello chiaveserratura presuppone che l’enzima (il blocco) sia flessibile e che il substrato (la chiave) si inserisca in
un sito specifico rigido (il sito attivo) sull’enzima per formare il complesso enzima substrato.
18.6
(p. 555)
La grandezza, la forma e la distribuzione di carica del sito attivo dell’enzima sono complementari a
quelle del substrato.
18.7
(p. 559)
Un enzima può distorcere un legame in modo da catalizzare la rottura del legame stesso. Un enzima è
in grado di portare due molecole vicine e nel corretto orientamento affinché la reazione avvenga.
Infine, un enzima può alterare il pH del microambiente del sito attivo agendo come donatore o
accettore di protoni.
18.8
(p. 559)
Lo stato di transizione è l’intermedio instabile in una reazione catalizzata da un enzima. Nello stato
di transizione il substrato condivide proprietà sia del substrato originale sia del prodotto finale.
18.9
(p. 561)
Le vitamine solubili in acqua sono richieste dall’organismo per la sintesi di coenzimi necessari per la
funzione di vari enzimi.
18.10 (p. 561)
a. Il coenzima A è prodotto dall’acido pantotenico.
b. La nicotinammide adenina dinucleotide (NAD +) e la nicotinammide adenina dinucleotide fosfato
(NADP +) sono sintetizzate dalla niacina.
c. La flavina adenina dinucleotide e flavina mononucleotide sono prodotte dalla riboflavina.
18.11 (p. 564)
Una diminuzione del pH può cambiare il grado di ionizzazione dei gruppi R all’interno di una catena
peptidica. Questo disturba le interazioni deboli che mantengono la struttura dell’enzima,
denaturandolo. Alterazioni meno drastiche della carica dei gruppi R nel sito attivo dell’enzima
possono inibire il legame enzima-substrato o alterare la capacità catalitica del sito attivo.
18.12 (p. 565)
L’alto calore denatura le proteine, compresi gli enzimi, delle cellule viventi. Così, riscaldare gli
strumenti chirurgici è un mezzo efficace per la sterilizzazione se il trattamento termico è eseguito in
condizioni di temperatura e di tempo sufficienti a uccidere forme di vita microbiche.
18.13 (p. 580)
Gli inibitori irreversibili si legano molto forte, talvolta anche in modo covalente, a gruppi R nel sito
attivo di diversi enzimi. La perdita di attività enzimatica impedisce il normale metabolismo cellulare,
con conseguente morte della cellula o dell’individuo.
18.14
(p. 580)
Un inibitore irreversibile lega fortemente, spesso covalentemente, un enzima, disattivando
permanentemente il sito attivo. Un inibitore non competitivo reversibile si lega più debolmente
all’enzima. L’attività enzimatica è ripristinata quando l’inibitore si dissocia dall’enzima.
18.15
(p. 580)
Un analogo strutturale è una molecola che ha una struttura e la distribuzione di carica molto simile a
quella del substrato naturale di un enzima. Generalmente gli analoghi strutturali sono in grado di
legarsi al sito attivo dell’enzima. Questo inibisce l’attività enzimatica poiché il substrato normale
deve competere con l’analogo strutturale per formare il complesso enzima-substrato.
18.16
(p. 580)
Un analogo strutturale assomiglia alla dimensione, forma e distribuzione di carica del normale
substrato per un enzima. A causa di questa somiglianza è in grado di legarsi al sito attivo. Tuttavia,
quando l’analogo strutturale si lega al sito attivo, non avviene alcuna reazione. Così l’enzima è
inibito dalla formazione del complesso enzima-analogo strutturale.
18.17 (p. 587)
18.18
(p. 588)
a. trp-val-gly
Chymotrypsin
O
N+H3
CH
C
O
H
N
CH2
O
H
N
CH
C
CH
CH3
CH
C
O-
H
Glycine
CH3
Valine
HN
Tryptophan
b. phe-ala-pro
O
Chymotrypsin
C
O
N +H3
CH
C
CH2
O
H
N
CH
C
N
CH3
Proline
Alanine
Phenylalanine
18.19 (p. 588)
O-
18.20
(p. 588)
trp-val-lys-ala-ser
Chymotrypsin
O
N+H3
CH
C
O
H
N
CH2
CH
C
CH
CH3
CH3
Elastase
Trypsin
O
H
N
CH
C
O
H
N
CH
C
O
H
N
CH
C
CH2
CH3
CH2
CH2
Alanine
OH
Serine
Valine
O-
CH2
HN
CH2
Tryptophan
N+H3
Lysine
Risposte a Domande ed Esercizi di fine capitolo
18.1
Gli enzimi sono normalmente classificati dal tipo di reazioni che catalizzano.
18.2 1-E; 2-C; 3-A; 4-F, 5-B; 6-D
18.3 Le classi di enzimi basate sul tipo di reazione che catalizzano:
a. Le ossidoriduttasi catalizzano reazioni di ossidoriduzione. La lattato deidrogenasi è una
ossidoriduttasi.
b. Le transferasi catalizzano il trasferimento di gruppi chimici da una molecola all’altra. L’alanina
transaminasi è una transferasi.
c. Le idrolasi catalizzano l’addizione di una molecola d’acqua ad un legame, con conseguente rottura
del legame stesso. La tripsina è una idrolasi.
d. Le liasi catalizzano l’addizione di un gruppo ad un doppio legame o la rimozione di un gruppo per
formare un doppio legame. La citrato liasi è una liasi.
e. Le isomerasi catalizzano la conversione di un isomero in un altro. La Trioso fosfato isomerasi è una
isomerasi.
f. Le ligasi catalizzano l’unione di due molecole. La DNA ligasi è una ligasi.
18.4
Un substrato è il reagente in una reazione catalizzata da enzima che si lega al sito attivo dell’enzima
ed è convertito in prodotto.
18.5
Il prodotto è la specie che deriva da una reazione chimica e che appare sul lato destro di
un’equazione chimica.
18.6
L’energia di attivazione di una reazione è l’energia necessaria perché la reazione avvenga.
18.7
Un enzima abbassa l’energia di attivazione di una reazione.
18.8
La costante di equilibrio per una reazione chimica riflette la differenza di energia dei reagenti e dei
prodotti.
Si consideri la seguente reazione:
aA + bB → cC + dD
La costante di equilibrio per questa reazione è:
K eq = [D]d [C]c /[A]a [B]b = [products]/[reactants]
Poiché la differenza di energia tra i reagenti e i prodotti è la medesima, indipendentemente dal
percorso della reazione, un enzima non altera la costante di equilibrio della reazione.
18.9
Un enzima, fornendo un percorso alternativo alla reazione, aumenta la velocità di una reazione
chimica, abbassando così l’energia di attivazione della reazione.
18.10
La velocità di una reazione chimica catalizzata tipicamente raddoppia ogni volta che raddoppia la
concentrazione del substrato.
18.11
A una certa concentrazione del substrato, la velocità di reazione raggiunge un livello massimo. A
questa velocità massima, ogni sito attivo è occupato da una molecola substrato.
18.12
Il fattore limitante è lo step più lento in una reazione catalizzata da un enzima, e quindi limita la
velocità con cui il substrato può essere convertito in prodotto.
18.13
Il grafico che mostra l’attività di un enzima rispetto alla concentrazione del substrato suggerisce che
la velocità di una reazione catalizzata da un enzima è limitata dal tempo richiesto alla reazione per
avvenire e/o dal tempo richiesto dal prodotto per essere rilasciato.
18.14 Il complesso enzima-substrato è l’aggregato molecolare che si forma quando il substrato si lega al
sito attivo di un enzima.
18.15
Il sito attivo di un enzima è la tasca o il solco sulla superficie di un enzima, che è il sito di legame
del substrato.
18.16 I siti attivi sono tasche sulla superficie dell’enzima che coinvolgono gruppi R aminoacidici coinvolti
nel legame con Il substrato e gruppi R coinvolti nella catalisi. La forma del sito attivo è
complementare a quella del substrato e ne determina la specificità. Il legame enzima substrato
coinvolge legami deboli.
18.17
Il modello ad adattamento indotto del legame enzima substrato è più accurate rispetto al modello
chiave-serratura perché considera anche le proteine e in particolare gli enzimi sono molecole
flessibili.
18.18 La specificità enzimatica è la capacità di un enzima di legarsi ad un solo, o pochissimi, substrati e
quindi catalizzare solo una singola reazione.
18.19 La specificità del gruppo è la catalizzazione, da parte di un enzima, di reazioni che coinvolgono
molecole simili aventi lo stesso gruppo funzionale.
18.20 La specificità di legame è la catalizzazione, da parte di un enzima, della formazione e della rottura di
un solo tipo di legame.
18.21 La specificità assoluta è la catalizzazione, da parte di un enzima, della reazione di un unico substrato.
18.22
La specificità stereochimica è la distinzione, da parte di un enzima, di un enantiomero da un altro.
18.23 Fase 1: formazione del complesso enzima-substrato. Fase 2: formazione dello stato di transizione.
Durante questa fase il substrato assume una forma intermedia tra il substrato e il prodotto originale.
Fase 3: conversione del substrato in prodotto e formazione del complesso enzima-prodotto. Fase 4:
rilascio del prodotto e rigenerazione dell’enzima nella sua forma originale.
18.24
Lo stato di transizione è uno stato ad alta energia in cui il substrato è costretto in una forma
intermedia simile al substrato e al prodotto. Lo stato di transizione favorisce la conversione del
substrato in prodotto.
18.25
Un amminoacido nel sito attivo che presenta un gruppo R acido o basico potrebbe alterare il pH
locale accettando o rilasciando un protone.
18.26 Un cofattore aiuta a mantenere la forma del sito attivo di un enzima.
18.27
Un coenzima si lega transitoriamente a un enzima e accetta o dona gruppi chimici al substrato in una
reazione biochimica.
18.28 La tiamina (B1) si trova nel coenzima tiamina pirofosfato. La riboflavina (B2) si trova sia nella
flavina mononucleotide e nella flavina adenina dinucleotide. La niacina (B3) è presente nella
nicotinammide adenina dinucleotide e nella nicotinammide adenina dinucleotide fosfato. La
piridossina (B6) si trova nel piridossal fosfato e nella piridossammina fosfato. La cianocobalamina
(B12) si trova nel coenzima deossiadenosil cobalamina. L’acido folico si trova nell’acido
tetraidrofolico. L’acido pantotenico si trova nel coenzima A. La biotina si trova nella biocitina.
18.29
Nelle reazioni chimiche i coenzimi possono donare gruppi al substrato o accettare gruppi che
vengono rimossi dal substrato.
Il coenzima tiamina pirofosfato è coinvolto nelle reazioni di decarbossilazione. La flavina
mononucleotide e la flavina adenina dinucleotide portano atomi di idrogeno. La nicotinammide
adenina dinucleotide e nicotinammide adenina dinucleotide fosfato sono portatori di ioni idruro. Il
piridossal fosfato e la fosfato piridossammina sono portatori di gruppi amminici e carbossilici. La
deossiadenosil cobalamina è un coenzima coinvolto nel metabolismo degli amminoacidi. L’acido
tetraidrofolico è un coenzima coinvolto nel trasferire gruppi con un atomo di carbonio. Il Coenzima
A trasferisce gruppi acilici. La biocitina è un coenzima della fissazione di CO2.
18.30 Ognuna delle seguenti risposte presuppone che l’enzima sia stato purificato da un organismo le cui
condizioni ottimali per la vita sono: 37 ° C, pH 7.
a. Diminuendo la temperatura da 37 ° C a 10 ° C si causerà la diminuzione della velocità dell’enzima
reazione perché la frequenza di collisioni tra enzima e substrato diminuirà al diminuire della velocità
di movimento molecolare.
b. Aumentando il pH da 7 a 11 generalmente si causerà una diminuzione della velocità della reazione
catalizzata dall’enzima. In realtà, la maggior parte degli enzimi sarebbe denaturato da un pH di 11 e
l’attività enzimatica cesserebbe.
c. Riscaldando l’enzima da 37 ° C a 100 ° C si distruggerà l’attività enzimatica perché l’enzima è
denaturato dal calore estremo.
18.31 L’alta temperatura denatura gli enzimi batterici e le proteine strutturali. Poiché la vita delle cellule
dipende dalla funzione di queste proteine, in queste condizioni la cellula muore.
18.32
Oltre una certa temperatura il calore può alterare o denaturare il sito attivo di un enzima
distruggendone l’attività, modificando la struttura tridimensionale della proteina
18.33
a. Le cellule regolano il livello di attività enzimatica per risparmiare energia. La produzione di un
enzima, se il suo substrato non è presente o se il suo prodotto è in eccesso, è uno spreco di energia
cellulare.
b. La produzione di enzimi digestivi proteolitici deve essere attentamente controllata perché l’enzima
attivo potrebbe distruggere la cellula che lo produce. Pertanto, sono prodotti in una forma inattiva e
sono attivati solo nel sito in cui effettuano la digestione.
18.34
L’enzima allosterico ha un sito di legame per un effettore nonché un sito attivo. Il legame
dell’effettore modifica la forma del sito attivo, rendendolo attivo (allosterismo positivo) o inattivo
(allosterismo negativo).
18.35 Nell’allosterismo positivo, il legame della molecola effettrice attiva l’enzima. Nell’allosterismo
negativo, il legame della molecola effettrice disattiva l’enzima.
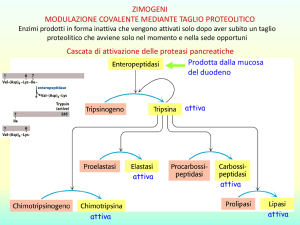
18.36 Un proenzima è la forma inattiva di un enzima che convertito in forma attiva solo nel sito dove deve
catalizzare la reazione.
18.37
Il vantaggio di produrre enzimi digestivi in forme inattive (proenzimi) è che in questo stato non
possono danneggiare le cellule che li producono. Essi possono quindi essere facilmente convertiti
nella forma attiva solo nel sito che necessita la loro attività.
18.38 L’inibizione enzimatica competitiva si verifica quando un analogo strutturale del substrato normale
occupa il sito attivo dell’enzima in modo che la reazione non possa avvenire. L’analogo strutturale e
il substrato normale competono per il sito attivo. In questo modo la velocità di reazione dipende dalle
concentrazioni relative delle due molecole.
18.39
Un analogo strutturale assomiglia alla dimensione, forma e distribuzione di carica del normale
substrato per un enzima. A causa di questa somiglianza è in grado di legarsi al sito attivo. Tuttavia,
quando l’analogo strutturale si lega al sito attivo, non avviene alcuna reazione. Così l’enzima è
inibito dalla formazione del complesso enzima-analogo strutturale.
18.40 Gli inibitori irreversibili si legano fortemente e bloccano il sito attivo di un enzima, eliminando la
catalisi.
18.41
Gli inibitori irreversibili vengono chiamati veleni perché distruggono permanentemente l’attività di
molti enzimi. L’interruzione delle reazioni biochimiche essenziali provoca malattie e morte.
18.42
a. La polifenolossidasi richiede ioni rame come cofattori, perché l’attività dell’enzima è bloccata
quando la feniltiourea rimuove tutti gli ioni rame disponibili.
b. La feniltiourea è un inibitore irreversibile non competitivo.
18.43 Un enzima proteolitico catalizza la scissione del legame peptidico che stabilizza la struttura primaria
della proteina.
18.44
Chimotripsina, tripsina ed elastasi hanno tutte strutture tridimensionali molto simili. Sono proteasi,
che tagliano il legame peptidico sul lato carbonilico di particolari amminoacidi.
18.45 Le elastasi tagliano i legami peptidici sul lato carbonilico di alanina e glicina. La tripsina taglia i
legami peptidici sul lato carbonilico di lisina e arginina. La chimotripsina taglia i legami peptidici sul
lato carbonilico di triptofano e fenilalanina.
18.46 La conformazione del sito attivo dona specificità agli enzimi proteolitici: per esempio il sito attivo
della tripsina è lungo e stretto, adatto per gruppi R di aminoacidi come la lisina o l’arginina, mentre il
sito attivo della chimotripsina può legare gruppi R aromatici.
18.47
La terapia di sostituzione enzimatica può essere utilizzata per trattare determinate malattie. Per
esempio nella malattia di Gaucher, che mostra una carenza dell’enzima glucocerebrosidasi, i pazienti
ricevono l’enzima lisosomiale umano β-glucocerebrosidasi per via endovenosa.
18.48 Creatina-chinasi MB, e aspartato aminotransferasi (AST / SGOT)
18.49
a. transferasi
b. transferasi
c. isomerasi
d. ossidoreduttasi
e. idrolasi
f. transferasi
g. esterasi
h. decarbossilasi
i. ossidoreduttasi