Orthomyxovirus
G. Di Bonaventura
Università di Chieti-Pescara
Orthomyxovirus
Caratteri generali
I virus dell’influenza A, B, C sono gli unici membri
della Famiglia Orthomyxoviridae
Tutti patogeni per l’uomo (A anche per animali)
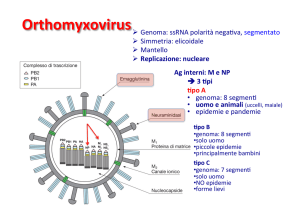
Virione (d=80-120 nm) pleomorfo (sferici o tubulari)
Envelope contenente emoagglutinina
(HA) e neuraminidasi (NA) e delimitato
internamente dalle proteine della matrice
(M1) e della membrana (M2)
Genoma costituito da RNA segmentato
(8 in A e B, 7 in C dove manca di NA, sebbene la
funzione sia vicariata dalla HA)
Ogni segmento è costituito da:
RNA, polarità negativa
nucleoproteina (NP)
trascrittasi (PB1, PB2, PA)
Orthomyxovirus
Emoagglutinina (HA), neuramminidasi (NA)
Emoagglutinina = trimero con forma di spicola
Proteina di attacco del virus (si lega all’acido sialico)
Bersaglio degli anticorpi neutralizzanti
Proteina di fusione
Agglutina (si lega ed aggrega) gli eritrociti umani
Modificazioni nella sua struttura sono responsabili della variabilità
antigenica minore (“drift” o deriva antigenica) e maggiore (“shift”)
Neuraminidasi = tetramero dotato di attività
enzimatica
taglia l’acido sialico delle glicoproteine
(recettore compreso), prevenendo così
l’agglutinazione dei virioni e facilitando la
liberazione delle unità virioniche
NA del virus influenzale tipo A subisce
modificazioni (N1, N2, ecc.)
HA
Orthomyxovirus
Ciclo replicativo
Adsorbimento virale, mediato da HA, a
residui di acido sialico su glicoproteine di
superficie cellulare
Internalizzazione virale per endocitosi
Scapsidazione M2-mediata: acidificazione
endosomale, fusione envelope-membrana
endocitica HA-mediata
Migrazione del nucleocapside nel nucleo
Trascrizione nucleocapside, con formazione di cap-mRNA-poliA
Traduzione citosolica mRNA in proteine
HA e NA processate nel RE e nel Golgi e trasferite alla superficie cellulare
Trascrizione (RNA+) e replicazione del genoma in sede nucleare
Trasferimento RNA nel citosol ed associazione con NP e polimerasi a
formare i nucleocapsidi
Formazione dell’envelope di derivazione cellulare
Gemmazione apicale indotta dall’inserzione di HA nella membrana
Orthomyxovirus
Patogenesi & immunità
Iniziale infezione citocida del tratto
respiratorio superiore (cellule ciliate,
cellule secernenti muco)
Possibile diffusione al tratto respiratorio
inferiore
Guarigione facilitata dalla produzione di IF
e della risposta cellulo-mediata (cellule NK
e T)
“Protezione” mediata da anticorpi anti-HA.
Risposta anticorpale specifica per ciascun ceppo influenzale ed anti-NA
Risposta cellulo-mediata è generica ed è in grado di agire su ceppi diversi
appartenenti allo stesso tipo (A o B)
Sintomatologia e durata della malattia dipendenti da azione IF, dalla
risposta cellulo-mediata e dall’entità del danno tessutale
Generalmente autolimitante, rimane circoscritta al polmone
Orthomyxovirus
Epidemiologia
Nomenclatura ceppi tipo A
tipo
luogo primo isolamento
data del primo isolamento [A/Bangkok/1/79(H3N2)]
antigene (NA e HA)
Nomenclatura ceppi tipo B
tipo
luogo primo isolamento
data del primo isolamento
[B/Singapore/3/64]
Diversità genetica dei virus influenzali
mutazione geni per HA ed NA
antigenic “drift” (modificazioni antigeniche minori) nei virus A e B
fenomeni epidemici, ogni 2-3 anni circa
riassortimento tra genomi di ceppi diversi (anche animali)
antigenic “shift” (modif. antigeniche maggiori) solo nei virus tipo A
fenomeni pandemici, ogni 10 anni circa (asiatica, 1957; Hong Kong, 1968)
Orthomyxovirus
Epidemiologia
Geografia
ubiquitari
malattia “stagionale”: maggiormente diffusa in inverno
Trasmissione
mediante aerosol, prodotto durante la fonazione, tossendo e
respirando
il virus predilige i climi freschi e poco umidi (inverno)
largamente diffuso nei bambini in età scolare
Soggetti a rischio
adulti
bambini: infezioni delle vie respiratorie (da asintomatiche a gravi)
a rischio elevato
anziani
immunocompromessi, pazienti cardiopatici e respiratori cronici (compresi
asmatici e fumatori)
Orthomyxovirus
Sindromi cliniche
Periodo di incubazione: 1 – 4 giorni
Influenza acuta negli adulti
repentini attacchi febbrili, malessere, mialgia, gola infiammata, tosse non
produttiva
Influenza acuta nei bambini
malattia acuta simile a quella degli adulti ma con febbre più alta, sintomi
gastrointestinali (dolori addominali, vomito), otite media, miosite e più
frequentemente croup
La malattia dura circa 3 giorni e, in assenza di complicazioni, la
guarigione è completa in 7-10 giorni
Complicazioni
polmonite virale primaria
polmonite batterica secondaria (S. pneumoniae, S. aureus, H. influenzae)
con espettorato produttivo e purulento
mastite e coinvolgimento cardiaco
sindromi neurologiche (sindrome di Guillain –Barrè, encefalopatia,
encefalite, sindrome di Reye)
Orthomyxovirus
Diagnosi di laboratorio
Diagnosi clinica in corso di epidemia
Laboratorio necessario per distinguere il virus influenzale da
altri virus respiratori e stabilirne il tipo ed il ceppo
Campioni clinici: secrezioni respiratorie
Isolamento in colture primarie di rene di scimmia o nella linea
cellulare di rene canino Madin-Darby
CPE dopo 2 giorni
Precoce emoadsorbimento (adesione di
eritrociti di cavia a cellule infette che
esprimono HA) ed emoagglutinazione
(aggregato gelatinoso), tuttavia aspecifici
Identificazione specifica mediante immunofluorescenza,
inibizione dell’emoagglutinazione o immunoenzimatica per
antigeni in colture cellulari
Indagini sierologiche utili solo a fini epidemiologici
Orthomyxovirus
Terapia, controllo
Amantadina, rimantadina
Interagiscono con la proteina M2, inibendo così la decapsidazione
virale (influenza tipo A)
Zanamivir, oseltamivir
Inibiscono la NA (vs tipo A e B). Senza NA, HA si lega all’acido
sialico delle altre particelle virali, inducendo così la formazione di
aggregati virali che inibiscono il rilascio cellulare delle unità
neoformate
Controllo
E’ impossibile limitare la diffusione aerea del virus influenzale
Il controllo ottimale è rappresentato dall’immunizzazione
Immunizzazione naturale, secondaria ad un’esposizione primaria, è
protettiva per lunghi periodi
Vaccino con virus inattivati con formalina (preparato in uova embrionate)
o vaccino a subunità (HA, NA)
Raccomandabile per i soggetti a rischio (anziani, soggetti con cardiopatie o
pneumopatie croniche)
In studio vaccini con virus vivi (attenuati)