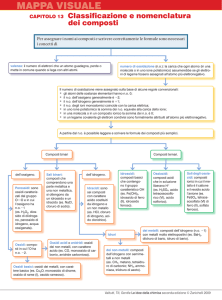
NOMENCLATURA CHIMICA
La nomenclatura chimica è il sistema di nomi che i chimici usano per identificare i composti e
tradizionalmente si distingue tra composti organici e composti inorganici:
1. Composti organici
: contengono C, H, N, O
2. Composti inorganici : tutti gli altri composti
Le regole su cui si fonda la nomenclatura dei composti inorganici è legata al numero di elementi
che la costituiscono:
Numero
elementi
1
Elementi allo stato libero
2
Composti binari
3
Composti ternari
In generale il nome può essere assegnato indicando:
a) Nome comune: non ha nulla a che vedere con la loro composizione e si riferisce ad una
proprietà chimica o fisica che li caratterizza
b) Nome sistematico: identifica la composizione chimica delle sostanze, indica quanti e quali
elementi sono presenti nel composto ed è assegnato secondo le regole stabilite dallo
IUPAC.
COMPOSTI MONOELEMENTO
In generale si tratta di elementi allo stato libero e che sono formati da 1 solo tipo fi atomi, Fe, Ca,
O2, H2 , … ; il nome è quello dell’atomo
COMPOSTI BINARI
Elemento
Idrogeno
Metallo
Metallo
Idruro metallico
Lega
Non - metallo
IV – V gruppo
idruro non metallico Sale aloide
VI – VII gruppo
idracido
Idruri metallici
Elemento poco elettronegativo + idrogeno
Es.
NaH idruro di sodio
Non – metallo
Ossigeno
Sale aloide
Ossido metallico
Composto
Inter non-metallico
Ossido
Non - metallico
Anidride
idruro di…..
Idruri non-metallici
IV – V gruppo: composti tra atomi con elettronegatività simile
idruro di…..
Es.
CH4 idruro di carbonio
VI – VII gruppo: composti tra atomi con notevole differenza di elettronegatività. L’idrogeno ha
carattere metallico, si scrive prima ed il non metallo dà il nome al composto con la desinenza URO
Es.
HCl
Cloruro di idrogeno – acido cloridrico
Metallo – metallo
Lega; nome comune; assenza di nomenclatura
Es. Ottone
Metallo – non metallo
Sono composti ionici in cui gli elettroni si trasferiscono dal metallo al non metallo e son detti anche
Sali aloidi
Es.
CaI2 ioduro di calcio – di ioduro di calcio – cloruro di calcio (II)
Composti inter non metallici
Composti tra atomi con valori di elettronegatività simile e quindi si tratta di molecole non
dissociabili in ioni. Si scrive prima l’elemento più elettropositivo e poi quello più elettronegativo che
dà il nome al composto
Es.
PCl3 tricloruro di Fosforo – cloruro di fosforo (III)
(elettropositivo) – URO DI – (elettronegativo)
Ossidi metallici
Si tratta di composti di tipo ionico tra l’ossigeno e un non metallo
Il nome si forma ossido di (metallo)
Es.
Cu2O ossido di rame (I); ossido rameoso ; monossido di di-Rame
CuO ossido di rame (II); ossido rameico ; monossido di Rame
Ossidi non – metallici o anidridi
Sono composti inter non metallici a carattere molecolare tra l’ossigeno e un non metallo;
l’elemento metallo può avere diverse valenze per cui il nome si ottiene a seconda della valenza
dell’elemento
Valenza
Prefisso
Suffisso
Esempio
1
ipo
Osa
Cl2O anidride ipoclorosa; ossido di dicloro
3–4
Osa
SO2 anidride solforosa: diossido di zolfo
5–6
Ica
N2O5 anidride nitrica; pentossido di azoto
7
per
ica
Mn2O7 anidride permanganica; eptaossido di manganese
COMPOSTI TERNARI
Idrossidi
Sono composti ionici costituiti da ioni metallici e ioni idrossido (OH-) che si ottengono per reazione
degli ossidi metallici con acqua
Il nome si ottiene utilizzando il prefisso idrossido seguito dal nome del metallo
Es.
NaOH
Idrossido di Sodio
Fe(OH)2
Idrossido Ferroso
Di idrossido di Ferro idrossido di Ferro (II)
Fe(OH)3
Idrossido Ferrico
Tri idrossido di Ferro Idrossido di Ferro (III)
Ossiacidi
Sono composti molecolari costituiti da un metallo legato all’ossigeno a cui è legato anche
l’idrogeno. Si ottengono per reazione tra l’anidride e l’acqua; la denominazione dipende dalla
valenza del non metallo e si ottiene dal nome dell’anidride corrispondente sostituendo la arola
anidride con acido
Valenza
1
3–4
5–6
7
Prefisso
Acido ipo
Acido
Acido
Acido per
Suffisso
oso
oso
ico
ico
HClO
H2SO3
H3PO4
HClO4
Esempio
acido ipocloroso – acido ossi clorico (I)
acido solforoso – acido tri osso solforico (IV)
acido fosforico – acido tetra osso fosforico (V)
acido perclorico – acido tetra ossi clorico (VII)
Ossisali
Sono composti ionici costituiti da ioni metallici e dal residuo alogenico (Es. SO 4--); si ottengono
dagli ossi sali per sostituzione dell’idrogeno con un catione metallico.
Il nome si forma a partire dall’acido eliminando la parola acido, sostituendo la desinenza (-oso con
-ito) e (-ico con -ato) seguito dal nome del metallo
Es.
Na2SO4
Solfato di Sodio
Na2SO3
Solfito di Sodio
Na3PO4
Fosfato di sodio – tetra osso fosfato di tri Sodio
COMPOSTI QUATERNARI
Sono costituiti essenzialmente dai Sali acidi, cioè composti formatisi a partire da un ossiacido e
con parziale sostituzione dell’idrogeno
Es.
Ca(HCO3)2
Bicarbonato di Calcio
Carbonato acido di Calcio
Idrogeno carbonato di Calcio
Ca(H2PO4)2
Di idrogeno fosfato di Calcio
Fosfato bi acido di Calcio
Ca(HPO4)
Idrogeno fosfato di Calcio
Fosfato mono acido di Calcio