L’OSPEDALE E LA RSA
SENZA DOLORE
UN OBIETTIVO POSSIBILE
IL DOLORE: MALATTIA DA CURARE
(FISIOPATOLOGIA DEL DOLORE)
SIMONE FRANZONI
TRENTO 22-5-2010
Il dolore è una esperienza spiacevole,
sensoriale ed emozionale,
correlata con un danno tissutale
o descritta in tali termini
Merskey H “Classification of chronic pain: description of
chronic pain syndromes and definition of pain terms”.
Pain, 1986, 3 (suppl):S1
COMPONENTI DEL DOLORE
•
•
•
•
NOCICEZIONE
SENSAZIONE
SOFFERENZA
COMPORTAMENTO
FORDYCE W.E. “Learning processes of pain” - In: Sternbach (Ed) :
The psychology of pain. Raven Press, New York, 1978
DOLORE FISIOLOGICO
E’ NOCICETTIVO
AD ALTA SOGLIA,
ACUTO
DOLORE UTILE
Cartesio
Willer, 1988
CONGENITAL INSENSITIVITY TO PAIN
Nolano et al. 2000
TRASDUZIONE: meccanismo attraverso il quale uno stimolo nocivo viene
convertito, a livello delle specifiche terminazioni nervose sensitive o nocicettori,
in attività elettrica.
TRASMISSIONE: meccanismo neurologico attraverso il quale l’impulso
elettrico raggiunge il cervello via nervi sensitivi (periferia-midollo), rete di
neuroni di connessione (midollo-tronco encefalo-talamo) e via talamo corticale.
MODULAZIONE: segnale doloroso può essere modificato, in
amplificazione o inibizione, a vari livelli del circuito algico. Viene attivato dallo
stesso input doloroso, sostanze endogene, stress, processi cognitivi, farmaci e
tecniche antalgiche.
PERCEZIONE: processo finale attraverso il quale trasduzione, trasmissione
e modulazione interagiscono per creare l’esperienza finale soggettiva ed emotiva
del dolore.
RECETTORI
Strutture periferiche nelle quali gli stimoli meccanici,
termici, chimici, ecc. vengono trasformati in potenziali
d’azione che poi verranno avvertiti come dolorosi.
• Nocicettivi: silenti in assenza di dolore, hanno
soglia eccitabilità alta in modo da essere attivati solo
da stimoli dolorosi
• Meccanocettori: attivati solo da stimoli di tipo
meccanico, presenti solo sulla cute, connessi con
fibre afferenti A!
• Polimodali: attivati da stimoli di varia natura, presenti
sia sulla cute che nei tessuti profondi e visceri, molto
sensibili alle variazioni microambiente biochimico
• Viscerali: coinvolti anche nella regolazione riflessa
delle funzioni del viscere stesso
NOCICETTORI PERIFERICI
Sottoclasse
nome
morfologia
Stimolo adeguata
Velocità di conduzione
Sensazione dolorosa
Mielinici
Amielinici
Nocicettore
mielinizzato
Nocicettore C
polimodale
C. di Schwann con
neurite mielinizzato
Deformazione
dolorosa cute
Terminazione libera
A! - A"#
5-40 m/s
Acuto, tagliente
C
0,7 m/s
Urente acuto o
sordo
Deformazione
dolorosa cute,calore
TRASDUZIONE
•
•
•
Coinvolte diverse sostanze: istamina, chinine, H
+, radicali O2, sostanza P e prostaglandine
Potenziali d’azione originatisi nei recettori della
nocicezione raggiungono il valore soglia ed
entrano nelle vie di conduzione come dolore
Raggiungimento valore soglia non dipende solo
dall’intensità dello stimolo, ma anche da
fenomeni di sommazione:
! spaziale: si verifica nei visceri dove i recettori sono
pochi e distanziati fra loro
! temporale: si verifica nei tessuti dove uno stimolo
singolo può essere innocuo, ma se si prolunga nel
tempo può diventare fortemente algogeno
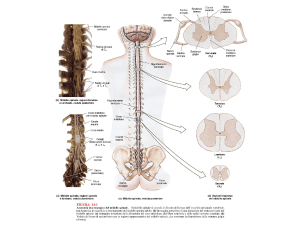
VIE DI CONDUZIONE
Nocicezione avviene attraverso sistema:
• Afferente: recettori, vie conduzione centrali e centri di
integrazione e interpretazione
• Efferente: vie e centri controllo endogeno del dolore
diretto a modulare imput algogeno
• Impulso algogeno decorre lungo fibre nervose il cui
neurone è situato nel ganglio spinale o nelle strutture
ad esso corrispondenti nervi cranici
• Esistono fibre mieliniche e amieliniche la cui velocità
di conduzione è diversa
Vie del dolore
Corteccia
sensitiva
III Neurone
nocicettivo
Verso il centro
Talamo
II Neurone
nocicettivo
I Neurone
nocicettivo
Corno posteriore
del midollo
Nocicettore
Verso la periferia
FIBRE NERVOSE
Tipo di fibra
Funzione
Diametro
micron
Velocità
conduzione m/ sec
A
"
Propriocezione,
moto
12-30
70-120
#
Tatto, pressione
5-12
30-70
$
Motrici (fusi m.)
3-6
15-30
!
Dolore, temperatura
2-5
12-30
B
Pregangliari
Sist.autonomo
0.5-2
3-15
C
Dolore
0.4-1.2
0.5-2
Trasporto stimolo doloroso
Molte strutture del corpo umano sono dotate di una
serie di piccoli apparati istologicamente indistinguibili
(terminazioni libere amieliniche intersecanti) capaci di
ricevere lo stimolo nocicettivo e di convogliarlo nei
nervi mediante “cavi elettrici” a diverso spessore:
- fibre A-delta mieliniche (responsabili dolore
ad insorgenza veloce)
- fibre C amieliniche (indurrebbero dolore tardivo)
NERVI
• Raggruppamenti di fibre nervose periferiche rivestiti
da guaine che oppongono scarsa resistenza alla
diffusione degli anestetici locali
• Confluiscono nei gangli spinali e da questi nelle radici
spinali posteriori secondo una distribuzione
metamerica
• Dolore somatico decorre dai nervi somatici attraverso
i gangli spinali
• Dolore viscerale decorre attraverso i gangli simpatici
paravertebrali attraverso il ramo comunicante bianco
per raggiungere il corpo neuronale sito nel ganglio
spinale
NEURONI AFFERENTI PRIMARI SENSITIVI
• Piccolo calibro: A! fibre leggermente mielinizzate
C fibre amielinizzate
• Rispondono a stimoli nocivi
• Trasmettono informazioni sensitive alle corna dorsali
• Terminano prevalentemente nella I lamina (zona
marginale), II (susbstantia gelatinosa), V (nucleo proprio)
e X (canale centrale – solo A!)
Possono rilasciare 1 o più mediatori:
• EAA (glutammato e aspartato) responsabili di depolarizzazione
rapida e di breve durata del II neurone
• Proteine neurotrasmettitrici (sostanza P, neurokinina A, CPRG)
responsabili depolarizzazione ritardata e di lunga durata
“GATE CONTROLL”
(Wall -Melzack ’65)
Azione inibitrice,
variabile,
anatomicamente
localizzata nella
sostanza grigia corno
posteriore del midollo
(lamine I, II, IV di Rexed)
Nelle lamine della sostanza gelatinosa del
corno posteriore del midollo viene esercitata
azione inibitrice sulle afferenze al fascio spinotalamico, deputato a convogliare lo stimolo a
livello superiore
Corna dorsali midollari
Sede di sinapsi tra fibre afferenti I e neuroni II ordine
• Contengono neuroni interessati nella trasmissione e
modulazione stimoli nocicettivi
• II neurone capace elaborare stimoli nocivi e non (gate
control) e modulazione del dolore
Neuroni II ordine sono 2 tipi:
• NS nocicettivo specifici (rispondono solo a fibre A! e C)
• WDR “ampio range dinamico”
– rispondono a stimoli nocivi e non
– stimolazione delle fibre C su WDR conduce a uno stato di
scarica continua, denominata wind up o facilitazione centrale,
che serve ad amplificare la trasmissione delle afferenze
VIA SPINOTALAMICA
• Fibre afferenti dolore si incrociano a livello
metamerico e decorrono nel settore
anterolaterale, controlaterale del midollo spinale
• Questa via termina nel nucleo ventrale
posterolaterale talamo (VIA LEMNISCALE)
• Via extralemniscale entra in contatto con i centri
reticolari e limbici responsabili dei riflessi suscitati
dal dolore
• Talamo: sede di integrazione ed elaborazione
delle sensazioni dolorose, per cui lesioni
vascolari talamiche provocano dolore violento
mal localizzato e di difficile trattamento
Bonica, 1980
CORTECCIA SOMATOSENSORIALE
• Corteccia giro postcentrale attribuisce alle
sensazioni la coscienza, tono affettivo e
localizzazione attraverso integrazioni con il
sistema limbico
• Soppressione coscienza del dolore lascia
integri il dolore stesso e tutte le sue
conseguenze riflesse
Modulazione spinale e sovra-spinale
Modulazione spinale: neuroni inibitori locali
Agenti endogeni ed esogeni che possono agire pre-/post- sinapsi
su:
- recettori oppiacei
- "-adrenorecettori
- GABA
- Glicina
Modulazione sulle vie discendenti:
Originano da strutture sopraspinali (ipotalamo, s.grigia
periacqueduttale, n.rafe magno, locus ceruleo)
Modulazione attraverso: encefaline, noradrenalina, serotonina
VIA DISCENDENTE
Sistemici neuronici e biochimici diretti a ridurre imput algogeno
Sito di origine:
• Corteccia
• Sostanza grigia periacqueduttale mesencefalica
• Rafe magno
Sito d’azione:
• Corna posteriori del midollo
• Nuclei del trigemino
Neurotrasmettitori implicati:
• Serotonina e adrenalina
• Oppiodi endogeni
Modulazione talamo-corticale
dello stimolo nocicettivo
Corteccia
somatosensoriale
Nucleo paraventricolare
ipotalamico
Campo tegmentario
pontino laterale
(controlaterale)
Nucleo del rafe
magno
Attraverso il funicolo dorso-laterale
Lamine I e IV
PEPTIDI OPPIODI ENDOGENI
Sono state identificate 3 famiglie:
1. Encefaline
2. Endorfine
3. Dinorfine
Ogni famiglia deriva da un precursore polipetidico
diverso:
1. Proencefalina (proencefalina A)
2. Prooppiomelanocortina (POMC da cui MSH, ACTH, #3.
lipotropina, #-endorfina e #-MSH)
Prodinorfina (proencefalina B)
RECETTORI MU
• Elevata affinità per morfina, ma legano anche
alcuni oppiodi endogeni come #-endorfina ed
encefaline
– µ1 a livello sovraspinale (analgesia)
– µ2 a livello spinale (stipsi e depressione respiratoria)
• Morfina e altri agonisti oppiodi producono
analgesia principalmente attraverso interazione
con tali recettori
• Loro stimolazione è anche responsabile della
miosi e di sensazione benessere (euforia)
RECETTORI KAPPA
• Elevata affinità per endorfine endogene
• Stimolazione
– K1 produce analgesia a livello sopraspinale
– K3 produce miosi e depressione respiratoria a
partenza spinali
– K effetti psicomimetici disforici (stati di disorientamento
e/o depersonalizzazione)
RECETTORI DELTA
• Legano le encefaline
• Danno analgesia sia spinale che
sopraspinale
• Legano sia agonisti che antagonisti
degli oppiodi
CARATTERI DEL DOLORE
Può essere descritto secondo:
• Sede
• Evoluzione nel tempo e nell’arco 24H
• Intensità (scale)
• Caratteristiche (pulsante, gravativo, lancinante, urente)
• Interferenza con attività e funzioni fisiologiche