6
DIAGNOSTICA
PER IMMAGINI
Medicina Nucleare
L’Imaging nelle malattie
neurodegenerative
IL RUOLO DELLA PET CEREBRALE
CON
FLUORODESOSSI -GLUCOSIO (FDG)
NELLA
MALATTIA DI ALZHEIMER,
NELLA
COMPROMISSIONE COGNITIVA LIEVE
DEMENZA FRONTO-TEMPORALE,
(MCI),
NELLA
E NELLA
MALATTIA DI PARKINSON.
L
e Malattie Neurodegenerative (MN) compren-
dono un ampio gruppo di patologie
neurologiche, nelle quali si osserva una
perdita selettiva e progressiva di specifiche popolazioni di neuroni, la cui
eziologia, nella maggior parte dei casi,
resta sconosciuta. Nei pazienti affetti,
disturbi neurodegenerativi più comuni
sono associati a depositi intracellulari
o extracellulari di proteine anomale
nelle cellule neuronali bersaglio, documentabili solo post mortem. La perdita
progressiva della popolazione neuronale
colpita determina la presentazione e la
storia clinica di ogni MN, la cui diagnosi
è ancora in gran parte affidata alla semeiotica neurologica clinica. Tuttavia,
in un sempre maggior numero di casi,
la diagnosi di MN beneficia di percorsi
diagnostici orientati dalla presenza di
test di laboratorio, di dosaggi biochimici
specifici e, con spazio sempre maggiore,
delle metodologie di neuroimmagine
morfologico (TC, RM cerebrale) e funzionale (SPET, PET e RM funzionale).
In questa breve relazione, si presenta, tra
le tecniche di neuroimaging, il ruolo della
PET (tomografia da emissione di positroni) nelle patologie neurodegenerative
maggiori associate a deficit cognitivo
progressivo che evolve in demenza: la
malattia di Alzheimer (AD), la demenza fronto temporale (FTD), la demenza
con corpi di Lewy (DLB) e la demenza
nella malattia di Parkinson (PDD).
LA PET CEREBRALE CON FGD
ALZHEIMER
(AD) E NELLA COMPROMISSIONE COGNITIVA LIEVE (MCI)
NELLA MALATTIA DI
Oltre 20 anni di applicazione della PET
nell’AD hanno dimostrato che il metabolismo del glucosio e il flusso sanguigno
cerebrale sono alterati in associazione
nella corteccia temporo-parietale e nel
giro angolare, spesso simmetricamente.
Può anche essere coinvolta la corteccia
frontale associativa, di solito durante la
progressione di malattia. Le zone più
precocemente alterate metabolicamente
sono le zone corticali mielinizzate più tardivamente nella maturazione cerebrale,
come la corteccia di associazione emisferica, e queste sono anche sedi maggiori di
deposito corticale di ß-Amiloide atipica
(A-ß) allo studio autoptico. Un interessamento corticale asimmetrico, meno
comune, corrisponde a deficit cognitivi
maggiori se è colpito l’emisfero dominante, con compromissione precoce del
linguaggio, della capacità visuo-spaziale
e dell’orientamento. A differenza di altri
tipi di demenza, nella AD il metabolismo
del glucosio è di solito ben conservato nei
gangli della base, nella corteccia motoria
primaria, nella corteccia visiva primaria
e nel cervelletto. Questo andamento riflette in generale i sintomi clinici della
AD, con progressiva compromissione
della memoria (temporale mesiale) e del
pensiero associativo (temporale laterale),
della elaborazione e pianificazione delle
azioni (corteccia associativa posteriore),
ma con conservazione metabolica della corteccia motoria principale e della
funzione sensoriale primaria. Confronti
“voxel-based” di singoli pazienti con
casistiche normali di riferimento hanno
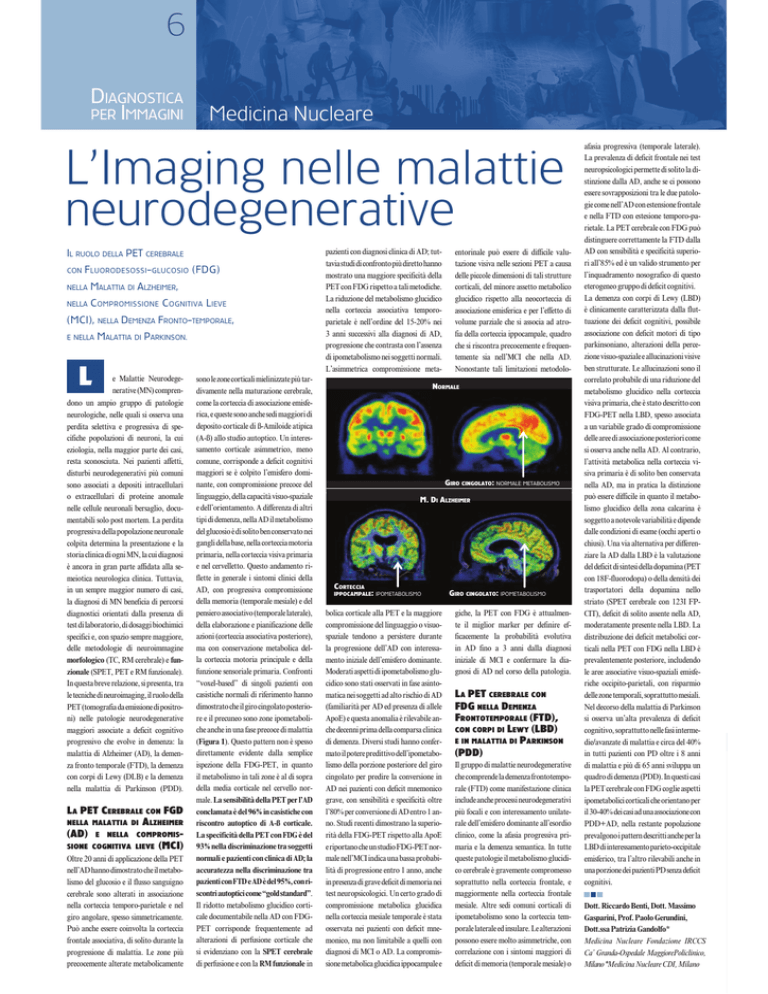
dimostrato che il giro cingolato posteriore e il precuneo sono zone ipometaboliche anche in una fase precoce di malattia
(Figura 1). Questo pattern non è spesso
direttamente evidente dalla semplice
ispezione della FDG-PET, in quanto
il metabolismo in tali zone è al di sopra
della media corticale nel cervello normale. La sensibilità della PET per l’AD
conclamata è del 96% in casistiche con
riscontro autoptico di A-ß corticale.
La specificità della PET con FDG è del
93% nella discriminazione tra soggetti
normali e pazienti con clinica di AD; la
accuratezza nella discriminazione tra
pazienti con FTD e AD è del 95%, con riscontri autoptici come “gold standard”.
Il ridotto metabolismo glucidico corticale documentabile nella AD con FDGPET corrisponde frequentemente ad
alterazioni di perfusione corticale che
si evidenziano con la SPET cerebrale
di perfusione e con la RM funzionale in
pazienti con diagnosi clinica di AD; tuttavia studi di confronto più diretto hanno
mostrato una maggiore specificità della
PET con FDG rispetto a tali metodiche.
La riduzione del metabolismo glucidico
nella corteccia associativa temporoparietale è nell’ordine del 15-20% nei
3 anni successivi alla diagnosi di AD,
progressione che contrasta con l’assenza
di ipometabolismo nei soggetti normali.
L’asimmetrica compromissione meta-
entorinale può essere di difficile valutazione visiva nelle sezioni PET a causa
delle piccole dimensioni di tali strutture
corticali, del minore assetto metabolico
glucidico rispetto alla neocorteccia di
associazione emisferica e per l’effetto di
volume parziale che si associa ad atrofia della corteccia ippocampale, quadro
che si riscontra precocemente e frequentemente sia nell’MCI che nella AD.
Nonostante tali limitazioni metodolo-
NORMALE
GIRO CINGOLATO: NORMALE METABOLISMO
M. DI ALZHEIMER
CORTECCIA
CORTECCIA
IPPOCAMPALE
: IPOMETABOLISMO GIRO CINGOLATO: IPOMETABOLISMO
IPPOCAMPALE
: IPOMETABOLISMO
bolica corticale alla PET e la maggiore
compromissione del linguaggio o visuospaziale tendono a persistere durante
la progressione dell’AD con interessamento iniziale dell’emisfero dominante.
Moderati aspetti di ipometabolismo glucidico sono stati osservati in fase asintomatica nei soggetti ad alto rischio di AD
(familiarità per AD ed presenza di allele
ApoE) e questa anomalia è rilevabile anche decenni prima della comparsa clinica
di demenza. Diversi studi hanno confermato il potere predittivo dell’ipometabolismo della porzione posteriore del giro
cingolato per predire la conversione in
AD nei pazienti con deficit mnemonico
grave, con sensibilità e specificità oltre
l’80% per conversione di AD entro 1 anno. Studi recenti dimostrano la superiorità della FDG-PET rispetto alla ApoE
e riportano che un studio FDG-PET normale nell’MCI indica una bassa probabilità di progressione entro 1 anno, anche
in presenza di grave deficit di memoria nei
test neuropsicologici. Un certo grado di
compromissione metabolica glucidica
nella corteccia mesiale temporale è stata
osservata nei pazienti con deficit mnemonico, ma non limitabile a quelli con
diagnosi di MCI o AD. La compromissione metabolica glucidica ippocampale e
giche, la PET con FDG è attualmente il miglior marker per definire efficacemente la probabilità evolutiva
in AD fino a 3 anni dalla diagnosi
iniziale di MCI e confermare la diagnosi di AD nel corso della patologia.
LA PET CEREBRALE CON
FDG NELLA DEMENZA
FRONTOTEMPORALE (FTD),
CON CORPI DI LEWY (LBD)
E IN MALATTIA DI PARKINSON
(PDD)
Il gruppo di malattie neurodegenerative
che comprende la demenza frontotemporale (FTD) come manifestazione clinica
include anche processi neurodegenerativi
più focali e con interessamento unilaterale dell’emisfero dominante all’esordio
clinico, come la afasia progressiva primaria e la demenza semantica. In tutte
queste patologie il metabolismo glucidico cerebrale è gravemente compromesso
soprattutto nella corteccia frontale, e
maggiormente nella corteccia frontale
mesiale. Altre sedi comuni corticali di
ipometabolismo sono la corteccia temporale laterale ed insulare. Le alterazioni
possono essere molto asimmetriche, con
correlazione con i sintomi maggiori di
deficit di memoria (temporale mesiale) o
afasia progressiva (temporale laterale).
La prevalenza di deficit frontale nei test
neuropsicologici permette di solito la distinzione dalla AD, anche se ci possono
essere sovrapposizioni tra le due patologie come nell’AD con estensione frontale
e nella FTD con estesione temporo-parietale. La PET cerebrale con FDG può
distinguere correttamente la FTD dalla
AD con sensibilità e specificità superiori all’85% ed è un valido strumento per
l’inquadramento nosografico di questo
eterogeneo gruppo di deficit cognitivi.
La demenza con corpi di Lewy (LBD)
è clinicamente caratterizzata dalla fluttuazione dei deficit cognitivi, possibile
associazione con deficit motori di tipo
parkinsoniano, alterazioni della percezione visuo-spaziale e allucinazioni visive
ben strutturate. Le allucinazioni sono il
correlato probabile di una riduzione del
metabolismo glucidico nella corteccia
visiva primaria, che è stato descritto con
FDG-PET nella LBD, spesso associata
a un variabile grado di compromissione
delle aree di associazione posteriori come
si osserva anche nella AD. Al contrario,
l’attività metabolica nella corteccia visiva primaria è di solito ben conservata
nella AD, ma in pratica la distinzione
può essere difficile in quanto il metabolismo glucidico della zona calcarina è
soggetto a notevole variabilità e dipende
dalle condizioni di esame (occhi aperti o
chiusi). Una via alternativa per differenziare la AD dalla LBD è la valutazione
del deficit di sintesi della dopamina (PET
con 18F-fluorodopa) o della densità dei
trasportatori della dopamina nello
striato (SPET cerebrale con 123I FPCIT), deficit di solito assente nella AD,
moderatamente presente nella LBD. La
distribuzione dei deficit metabolici corticali nella PET con FDG nella LBD è
prevalentemente posteriore, includendo
le aree associative visuo-spaziali emisferiche occipito-parietali, con risparmio
delle zone temporali, soprattutto mesiali.
Nel decorso della malattia di Parkinson
si osserva un’alta prevalenza di deficit
cognitivo, soprattutto nelle fasi intermedie/avanzate di malattia e circa del 40%
in tutti pazienti con PD oltre i 8 anni
di malattia e più di 65 anni sviluppa un
quadro di demenza (PDD). In questi casi
la PET cerebrale con FDG coglie aspetti
ipometabolici corticali che orientano per
il 30-40% dei casi ad una associazione con
PDD+AD, nella restante popolazione
prevalgono i pattern descritti anche per la
LBD di interessamento parieto-occipitale
emisferico, tra l’altro rilevabili anche in
una porzione dei pazienti PD senza deficit
cognitivi.
Dott. Riccardo Benti, Dott. Massimo
Gasparini, Prof. Paolo Gerundini,
Dott.ssa Patrizia Gandolfo*
Medicina Nucleare Fondazione IRCCS
Ca’ Granda-Ospedale MaggiorePoliclinico,
Milano *Medicina Nucleare CDI, Milano