MALATTIE INFETTIVE
Malattie Esantematiche
Le manifestazioni esantematiche non sono una prerogativa delle infezioni,
tuttavia le cause infettive sono numerose e le caratteristiche cliniche generali e
dell'esantema nello specifico possono essere dirimenti per una diagnosi clinica
sicura senza la necessità di ricorrere ad approfondimenti laboratoristici.
Morbillo
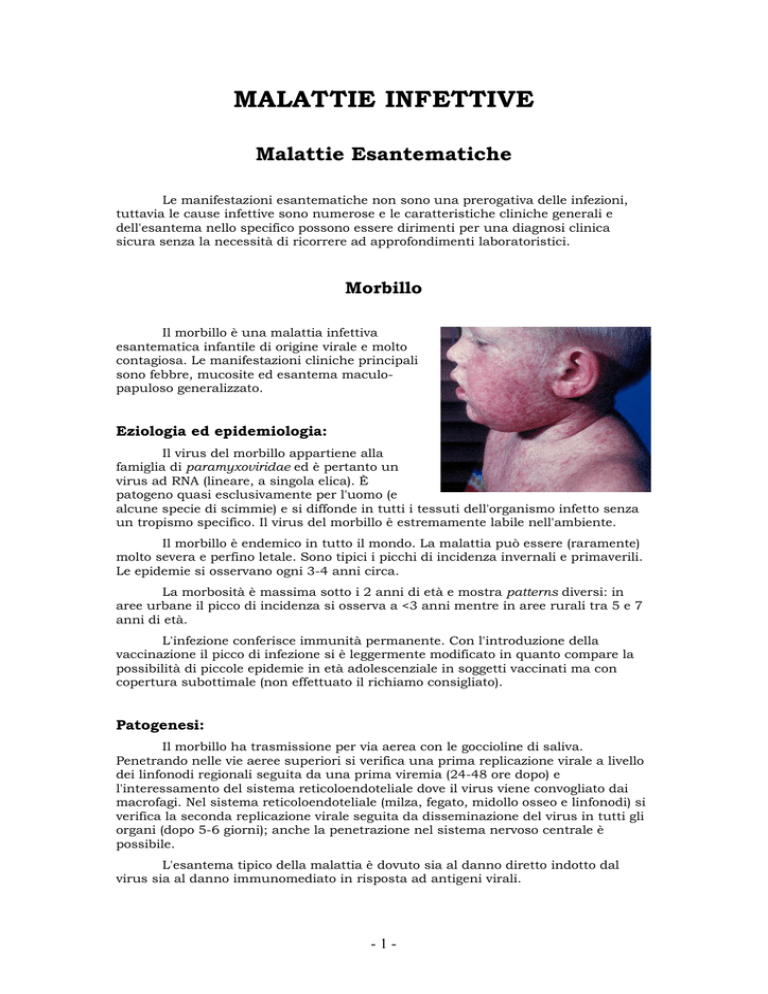
Il morbillo è una malattia infettiva
esantematica infantile di origine virale e molto
contagiosa. Le manifestazioni cliniche principali
sono febbre, mucosite ed esantema maculopapuloso generalizzato.
Eziologia ed epidemiologia:
Il virus del morbillo appartiene alla
famiglia di paramyxoviridae ed è pertanto un
virus ad RNA (lineare, a singola elica). È
patogeno quasi esclusivamente per l'uomo (e
alcune specie di scimmie) e si diffonde in tutti i tessuti dell'organismo infetto senza
un tropismo specifico. Il virus del morbillo è estremamente labile nell'ambiente.
Il morbillo è endemico in tutto il mondo. La malattia può essere (raramente)
molto severa e perfino letale. Sono tipici i picchi di incidenza invernali e primaverili.
Le epidemie si osservano ogni 3-4 anni circa.
La morbosità è massima sotto i 2 anni di età e mostra patterns diversi: in
aree urbane il picco di incidenza si osserva a <3 anni mentre in aree rurali tra 5 e 7
anni di età.
L'infezione conferisce immunità permanente. Con l'introduzione della
vaccinazione il picco di infezione si è leggermente modificato in quanto compare la
possibilità di piccole epidemie in età adolescenziale in soggetti vaccinati ma con
copertura subottimale (non effettuato il richiamo consigliato).
Patogenesi:
Il morbillo ha trasmissione per via aerea con le goccioline di saliva.
Penetrando nelle vie aeree superiori si verifica una prima replicazione virale a livello
dei linfonodi regionali seguita da una prima viremia (24-48 ore dopo) e
l'interessamento del sistema reticoloendoteliale dove il virus viene convogliato dai
macrofagi. Nel sistema reticoloendoteliale (milza, fegato, midollo osseo e linfonodi) si
verifica la seconda replicazione virale seguita da disseminazione del virus in tutti gli
organi (dopo 5-6 giorni); anche la penetrazione nel sistema nervoso centrale è
possibile.
L'esantema tipico della malattia è dovuto sia al danno diretto indotto dal
virus sia al danno immunomediato in risposta ad antigeni virali.
-1-
Clinica:
Clinicamente si distinguono alcune fasi corrispondenti ai periodi patogenetici
dell'infezione:
o
Periodo di incubazione: 9-12 giorni (la diffusione del virus nell'organismo).
o
Fase prodromica o di invasione: dura 1-3 giorni
o
Fase esantematica: di durata di 1 settimana circa
o
Risoluzione e convalescenza: 3-5 giorni
Ogni fase ha delle peculiari caratteristiche cliniche:
o
Fase prodromica: caratterizzata da:
o
Febbre alta, malessere, astenia (sintomi simil-influenzali)
o
Mucosite: congiuntivite, faringodinia, rinite e rinorrea. La tosse secca
per interessamento delle vie aeree è tipica.
o
Segno di Köplik: è un
segno patognomonico del
morbillo. Consiste in un
enantema della mucosa
orale che si manifesta
con chiazze
rotondeggianti rosse con
centro biancastro che
insorgono sulla mucosa
della guancia
anteriormente ai denti
molari. La comparsa di
questo segno precede di
poco l'esantema e
permane assieme a
questo per alcuni giorni.
Dopo 1-3 giorni i sintomi
prodromici si attenuano a addirittura scompaiono. A questo punto compare
l'esantema.
o
o
Fase esantematica: caratterizzata da una ripresa febbrile, cefalea, astenia,
inappetenza ed esantema che ha caratteristiche peculiari:
o
Esantema maculo-papuloso con progressione cranio-caudale:
coinvolge in sequenza la testa ed il volto, il
tronco e, per ultimi gli arti.
o
L'esantema risparmia i palmi e le piante.
o
Le macule tendono a confluire
o
Può associarsi ad un edema del volto,
comunque le macule sono per definizione
rilevate rispetto alla cute circostante indenne.
o
Linfoadenomegalia cervicale e retronucale,
splenomegalia
Fase di risoluzione: si ha la scomparsa della febbre per lisi, il quadro clinico
generale migliora, l'esantema regredisce con lo stesso ordine cranio-caudale.
In caso di esantema intenso si può avere una moderata desquamazione. La
linfoadenopatia e la splenomegalia si risolvono in qualche settimana.
Anche se questo decorso clinico è quello classico ci possono essere delle
manifestazioni rare:
-2-
o
Morbillo attenuato: in neonati di età <6 mesi (protetti in certa misura da
anticorpi materni). Il quadro è molto lieve.
o
Morbillo emorragico o ipertossico: quadro severo che si può osservare in
soggetti immunodeficienti. Possono comparire segni di interessamento del
sistema nervoso (encefalite, meningite), frequenti sono le sovrinfezioni
batteriche.
o
In gravidanza: il virus del morbillo può provocare danni fetali variabili in
base al periodo di gestazione.
Complicanze:
o
Sovrinfezioni batteriche: otiti, sinusiti eccetera
o
Interessamento respiratorio o cardiaco
o
Encefalomielite
o
PESS (Panencefalite Subacuta Sclerosante): si può manifestare a distanza di
anni dall'infezione acuta ed è una demielinizzazione progressiva che
comporta l'exitus in 1-3 anni.
o
Piastrinopenia
Diagnosi:
La diagnosi di morbillo è clinica in presentazione del quadro classico. Il
quadro laboratoristico può mostrare leucopenia, neutropenia, piastrinopenia e
anemia per la replicazione virale a livello del midollo osseo con la conseguente
compromissione emopoietica transitoria. In casi dubbi si può ricorrere ad esami
sierologici (IgM e IgG virus-specifici) oppure alla ricerca di antigeni o RNA virale
(importante in soggetti immunocompromessi).
Terapia:
Esssendo una malattia autolimitante la terapia è sintomatica:
o
Riposo a letto, antipiretici e antidolorifici
(paracetamolo in bambini), espettoranti
o
Antibiotici in caso di una sovrapposizione
batterica
o
Cortisonici in caso di interessamento del
SNC (riducono l'edema cerebrale e l'entità
del danno immunomediato).
o
Isolamento fino a 5 giorni dopo l'esantema
per la contagiosità del morbillo.
o
Immunoprofilassi passiva: utile in donne
gravide esposte a malati di morbillo. Di
effettua con IgG specifiche ed è utile se
somministrata entro 72 ore dal contatto a
rischio. La durata della copertura è di 3
settimane.
o
Immunoprofilassi attiva – vaccinazione: il
vaccino anti-morbillo è un virus vivo
attenuato (percui è controindicato in gravidanza e in
immunocompromissione) inettato s.c. o i.m. La vaccinazione è caldamente
consigliata (in associazione ad anti-rosolia e anti-parotite) al 15° mese di vita
-3-
e un richiamo all'età di 12-15 anni per una copertura ottimale. La
vaccinazione può avere effetti collaterali che si manifestano perlopiù nel sito
dell'innoculo dopo 10-15 giorni:
o
Flogosi locale: 20-30%
o
Febbre 10-20%
o
Rash, rinite, congiuntivite o tosse secca 2-6%
o
Encefalite post-vaccinica (1/1.000.000)
Rosolia
La rosolia è una malttia infettiva esantematica acuta
di origine virale, tipica dell'età pediatrica ed autolimitante di
importanza notevole per le possibili complicanze in
gravidanza; si manifesta con un esantema maculo-papuloso
e un importante coinvolgimento linfoghiandolare (che può
essere l'unica manifestazione della malattia).
Il virus responsabile della rosolia appartiene alla
famiglia di togaviridae (virus ad RNA, molto labile). La
rosolia è endemica in tutto il mondo; analogamente al
morbillo i picchi stagionali di incidenza si osservano in
inverno e primavera e piccole epidemie si osservano ogni 510 anni. La morbosità è prevalentemente pediatrica e
l'immunità è permanente.
Trasmissione e patogenesi:
Il virus si trasmette per via aerea con le goccioline di saliva e penetra
nell'organismo attraverso la mucosa respiratoria (o congiuntivale). La contagiosità è
accertata da 5 giorni prima a 5 giorni dopo l'esantema nella rosolia tipica mentre un
neonato con rosolia congenita elimina il virus per 12-18 mesi.
L'iniziale replicazione virale avviene a livello della mucosa respiratoria e delle
linfoghiandole regionali. Da questi siti il virus è disseminato per via ematica e si
localizza e si replica nel tessuto linfonodale (e placentare in gravidanza), così come è
capace di replicarsi bene nei tessuti fetali. Per quanto riguarda la gravidanza
l'infezione al primo trimestre causa i danni maggiori in relazione al periodo
embriogenetico mentre in trimestri successivi le manifestazioni fetali sono modeste o
scarse.
Rosolia acquisita:
Nel 50% dei casi circa
l'infezione è asintomatica, in
alcuni casi le manifestazioni si
limitano alla linfoadenomegalia.
o
Periodo di incubazione:
12-23 giorni
o
Periodo di invasione:
febbricola, malessere,
linfoadenomegalia
laterocervicale,
retronucale,
-4-
retroauricolare, sottomandibolare.
o
Esantema: il periodo esantematico può essere
associato o meno a febbre. L'esantema ha una
progressione cranio-caudale ma le macule non
tendono a confluire, sono di colore rosa sfumato e
non è preceduto da un periodo prodromico (d.d.
con il morbillo). Questo esantema puntiforme dura
3-4 giorni.
o
La regressione dell'esantema segue lo stesso
percorso cranio-caudale.
Complicanze:
Le complicanze sono più
frequenti in adulto.
o
Artropatia: interessa il 30% delle
donne in età adulta
o
Encefalomielite: 1/6.000 ed è
letale nel 205 dei casi
o
Encefalite progressiva: simile a
quella del morbillo e può
insorgere tardivamente. È una
complicanza estremamente rara.
o
Piatrinopenia autoimmune
(transitoria) che si può manifestare con emorragie cutanee e mucose
Rosolia congenita:
La rosolia congenita può avere manifestazioni più o meno gravi a seconda del
periodo di gestazione in cui è avvenuta l'infezione della madre. Il primo trimestre è
gravato da 70% di trasmissione al feto (prima della 11° settimana – 90%) mentre il
secondo ed il terzo trimestre sono meno a rischio.
La rosolia congenita si può
manifestare con:
o
Aborto: 70-90% dei casi nel
primo trimestre
o
Ritardo della crescita
intrauterina
o
Sordità, cataratta,
cardiopatie congenite –
sindrome della rosolia
congenita.
Alla nascita il bambino può essere
completamente asintomatico, può
manifestare sintomi transitori
(rash, porpora, epatite, miocardite,
piastrinopenia eccetera) opppure
delle lesioni permanenti (anche a
manifestazione tardiva) quali ipoacusia, sordità, malattie autoimmuni quali ad
esempio il diabete mellito di tipo I.
-5-
Diagnosi:
La diagnosi di rosolia è clinica in base ai segni e sintomi caratteristici della
malattia e dell'esantema nello specifico. Le indagini sierologiche possono confermare
la diagnosi con la positività di IgM o aumento di titolo di IgG specifiche. Nel neonato
la conferma sierologica può essere fatta con:
o
IgM positive alla nascita
o
IgG positive dopo 6-9 mesi (il tempo necessario per eliminare le IgG materne
acquisite passivamente)
o
IgM nel sangue fetale (alla 20°-26° settimana)
o
Ricerca dell'RNA virale su villi coriali o nel liquido amniotico
Terapia:
La terapia della rosolia è sintomatica:
o
Riposo a letto, antipiretici e antiflogistici
o
Cortisonici in caso di interessamento del sistema nervoso centrale o di
porpora trombocitopenica
o
Isolamento per 7 giorni dopo l'esantema (eliminazione del virus da 5 giorni
prima e fino a 5 giorni dopo l'esantema)
o
Immunoprofilassi passiva: utile in caso di una donna gravida esposta al
rischio di rosolia. Le IgG specifiche sono utili se somministrate entro 72 ore
dal contatto. Il vaccino è controindicato in gravidanza.
o
Vaccinazione: vaccino con virus vivo attenuato (combinato con anti-morbillo
e anti-parotite) al 15° mese di vita seguito da un richiamo all'età 12-15 anni
per una copertura ottimale.
Scarlattina
La scarlattina è una malattia esantematica
infettiva acuta ad eziologia batterica di cui è
responsabile lo Streptococcus pyogenes β-emolitico
produttore della tossina pirogena. La scarlattina è
endemica in tutto il mondo e si trasmette per via aerea
colpendo principalmente i bambini.
Clinica:
o
Periodo di incubazione: 2-5 giorni
o
Esordio clinico: improvviso con febbre, cefalea,
nausea, vomito, faringodinia (tipica della
scarlattina), enantema della lingua ("a
fragola").
o
Esantema: compare 1-2 giorni dopo
l'esordio clinico. Lesantema è maculopapuloso, a volte pettecchiale, che
inizia sempre alle radici degli arti e si
diffonde al tronco e a lvolto
risparmiando però le zone periorale, il
-6-
naso e il mento. Il quadro cllinico è patognomonico.
o
Risoluzione in 1 settimana circa con
un'importante desquamazionme cutanea.
Diagnosi:
La diagnosi è clinica. Gli indici orientativi di
laboratorio sono gli indici di infezione come la VES,
la leucocitosi neutrofila. È specifico l'aumento del
TAS (titolo anticorpale anti-streptolisina). L'esame
colturale a partire da un tampone faringeo è
risolutivo.
Complicanze:
o
Diffusione dell'infezione: ascessi tonsillari,
cerebrali, otite media.
o
Complicanze tossiche: miocardite, nefrite
interstiziale
o
Complicanze immunologiche: glomerulonefrite da immunocomplessi,
malattia reumatica.
Terapia:
o
Terapia antibiotica con benzilpenicillina, amoxicillina o eritromicina in caso
di allergia. L'inizio deve essere precoce.
o
Isolamento per 48 ore dall'inizio della terapia antibiotica.
Esantema Critico
L'esantema critico, detto anche la sesta
malattia, è una malattia esantematica acuta ad
eziologia virale dovuta al virus herpetico umano 6
(HHV-6) della famiglia degli herpesviridae (DNA
bicatenario). L'HHV-6 è un virus linfotropo che
permane caratteristicamente latente nell'organismo
dopo l'infezione. L'infezione si acquisice per via aerea,
di solito nei primi 2 anni di vita.
Clinica:
o
Periodo di incubazione: 5-15 (in media 9)
giorni
o
Esordio clinico: febbre elevata, malessere,
rinite, faringodinia, nausea, vomito.
o
Dopo 2-3 giorni compare la linfoadenopatia a
carico dei linfonodi retronucali e laterocervicali.
o
Esantema: dopo 3-5 giorni scompaiono i sintomi clinici generali e compare
l'esantema maculo-papuloso di color rosa pallido al tronco, glutei, torace,
collo. L'eruzione risparmia caratteristicamente il volto.
-7-
Diagnosi e complicanze:
La diagnosi è clinica. Le complicanze possibili sono le crisi convulsive e
l'epatite acuta ma sono manifestazioni rare.
Esantema critico in adulti:
In soggetti immunocompetenti più spesso l''infezione passa asintomatica,
raramente si manifesta come un quadro di sindrome mononucleosica.
In soggetti immunodepressi l'infezione primaria o la riattivazione del virus
latente possono dare quadri di febbre persistente, polmonite interstiziale,
corioretinite, meningite acuta. In paziente immunodepresso la diagnosi richiede il
dosaggio della viremia mediante PCR in quanto la sierologia è poco utile in
immunodepressione.
Varicella-Zoster
La varicella è una malattia
infettiva acuta di origine virale, altamente
contagiosa che predilige l'età infantile e si
manifesta con esantema vescicoloso.
L'agente eziologico è il VZV (Varicella
Zoster Virus) che fa parte degli
herpesviridae ai quali appartengono
anche altri agenti infettivi patogeni per
l'uomo:
o
Famiglia α-herpesviridae: HHV-1,
HHV-2, VZV
o
Famiglia ß-herpesviridae: CMV, HHV-6, HHV-7
o
Famiglia γ-herpesviridae: EBV, HHV-8
Come da caratteristiche dei virus erpetici anche VZV rimane latente nell'organismo
dopo l'infezione primaria e può riattivarsi provocando le manifestazioni di Herpes
Zoster.
Il virus è endemico in tutto il mondo e il 90% dei casi sono acquisiti prima
dei 9 anni. L'incidenza mostra picchi inverno-primaverili e decorso epidemico ogni 23 anni.
La trasmissione è per contatto
diretto con le vescocole e per via aerea con
goccioline di saliva. Il paziente è contagioso
a partire da 1 giorno prima dell'inizio
dell'esantema e fino alla comparsa di croste
(risoluzione dell'esantema).
Patogenesi:
Penetrando nell'organismo il virus
ha la sua prima replicazione a livello del
tessuto linfatico locale (tonsille) alla quale
segue la prima viremia e la localizzazione
del virus nelle cellule del sistema reticolo-
-8-
endoteliale (fegato, milza, linfonodi). Alla replicazione in questi tessuti segue la
seconda viremia e la localizzazione del virus a livello della cute e delle mucose dove è
responsabile della comparsa di lesioni vescicolose. Istologicamente nelle vescicole si
trovano cellule giganti multinucleate con inclusi eosinofili.
Dopo l'infezione primaria il virus rimane latente nei gangli sensitivi del
sistema nervoso per poter riattivarsi in condizioni di immunodepressione transitoria
o permanente e provocare le eruzioni tipiche dello Zoster limitate al dermatomero
innervato dal ganglio sensitivo che ospita il virus.
Ci sono diversi varianti antigeniche del VZV per cui la reinfezione è possibile
ma il decorso è di solito subclinico.
Clinica:
o
Periodo di incubazione: 10-23 giorni (dalla penetrazione alla seconda viremia).
o
Esordio: esantema che interessa torace e addome per diffondersi poi agli arti
e al volto. L'esantema è
inizialmente maculopapulare
rosso ma le papule evolvono in
poche ore in vescicole
circondate da un alone
eritematoso. 3-4 giorni dopo la
comparsa le vescicole
diventano pustole, evolvono in
croste e guariscono senza
lasciare cicatrici.
La caratteristica clinica dell'esantema
è la contemporanea presenza di più
fasi evolutive delle vescicole (lesioni
asincrone, d.d. vaiolo). Il numero delle
lesioni è variabile ma l'interessamento del cuoio capelluto e della mucosa orale è
costante.
La sintomatologia generale può essere attenuata o
assente ma di solito l'eruzione si accompagna a febbre
moderata, prurito, cefalea, artromialgie, inappetenza,
insonnia. I sintomi regrediscono assieme all'esantema in 1-2
settimane.
La complicanza principale dell'esantema della
varicella è l'impetigginizzazione – sovrinfezione delle lesioni
da Staphilococcus.
Ci possono essere delle forme cliniche atipiche:
o
Forma abortiva e forma attenuata: con clinica
pressocché assente.
o
Varicella bollosa (figura): in immunodeficienti
o
Varicella emorragica o ipertossica (figura): in
immunodeficienti ci possono essere dei danni
d'organo severi a carico di polmoni, cervelletto
eccetera.
o
In gravidanza: nei primi 4 mesi di gestazione
l'infezione virale può provocare innumerevoli danni
al feto fino all'aborto. Se acquisita dalla madre
pochi giorni prima del parto il decorso nel neonato
può essere molto severo dal momento che la madre
non riesce a passare al bambino le IgG protettive e
-9-
il neonato rimane scoperto dal punto di vista immunitario. Quest'ultima
forma è gravata da 30% di mortalità.
Complicanze:
o
Impetiginizzazione: è la complicanza più frequente
o
Nevrassite con cerebellite: si
manifesta con atassia, è
relativamente frequente ma si
risolve senza sequele nella
maggioranza dei casi
o
Polmonite interstiziale con possibile
sovrapposizione batterica
o
Glomerulonefrite da
immunocomplessi
o
Epatite
o
Cheratite
o
Neutropenia, piastrinopenia
o
Purpura Fulminans: CID con
emorragie cutanee e viscerali.
o
Sd. di Reye: steatoepatite in bambini trattati con salicilati. Per questa ragione
si debba usare il paracetamolo come antipiretico nei bambini.
- 10 -
Diagnosi:
La diagnosi è perlopiù clinica essendo il quadro molto caratteristico. I test
routinari di laboratorio sono aspecifici. Diagnosi eziologica di precisione può essere
fatta in rari casi dubbi mediante:
o
Ricerca del virus: PCR o ricerca di antigeni virali
o
Titolazione anticorpale specifica IgM e IgG.
Terapia:
o
Riposo e farmaci sintomatici: antipiretici (paracetamolo) e antiistaminici
o
Aciclovir 10mg/kg e.v. X 3/die in immunodeficienti per 7-14 giorni. Lo stesso
principio in gravidanza e in forme gravi. Aciclovir o famciclovir sono efficaci
se somministrati entro 24 ore dall'inizio della sintomatologia e possono
essere assunti per os nelle forme meno gravi.
o
Immunoprofilassi passiva: IgG specifiche sono indicate in caso di esposizione
al contagio da parte di soggetti a rischio di forme gravi (neonati prematuri,
pazienti con linfoni o leucemie, immunodeficienti)
o
Vaccinazione: virus vivo attenuato. Il vaccino è consigliato a 12-18 mesi di
età con un eventuale richiamo a 12-14 anni. Vista la tipologia del vaccino le
controindicazioni sono facilmente deducibili: immunodeficienza, gravidanza,
infezione in atto.
Herpes Zoster:
Lo Zoster (il Fuoco di Sant'Antonio) è la
manifestazione clinica della riattivazione del
VZV che si presenta di solito nell'anziano e
nell'immunodepresso.
Clinicamente si presenta come eruzione
cutanea vescicolosa a livello di un dermatomero
innervato dal nervo interessato. Lo Zoster è
una patologia sporadica che compare spesso
dopo anni di infezione latente. La clinica
comprende:
o
Febbricola, cefalea, astenia: non sono
costanti
o
Eruzione a grappolo a gettate successive di lesioni sincrone con dolore locale
urente, parestesie
o
Può esserci una
linfoadenopatia regionale
o
Risoluzione in 2-4 settimane
Le complicanze sono perlopiù delle
forme clinicahe peculiari per
interessametno di definiti gangli
sensitivi:
o
Zoster oftalmico: branca
oftalmica del trigemino (V1).
Congiuntivite, cheratite
o
Sd. di Ramsay-Hunt:
- 11 -
interessamento del ganglio genicolato con paralisi faciale periferica, eruzione
a livello del faringe, del volto e del condotto uditivo esterno.
o
Zoster del nervo uditivo
La terapia prevede Aciclovir 800mg X 5/die per 7 giorni da iniziare entro 24 ore
dall'esordio clinico. In casi particolarmente gravi si associano FANS e cortisonici. In
caso di nevralgia posterpetica (manifestazioni dolorose senza eruzione cutanea nel
territorio del nervo colpito da Zoster) sono utili i seguenti farmaci: amitriptilina,
carbamazepina, gabapentina, desipramina.
Malattia Erpetica
La malattia erpetica comprende le
infezioni primarie, le riattivazioni e le
reinfezioni da virus erpetici umani 1 e 2
(HHV-1,2) dove l'HHV-1 interessa
prevalentemente il volto mentre l'HHV-2
colpisce perlopiù i genitali.
I due virus fanno parte della
famiglia di α-heresviridae e hanno il 50% di
omologia a livello del DNA. La trasmissione
è per contatto diretto con le lesioni cutanee
o tramite le goccioline di saliva per HHV-1,
mentre HHV-2 si acquisisce per contatto
sessuale oppure con la trasmissione
perinatale con il passaggio del neonato attraverso un canale
di parto infetto.
Una volta penetrato nell'organismo il virus erpetico si
replica nell'epidermide e nel derma (nel punto di contatto),
migra nei gangli spinali per ri-migrare in periferia verso la
cute e le mucose. Le riattivazioni della latenza virale nei
gangli sensitivi coinvolgono caratteristicamente lo stesso
territorio interessato dalle manifestazioni primarie. Nelle
lesioni vescicolose si repertano cellule giganti multinucleate
come in varicella.
Clinica:
L'infezione primaria è molto spesso asintomatica. Il periodo di incubazione è
breve (2-12 giorni) e l'eruzione può presentarsi a livello orale, faringeo, cutaneo od
oculare (vulvovaginite, cervicite, proctite
nel caso di erpes genitale). In soggetti
immunodeficienti la presentazione può
essere generalizzata. Le riattivazioni
coivolgono lo stesso punto delle
manifestazioni primarie e sono
caratterizzate dalle tipiche lesioni
vescicolose "a grappolo". È possibile
l'interessamento del SNC con encefalite o
meningite.
Le riattivazioni sono frequenti e gli
intervalli tra le recidive sono variabili,
frequentemente correlate a fattori stressanti di varia natura.
La complicanza principale è la sovrinfezione batterica.
- 12 -
Terapia:
La terapia è la stessa della varicella. L'aciclovir è
indicato in casi debilitanti così come può essere
considerato come una valida profilassi in soggetti com
frequenti recidive. In interessamenti del sistema nervoso
centrale la terapia antivirale va somministrata endovena.
- 13 -
Mononucleosi Infettiva
La mononucleosi infettiva è
una malattia infettiva a decorso
tipicamente acuto causata dal virus di
Epstein-Barr (EBV) e caratterizzata da
febbre elevata, faringotonsillite e
linfoadenopatia laterocervicale e
sottomandibolare con
epatosplenomegalia, linfomonocitosi
con elementi mononucleati atipici
detti virociti.
L’EBV è un γ-herpesvirus (ne
esistono due sottotipi EBV-1 e EBV-2)
che rimane latente nell’organismo e può dare manifestazioni da riattivazione. Il
tropismo è elettivo per i linfociti B e le cellule epiteliali del rinofaringe. Il DNA virale
nella cellula infetta può trovarsi in forma episodica oppure essere integrato nel DNA
cellulare. In vitro le cellule infette sono immortalizzate. Gli antigeni virali diagnostici
sono VCA (capside), EBNA (nucleare), EA (precoce).
Al virus di Epstein-Barr sono associate diverse manifestazioni patologiche:
•
Mononucleosi infettiva
•
Linfoma di Burkitt africano
•
Carcinoma rinofaringeo
•
Altre malattie linfoproliferative
Epidemiologia:
La mononucleosi infettiva è endemica in tutto il mondo e colpisce
prevalentemente all’età di 15-20 anni. In paesi in via di sviluppo l’infezione si
acquisisce in età più precoce (1-4 anni) e può decorrere con manifestazioni scarse o
assenti. Il virus è trasmesso per via aerea, per contagio diretto tramite la saliva e ci
sono possibilità di trasmissione per via ematica e per contagio indiretto attraverso
oggetti contaminati (stoviglie, posate eccetera).
Patogenesi:
Il virus penetra attraverso la
mucosa faringea e infetta le cellule
epiteliali e i linfociti B locali con
disseminazione linfonodale regionale e
ematica. Il contatto con i linfociti B
avviene tramite il recettore CR2
(presente anche sull’epitelio della
cervice uterina e nelle cellule
dendritiche dove il virus si può
replicare) e può interessare fino al
20% dei linfociti B circolanti.
L’infezione dei linfociti B provoca
un’iperstimolazione e l’attivazione
policlonale di questi con la produzione
di autoanticorpi (autoAc) che sono capaci di agglutinare emazie di montone e di bue
(reazione di Paul Bunnel, può mancare in soggetti pediatrici).
- 14 -
La comparsa dei virociti (detti anche cellule di Downey) nel sangue
corrisponde al ritrovare di queste cellule anche nei tessuti quali il fegato, la milza, i
linfonodi ed il midollo osseo. I virociti non sono altro che linfociti attivati. La
splenomegalia conseguente alla localizzazione di queste cellule nella milza aumenta
notevolmente il rischi di rottura della milza o di lacerazioni e sanguinamenti (perciò
va sconsigliata attività sportiva).
infette.
La stimolazione policlonale è limitata dai linfociti CD8+ attivi contro le cellule
Con il superamento della fase acuta il virus continua ad essere eliminato
dall’organismo per oltre 1 anno rimanendo comunque latente spiegando la
possibilità di riattivazioni in relazione ad episodi di riduzione della competenza
immunitaria.
Clinica:
•
P.I.: variabile. 1-2 mesi
nell’adulto, 10-15 giorni nel
bambino.
•
Esordio: febbre elevata,
cefalea, malessere generale
•
Faringotonsillite eritematosa
o pseudomembranosa con
faringodinia presente nel 7080% dei pazienti
•
Linfoadenopatia
laterocervicale o
sistemica con linfonodi
duro-elastici, mobili e
dolenti alla palpazione.
•
Splenomegalia (50%) con
rischio di rottura,
epatomegalia (20%)
talora con epatite, ittero
(8%)
•
Rash cutaneo maculopapuloso (10%), perlopiù
compare in pazienti
tattati con penicilline
semisintetiche.
•
Sindromi neurologiche (<1%)
sostenute dal virus:
meningite, encefalite,
sindrome di Guillain-Barré
•
Anemia emolitica
autoimmune (0,5-3%),
piastrinopenia autoimmune
•
Manifestazioni molto rare:
polmonite interstiziale,
miocardite, pericardite,
orchite, ulcere dei genitali.
I dati di laboratorio mostrano
leucocitosi (linfomonocitosi e
- 15 -
neutropenia relativa), virociti nel sangue periferico, rialzo delle transaminasi,
raramente elevata bilirubina, fosfatasi alcalina o piastrinopenia grave.
L’episodio acuto si risolve nel giro di 2 settimane in maniera spontanea ed
entro 1 mese regrediscono le manifestazioni d’organo come la splenomegalia,
l’epatomegalia e la linfoadenopatia. L’infezione cronica da EBV può provocare uno
stato di affaticamento cronico con febbricola e cefalea (epidemiologicamente sembra
correlata alla sindrome da affaticamento cronico)
Complicanze:
•
Rottura della milza
•
Anemia emolitica autoimmune
•
Porpora trombocitopenica
•
Faringotonsillite batterica
•
Dispnea da ostacolo alle vie aeree
•
Meningite, sd. di Guillain-Barré
•
Infezione generalizzata in immunocompromessi
•
Sindrome di Duncan (detta anche sd. XLP) da abnorme produzione di
anticorpi
Diagnosi:
•
Reazione di Paul-Bunnel: ricordando che la reazione si negativizza dopo
alcuni mesi e che in soggetti pediatrici può non essere positiva
•
Ricerca di anticorpi specifici: con immunofluorescenza (IF) o ELISA: gli
anticorpi ricercati sono diretti contro VCA, EBNA ed EA.
•
PCR alla ricerca del DNA virale
•
Coltura del EBV
Gli anticorpi IgM anti-VCA sono i primi a comparire nel siero e durano circa 2 mesi.
Le IgG anti-VCA sono a vita. IgG anti-EBNA compaiono al superamento della fase
acuta e permangono a vita; la loro presenza indica che l’infezione non è recente. IgG
anti-EA sono sensibili al 70% e compaiono 1 mese dopo l’esordio per scomparire
dopo 3-6 mesi. Nelle riacutizzazione il titolo anticorpale cresce come è ragionevole
supporre.
Entrano in diagnosi differenziale con la mononucleosi infettiva numerose
condizioni:
•
Sindrome mononucleosica da CMV: Ac CMV-specifici, manca la faringodinia
e la splenomegalia. La linfoadenopatia è di entità minore.
•
Toxoplasmosi linfoghiandolare: manca la faringotonsillite, la febbre è
moderata o assente.
•
Rosolia: mancano la leucocitosi, la faringodinia e la febbre elevata
•
Leucemia: quadro ematologico monoclonale
•
Epatite virale acuta: mancano la leucocitosi e la faringotonsillite
•
Faringotonsillite batterica: transaminasi nella norma, leucocitosi neutrofila.
- 16 -
Terapia:
La terapia della mononucleosi infettiva è una
terapia sintomatica a domicilio con riposo per 2
settimane e trattamento delle eventuali complicanze:
ad esempio prednisone nelle manifestazioni
autoimmuni. In confizioni gravi può essere
intrapresa una terapia antivirale. Le considerazioni
generali includono: evitare attività fisica intensa e
evitare donazioni di sangue.
- 17 -
Malattia di Lyme
La malattia di Lyme è una malattia
infiammatoria acuta (talvolta cronica) causata
da una spirocheta Borrelia burgdorferi trasmessa
mediante puntura di zecca del genere Ixodes. La
malattia di Lyme si manifesta con sintomi
cutanei, articolari, cardiaci e a carico dell’SNC.
La malattia è soggetta a notifica obbligatoria.
Borrelia burgdorferi è una spirocheta
mobile microaerofila a crescita lenta che richiede
comunque terreni particolari. Questa spirocheta
è dotata da più di 100 antigeni alcuni dei quali
sono usati in diagnostica. Esistono diversi
sottotipi di B. burgdorferi con diversa
distribuzione geografica:
•
B. burgdorferi sensu strictu: USA, Europa.
Provoca manifestazioni prevalentemente
articolari
•
B. burgdorferi afzeli: Europa ed Asia. Provoca sopratutto manifestazioni
cutanee
•
B. burgdorferi garinii: Asia ed Europa. Interessa l’SNC
Epidemiologia:
Il numero reale dei casi di infezione è largamente sottostimato per il
frequente decorso asintomatico. La sieroprevalenza in Italia è attorno al 2-4% (2-8%
in Europa). La trasmissione
avviene per puntura da parte di
una zecca infetta (il ciclo vitale
della zecca è di 2 anni) e a questo
proposito le forme più pericolose
sono le forme piccole della zecca
(ninfe) che sono difficilmente
visibili. Il contatto con la zecca
avviene generalmente in
primavera-estate in climi
temperati e umidi con abbondante
vegetazione. I serbatoi animali
della spirocheta sono molteplici
tra roditori, mammiferi e uccelli. L’infezione si trasmette al termine del pasto
ematico della zecca per cui più tempo rimane attaccato il parassita più alta è la
probabilità di trasmissione dell’infezione.
Tra i fattori di rischio per la malattia di Lyme vanno menzionati:
•
Maggiore durata del pasto ematico (>48 ore)
•
Zecca in forme di ninfa (piccole dimensioni)
•
Periodo tra maggio e luglio
•
Categorie a rischio: cacciatori, allevatori, boscaioli ecc.
•
Ampie aree corporee esposte
- 18 -
Patogenesi:
La B. burgdorferi penetra nell’organismo
umano attraverso il sito di puntura della zecca, si
moltiplica a livello cutaneo per disseminarsi per via
linfatica ed ematica con localizzazioni articolari,
cardiache, a livello dell’SNC e SNP.
L’azione patogena di queste spirochete sta
sia nell’azione diretta del germe che in altri fattori
quali:
•
Stimolazione della risposta infiammatoria
•
Permanenza nell’ospite per lunghi periodi
con possibilità di indurre fenomeni
autoimmuni.
Clinica:
Anche se l’infezione passa in maniera
asintomatica nel 50% dei casi circa è utile
delineare le fasi classiche della malattia che
comprendono fasi precoci e tardive:
•
Periodo di incubazione: circa 2 settimane
•
Fase precoce dell’infezione localizzata:
compare nel 50% degli infetti. La
sintomatologia comprende
•
•
o
febbre, malessere, artromialgie,
cefalea (a volte con rigidità nucale)
o
eritema cronico migrante: eritema
anulare che aumenta di dimensioni
con vescicola o necrosi centrale
o
linfoadenomegalia,
epatosplenomegalia
o
risoluzione spontanea in 2-3
settimane
Fase precoce con infezione disseminata:
interessa il 15-20% dei casi e compare
settimane o mesi dopo l’infezione. La clinica
di questa fase include:
o
Meningite (a liquor limpido), encefalite, mielite, polineuropatie
sensitivo-motorie, paralisi del faciale (o di altri nervi cranici),
poliradiculoneuriti.
o
Blocco AV, miocardite, pericardite
o
Artralgie migranti simmetriche, mialgie
o
Lesioni cutanee eritematose secondarie
o
Raramente: epatite, iridociclite, corioretinite, linfoadenomegalia
Fase tardiva: 50-60% dei casi, si manifesta dopo 6 settimane fino a 2 anni
dopo l’infezione:
o
Artriti ricorrenti delle grosse articolazioni, ingravescenti e con gravi
sequele artrosiche
- 19 -
o
Encefalomielite progressiva
o
Acrodermatite cronica atrofizzante
(discromia rosso-blu e atrofia cutanea)
o
Polineuropatia assonale cronica
Diagnosi:
•
Clinica: eritema, artralgie, ecc
•
Laboratorio: lieve anemia, aumento della VES e
dell'LDH
•
Rx articolazioni, ECG
•
Isolamento della B. burgdorferi (da biopsie
cutanee, liquor, liquido sinoviale) mediante
coltura o PCR
•
Sierologia: IgM o IgG con conferma con Western Blot di almeno 2 bande di
IgG e almeno 2 bande di IgG specifiche
Terapia:
In assenza di complicanze cardiache o a livello nervoso il trattamento si basa
su doxiciclina, amoxicillina o eritromicina per via orale per 14-60 giorni. In presenza
di interesamento encefalico o con blocco AV di 3° grado – benzilpenicillina,
ceftriaxone o cefotaxime e.v. per 30 giorni.
La profilassi della malattia di Lyme consiste nella precoce rimozione della
zecca con disinfezione della puntura mentre il ruolo di una profilassi antibiotica è
soggetto a dibattito. È possibile la vaccinazione per soggetti a rischio con necessità
di richiami (vaccino a DNA ricombinante).
- 20 -
Febbre Ricorrente
La febbre ricorrente è un'infezione da borrelie
trasmessa da diversi vettori:
o
Pidocchi: prevale in Nord Africa, il germe
responsabile è la Borrelia recurrentis.
o
Zecche: presente in Africa, Europa, America
centromeridionale e nel bacino del Mediterraneo.
Le specie coinvolte sono Borrelia duttoni e turicatae.
Epidemiologia:
Trasmissione tramite zecche o pidocchi con malattia manifesta
sporadicamente. Il serbatoio naturale dell'infezione è rappresentato dai roditori. Le
borrelie presentano fenomeni frequenti di modificazione antigenica la quale rende i
meccanismi immunitari poco efficienti con il risultato di episodi febbrili ricorrenti
per la non eradicazione del germe.
Clinica:
o
Periodo di incubazione: 5-8 giorni
o
Esordio: improvviso con febbre, brividi, cefalea, artromialgie intense, talora
sintomi gastrointestinali, rash fugace al tronco, epatosplenomegalia.
o
Risoluzione spontanea in 3-6 giorni con nuovi episodi ricorrenti della
sintomatologia intervallati da 7-10 giorni di completo benessere. La
convalescenza è prolungata con manifestazioni asteniche anche marcate.
La prognosi è generalmente buona, salvo le complicanze le quali non sono rare in
soggetti anziani, defedati o
immunodeficienti. Le complicanze
possono essere:
o
Meningite o meningoencefalite
a liquor limpido
o
Paralisi dei nervi cranici
(sopratutto il faciale)
o
Endocardite, miocardite
o
Iridociclite
o
Epatite acuta
Diagnosi:
La diagnosi può essere fatta mediante identificazione del patogeno nel liquor
o nel sangue oppure con analisi sierologiche (immunofluorescenza indiretta o
fissazione del complemento).
Terapia:
La terapia si avvale di antibiotici quali la doxiciclina, l'eritromicina o il
cloramfenicolo per la durata di 4-5 giorni. È importante che l'antibiotico abbia un
buon transfer liquorale come quelli segnalati in precedenza.
- 21 -
Toxoplasmosi
La toxoplasmosi è un'infezione acuta e cronica da Toxoplasma gondii, un
protozoo parassita endocellulare obbligato. Nell'ospite immunocompetente l'infezione
è perlopiù asintomatica ma può dare quadri severi in immunocompromessi e in
gravidanza:
o
Toxoplasmosi congenita: contratta durante la vita intrauterina, colpisce
l'SNC e l'occhio e può essere di varia gravità a seconda del periodo
gestazionale in cui è stata acquisita.
o
Toxoplasmosi acquisita: contratta dopo la nascita ed è di solito
asintomatica. Superata l'infezione acuta il parassita rimane latente racchiuso
in cisti nel tessuto muscolare e nell'SNC con la possibilità di riattivazioni in
relazione ad episodi di immunodepressione. Infatti in immunodeficienti la
toxoplasmosi è più spesso un risultato di riattivazione del parassita e non
un'infezione primaria. Colpisce l'SNC, la retina, il miocardio e il polmone.
Toxoplasma gondii:
L'ospite definitivo di questo protozoo è il gatto nel quale si svolge la fase
sessuata del ciclo vitale del parassita. Le cisti protozoarie sono eliminate con le feci.
Altri animali (bovini, equini, suini), così come l'uomo, sono ospiti intermedi che
subiscono la fase asessuata del ciclo vitale del Toxoplasma. Nell'intestino del gatto
gli sporozoiti sono eliminati in forma di oocisti le quali hanno una sorprendente
resistenza nell'ambiente – fino a 18 mesi in terreno umido.
Le oocisti ingeriti da ospiti intermedi liberano gli sporozoiti nello stomaco e i
tachizoiti compaiono nel circolo ematico per incistarsi come bradizoiti nel tessuto
- 22 -
muscolare e nervoso controllati dall'immunità cellulo-mediata. Le cisti ingerite
possiedono capacità infettiva.
Clinica:
La toxoplasmosi acquisita è generalmente contratta tramite l'ingestione di
oocisti mature oppure di cisti tissutali in carne cruda o poco cotta oppure di
alimenti contaminati dai gatti. Altre modalità includono l'ingestione diretta di oocisti
eliminate dai gatti, le trasfusioni di sangue e/o leucociti, trapianti di organi
contenenti cisti (sopratutto il cuore) oppure mediante puntura con materiale infetto.
La toxoplasmosi congenita invece si acquisisce mediante un passaggio
transplacentare di tachizoiti durante l'infezione materna.
Nell'ospite immunocompetente i tachizoiti a livello intestinale sono fagocitati
dai macrofagi con la conseguente produzione di IgA (i primi anticorpi a comparire
nella fase iniziale dell'infezione). Passati in circolo i parassiti, si sviluppa un'intensa
reazione immunitaria con produzione di IgM e
IgG mentre la risposta CD8+ elimina i macrofagi
infetti. 7 giorni dal contagio la parassitemia cessa
e rimangono i bradizoiti incistati nei tessuti e
controllati dalla risposta cellulare. I sintomi,
quando presenti, sono linfoadenite, febbricola,
astenia, modesta epatosplenomegalia,
linfomonocitosi reattiva.
In ospiti con deficit dell'immunità la fase
parassitemica non cessa e vengono coinvolti più
organi e tessuti. Pertanto, i sintomi si
racchiudono all'interno di quadri complessi:
o
Toxoplasmosi cerebrale: interessamento
locale con segni focali, comportamentali,
convulsioni, febbre (presente nel 10-70%
dei casi, confusione, letargia. La diagnosi
della toxoplasmosi cerebrale si fa con la
TC o la RM in quanto le cisti hanno un
aspetto patognomonico – cisti corticali o
sottocorticali (assenza di lesioni a carico
della sostanza bianca) con il tipico
enhancement dopo la somministrazione
del mezzo di contrasto.
o
Toxoplasmosi d'organo: miocardite,
epatite, broncopolmonite, corioretinite
(l'unica manifestazione d'organo che può
essere presente anche in ospiti
immunocompetenti). La biopsia della lesione pone la diagnosi.
Il rischio di trasmissione della toxoplasmosi dalla madre al feto varia in base al
periodo gestazionale essendo del 10-15% nel primo trimestre e del 60-70% nel 3°
trimestre. Questo maggiore rischio in gravidanza avanzata è "compensato" dalla
minore gravità; infatti le toxoplasmosi acquisite precocemente sono più gravi. Le
possibili manifestazioni della toxoplasmosi congenita sono:
o
Aborto nel primo trimestre
o
Alterazioni neurologiche: idrocefalo, calcificazioni, alterazioni dell'EEG,
convulsioni, ritardo mentale
o
Malattia acuta generalizzata: polmonite, ittero, encefalopatia,
epatosplenomegalia
- 23 -
o
Malattia subacuta cronica: nessuna manifestazione alla nascita ma uno
sviluppo di corioretinite e di alterazioni tardive dell'EEG.
Diagnosi:
Il protozoo può essere identificato direttamente isolandolo dal liquor o dal
sangue del paziente oppure ricercando il DNA con la PCR. La sierologia con la
ricerca di IgA, IgM (rimangono per 6-9 mesi) e IgG. Il test di avidità delle IgG è utile
per stabilire la durata dell'infezione in qunto l'avidità cresce col tempo di contatto col
protozoo. TC ed RMN sono di indubbia utilità nella forma cerebrale.
La diagnosi di toxoplasmosi nel neonato può essere fatta con:
o
Ricerca del DNA del protozoo nel liquido amniotico
o
Coltura su sangue fetale
o
Ricerca di IgM o IgA (le IgG hanno origine materna) dopo 7 giorni di vita
Terapia:
Nell'immunocompetente:
o
Corioretinite: pirimetamina 100mg e sulfadiazina (o clindamicina) per 4
settimane. Sono sempre consigliate associazioni di acido folinico.
o
In gravidanza: pirimetamina e sulfadiazina (nel 2° o nel 3° trimestre) oppure
spiramicina in associazione alla sulfadiazina.
Nel caso di toxoplasmosi congenita: pirimetamina e sulfadiazina alterante con la
spiramicina per 6-12 mesi.
Nell'ospite immunocompromesso la terapia è ovviamente più aggressiva
con pirimetamina e sulfadiazina associate all'acido folinico con clindamicina,
claritromicina o azitromicina e atorvaquone. La profilassi con atorvaquone può
essere utile in casi selezionati.
- 24 -
Tularemia
La malattia è causata da Francisella tularensis, un gram-negativo immobile,
labile al calore ma resistente a lungo in ambiente freddo. Il serbatorio di questo
germe è dato da animali selvatici quali lepri, scoiattoli, volpi eccetera e la malattia è
endemica in Europa, USA, Russia. La
trasmissione avviene per:
o
Morso di zecca: è la via di
trasmissione prevalente
o
Puntura di mosche o zanzare infette
o
Contatto con animali infetti
o
Inalazione o ingestione di aque (o
vapori) contaminati
Patogenesi:
Nel punto di inoculo del germe si sviluppa una lesione locale con
linfoadenopatia regionale, talora si verifica una diffusione sistemica dell'infezione. La
trasmissione per inalazione può dar luogo a polmonite. In immunodeficienti i quadri
clinici sono quelli di infezione disseminata.
Clinica:
Dopo un periodo di incubazione di 3-7 giorni l'esordio clinico si presenta con
febbre, cefalea, fotofobia, bradicardia, nausea e vomito, diarrea. Nel punto di inoculo
compare la lesione cutanea che è una papula che si trasforma in ulcerazione
accompagnata da linfoadenopatia talora complicata da fistolizzazione.
Di regola si ha una guarigione spontanea in 2-3 settimane. Altre
manifestazioni cliniche possibili:
o
Linfoadenite senza lesione cutanea
o
Forma oculoghiandolare
o
Forma gastrointestinale
o
Forma polmonare
o
Forma tifoidea
o
Altre ancora più rare
La prognosi è favorevole ad eccezione dei casi con infezione sistemica
(immunocompromessi dove si raggiunge il 30% di mortalità).
Diagnosi e terapia:
La diagnosi di tularemia si avvale dei dati clinici, dell'identificazione del
germe con biopsia tissutale o sul prelievo di sangue (o espettorato nella forma
polmonare) e delle indagini sierologiche.
La terapia antibiotica si basa su streptomicina, gentamicina, tetraciclina o
cloramfenicolo i.m. o per os per 10 giorni. Ascessi e fistole vanno trattate
chirugicamente.
- 25 -
Dengue
Dengue: malattia virale con una forma classica e
una emorragica il cui agente causale è un flavivirus
trasmesso dalla zanzara (femmina) Aedes aegypti (zanzara
tigre). Il virus Dengue è un virus ad RNA con 4 sierotipi
diversamente distribuiti nelle aree endemiche. Ogni
sierotipo conferisce immunità permanente sierotipospecifica e una bassa cross-immunità. Ogni sierotipo può
dare forme gravi e ci possono essere delle reinfezioni con
sierotipi diversi.
La zanzara si infetta con il virus durante un pasto
ematico da un uomo malato in fase viremica. In questo
modo il virus è trasmesso con la zanzara ad altro ospite
umano. È utile rocordare che la zanzara Aedes è attiva
sopratutto nelle ore diurne (l'Anopheles invece nelle ore notturne).
Una volta penetrato nell'organismo umano il virus del Dengue si replica negli
organi bersaglio infettando leucociti e il tessuto linfoghiandolare da dove si diffonde
in circolo – la fase viremica.
Epidemiologia:
Ad oggi in Italia tutti i casi di Dengue sono di importazione. Le aree
endemiche sono: America Latina, Africa SubSahariana, Australia, India e Sud-Est
Asiatico. Attualmente si stimano circa 100 milioni di nuovi casi annuali di Dengue
classica e 250,000 di Dengue emorragica. I fattori di rischio per la forma emorragica
sono:
o
Ceppo virale più virulento:
anche se tutti i sierotipi
possono dare la forma
emorragica
o
Precedente contatto con il
virus (o anticorpi acquisiti
dalla madre) conferisce un
maggiore rischio di febbre
emorragica
o
Fattori genetici dell'ospite
o
Età dell'ospite
o
Zone con più sierotipi
endemici
Patogenesi:
Il superamento dell'infezione lascia anticorpi specifici per lo stesso sierotipo
(detti Ac omologhi). Nell'infezione secondaria con un altro sierotipo gli anticorpi
preesistenti formano immunocomplessi non neutralizzanti detti immunocomplessi
infettivi. L'iperstimolazione delle cellule mononucleate che ne consegue con la
esagerata reazione cellulare è responsabile delle manifestazioni emorragiche. Infatti
la stimolazione della risposta cellulare stimola a sua volta la replicazione virale e i
monociti infetti rilasciano grandi quantità di mediatori flogistici vasoattivi che
permeabilizzano i vasi sanguigni.
- 26 -
Clinica:
L'infezione da virus di Dengue si può presentare come si è accenato sotto
diverse forme:
o
Febbre indifferenziata: la forma più comune e spesso asintomatica e
autolimitante
o
Classica: clinica di febbre intensa (detta febbre "spaccaossa"), cefalea, dolori
articolari e muscolari, nausea e vomito, rash cutaneo che risparmia le zone
palmoplantari con possibili lievi manifestazioni emorragiche.
L'interessamento epatico è possibile come lo è l'interesamento dell'SNC anche
se più raro (alterato livello di coscienza, convulsioni, rigidità nucale e segni
focali).
o
Dengue emorragica: per la diagnosi di questa forma sono necessari 4 criteri
diagnostici:
o
o
Febbre presente o storia di
febbre recente
o
Manifestazioni emorragiche:
petecchie, aumentato flusso
mestruale, ecchimosi,
porpora, epistassi, melena,
ematuria o ematemesi.
o
Piastrinopenia (<100.000)
o
Alterazioni in senso di
permeabilizzazione capillare:
ipoalbuminemia, aumentato ematocrito,
ascite o versamenti pleurici
Dengue con shock: oltre a rispondere ai 4 criteri
per la dengue emorragica ha evidenze di
instabilità circolatoria o shock franco.
La dengue emorragica può presentarsi con vari gradi di
gravità dalla forma classica allo shock e la severità può
essere gradata in:
o
Grado I:
o
Febbre e sintomi aspecifici
o
Test del tourniquet positivo: comparsa di
petecchie dopo 5 minuti di applicazione
del manicotto dello sfigmomanometro al
braccio.
o
Grado II: ai precedenti si aggiungono i
sanguinamenti spontanei
o
Grado III: iniziali sintomi di insufficienza
circolatoria
o
Gradi IV: shock franco
Diagnosi:
Per la diagnosi sono indispensabili le
considerazioni epidemiologiche come la stagione, la
permanenza in regioni endemiche. In questo modo la comparsa di febbre dopo 2
settimane o più dal ritorno dalla zona endemica esclude la dengue dalla diagnosi.
- 27 -
Entrano in diagnosi differenziale con la dengue numerose affezioni tra cui:
morbillo, influenza, rosolia, malaria, febbre tifoide, leptospirosi, sepsi
meningococcica o batterica, rickettsiosi, altre febbri emorragiche.
Gli esami di laboratorio devono includere la conta ematica, albumina e
funzionalità epatica così come l'esame delle urine per la valutazione di
microematuria. I test specifici per dengue sono l'isolamento del virus ricercando il
suo genoma con tecniche di RT-PCR o indagini sierologiche con ELISA per
evidenziare IgM o IgG specifiche.
Terapia:
La terapia è sintomatica e di supporto circolatorio. Non esiste terapia
antivirale specifica.
- 28 -
Leishmaniosi
La leishmaniosi è una antropozoonosi causata da protozoi flagellati del
genere Leishmania trasmessi da artropodi del genere Phlebotomus (papatacci). Le
forme umane di leishmaniosi sono:
o
Leishmaniosi generalizzata (viscerale): Mediterraneo, Asia, Africa e Sud
America. Causata da Leishmania donovani.
o
Leishmaniosi cutanea: Asia e Mediterraneo
o
Leishmaniosi mucocutanea: America Centro-Meridionale
Altre specie coinvolte sono la L. mexicana, brasiliensis e tropica.
Il serbatoio dell'infezione è dato da roditori e da cani (solo in India anche l'uomo
funge da serbatoio). I flebotomi ematofagi sono le femmine e sono attive di giorno. Il
protozoo pentra nell'organismo tramite la puntura dell'insetto (anche la trasmissione
parenterale è possibile durante la parassitemia) e nel luogo della puntura si sviluppa
una lesione cutanea primaria. I parassiti promastigoti vengono fagocitati e si
trasformano in amastigoti che proliferano e si liberano per lisi dei macrofagi per
disseminarsi negli organi del sistema reticoloendoteliale nella forma viscerale,
oppure per essere limitati in granulomi cutanei o mucosi tenuti sotto controllo da
parte del sistema immunitario.
Leishmaniosi viscerale:
La leishmaniosi viscerale
ha più fasi cliniche:
o
Esordio: la lesione
primaria può passare
incosservata. Graduale
comparsa di poussé febbrili,
astenia, anoressia, disturbi
gastrointestinali e
splenomegalia reattiva.
o
Fase di stato: febbre
intermittente subcontinua
(serotina) con sudorazioni,
epatosplenomegalia,
linfoadenopatia e
deperimento organico generale.
Lo sviluppo dei segni clinici è
graduale e può durare mesi in
cui compaiono: febbre,
alterazioni epatiche e
disprotidemia, interessamento
midollare con leucopenia,
piastrinopenia ed anemia.
La diagnosi della forma viscerale si fa
identificando il parassita da una biopsia
epatica o midollare mentre l'evidenza
sierologica non dà la certezza
diagnostica.
- 29 -
Terapia:
In assenza di terapia efficace la prognosi è infausta. Il trattamento deve
essere attuato con antimoniali pentavalenti, amfotericina B o pentamidina.
Leishmaniosi cutanea:
Si distingue la
leishmaniosi del Nuovo
Mondo e quella del
Vecchio Mondo (il Bottone
d'Oriente). La clinica
consiste in lesioni cutanee
che guariscono con
cicatrizzazione. Il nodulo
si può sovrinfettare o
anche erodere strutture
scheltriche sottostanti
(specie in faccia). La
terapia specifica è
risolutiva.
- 30 -
La Malaria
La malaria è una
malattia infettiva da protozoi del
genere Plasmodium trasmessa
da zanzare femmine del genere
Anopheles. I plasmodi sono
distinti in 4 specie:
o
Plasmodium falciparum: il
più virulento
o
Plasmodium vivax
o
Plasmodium ovale
o
Plasmodium malariae
Epidemiologia:
La malaria è diffusa in aree
di diffusione delle zanzare Anopheles:
aree tropicali e subtropicali fino
all'altitudine di 1500-2500m in
temperature di 20-30°C e condizioni
di umidità alta.
Le 4 specie di plasmodi sono
distribuiti diversamente nelle varie
regioni endemiche: il P. vivax prevale
in Asia e America Centromerodionale, il P. falciparum nel
Sud-Est asiatico e nell'Africa
occidentale.
Ogni anno ci sono circa 270-500 milioni di casi che comportano 1-1.5 milioni
di morti, sopratutto tra i bambini africani. Si stimano circa 30.000 casi annuali di
malaria importata da viaggiatori in zone endemiche – a maggior rischio sono i viaggi
in Africa Occidentale. Attualmente nessuna profilassi farmacologica o vaccinale è
obbligatoria per i viaggiatori, salvo la febbre gialla in certe zone dell'Africa.
Ciclo vitale del plasmodio:
Il ciclo è duplice: sessuato e asessuato. Il ciclo vitale asessuato avviene
nell'ospite umano mentre il ciclo sessuato ha luogo nelle zanzare.
Il plasmodio maturo che si localizza nelle ghiandole salivari dell'Anopheles
viene inettato in circolo con la puntura dell'insetto e si localizza nel fegato dove si
replica in forma di schizonte. Questa fase extraerotrociatria è asintomatica. Lo
schizonte epatico libera in circolo le forme parassitarie immature che infettano i
globuli rossi dove diventano trofozoiti che maturano a schizonti i quali liberano
nuovi elementi parassitari attraverso la lisi del globulo rosso. Gli schizonti
eritrocitari liberano anche i gametociti i quali possono essere assunti dalla zanzara
ed espletare nell'insetto il ciclo sessuato per migrare nelle ghiandole salivari e poter
quindi infettare nuovamente un ospite umano.
La febbre che costituisce la tipica manifestazione clinica della malaria è
dovuta infatti agli episodi emolitici di liberazione dei parassiti in circolo.
- 31 -
La fase di replicazione preerotrocitaria che avviene nel fegato ha durata di
circa 1 settimana (fino a 2 settimane per P. malariae). Il ciclo eritrocitario è
sincronizzato e la lisi dei globuli rossi avviene con cadenze regolari di 48 ore (febbre
terzana del P. falciparum, vivax e ovale) o 72 ore (febbre quartana del P. malariae). I
plasmodi delle specie vivax e ovale hanno la proprietà di lasciare forme quiescenti
nel fegato – ipnozoiti che possono riattivarsi dopo periodi anche lunghi - che
necessitano di terapia anti-ipnozoiti (con primachina).
Nella fase eritrocitaria la
microscopia ottica è in grado di
descrivere le caratteristiche peculiari
di ogni specie di plasmodio: per
esempio il P. falciparum potrà
presentarsi come multipli anelli con
castone all'interno dell'eritrocita
mentre gli altri plasmodi possono dare
solo un'unico anello con castone.
Ovale, vivax e malariae invece
alterano la forma dell'eritrocita che
rimane normale quando infetto da falciparum.
Malaria non complicata:
Questa è la forma clinica più
comune dell'infezione da plasmodi
che si riferisce all'assenza di
complicanze tipiche della forma
severa. Tutte le malarie benigne (da
vivax, ovale e malariae) si
presentano come malaria non
complicata, così come l'infezione
iniziale da P. falciparum la quale se
non adeguatamente trattata può
evolvere nella forma severa.
- 32 -
La caratteristica principale del quadro clinico è la febbre percui entra in
diagnosi differenziale con influenza, febbre tifoide, dengue, febbre emorragica virale
e altre malattie con quadro clinico simile. Pertanto l'anamnesi di permanenza in
zone endemiche (e nella stagione adatta alle zanzare) è di fondamentale importanza.
Le fasi cliniche sono:
o
Periodo di incubazione: fino a 2 settimane (fino a 40 giorni o addirittura
superiore per P. malariae)
o
Febbre periodica: è l'unica caratteristica clinica della malaria. La tipica
periodicità può mancare nell'infezione iniziale. Nella fase conclamata le crisi
febbrili sono precedute da brividi e seguite da sudorazione intensa. La
periodicità della febbre è di 48 ore (72 per P. malariae).
Aspetti clinici peculiari sono:
o
Possibile sindrome nefrosica in infezione da P. malariae
o
Sintomatologia lieve in P. vivax/ovale che si attenua nel tempo. La mortalità
per malaria benigna è rara ma se non vengono trattati gli ipnozoiti le recidive
non sono una rarità anche a distanza di mesi o anni.
I sintomi e i segni della malaria:
o
Febbre, cefalea, malessere
o
Mialgia
o
Dolori addominali, diarrea, vomito
o
Splenomegalia, ittero emolitico (a
bilirubina indiretta) con urine
cariche e anemia.
o
Nel bambino i sintomi comuni
sono:
o
Tosse
o
Tachipnea
o
Convulsioni febbrili
La malaria non complicata non è un'emergenza medica ma va trattata
tempestivamente.
Il quadro clinico trova spiegazione nella stimolata secrezione di TNF per
attivazione del sistema reticoloendoteliale. La concentrazione del TNF sierico è
direttamente correlata alla severità della presentazione clinica.
- 33 -
Un ulteriore momento patogenetico è la lisi dei globuli rossi che aderiscono
facilmente tra di loro e all'endotelio formando aggregati occludenti il microcircolo
spiegando la ragione della possibilità di complicanze per interessamento polmonare,
renale e cerebrale, nonché i segni di ittero emolitico e anemia.
Malaria severa:
Il termine di malaria severa (emergenza medica con rischio di vita per il
paziente) si riferisce a quadro di parassitemia asessuata e presenza di una delle
comlicanze:
o
Alterato stato di coscienza
o
Distress respiratorio: quadro
simil-ARDS o edema polmonare
o
Collasso cardiocircolatorio
o
Convulsioni febbrili recidivanti
o
Anemia severa (Hb<5gr/dL)
o
Ittero o emoglobinuria
o
Emorragia
La maggioranza dei casi di malaria
severa è dovuta a Plasmodium
falciparum e il quadro clinico può
evolvere rapidamente in
o
Insufficienza renale (Crt>3mg/dL)
o
Ipoglicemia (<40mg/dL)
o
Iperpiressia
o
Iperparassitemia (>5% di eritrociti infetti) con accreciuto rischio di danni
d'organo.
Le categorie a maggior rischio di manifestazioni della malaria severa sono:
o
Pazienti con deficit immunitari: con particolare suscettibilità dei soggetti con
AIDS
o
Bambini in età di 1-3 anni
o
Donne in gravidanza
o
Infezione da P. falciparum
o
Ritardata diagnosi o trattamento
Le singole manifestazioni della malaria
severa possono essere:
o
Malaria cerebrale: alterazioni della
coscienza fino al coma. Si manifesta
con disfunzione cerebrale
progressiva senza segni di
meningismo (no rigidità nucale per
esempio), opistotono (figura),
iperriflessia, deficit focali, emorragia
retinica. Le manifestazioni sono
dovute all'occlusione del
microcircolo o al sequestro splenico
e anemia. L'interessamento
- 34 -
cerebrale è frequente in bambini di 1-5 anni.
o
Emolisi, anemia severa e
splenomegalia: dovute alla lisi degli
eritrociti e al sequstro splenico. Una
grave anemizzazione può portare a
scompenso cardiaco ad alta gittata o
al manifestarsi di sintomi cerebrali
docuti all'ipoossigenazione.
o
Insufficienza renale: da
disidratazione, ipovolemia, necrosi
tubulare acuta da emoglobinuria o
da occlusione del microcircolo
renale. L'insufficienza renale
compare con maggior frequenza in caso di deficit di G6PD (Glucose-6Phosphate Dehydrogenase).
o
Distress respiratorio: quadro simil-ARDS
(figura), edema polmonare. A maggior
rischio sono i pazienti con preesistente
insufficienza renale, con iperparassitemia,
in gravidanza. Al deficit respiratorio spesso
si associa ipoglicemia e acidosi.
o
Ipoglicemia: dovuta a tre fattori principali:
o
Metabolismo anaerobio del parassita
o
Alterata glicogenesi epatica
o
Uso di chinina per il trattamento:
chinina stimola la secrezione
insulinica.
o
Acidosi: al manifestarsi dell'acidosi
contribuiscono: il metabolismo anaerobio del parassita, il danno renale
concomitante e l'ipoglicemia con la conseguente chetoacidosi.
o
CID: emorragie gastrointestinali,
retiniche, epistassi, emorragie
congiuntivali e petecchie cutanee
non sono rare. A maggior rischio
sono gli adulti, specie se in
trattamento steroideo. Nello
stesso modo si possono
manifestare qudri ischemici
come nella figura.
o
In gravidanza sono più
frequenti le complicanze e c'è la
possibilità di aborto, basso peso
alla nascita e parto prematuro.
Diagnosi:
L'infezione malarica per essere diagnosticata deve prima essere sospettata e
l'anamnesi gioca in questo un ruolo primario. In presenza di clinica compatibile la
diagnosi si pone riscontrando direttamente il parassita o i suoi antigeni oppure
utilizzando test indiretti. Altri parametri di laboratorio che indirizzano la diagnosi
sono:
o
Emoglobinuria
- 35 -
o
Ipoglicemia
o
La rachicentesi è indicata al sospetto di coinvolgimento dell'SNC:
o
o
Alterazioni della coscienza
o
Convulsioni
o
Coma
Esami complementari che possono essere d'aiuto nella gestione del paziente
sono: Rx torace, esami del sangue con particolare attenzione alla
creatininemia, emogasanalisi ed emocoltura.
I metodi diagnostici diretti sono volti a ricercare il
parassita o i suoi antigeni in circolo:
o
Microscopia si striscio di sangue: è il metodo
più economico e permette la diagnosi di
specie.
o
Goccia spessa: una goccia di sangue
periferico viene defibrinizzata percui i globuli
rossi sono lisati. Questo metodo non permette
la diagnosi di specie ma ha il preggio di
concentrare notevolmente il sangue e fare
diagnosi di malaria anche in presenza di
basse parassitemie.
o
Immunofluorescenza contro antigeni
parassitari.
o
Immunocromatografia (figura): test rapido
con dei sticks specifici per ogni specie che
reagiscono cambiando colore in presenza di
proteine specie-specifiche del plasmodio. Il
preggio sta nell'immediatezza della diagnosi,
lo svantaggio è il costo.
o
PCR: essendo una metodica costosa è
impiegata sopratutto nella ricerca.
Terapia e profilassi:
La profilassi della malaria si articola in profilassi comportamentale e in
profilassi chemioterapica:
o
Profilassi comportamentale: evitare il contatto con la zanzara che sono
maggiormente attive nelle ore notturne (al contrario della mosca Tse Tse che
trasmette la dengue ed è attiva sopratutto di giorno), usare zanzariere, creme
repellenti, e così via.
o
Chemioprofilassi: è indicata in caso di viaggio in zone a rischio. La profilassi
è fatta con gli stessi principi attivi usati in terapia con l'accortezza di non
usare la clorochina in aree con diffusa resistenza alla clorochina (del P.
falciparum). In queste zone è utile avere con se i farmaci necessari per
eventuale trattamento (standby treatment) in caso che le strutture
ospedaliere non siano facilmente raggiungibili. Sono state definite zone da A
a C in base alla diffusione della malaria e della clorochino-resistenza:
o
Zona A: malaria endemica con plasmodi clorochino-sensibili
o
Zona B: segnalata clorochino-resistenza
o
Zona C: diffusa clorochino-resistenza e segnalata multifarmacoresistenza.
- 36 -
I farmaci utilizzati per la malaria sono:
o
Clorochina: farmaco di scelta per la profilassi in viaggi in zona A. la
profilassi va effettuata da 1 settimana prima della partenza e fino a 4
settimane dopo il rientro a dosaggio di 300mg 1 volta a settimana. La
clorochina può essere impiegata in donne gravide e in bambini (5mg/kg
settimanalmente). Tra gli effetti collaterali ci sono: retinopatia, psoriasi,
neuropatie perfieriche. Il deficit della G6PD è una controindicazione.
o
Meflochina: indicata per profilassi in viaggi in zone con diffusa clorochinoresistenza al dosaggio di 250mg 1 volta a settimana da 1 settimana prima a 4
settimane dopo. Controindicata in gravidanza e in bambini sotto i 15kg di
peso. Altre controindicazioni: uso di Ca++-antagonisti, di β-bloccanti, disturbi
psichiatrici o neurologici. Effetti collaterali: disturbi neurologici, allucinazioni.
o
Proguanil: può essere usato in associazione alla clorochina in zone con
segnalata resistenza. Può essere usato in gravidanza e in bambini. La dose è
di 200mg/die (3mg/kg/die per bambini) e la profilassi va cominciata 1
settimana prima e protratta fino a 4 settimane dopo. Controindicazioni:
insufficienza renale o epatica, ulcera gastroduodenale.
o
Doxiciclina: è un'alternativa alla meflochina in zone con una segnalata
resistenza alla meflochina stessa. La profilassi con 100mg/die deve iniziare
1-2 giorni prima della partenza e continuata fino a 4 settimane dopo il
rientro. La doxiciclina essendo una tetraciclina è controindicata in bambini
al di sotto di 8 anni di età, in gravidanza e in terapia ormonale. Il principale
effetto avverso è la fotosensibilizzazione.
o
Malarone: associazione di atovaquone (250mg) e proguanil (100mg). Non ci
sono ancora resistenze segnalate a questa combinazione. La profilassi deve
essere assunta giornalmente a partire da 1-2 giorni prima fino a 8 giorni
dopo il ritorno dalla zona a rischio. Il malarone è controindicato in
gravidanza, in bambini piccoli (<15kg) e in insufficienza renale.
I criteri per iniziare l'automedicazione (standby treatment, o emergency self treatment)
sono: febbre con sintomi non specifici, presenza in area endemica per più di 7 giorni
e assenza di terapia medica in atto. I farmaci per la terapia sono diversi in base alla
profilassi attuata:
o
Nessuna profilassi:
o
Zona A: clorochina
- 37 -
o
Zona B o C: meflochina o chinino
o
Profilassi con clorochina: meflochina, chinino o sulfadiazina/pirimetamina.
o
Profilassi con meflochina: chinino eventualmente associato a doxiciclina.
Un nuovo farmaco in commercio degno di segnalazione è l'associazione
artemether/lumefantrin.
- 38 -












