ICUAW
DEBOLEZZA ACQUISITA IN TERAPIA INTENSIVA
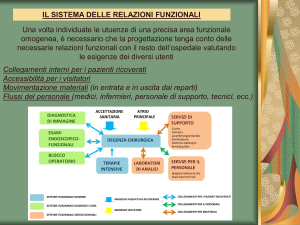
La debolezza acquisita in terapia intensiva è una sindrome di frequente riscontro nei pazienti critici
(non nei pazienti ricoverati in terapia intensiva come monitoraggio post-operatorio. È secondaria a
un danno a livello dell’unità motrice (motoneurone-placca neuromuscolare-muscolo); tale danno
può essere diagnosticato precocemente attraverso uno studio elettrofisiologico (elettroneurografiaelettromiografia), eseguito a livello dei distretti corporei più frequentemente interessati: arti inferiori
e diaframma. Dal momento che uno dei criteri per fare diagnosi di ICUAW è quello
elettrofisiologico, spesso l’ICUAW è stata identificata con la Polineuropatia-miopatia da malattia
critica. In realtà queste 2 sindromi non coincidono sempre, come si può vedere dalla figura.
Esistono in letteratura numerosi termini per descrivere la Polineuropatia-miopatia da malattia
critica:
In Italia si è soliti parlare di CRYMINE. La CRYMINE può essere definita come un termine
“ombrello” sotto il quale trovano riparo uno spettro di disordini neuromuscolari associati al paziente
critico, che includono la CIP (critical illness polyneuropathy), la CIM (critical illness Myopathy) e i
disordini della giunzione neuromuscolare.
La prevalenza di CIP e CIM varia in funzione del metodo usato per la diagnosi, del case-mix, del
timing nell’esecuzione degli accertamenti diagnostici. 47-100% alterazioni elettrofisiologiche
(coma + sepsi); 71-96% alterazioni istologiche; tuttavia la prevalenza di ICUAW (cioè del quadro
clinico sostenuto dalle alterazione elettrofisiologiche) è solo del 50% e il numero di pazienti con
CIP-CIM alla dimissione dalla TI è basso. Questo perché la diagnosi clinica (ICUAW) e quella
elettrofisiologica (CRYMINE) intercettano la malattia a diversi stadi: dapprima insorgono le
alterazioni elettrofisiologiche, successivamente quelle citostrutturali (visibili alla biopsia nervosa e
muscolare) e solo con il progredire della malattia compare la debolezza muscolare clinicamente
evidente. Tutto ciò è compatibile con la teoria eziopatogenetica più accreditata: quella
bioenergetica, che comporta come fase finale una canalopatia dei canali del sodio a livello della
membrana nervosa e muscolare. Per mantenere il normale potenziale di membrana a riposo, il
muscolo e il nervo consumano energia, così come per propagare il potenziale di azione. Se la
produzione di ATP si riduce, il primo effetto sarà quello di una alterata conduzione dello stimolo
elettrico (alterazioni elettrofisiologiche); se il deficit energetico perdura, il muscolo e il nervo
iniziano a perdere la capacità di costruire le proteine intracellulari e i componenti della membrana
cellulare (danno istologico visibile alla biopsia); da ultimo se il danno cellulare prosegue
interessando un numero significativo di assoni o di fibre muscolari, compare la debolezza
clinicamente evidente.
Le cause predisponenti lo sviluppo di ICUAW sono:
1. Sepsi
2. Trauma
3. Tumori
4. L’iperglicemia
5. La somministrazione di catecolamine
6. Insufficienza renale
7. Insufficienza epatica
8. Immobilizzazione (dovuta al riposo forzato a letto, sedazione, curarizzazione)
9. Malnutrizione
10. Il sesso femminile
Perché è importante parlare di ICUAW: perché può influenzare degli esiti (outcome) sia a breve che
a lungo termine.
Outcome a breve termine:
1. Approccio al paziente in coma à l’assenza di movimento nel GCS è considerato un fattore
prognostico sfavorevole (deadly sign);
2. Difficoltà di weaning dalla ventilazione meccanica in pazienti senza evidenza di disturbi
della coscienza, malattie acute o croniche polmonari, insufficienza cardiaca o sepsi
persistente;
3. Insufficienza respiratoria acuta di origine neuromuscolare può essere la causa di riamissione
in TI o di morte inaspettata dopo il trasferimento in corsia
4. Disfunzione dei muscoli faringei e quindi aumentato rischio di aspirazione tracheale à
l’utilità del test al blu di metilene per valutare la deglutizione
Outcome a lungo termine:
1. Debolezza muscolare che migliora col tempo;
2. Disabilità (più frequente in CIP): 28.1% dei pazienti presenta impossibilità a camminare o
dipendenza dalla ventilazione meccanica; problema à in alcuni articoli follow-up troppo
breve (2 d-8 y);
3. Mortalità: non è chiaro se sviluppare ICUAW influenzi la mortalità a lungo termine.
M Herridge ha seguito per 5 anni dopo la dimissione dalla terapia intensiva 109 pazienti, con
diagnosi all’ingresso di ARDS. A 5 anni 1 paziente su 4 non era in grado di lavorare e questo era
dovuto principalmente alla debolezza muscolare. L’età mediana dei pazienti era 45 anni, quindi
soggetti giovani resi inabili al lavoro dalle conseguenze della malattia critica.
È importante avere presente il problema, perché si può fare molto per ridurre l’incidenza di
ICUAW. Esistono dei bundle per la prevenzione dell’ICUAW:
• A Awakening
• B Breathing
• C Coordination of awakening and breathing
• D Delirium assessment
• E Early excercise
Altri autori suggeriscono:
1. Controllo glicemico stretto (target glicemico 80-110 mg/dl) tramite insulina (Greet Van den
Berghe)
2. Apporto calorico adeguato
3. Mobilizzazione precoce e terapia fisica (sedersi sul bordo del letto, letto-poltrona,
deambulare)
4. Terapia occupazionale
In conclusione si deve avere ben presente che il sopravvivere a una malattia grave che ha
comportato il ricovero in terapia intensiva è solo l’inizio; la dimissione dalla terapia intensiva
equivale alla partenza per un viaggio lungo attraverso una riabilitazione difficile, stress psicologici,
disturbi cognitivi e un elevato carico assistenziale per i sanitari e i familiari del paziente stesso. Dal
punto di vista medico, ma soprattutto infermieristico si può fare molto durante il ricovero in terapia
intensiva per ridurre le difficoltà incontrate dai pazienti dopo la dimissione.