didattica attiva
approfondimento > Energia di ionizzazione
e gusci elettronici
CHIMICA DI BASE
L’energia di ionizzazione è l’energia necessaria per
strappare un elettrone a un atomo allo stato gassoso,
vincendo l’attrazione del nucleo. Si parla di energia di
prima ionizzazione, se si allontana un elettrone da un
atomo neutro. Energia di seconda ionizzazione è quella
necessaria per allontanare un elettrone da uno ione con
una carica positiva e così di seguito, finché il numero di
elettroni lo consente: energia di terza ionizzazione, di
quarta ionizzazione ecc.
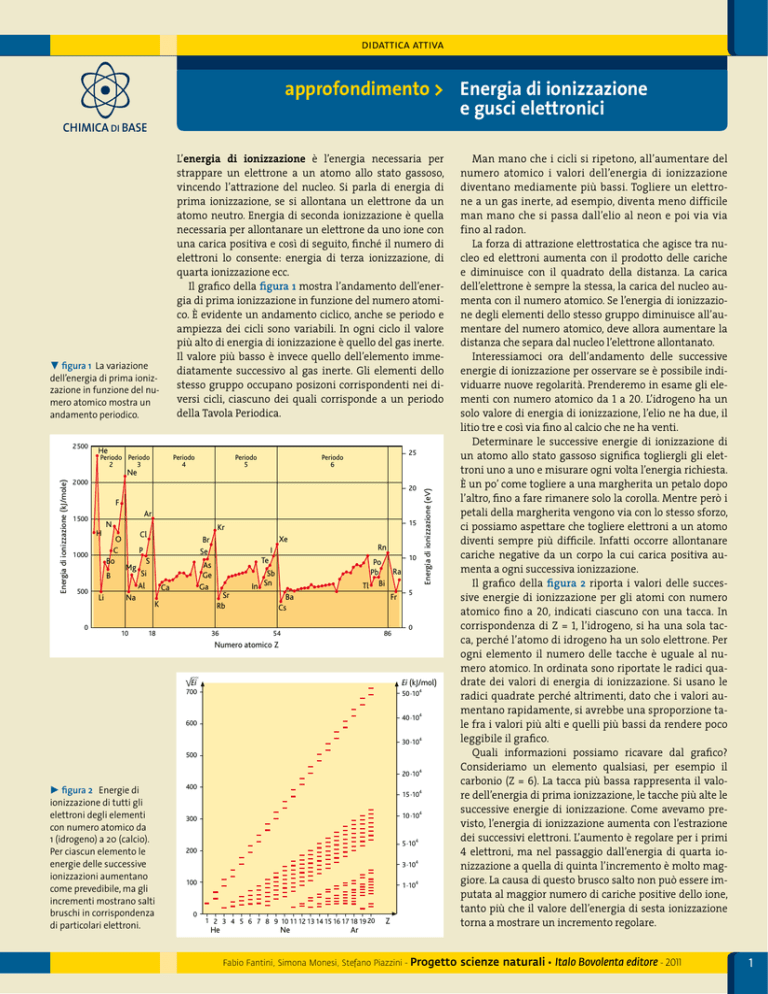
Il grafico della figura 1 mostra l’andamento dell’energia di prima ionizzazione in funzione del numero atomico. È evidente un andamento ciclico, anche se periodo e
ampiezza dei cicli sono variabili. In ogni ciclo il valore
più alto di energia di ionizzazione è quello del gas inerte.
Il valore più basso è invece quello dell’elemento immediatamente successivo al gas inerte. Gli elementi dello
stesso gruppo occupano posizoni corrispondenti nei diversi cicli, ciascuno dei quali corrisponde a un periodo
della Tavola Periodica.
2 500
He
Periodo Periodo
2
3
Periodo
4
Energia di ionizzazione (kJ/mole)
Ne
Periodo
5
25
Periodo
6
2 000
20
F
Ar
1 500
H
1 000
N
O
C
Bo
B
500
0
Li
Xe
Br
Se
P
S
Mg
Si
Al
Na
10
15
Kr
Cl
As
Ge
Ga
Ca
K
18
Rn
I
Sr
Rb
36
Te
Sb
In Sn
Po
Ra
Pb
Tl Bi
Ba
Cs
Fr
54
86
10
Energia di ionizzazione (eV)
figura 1 La variazione
dell’energia di prima ionizzazione in funzione del numero atomico mostra un
andamento periodico.
5
0
Numero atomico Z
Ei (kJ/mol)
Ei
700
50 ·104
40 ·104
600
30 ·104
500
20 ·104
figura 2 Energie di
ionizzazione di tutti gli
elettroni degli elementi
con numero atomico da
1 (idrogeno) a 20 (calcio).
Per ciascun elemento le
energie delle successive
ionizzazioni aumentano
come prevedibile, ma gli
incrementi mostrano salti
bruschi in corrispondenza
di particolari elettroni.
400
15 ·104
10 ·104
300
5 ·104
200
3 ·104
100
0
1 ·104
1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20
He
Ne
Ar
Z
Fabio Fantini, Simona Monesi, Stefano Piazzini - Progetto
Man mano che i cicli si ripetono, all’aumentare del
numero atomico i valori dell’energia di ionizzazione
diventano mediamente più bassi. Togliere un elettrone a un gas inerte, ad esempio, diventa meno difficile
man mano che si passa dall’elio al neon e poi via via
fino al radon.
La forza di attrazione elettrostatica che agisce tra nucleo ed elettroni aumenta con il prodotto delle cariche
e diminuisce con il quadrato della distanza. La carica
dell’elettrone è sempre la stessa, la carica del nucleo aumenta con il numero atomico. Se l’energia di ionizzazione degli elementi dello stesso gruppo diminuisce all’aumentare del numero atomico, deve allora aumentare la
distanza che separa dal nucleo l’elettrone allontanato.
Interessiamoci ora dell’andamento delle successive
energie di ionizzazione per osservare se è possibile individuarre nuove regolarità. Prenderemo in esame gli elementi con numero atomico da 1 a 20. L’idrogeno ha un
solo valore di energia di ionizzazione, l’elio ne ha due, il
litio tre e così via fino al calcio che ne ha venti.
Determinare le successive energie di ionizzazione di
un atomo allo stato gassoso significa togliergli gli elettroni uno a uno e misurare ogni volta l’energia richiesta.
È un po’ come togliere a una margherita un petalo dopo
l’altro, fino a fare rimanere solo la corolla. Mentre però i
petali della margherita vengono via con lo stesso sforzo,
ci possiamo aspettare che togliere elettroni a un atomo
diventi sempre più difficile. Infatti occorre allontanare
cariche negative da un corpo la cui carica positiva aumenta a ogni successiva ionizzazione.
Il grafico della figura 2 riporta i valori delle successive energie di ionizzazione per gli atomi con numero
atomico fino a 20, indicati ciascuno con una tacca. In
corrispondenza di Z = 1, l’idrogeno, si ha una sola tacca, perché l’atomo di idrogeno ha un solo elettrone. Per
ogni elemento il numero delle tacche è uguale al numero atomico. In ordinata sono riportate le radici quadrate dei valori di energia di ionizzazione. Si usano le
radici quadrate perché altrimenti, dato che i valori aumentano rapidamente, si avrebbe una sproporzione tale fra i valori più alti e quelli più bassi da rendere poco
leggibile il grafico.
Quali informazioni possiamo ricavare dal grafico?
Consideriamo un elemento qualsiasi, per esempio il
carbonio (Z = 6). La tacca più bassa rappresenta il valore dell’energia di prima ionizzazione, le tacche più alte le
successive energie di ionizzazione. Come avevamo previsto, l’energia di ionizzazione aumenta con l’estrazione
dei successivi elettroni. L’aumento è regolare per i primi
4 elettroni, ma nel passaggio dall’energia di quarta ionizzazione a quella di quinta l’incremento è molto maggiore. La causa di questo brusco salto non può essere imputata al maggior numero di cariche positive dello ione,
tanto più che il valore dell’energia di sesta ionizzazione
torna a mostrare un incremento regolare.
scienze naturali • Italo Bovolenta editore - 2011
1
didattica attiva
Occorre concludere che la rilevante difficoltà a estrarre il quinto e il sesto elettrone deriva da una loro maggiore vicinanza al nucleo, che fa aumentare la forza di
attrazione che occorre vincere. I primi 4 elettroni, che
devono trovarsi più lontano dal nucleo, sono estratti con
relativa facilità.
Anche se il numero degli elettroni cambia, quanto
abbiamo osservato per il carbonio torna a presentarsi
in ogni elemento. Tutto ciò ci fa capire che dobbiamo
figura 3 I valori delle
energie delle successive
ionizzazioni rivelano una
disposizione stratificata
degli elettroni intorno al
nucleo atomico.
Ei (kJ/mol)
Ei
700
50 ·104
40 ·104
600
Primo
guscio
500
30 ·104
Secondo
guscio
400
Terzo
guscio
300
100
0
15 ·104
10 ·104
Quarto
guscio
200
20 ·104
5 ·104
3 ·104
1 ·104
1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20
He
Ne
Ar
Z
Fabio Fantini, Simona Monesi, Stefano Piazzini - Progetto
aggiornare il nostro modello della struttura dell’atomo. Gli elettroni occupano il volume intorno al nucleo, ma non sono distribuiti in modo omogeneo. I
valori delle energie di ionizzazione si presentano allineati in fasce che suggeriscono una disposizione degli
elettroni un po’ come su «gradini» a distanze diverse
dal nucleo. Per rendere meglio la struttura tridimensionale dell’atomo i «gradini» sono chiamati gusci
elettronici, o brevemente gusci.
Gli elettroni occupano un guscio solamente dopo che
quelli più interni hanno raggiunto il numero massimo
di elettroni che può esservi contenuto. Questo numero
massimo non è lo stesso in tutti i gusci: 2 elettroni nel
primo guscio, 8 nel secondo e nel terzo (figura 3). Esistono altri gusci, ma il loro riempimento avviene con modalità più complesse di quelle appena descritte e per
questo motivo ce ne interesseremo più avanti.
Il primo guscio è presente in tutti gli atomi. Il secondo guscio inizia a essere presente a partire dal litio (Z =
3), quando il primo guscio è completato. A partire dal sodio (Z = 11) gli elettroni iniziano a disporsi sul terzo guscio e a partire dal potassio (Z = 19) iniziano a occupare
il quarto guscio. La descrizione della disposizione degli
elettroni nei gusci prende il nome di configurazione
elettronica dell’elemento. Un semplice modo di scrivere
la configurazione elettronica è quello di scrivere i numeri di elettroni nei gusci separati da virgole, da sinistra
verso destra a partire dal primo guscio. Ad esempio, la
configurazione elettronica del carbonio è 6C: 2, 4; la configurazione elettronica del calcio è 20Ca: 2, 8, 8, 2.
scienze naturali • Italo Bovolenta editore - 2011
2