Le molecole di adesione
cellula-cellula e cellula-matrice
Principi di Citologia e Istologia. Prof. Pucci, 2003
Le CAMs
Modulo caderinico
NH2
Modulo Ig
D
E
B
A
G
F
C
S S
COOH
Ca++
Le principali famiglie di Molecole di
Adesione cellula-cellula (CAMs) sono le
seguenti:
-Selectine: formano legami transitori
principalmente tra leucociti e cellule
endoteliali
-Immunoglobuline di superficie (IgSF):
formano legami stabili o transitori tra una
varietà di tipi cellulari. Alle IgSf
appartiene anche la sottoclasse delle
mucine espresse principalmente da cellule
epiteliali. Formano legami transitori.
-Caderine: formano legami omotipici
stabili principalmente tra cellule epiteliali,
cellule nervose e cellule muscolari
Ca++
SS
Ca++
SS
Ca++
SS
Ca++
SS
Selectine
Ca++
Immunoglobuline
di superficie
Caderine
Le Selectine
Glicoproteina di superficie
Ca++
L-selectina
Le selectine sono una famiglia di glicoproteine
integrali, che riconoscono e legano specifiche
sequenze di carboidrati presenti sulla superficie
di altre cellule.
Sono espresse principalmente sui leucociti e
sono coinvolte nella risposta infiammatoria.
Se ne conoscono tre membri, le L-, le P- e le E-.
Le L-selectine sono espresse su tutte le classi di
leucociti e legano le P e le E presenti sulle
cellule endoteliali, in modo calcio-dipendente.
Membrana plasmatica
Modello di adesioni transitorie cellula-cellula che si verificano tra leucociti
ed endotelio vasale durante la risposta infiammatoria
Vaso sanguigno
Flusso sanguigno
Lamina basale
Cellule endoteliali
rotolamento
adesione
connettivo
Citochine infiammatorie
Da C.B. Bertozzi, Current Biology, 1995
diapedesi
migrazione
Le Immunoglubuline di superficie
Le IgSF hanno struttura secondaria formata da domini omologhi a foglietti
beta (Ig- fold), presenti sul versante extracellulare delle molecole. Ciascun
modulo immunoglobulinico è composto da 70-110 residui amminoacidici.
Ciascun modulo Ig interagisce con unità adiacenti, tramite legami deboli
venendo a costituire una struttura terziaria globulare molto resistente alle
proteasi. La maggior parte delle IgSF forma adesioni di tipo omofilico
(con molecole dello stesso tipo) indipendenti da calcio.
Elementi variabili nell'ambito dei sottogruppi delle
IgSF sono il numero di ripetizioni del dominio Ig, la
lunghezza della porzione citoplasmatica, la presenza o
l'assenza di altri domini strutturali e funzionali (in
particolare domini di tipo fibronectinico), il grado di
glicosilazione.
Alcuni membri delle IgSF vennero originariamente
identificati per la loro associazione a certi tumori; tra
questi il più noto é il CEA (Carcino-Embryonic
Antigen), presente in alte concentrazioni nel siero di
pazienti affetti da carcinoma del colon, della mammella
e di altri tumori, e normalmente espresso in derivati
endodermici nel corso dello sviliuppo embrionale.
Altre IgSF, tipicamente associate a tumore, sono
l'oncoproteina DCC (Delete in Colon Cancer), la BGP
(Biliary GlycoProtein), la NCA (Non-specific Crossreacting Antigen) e l'NFA-1 (Normal and Fetal
Antigen).
NH2
D
E
B
A
G
F
C
S S
Modulo Ig
COOH
zuccheri
Domini
fibronectinici
Membra
plasmatica
Domini citoplasmatici
Le Caderine
NH2
Ca++
Ca++
Ca++
Ca++
Ca++
Ca++
Modulo caderinico a struttura beta.
Ciascun dominio di circa 110 residui
amminoacidici, contiene due motivi
leganti Ca2+, altamente conservati e
presenti in posizione simile in tutte
le caderine.
COOH
Le caderine are sono una famiglia di proteine
transmembranarie di tipo I, calcio dipendenti che
interagiscono preferenzialmente con se stesse in modo
omofilico, connettendo stabilmente cellule adiacenti.
Possono anche legare integrine alfa e beta7.
Hanno un PM di circa 97 kDa e presentano domini
ripetuti a foglietti beta. La presenza del Ca++ è
necessaria non solo alla loro funzione adesiva, ma
anche all' integrità strutturale della molecola: la
rimozione del calcio dal dominio caderinico, provoca
infatti una loro rapida proteolisi.
Le sottoclassi caderiniche più note sono
• le epiteliali (E-caderine),
•le neuronali (N-caderine),
•le placentari (P-caderine),
•le desmosomali (desmocolline e desmogleine).
Il segmento polipeptidico all'estremo N-terminale della
molecola, formato da circa 113 amminoacidi,
rappresenta la regione di riconoscimento e di specificità
del legame, mentre la regione citoplasmatica, anch'essa
altamente conservata, é indispensabile per la stabilità
del legame ed in particolare per la formazione ed il
mantenimento delle giunzioni aderenti.
Sono coinvolte nella cancerogenesi.
Le catenine
L’adesione cellulare negli epiteli è iniziata attraverso i domini extracellulari delle caderine, e
mantenuta attraverso il segmento citoplasmatico che interagisce con una classe di proteine di circa
100kDa definite catenine. Le catenine, a loro volta sono in grado di legarsi al citoscheltro
partecipando alla formazione delle giunzioni intermedie e dei desmosomi. Sono membri di questa
classe di proteine le catenine α1 e α2 (omologhe alla vinculina), la β catenina (o placoglobina) e la γ
catenina (o desmoplakina).
In aggiunta alla funzione adesiva, le catenine sono in grado di interagire con protein-kinasi coinvolte
nei pathway di trasduzione del segnale indotto da fattori di crescita come l’EGF, oncogeni e
oncosoppressori. In particolare la β-catenina, in seguito a fosforilazione, si stacca dal complesso e
migra nel nucleo dove stimola la trascrizione di diversi geni, tra cui c-myc, c-jun, e la ciclina D1.
Pertanto le adesioni cellula-cellula sono anche coinvolte nel controllo della proliferazione cellulare.
B
actina
catenine
A
Schema che illustra l’inizio dell’adesione
cellulare (A) ed il suo consolidamento (B).
Da R. Kemler, Cell Biology, 3, 149-155, 1992
Il complesso di adesione
caderina
Una causa della distruzione delle giunzioni intercellulari é
l'espressione dell' oncoproteina APC (Adenomatous Polyposis
Coli), prodotta da un gene oncosoppressore, iperespresso in un
elevato numero di carcinomi del colon.
APC è in grado di legarsi stabilmente alle alfa e beta catenine
presenti nelle giunzioni aderenti. L'interazione di APC con le
catenine spiazza il legame citoplasmatico tra caderine-cateninecitoscheletro, provocando la dissociazione del legame tra le
caderine e favorendo il distacco delle cellule.
Ca++
Ca++
Ca++
Ca++
Ca++
Beta-catenina
Alfa-catenina
Oncogene APC
vinculina
Alfa-actinina
F-actina
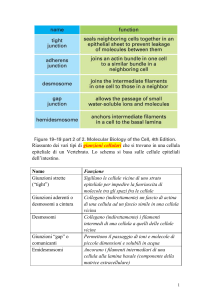
I sistemi di giunzione
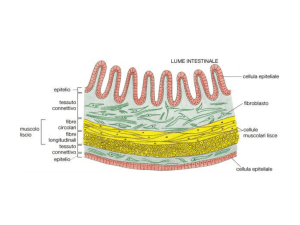
Micrografia elettronica di una sezione della
regione apicale di epitelio intestinale
sinonimi
Giunzioni occludenti
Tight junctions
Giunzioni strette
Giunzioni aderenti
Desmosomi anulari
Desmosomi a banda
Desmosomi puntiformi
Desmosomi a macula
Da Blomm and Fawcett, Atlas of fine structure
Ricostruzione tridimensionale dei sistemi di giunzione dell’epitelio intestinale
Proprieta’
Microvilli
Formano una saldatura impermeabile
intorno alla superficie apicale delle cellule,
impedendo diffusione di soluti
Formano una cintura di connessione plastica
Giunzioni occludenti
Giunzioni aderenti
Formano connessioni puntiformi multiple
capaci di resistere agli stress meccanici
Desmosomi puntiformi
Formano canali di comunicazione intercellulare
Giunzioni comunicanti
Filamenti intermedi
Emidesmosomi
Ancorano la cellula alla lamina basale
Lamina basale
da J Darnell, H Lodish, D Baltimore, Biologia Molecolare Della Cellula, Zanichelli, 1994
Le giunzioni occludenti
ZO2
160 kDa Rab
F-actina
Occludina
65kDa
Cingulina
140 kDa
ZO1
Membrana1
225 kDa
Membrana2
Spazio intercellulare
Schema tridimensionale della giunzione stretta,
o occludente (tight junction).
da J Darnell, H Lodish, D Baltimore, Biologia
Molecolare Della Cellula, Zanichelli, 1994
L’organizzazione molecolare della giunzione occludente
comprende le seguenti proteine:
•Occludina:proteina integrale occludente simile alla
connexina
•Zonula 1 e Zonula 2: contengono domini fosforilabili e
quindi partecipano alla trasduzione del segnale
•Rab, piccole proteine che legano GTP
•Cingulina: simile alla miosina, lega il complesso di
chiusura ai filamenti di actnina
Micrografia elettronica di una sezione di due
cellule epatiche a contatto dove sono visibili le
giunzioni occludenti (frecce).
Lume dell’acino pancreatico
Micrografia elettronica della superfice
apicale di due cellule pancreatiche,
dopo breve incubazione con idrossido
di lantanio.
Si osserva che il colorante penetra
negli interstizi intercellulari e si arresta
a livello della giunzione occludente.
Regione
apicale
Giunzione
occludente
Vescicola
di zimogeno
Riprodotto da J Darnell, H Lodish, D Baltimore,
Biologia Molecolare Della Cellula, Zanichelli, 1994
Idrossido
di lantanio
Giunzioni aderenti
Desmosomi
desmocolline e desmogleine
filamenti di keratina
filamenti di actina
caderine
Spazio
intercellulare
Proteine del
complesso
di adesione
Placche citoplasmatiche formate
dall’ancoraggio del complesso di
adesione con i filamenti intermedi
Da S.L.Wolf, Biologia Cellulare e Molecolare, edi SES
ricostruzione
tridimensionale
Desmosomi ed emidesmosomi
come appaiono in Microscopia elettronica tradizionale
Spazio intercellulare
Placche citoplasmatiche
Filamenti intermedi
Micrografia elettronica di
desmosoma tra cheratinociti
Micrografia elettronica di emidesmosomi
che ancorano la superficie basale delle
cellule alla lamina basale.
Da Bloom and Fawcett
Le giunzioni comunicanti
o giunzioni serrate, gap junction
Le gap junctions sono aree specializzate della membrana che connettono funzionalmente cellule
adiacenti.
Sono formate da canali a bassa resistenza elettrica, attraverso cui ioni, piccole molecole
regolative e metaboliti al di sotto dei 1000 daltons (come Ca++, C-AMP, glutatione,
amminoacidi, carboidrati, nucleotidi) possono passare liberamente da una cellula all’altra. Il
canale della giunzione è formato da due “emicanali” definiti “connexoni”. Ciasun connexone è
formato da sei subunità proteiche definite connexine.
Struttura del connessone
Membrane plasmatiche
a contatto
Canale di
1.5 nm di diametro
Canale formato da
due connexoni in registro
esamero di connexine
Le Integrine
funzionano in coppia
Integrine
catena alfa
Sito di
legame
catena beta
Ruoli
• Adesione cellulare all’ECM
• Migrazione
• Extravasazione
•Segnali provenienti dalla matrice
Sono eterodimeri di due subunità alfa e beta.
Si conoscono 12 subunità di alfa (PM da 150 a 200
kDa) e 8 di beta (PM da 90 a 110 kDa).
L subunità alfa sono di due tipi: a catena intera (α1, α2,
α L, αΜ) o formate da due catene legate da ponti
disolfuro.
Dominio
ricco in cisteine
membrana
Possibili combinazioni della subunità beta 1 (A) e beta 2 (B)
con le varie subunità alfa nella formazione degli etrodimeri integrinici
α2
A
α3
LM
COLL IV
COLL I
FN
LM
COLL I
FN
FN alt
α4
Placche
di Peyers
FN
RGD
α5
α1
LM
COLL IV
COLL I
VN
β 5 RGD
β 6 FN
β8 ?
FN
β1
?
RG D
αV
α8
LM
LM
α7
β2
MB
β4
FB
RGD
B
α6
β7
β3
FB
αx
C3bi
FX
FB
ICAM-1
αΜ
ICAM-1
ICAM-2
αL
Organizzazione del citoscheletro e
adesione focale mediata dalle integrine
paxillina
Filamenti di actina
talina
CAP
tensina
vinculina
vinculina
paxillina
α-actinina
FAK
CRK
talina
CSK
SRC
α β
FAK
α β
vinculina
talina
CAS
α β
integrine
L’adesione della cellula alla matrice extracellulare (ECM) tramite le integrine induce la formazione della
placca di adesione focale e la riaggregazione del citoscheletro. Tensina, paxillina , CAS e FAK (focal
adhesion-kinase) sono intermediari fosforilabili che dirigono l’assemblaggio dell’actina in fibre connesse da
alfa-actinina. La talina forma il collegamento tra integrine e vinculina-actina. CSK, CRK e CAS sono
modulatori del sistema di adesione focale. Tramite FAK e le altre proteine fosforilabili, l’adesione delle
cellule al substrato entra nel circuito della rete di trasduzione del segnale, partecipando oltre che alla
riorganizzazione del citoscheletro, al controllo della proliferazione cellulare e dell’apoptosi.