Formule e Modelli
1
Una formula molecolare mostra l’esatto numero
degli atomi di ciascun elemento nella più piccola
unità di una sostanza
Una formula empirica mostra il più piccolo rapporto
fra gli atomi in una sostanza
molecolare
empirica
H 2O
H 2O
C6H12O6
CH2O
O3
O
N 2H 4
NH2
2
I composti ionici sono una combinazione di cationi
ed anioni
• La formula è di solito la stessa della formula empirica
• La somma delle cariche dei cationi ed anioni in ciascuna
unità formula deve essere uguale a zero
NaCl
3
I metalli più reattivi (verde) ed i nonmetalli più reattivi
(blue) reagiscono per formare composti ionici.
4
Formule di Composti Ionici
2 x +3 = +6
3 x -2 = -6
Al2O3
Al3+
1 x +2 = +2
Ca2+
1 x +2 = +2
Na+
O22 x -1 = -2
CaBr2
Br1 x -2 = -2
Na2CO3
CO325
Nomenclatura Chimica
• Composti Ionici
Spesso un metallo + nonmetallo
Anione (nonmetallo), aggiunge “uro” al nome dell’ elemento
BaCl2
Cloruro di bario
K2O
Ossido di potassio
Mg(OH)2
Idrossido di magnesio
KNO3
Nitrato di potassio
6
• Compsti ionici dei metalli di transizione
– indicare la carica sul metallo con il numero Romano
FeCl2
2 Cl- -2 so Fe is +2
Cloruro di ferro(II)
FeCl3
3 Cl- -3 so Fe is +3
Cloruro di ferro(III)
Cr2S3
3 S-2 -6 so Cr is +3 (6/2) Solfuro di cromo(III)
7
8
9
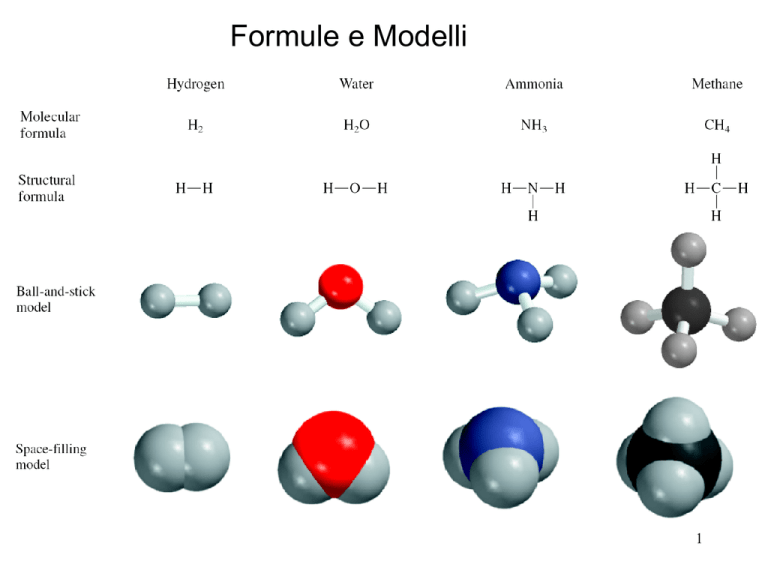
• Composti Molecolari
− Nonmetalli o nonmetalli + metalloidi
− Nomi comuni
H2O, NH3, CH4,
− Gli Elementi più a sinistra nel periodo e
più in basso nel gruppo della tavola
periodica sono scritti per primi nella
formula
− Se più di un composto può essere
formato dagli stessi elementi, usare
prefissi per indicare il numero di ciascun
tipo di atomo
− Il nome dell’ultimo elemento finisce in uro
oppure Ossido se è presente l’ossigeno
10
Composti Molecolari
HI
ioduro di idrogeno
NF3
trifluoruro di azoto
N2Cl4
tetracloruro di diazoto
NO2
diossido di azoto
N 2O
monossido di diazoto
SO2
diossido di zolfo (diossido solfuro)
11
12
Un acido può essere definito come una sostanza che
produce ioni idrogeno (H+) quando è disciolta in acqua.
Per esempio: HCl gas e HCl in acqua
• Sostanza pura, Cloruro d’idrogeno
• Sciolto in acqua (H3O+ e Cl−),
acido cloridrico
13
14
Un ossoacido è un acido che contienea idrogeno,
ossigeno ed un altro elemento.
HNO3
Acido nitrico
H2CO3
Acido carbonico
H3PO4
Acido fosforico
15
Ossoacidi ed Ossoanioni
16
Le regole per la nomenclatura degli ossoanioni,
anioni degli ossoacidi, sono le seguenti:
1. Quando tutti gli ioni H sono rimossi dall’acido
“-ico”, il nome dell’anione finisce con “-ato.”
2. Quando tutti gli ioni H sono rimossi dall’acido
“-oso”, il nome dell’anione finisce con “-ito.”
3. Se non tutti gli H sono rimossi, si deve indicare
il numero degli H ancora presenti.
Per esempio:
– H2PO4- diidrogeno fosfato
– HPO42- (mono)idrogeno fosfato
– PO43- fosfato
17
18
Una base può essere definita come una sostanza
che, disciolta in acqua, fornisce ioni idrossido (OH-).
NaOH
Idrossido di sodio
KOH
Idrossido di potassio
Ba(OH)2
Idrossido di bario
19
Idrati sono i composti che hanno uno specifico
numero di molecole di acqua di cristallizzazione.
BaCl2•2H2O
Cloruro di bario diidrato
LiCl•H2O
Cloruro di litio monoidrato
MgSO4•7H2O
Solfato di magnesio eptaidrato
CuSO4•5H2O
CuSO4
20
Stechiometria
Copyright © The McGraw-Hill Companies, Inc. Permission required for reproduction or display.
Proprietà Intensive ed Estensive
Una proprietà estensiva di un materiale dipende
dalla quantità di materia.
• mass
• length
• volume
Una proprietà intensiva di un materiale non
dipende dalla quantità di materia.
• density
• temperature
• color
22
Materia – tutto ciò che occupa spazio ed ha massa.
massa – misura della quantità di materia
SI unità di massa è il chilogrammo (kg)
1 kg = 1000 g = 1 x 103 g
peso – forza che la gravità esercita su un oggetto
peso = c x massa
Un 1 kg peserà
Terra, c = 1.0
1 kg sulla Terra
Luna, c ~ 0.1
0.1 kg sulla Luna
23
Sistema Internazionale delle Unità (SI)
24
25
Volume – SI unità per il volume è il metro cubo (m3)
1 cm3 = (1 x 10-2 m)3 = 1 x 10-6 m3
1 dm3 = (1 x 10-1 m)3 = 1 x 10-3 m3
1 L = 1000 mL = 1000 cm3 = 1 dm3
1 mL = 1 cm3
26
Densità – SI unità per la densità è il kg/m3
1 g/cm3 = 1 g/mL = 1000 kg/m3
massa
densità = volume
m
d= V
Una barra di platino, con densità di 21.5 g/cm3, ha
un volume di 4.49 cm3. Qual è la sua massa?
m
d= V
m = d x V = 21.5 g/cm3 x 4.49 cm3 = 96.5 g
27
28
Un confronto delle Scale di Temperatura
K = °C + 273.15
273 K = 0 °C
373 K = 100 °C
°F
9
=
x °C + 32
5
32 0F = 0 °C
212 0F = 100 °C
29
Notazione Scientifica
Il numero di atomi in 12 g di carbonio:
602,200,000,000,000,000,000,000
6.022 x 1023
La massa di un singolo atomo di carbonio in grammi:
0.0000000000000000000000199
1.99 x 10-23
N x 10n
N è un numero
fra 1 e 10
n è un numero intero
positivo o negativo
30
Notazione Scientifica
568.762
0.00000772
muovere i decimali a sinistra
n>0
568.762 = 5.68762 x 102
muovere i decimali a destra
n<0
0.00000772 = 7.72 x 10-6
Addizione o Sottrazione
1.
2.
3.
Scrivere le quantità con lo stesso
esponente n
Combinare N1 e N2
L’ esponente, n, rimane lo stesso
4.31 x 104 + 3.9 x 103 =
4.31 x 104 + 0.39 x 104 =
4.70 x 104
31
Notazione Scientifica
Moltiplicazione
1.
2.
Moltiplicare N1 e N2
Addizionare gli esponenti n1 ed n2
Divisione
1.
2.
Dividere N1 ed N2
Sottrarre gli esponenti n1 ed n2
(4.0 x 10-5) x (7.0 x 103) =
(4.0 x 7.0) x (10-5+3) =
28 x 10-2 =
2.8 x 10-1
8.5 x 104 ÷ 5.0 x 109 =
(8.5 ÷ 5.0) x 104–9 =
1.7 x 10-5
32
Cifre Significative
• Ogni numero che non sia zero è significativo
1.234 kg
4 cifre significative
• Gli Zero fra due numeri (che non siano zero anch’essi) sono significativi
606 m
3 cifre significative
• Gli Zero a sinistra del primo numero nonzero non sono significativi
0.08 L
1 cifra significativa
• Se un numero è maggiore di 1, allora tutti gli zero a destra del punto sono
significativi
2.0 mg
2 cifre significative
• Se un numero è minore di 1, allora solo gli zero che sono alla fine o fra altri
numeri sono significativi
0.00420 g
3 cifre significative
33
Quante cifre significative ci sono in
ciascuna delle seguenti misure?
24 mL
2 cifre significative
3001 g
4 cifre significative
0.0320 m3
3 cifre significative
6.4 x 104 molecules
2 cifre significative
560 kg
2 cifre significative
34
Cifre Significative
Addizione o Sottrazione
Il risultato non può avere più numeri dopo la virgola di quelli di ciascun addendo.
89.332
+ 1.1
Una cifra dopo la virgola
90.432
Approssima a 90.4
3.70
-2.9133
Due cifre significative dopo la virgola
0.7867
Approssima a 0.79
35
Cifre Significative
Moltiplicazione o Divisione
Il numero di cifre significative nel risultato è determinato dal dato che ha il minor
numero di cifre significative
4.51 x 3.6666 = 16.536366
3 cifre sig.
Approssima a
3 cifre sig.
6.8 ÷ 112.04 = 0.0606926
2 cifre sig.
= 16.5
= 0.061
Approssima a
2 cifre sig.
36
Cifre Significative
Numeri Interi
I numeri da definizioni o numeri di oggetti sono considerati come aventi un numero
Infinito di cifre significative
La media di tre lunghezze misurate: 6.64, 6.68 and 6.70?
6.64 + 6.68 + 6.70
3
= 6.67333 = 6.67
=7
Perchè 3 è un numero intero
37
Accuratezza – quanto vicina è una misura al valore reale
Precisione – quanto simili sono i valori di una serie di misure
accurata
&
precisa
precisa
ma
non accurata
non accurata
&
non precisa
38
Micro
atomi & molecole
Macro
grammi
Massa Atomica è la massa di un atomo in unità di
massa atomica (amu)
Per definizione:
1 atomo 12C “pesa” 12 amu
In questa scala
1H
= 1.008 amu
16O
= 16.00 amu
39
La massa atomica media è la media pesata
di tutti gli isotopi naturali dell’elemento.
40
Per il Litio:
7.42% 6Li (6.015 amu)
92.58% 7Li (7.016 amu)
Massa atomica media del litio:
(7.42 x 6.015) + (92.58 x 7.016)
100
= 6.941 amu
41
Average atomic mass (6.941)
42
uova
La massa Molare è la massa di 1 mole di scarpe in grammi
palline
atomi
1 mole 12C atomi = 6.022 x 1023 atomi = 12.00 g
1 12C atomo = 12.00 amu
1 mole 12C atomi = 12.00 g 12C
1 mole litio atomi = 6.941 g di Li
Per ogni elemento
massa atomica (amu) = massa molare (grammi)
43
Una Mole di:
S
C
Hg
Cu
Fe
44
1 12C atom
12.00 g
x
12.00 amu
6.022 x 1023 12C atoms
1.66 x 10-24 g
=
1 amu
1 amu = 1.66 x 10-24 g o 1 g = 6.022 x 1023 amu
M = massa molare in g/mol
NA = Numero di Avogadro
45
Quanti atomi ci sono in 0.551 g di potassio (K) ?
1 mol K = 39.10 g K
1 mol K = 6.022 x 1023 atomi K
1 mol K
6.022 x 1023 atomi K
0.551 g K x
x
1 mol K
39.10 g K
=
8.49 x 1021 atomi K
46
Massa Molecolare (o peso molecolare) è la somma delle
masse atomiche (in amu) in una molecola.
1S
SO2
2O
SO2
32.07 amu
+ 2 x 16.00 amu
64.07 amu
Per ogni molecola
massa molecolare (amu) = massa molare (grammi)
1 molecola SO2 = 64.07 amu
1 mole SO2 = 64.07 g SO2
47
Quanti atomi di H ci sono in 72.5 g of C3H8O ?
1 mol C3H8O = (3 x 12) + (8 x 1) + 16 = 60 g C3H8O
1 mol C3H8O molecole = 8 mol H atomi
1 mol H = 6.022 x 1023 atomi H
8 mol H atoms 6.022 x 1023 H atoms
1 mol C3H8O
72.5 g C3H8O x
x
x
1 mol C3H8O
1 mol H atoms
60 g C3H8O
=
5.82 x 1024 atoms H
48
Peso Formula è la somma delle masse atomiche
(in amu) in un’unità formula di un composto ionico.
NaCl
1Na
22.99 amu
1Cl
NaCl
+ 35.45 amu
58.44 amu
Per ogni composto ionico
Peso formula (amu) = massa molare (grammi)
1 unità formula NaCl = 58.44 amu
1 mole NaCl = 58.44 g NaCl
49
Qual è il peso formula di Ca3(PO4)2 ?
1 unità formula di Ca3(PO4)2
3 Ca
3 x 40.08
2P
8O
2 x 30.97
+ 8 x 16.00
310.18 amu
50
Heavy
Light
Heavy
Light
Spettrometro di Massa
Mass Spectrum of Ne
51
Composizione Percentuale di un elemento in un composto =
n x massa molare dell’ elemento
x 100%
massa molare del composto
n è il numero di moli dell’elemento in 1 mole del
composto
%C =
%H =
%O =
C2H6O
2 x (12.01 g)
46.07 g
6 x (1.008 g)
46.07 g
1 x (16.00 g)
46.07 g
x 100% = 52.14%
x 100% = 13.13%
x 100% = 34.73%
52.14% + 13.13% + 34.73% = 100.00%
52
Composizione Percentuale e Formula Empirica
Determinare la formula empirica di un composto che
ha le seguneti percentuali in peso: K 24.75, Mn 34.77,
O 40.51 percent.
1 mol K
nK = 24.75 g K x
nMn = 34.77 g Mn x
39.10 g K
1 mol Mn
54.94 g Mn
nO = 40.51 g O x
1 mol O
16.00 g O
= 0.6330 mol K
= 0.6329 mol Mn
= 2.532 mol O
53
Composizione Percentuale e Formula Empirica
nK = 0.6330, nMn = 0.6329, nO = 2.532
0.6330
K:
0.6329
Mn :
O:
~ 1.0
~
0.6329
= 1.0
0.6329
2.532
0.6329
~ 4.0
~
KMnO4
54
Combustione 11.5 g etanolo
Raccolgo 22.0 g CO2 e 13.5 g H2O
g CO2
mol CO2
mol C
gC
6.0 g C = 0.5 mol C
g H 2O
mol H2O
mol H
gH
1.5 g H = 1.5 mol H
g of O = g del campione – (g of C + g of H)
4.0 g O = 0.25 mol O
Formula Empirica C0.5H1.5O0.25
Diviso il numero più piccolo (0.25)
Formula Empirica C2H6O
55
Un processo in cui una o più sostanze sono trasformate in una o più sostanze nuove è una
reazione chimica
Un’ equazione chimica usa simboli chimici per mostrare cosa avviene durante una reazione
chimica
reagenti
prodotti
3 modi di rappresentare la reazione fra H2 e O2 per formare H2O
56
Come “Leggere” le Equazioni Chimiche
2 Mg + O2
2 MgO
2 atomi Mg + 1 molecola O2 formano 2 unità formula MgO
2 moli Mg + 1 mole O2 formano 2 moli MgO
48.6 grammi Mg + 32.0 grammi O2 formano 80.6 g MgO
NON
2 grammi Mg + 1 grammo O2 formano 2 g MgO
57
Bilanciare le Equazioni Chimiche
1. Scrivere le formule corrette per i reagenti a sinistra e
le le formule corrette per i prodotti a destra.
Ethane reacts with oxygen to form carbon dioxide and water
C2H6 + O2
CO2 + H2O
2. Cambiare i coefficienti di fronte alle formule in modo
che il numero di atomi di ciascun elemento sia lo
stesso da entrambi i lati della reazione. Non cambiare
gli indici.
2C2H6
NOT
C4H12
58
Bilanciare le Equazioni Chimiche
3. Iniziare a bilanciare quegli elementi che sono presenti
in un solo reagente o in un solo prodotto.
C2H6 + O2
2 carbon
on left
C2H6 + O2
6 hydrogen
on left
C2H6 + O2
CO2 + H2O
1 carbon
on right
start with C or H but not O
multiply CO2 by 2
2CO2 + H2O
2 hydrogen
on right
2CO2 + 3H2O
multiply H2O by 3
59
Bilanciare le Equazioni Chimiche
4. Bilanciare quegli elementi presenti in due o più
reagenti o prodotti.
C2H6 + O2
2 oxygen
on left
2CO2 + 3H2O
4 oxygen
(2x2)
+ 3 oxygen
(3x1)
7
O
2 2
2CO2 + 3H2O
2C2H6 + 7O2
4CO2 + 6H2O
C2H6 +
multiply O2 by
7
2
= 7 oxygen
on right
remove fraction
multiply both sides by 2
60
Bilanciare le Equazioni Chimiche
5. Controllare che ci sia lo stesso numero di atomi degli
elementi fra reagenti e prodotti.
2C2H6 + 7O2
4CO2 + 6H2O
4 C (2 x 2)
4C
12 H (2 x 6)
12 H (6 x 2)
14 O (7 x 2)
14 O (4 x 2 + 6)
Reactants
Products
4C
4C
12 H
12 H
14 O
14 O
61
Quantità di Reagenti e Prodotti
1.
Scrivere la reazione bilanciata
2.
Convertire le quantità di sostanza in moli
3.
Usare i coefficienti nelle reazioni bilanciate per calcolare il numero di moli della
sostanza desiderata
4.
Convertire le moli della sostanza desiderata in grammi
62
Methanol burns in air according to the equation
2CH3OH + 3O2
2CO2 + 4H2O
If 209 g of methanol are used up in the combustion, what mass of water is produced?
grams CH3OH
moles CH3OH
molar mass
CH3OH
209 g CH3OH
x
moles H2O
molar mass
H2O
coefficients
chemical equation
4 mol H2O
1 mol CH3OH
x
32.0 g CH3OH
2 mol CH3OH
grams H2O
x
18.0 g H2O
1 mol H2O
=
235 g H2O
63
Reagente Limitante :
Il reagente che si consuma
prima in una reazione.
2NO + O2
2NO2
NO è il reagente limitante
O2 è il reagente in eccesso
64
In one process, 124 g of Al are reacted with 601 g of Fe2O3
2Al + Fe2O3
Al2O3 + 2Fe
Calculate the mass of Al2O3 formed.
g Al
mol Al
mol Fe2O3 needed
g Fe2O3 needed
OR
g Fe2O3
124 g Al x
mol Fe2O3
1 mol Al
27.0 g Al
mol Al needed
x
Start with 124 g Al
1 mol Fe2O3
2 mol Al
160. g Fe2O3
x
1 mol Fe2O3
g Al needed
=
367 g Fe2O3
need 367 g Fe2O3
Have more Fe2O3 (601 g) so Al is limiting reagent
65
Use limiting reagent (Al) to calculate amount of product that
can be formed.
g Al
mol Al
mol Al2O3
2Al + Fe2O3
124 g Al x
1 mol Al
27.0 g Al
x
1 mol Al2O3
2 mol Al
g Al2O3
Al2O3 + 2Fe
102. g Al2O3
x
1 mol Al2O3
=
234 g Al2O3
At this point, all the Al is consumed and Fe2O3
remains in excess.
66
Resa di Reazione
La resa teorica è la quantità di prodotto che si otterrebbe
se la reazione fosse completata al 100%.
La resa reale è la quantità di prodotto realmente ottenuta.
Resa reale
% Resa =
x 100%
Resa teorica
67










