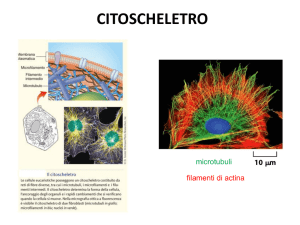
CITOSCHELETRO
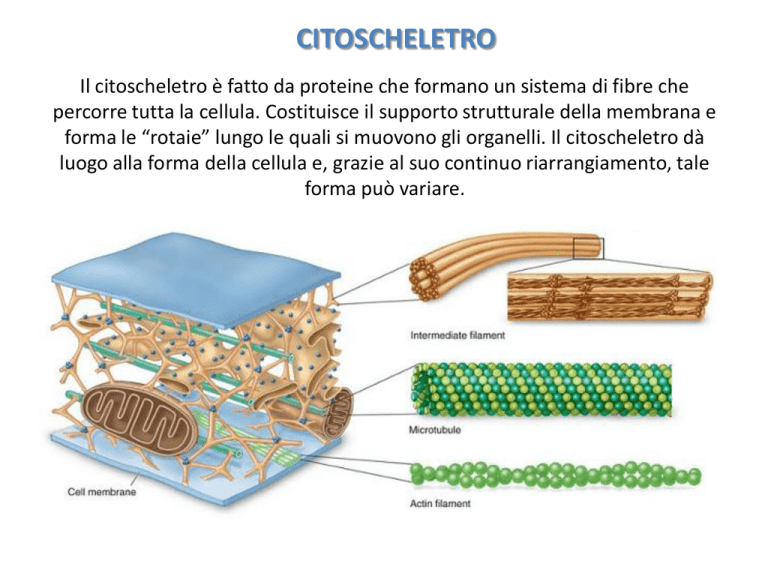
Il citoscheletro è fatto da proteine che formano un sistema di fibre che
percorre tutta la cellula. Costituisce il supporto strutturale della membrana e
forma le “rotaie” lungo le quali si muovono gli organelli. Il citoscheletro dà
luogo alla forma della cellula e, grazie al suo continuo riarrangiamento, tale
forma può variare.
Le proteine del citoscheletro possono essere evidenziate con anticorpi
legati a fluorocromi
Il citoscheletro è una impalcatura
tridimensionale dinamica fatta di
microfilamenti
di
actina,
filamenti intermedi e microtubuli.
FUNZIONI DEL CITOSCHELETRO
1 - Fornisce un supporto strutturale dinamico che
determina la forma della cellula (es. microvilli di
cellule epiteliali, forma a disco biconcavo degli
eritrociti dei mammiferi, pseudopodi dell’ameba).
pseudopodi
2 - Determina la posizione degli organelli
citoplasmatici (es. polarità degli organelli
nelle cellule ghiandolari esocrine)
3 - Direziona le molecole, gli
organelli e le vescicole lungo
specifici percorsi (es. trasporto di
vescicole di neurotrasmettitori
lungo l'assone di una cellula
nervosa). Contribuisce anche alla
formazione delle vescicole rivestite.
4 – Definisce e regola la
posizione dei ribosomi liberi.
Probabilmente
anche
i
ribosomi non ancorati alle
membrane
del
reticolo
endoplasmatico rugoso, sono
in realtà adesi alla rete
microtrabecolare
del
citoscheletro e pertanto
strettamente
dipendenti
dall'organizzazione di questa
(modificata da K.R. Porter e
J.B. Tucker).
5- Forma il macchinario per la divisione cellulare
(fuso mitotico, anello contrattile della citodieresi)
4 - Presiede al movimento cellulare (es.
movimento flagellare di uno spermatozoo,
contrazione
muscolare,
movimento
ameboide).
A: nucleo
B: pseudopodi
Ameoba locomotion
PROTEINE DEL CITOSCHELETRO E PROTEINE MOTRICI
Motilità e forma della cellula: la cellula può muoversi nello spazio e gli organelli
possono muoversi dentro la cellula. Tutti i movimenti cellulari sono la
manifestazione di un lavoro meccanico e richiedono un combustibile (ATP) e
proteine che sappiano convertire l’energia dell’ATP in movimento.
•
Perché il movimento cellulare abbia
luogo è necessaria la partecipazione
di due tipi di proteine: le proteine
del citoscheletro e le proteine
motrici. Le prime costituiscono il
supporto strutturale perché le
proteine motrici possano agire.
Cytoskeleton Microtubules | Cell
Biology - YouTube
MECCANISMI RESPONSABILI DEL CAMBIAMENTO DI
FORMA E DEL MOVIMENTO DELLE CELLULE
• Presenza di proteine motrici.
• Assemblaggio e disassemblaggio delle proteine del citoscheletro
(in particolare di microtubuli e microfilamenti).
ELEMENTI STRUTTURALI DEL
CITOSCHELETRO
I componenti del citoscheletro sono: i filamenti di actina
(microfilamenti), i microtubuli e i filamenti intermedi. I primi due
costituiscono gli elementi strutturali su cui agiscono le proteine
motrici, mentre i filamenti intermedi sono solo strutturali.
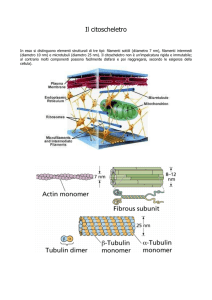
Le tre principali componenti fibrillari del citoscheletro: il microtubulo (a), il filamento
intermedio (b) e il microfilamento (c). I valori dimensionali, riportati in figura,
provengono da misurazioni effettuate al microscopio elettronico su sezioni cellulari.
I MICROTUBULI
L’unità di base dei microtubuli è rappresentata dall’eterodimero costituito da
tubulina a e tubulina b, che legano di preferenza, rispettivamente, il GTP e il GDP.
Dimeri di a- e b-tubulina polimerizzano a formare microtubuli
che sono strutture cave composte da tredici protofilamenti
assemblati insieme..
Le sottounità di tubulina si allineano testa-coda in un protofilamento. A
questo si allineano lateralmente altri protofilamenti polimerizzati come il
precedente in modo che le a e b tubuline siano fianco a fianco.
Si distingue una testa + (dalla parte della subunità b) in cui la polimerizzazione in vitro è
più veloce ed una coda – (dalla parte della subunità a) in cui è meno veloce. La tubulina
a che ha GTP legato stabilmente non lo idrolizza, mentre la tubulina b idrolizza GTP e
rimane legata a GDP. Poiché la polimerizzazione è più veloce dell’idrolisi, all’estremità +
rimane un cappuccio di eterodimeri con tubulina b legata a GTP.
Modello del cappuccio a GTP per l’instabilità dinamica dei microtubuli
MODELLO DEL CAPPUCCIO A GTP
La crescita di un microtubulo è strettamente legata alla presenza
all’estremità positiva del cappuccio a GTP, che poco dopo è
idrolizzata a GDP. Se la concentrazione dei dimeri liberi è alta, la
velocità di aggiunta è maggiore dell'idrolisi del GTP a GDP e il
microtubulo cresce. Quando la concentrazione dei dimeri è al di
sotto di un livello critico la velocità di aggiunta dei dimeri è
inferiore a quella dell'idrolisi e il microtubulo espone il cappuccio
a GDP. Ciò rende instabile il microtubulo, che collassa, diminuendo
velocemente di lunghezza fino anche a scomparire del tutto.
ORGANIZZAZIONE DEI PROTOFILAMENTI IN MICROTUBULI SINGOLI, DOPPI O
TRIPLI. In sezione trasversa, un tipico microtubulo, fatto da 13 protofilamenti
(singoletto). Nel doppietto di microtubuli, oltre ad un tubulo completo A, c’è un
secondo tubulo B fatto da 10 protofilamenti che si associano con la parete del
tubulo A (es. ciglia e flagelli). L’attacco di altri 10 protofilamenti al tubulo B del
doppietto di microtubuli forma un tubulo C e una tripletta di microtubuli
(centrioli e corpi basali).
Nella cellula in interfase i microtubuli sono organizzati in lunghe fibre che riempiono
tutta la cellula. Durante la mitosi vanno, invece, ad organizzare il fuso mitotico.
CELLULA IN
MITOSI
CELLULA IN
INTERFASE
I microtubuli dei flagelli, delle ciglia o quelli che si trovano all’interno degli
assoni dei neuroni sono strutture stabili.
I microtubuli in vivo si irradiano da un centro di organizzazione dei
microtubuli, il MTOC (MicroTubule Organizing Center). Il MTOC contiene
sempre tubulina g e nella maggior parte dei casi anche due corpiccioli detti
centrioli.
Nelle cellule animali l’MTOC si chiama anche centrosoma
CENTRIOLI
Polymerization of tubulin nucleated
by g-tubulin ring complexes. (A)
Model for the nucleation of
microtubule growth by the g-TuRC (gTUbulin Ring Complex). The red
outline indicates a pair of proteins
bound to two molecules of g-tubulin;
this group can be isolated as a
separate subcomplex of the larger
ring. (B) Electron micrographs of
purified g-tubulin ring complexes
(top) and single microtubules
nucleated from the purified g-tubulin
ring complexes (middle and bottom).
(A, modified from M. Moritz et al.,
Nature Cell Biol. 2:365-370, 2000; B,
courtesy of Y. Zheng et al., Nature
378:578-583, 1994).
I microtubuli, che si irradiano dal MTOC, hanno quasi sempre una precisa
polarizzazione. L’estremità – è prossimale al MTOC e quella + è distale da questo.
MICROFILAMENTI DI ACTINA
L’actina è una proteina globulare (G actina) che si assembla in lunghi polimeri
elicati (actina F). La G actina è legata ad ATP che si idrolizza ad ADP e Pi
durante l’assemblaggio in actina F. L’assemblaggio potrebbe avvenire anche
senza idrolisi, ma questa aumenta la sua cinetica.
La G actina si lega a Mg2+ (sito ad alta affinità) ed ha anche siti a bassa affinità
per ioni monovalenti.
L’actina G polimerizza quando i monomeri hanno la concentrazione adeguata
(concentrazione critica). Il primo nucleo di monomeri (nucleazione) si forma
lentamente, poi la polimerizzazione procede più speditamente
(allungamento). Quando sono polimerizzati alcuni monomeri, l’ATP viene
idrolizzato e l’actina F si stabilizza. Alle due estremità (+ end e – end), le
unità vengono aggiunte ed eliminate a velocità diverse.
ATTIVAZIONE: cambiamento conformazionale del monomero in
seguito all’interazione con ioni bivalenti.
NUCLEAZIONE: è promossa da un complesso proteico
comprendente anche “actin-related proteins” (ARPs). Il complesso
ARP è localizzato in regioni in cui è richiesta una rapida
polimerizzazione dell’actina, come gli pseudopodi.
ALLUNGAMENTO: è favorita dalla concentrazione citoplasmatica dei
monomeri di actina che è molto più alta (50-200mM nelle cellule
non muscolari) della concentrazione critica necessaria perché
avvenga la polimerizzazione (1mM) di entrambe le estremità.
STATO STAZIONARIO: si tratta di una fase in cui c’è equilibrio tra il
processo di polimerizzazione e quello di depolimerizzazione dei
monomeri (actina G) dai filamenti di actina (actina F).
http://bcs.whfreeman.com/lodish5e/pages/bcsmain.asp?v=category&s=00010&n=19000&i=19010.01&o=|00510|00520|00530|00540|00560|
00570|00590|00600|00700|00010|00020|00030|00040|00050|01000|02000|03000|04000|0
5000|06000|07000|08000|09000|10000|11000|120
ALCUNE PROTEINE CHE LEGANO L’ACTINA
1– Proteine di nucleazione (complesso Arp2/3, formina)
2 – Proteina che sequestrano i monomeri (timosine)
3 – Proteine di incappucciamento (CapZ – estremità barbed o +)
(tropomodulina estremità pointed o -)
4 – Proteine che promuovono la polimerizzazione dei monomeri (profilina)
5 - Proteine che depolimerizzano i filamenti di actina (cofiline)
6 – Proteine che formano legami crociati (filamina – reti lasse tridimensionali)
7 – Proteine che formano fasci compatti paralleli (villina)
8 – Proteine che tagliano i filamenti (gelsolina)
9 – Proteine che legano proteine di membrana (vinculina, spectrina, distrofina)
L’actina è presente in tutte le cellule con distribuzione specifica per
ognuna di esse. Esistono numerose proteine leganti l’actina (ABP,
actin binding proteins) che influenzano la struttura e
l’organizzazione della F actina.
1) Capping proteins (per esempio, tropomodulina, e CapZ) che legano
le estremità dei filamenti e possono bloccare la depolimerizzazione
regolare il turnover del filamento stesso.
+
-
-
SARCOMERO
+
2) Crosslinking proteins quali a–actinina, filamina e spectrina possono
organizzare la F-actina in reti distinte (gel) o fasci.
3) Altre Actin Binding Proteins (ABPs) modificano la F-actina promovendo la
sua depolimerizzazione (per esempio, cofilina), la sua rottura (per esempio,
gelsolina e cofilina) o la sua polimerizzazione (per esempio, profilina) .
.
Nel citoscheletro dei globuli rossi esiste un complesso sistema di proteine
che legano l’actina alla membrana e ad altri filamenti citoscheletrici.
La membrana plasmatica è associata con una rete di tetrameri di spectrina crosslegati da
corti filamenti di actina in associazione con la proteina 4.1. La rete di spectrina ed actina
è legata alla membrana attraverso l’ankirina, che lega sia la spectrina, sia un’abbondante
proteina transmembrana chiamata banda 3. Un legame aggiuntivo alla membrana
plasmatica è fornito dalla proteina 4.1 che si associa alla glicoforina transmembrana.
Human erythrocyte showing the hubs and linking spectrin network.
In ogni tipologia cellulare le proteine di membrana e quelle che legano
l’actina alle proteine di membrana sono diverse (es. filamina nelle
piastrine, distrofina nelle cellule muscolari, ezrina nelle cellule epiteliali,
proteina 4.1 e ankirina nei globuli rossi).
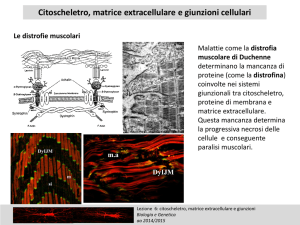
La distrofina aggancia l’actina F
della
fibra
muscolare
a
glicoproteine transmembrana
che a loro volta, attraverso la
laminina, si agganciano alla
matrice extracellulare.
(Extracellular
matrix)
Laminin
Actin
I PRINCIPALI FILAMENTI INTERMEDI DEI MAMMIFERI
Tipo I
Cheratine acide
Tipo II
Cheratine basiche
Tipo III
Vimentina
Desmina
Periferina
Tipo IV
Internessina
Neurofilamenti
Tipo V
Lamina A
Lamina B
Lamina C
Sono molto eterogenei.
I monomeri non hanno forma globulare e non legano nucleotidi
fosfato.
Non hanno polarità intrinseca.
Sono stabili e danno resistenza alla trazione, ma anche dinamici (es.
lamine).
Non sono note proteine motrici associate.
I filamenti intermedi (IF)
hanno un ruolo strutturale.
Rinforzano le cellule e le
organizzano
per
la
formazione dei tessuti. Il
loro ruolo di supporto
appare chiaro se si pensa
che capelli e unghie sono
fatti principalmente di IF.
L’assemblaggio degli IF
deriva per formazione di
dimeri paralleli e tetrameri
antiparalleli.
Distribuzione delle tre tipologie di proteine del citoscheletro nei fibroblasti. Nelle cellule
tumorali, che per molte caratteristiche si sdifferenziano, i filamenti intermedi sono gli unici che
restano quelli specifici del tipo cellulare da cui la cellula tumorale è derivata. Il rilevamento
degli IF è quindi importante per la diagnosi di derivazione delle masse tumorali.
PROTEINE MOTRICI
Le proteine motrici sono tre: la DINEINA, la CHINESINA e la MIOSINA. Le
prime due, per trasformare energia chimica in movimento usano i microtubuli
come supporto, la terza usa, invece, l’actina.
Le miosine appartengono ad una famiglia genica con trenta componenti. La
miosina I è la più rappresentata in tutte le cellule, la miosina II è quella
presente nei muscoli. La miosina è una proteina costituita da una testa
globulare e una coda filamentosa
Le miosine I e V sono in genere localizzate sulle membrane cellulari
mediante siti sulla loro coda, mentre due molecole di miosina II legano
prima le loro code in un sistema di elica elicata e poi le code si associano
lateralmente e formano spessi filamenti con le teste che sporgono alle
estremità di tale filamento.
La testa di miosina ha attività ATPasica, un sito legante ATP e una forte
affinità per l’actina. Se facciamo aderire la miosina ad una vetro e poi
mettiamo filamenti di actina e ATP vediamo che i filamenti di actina si
muovono dall’estremità + a quella -.
In vitro motility assay
http://bcs.whfreeman.com/lodish5e/pages/bcsmain.asp?v=category&s=00010&n=19000&i=19010.02&o=|00510|00520|00530|00540|00560|
00570|00590|00600|00700|00010|00020|00030|00040|00050|01000|02000|03000|04000|0
5000|06000|07000|08000|09000|10000|11000|120
Il movimento è dato dalla variazione di angolo della testa della miosina che si
ottiene come risultato dell’energia emessa dalla scissione di ATP.
•
La testa di miosina si lega all’actina per affinità.
Questo stato può variare solo se arriva una
molecola di ATP che si lega al sito sulla testa
della miosina. Il legame ATP-miosina rende
debole il legame miosina-actina e la testa di
miosina si stacca dall’actina ed è libera di
iniziare l’idrolisi di ATP. L’idrolisi fa cambiare
l’angolo della testa e cambia anche il sito di
legame di miosina con ATP che ora è ADP+P. Così
la testa di miosina si lega di nuovo all’actina, ma
in un sito più lontano. Il legame miosina-actina
provoca la fine dell’idrolisi e l’energia prodotta
sposta nuovamente l’angolo della testa di
miosina e di conseguenza trascina l’actina che a
questa è legata. A questo punto anche l’ADP
lascia la testa di miosina e questa resta legata
all’actina finché non interviene di nuovo ATP.
La CHINESINA è un dimero in cui le teste globulari sono
libere e le code sono elicate insieme. Anche la chinesina
ha attività ATPasica e idrolizza ATP per cambiare
conformazione e generare movimento.
Le teste di chinesina hanno affinità per i microtubuli a cui si legano, mentre le code
hanno capacità di legare recettori di membrana di vescicole cellulari. I cambiamenti
conformazionali delle teste sui microtubuli producono un movimento della chinesina
su questi e di conseguenza il trasporto delle vescicole a cui la chinesina è legata. Il
trasporto veicolato da chinesina va dall’estremità – all’estremità + del microtubulo.
La DINEINA, come la chinesina, è costituita da due monomeri con le teste globulari
libere e le code elicate. Come la chinesina trasporta vescicole, ma non è capace di farlo
da sola. Richiede, per farlo, di un complesso proteico di appoggio. Il più conosciuto è la
dinactina, un eterocomplesso di otto proteine che insieme alla dineina operano il
trasporto delle vescicole lungo i microtubuli dall’estremità + a quella -.
Trasporto degli organelli lungo i microtubuli mediato da chinesina e dineina.
Effect of depolymerizing microtubules on the Golgi apparatus. (A) In this
endothelial cell, the microtubules are labeled in red, and the Golgi apparatus is
labeled in green (using an antibody against a Golgi protein). As long as the system
of microtubules remains intact, the Golgi is localized near the centrosome, close to
the nucleus at the center of the cell. The cell on the right is in interphase, with a
single centrosome. The cell on the left is in prophase, and the duplicated
centrosomes have moved to opposite sides of the nucleus. (B) After exposure to
nocodazole, which causes microtubules to depolymerize, the Golgi apparatus
fragments and is dispersed throughout the cell cytoplasm.
Il movimento: il movimento ciliare e flagellare
STRUTTURA DEL FLAGELLO E DEL CIGLIO: l’assonema
Movimento flagellare: secondo il modello dello slittamento mediato da
dineina, il movimento flagellare avviene perché la dineina legata al
microtubulo A cammina lungo il microtubulo B del doppietto adiacente con
direzione estremità – e quindi muove tale doppietto verso l’estremità +
BATTITO FLAGELLARE
MICROTUBULI E PROTEINE MOTRICI NELLA FORMAZIONE DEL
FUSO MITOTICO
Formazione del fuso mitotico. Nella
profase i centrosomi duplicati si
muovono ai due poli opposti della
cellula.
L’involucro
nucleare
si
disassembla e i microtubuli si
riorganizzano a formare il fuso
mitotico.
I microtubuli del cinetocore si attaccano ai cromosomi duplicati, i microtubuli
polari si sovrappongono gli uni agli altri al centro della cellula e sono i
responsabili dell’allontanamento dei due MTOC e del mantenimento
dell’integrità del fuso mitotico. I microtubuli astrali si estendono verso la
periferia cellulare. In metafase i cromosomi condensati sono allineati al centro
del fuso.
L’aggancio delle fibre del cinetocore ai cromosomi deriva da un meccanismo di
polimerizzazione dei microtubuli molto dinamico che si stabilizza solo quando il
cromosoma è catturato. L’aggancio al cromosoma avviene in segmenti ripetuti del
DNA e con la mediazione di proteine.
ANAFASE A
Il movimento dei cromatidi
fratelli verso i poli del fuso
sembra essere guidato da
proteine motrici (dineine)
dirette verso l’estremità – dei
microtubuli del cinetocore e
dal
disassemblaggio
ed
accorciamento
dei
microtubuli stessi.
ANAFASE B
Separazione dei poli del fuso 1) per azione (allungamento)
dei microtubuli polari che riducono la loro sovrapposizione
slittando uno sull’altro grazie a proteine della famiglia delle
chinesine (verso l’estremità +); 2) per azione dei
microtubuli astrali che possono utilizzare o proteine
motrici ancorate alla membrana (blu) che tirano a sé i
microtubuli movendosi verso l’estremità – (dineine) o
ancorate sui microtubuli stessi, ma dirette verso l’estremità
+ (chinesine).
http://bcs.whfreeman.com/lodish5e/pages/bcsmain.asp?v=category&s=00010&n=20000&i=20010.01&o=|00510|00520|00530|00540|00560|
00570|00590|00600|00700|00010|00020|00030|00040|00050|01000|02000|03000|04000|0
5000|06000|07000|08000|09000|10000|11000|120
Microtubule dinamics ch20
Inner Life Of A Cell - Full Version.mkv
The Inner Life of the Cell - YouTube




![[ XI ] INDICE GENERALE Riconoscimento e interazioni tra cellule](http://s1.studylibit.com/store/data/001175494_1-9062ea75af318561914dbe68aa0e27ca-300x300.png)