11.1
Processi di ossidazione
11.1.1 Processi di ossidazione
in fase vapore
Introduzione
I processi di ossidazione selettiva, in particolare quelli che utilizzano catalizzatori solidi (processi di ossidazione eterogenea) hanno un ruolo fondamentale nella
petrolchimica. Circa il 50% dei principali prodotti chimici e oltre l’80% dei monomeri vengono sintetizzati
mediante almeno uno stadio di ossidazione catalitica
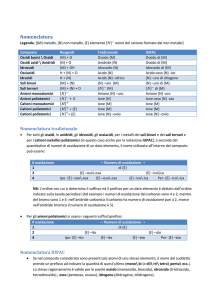
selettiva eterogenea. La tab. 1 riporta un elenco dei principali processi di ossidazione selettiva di idrocarburi utilizzanti catalizzatori solidi, con l’indicazione dei valori
di conversione e di selettività ottenuti. In molti processi
commerciali di ossidazione selettiva esiste ancora un
margine significativo di miglioramento delle prestazioni. Per esempio, il possibile incremento di selettività in
due dei principali processi di ossidazione selettiva (etilene a ossido di etilene e propilene ad acrilonitrile) permetterebbe un risparmio annuale sul costo dei reagenti
di circa 800 milioni di euro.
Già agli inizi dell’Ottocento era nota l’attività di catalizzatori solidi nell’ossidazione, ma è solo verso la metà
del 20° secolo che è iniziato lo studio sistematico dei processi di ossidazione selettiva con catalizzatori solidi e della
loro applicazione industriale. I primi processi che hanno
avuto sviluppo industriale sono stati: l’ossidazione e l’ammonossidazione (ossidazione in presenza di ammoniaca)
del propilene a formare rispettivamente acroleina e acrilonitrile, l’ossidazione dell’etilene a ossido di etilene e
l’ossidazione di aromatici a formare anidridi (anidride
maleica e ftalica). Lo sviluppo di questi processi, derivante anche dalla crescente domanda verso questo tipo di
prodotti, ha portato al potenziamento della ricerca di base,
con effetto sinergico all’attuazione di nuove applicazioni
e il miglioramento di quelle già commercializzate.
Come esempio si può riportare il processo di ammonossidazione del propilene con aria e ammoniaca, che
VOLUME II / RAFFINAZIONE E PETROLCHIMICA
ha sostituito rapidamente il processo precedente basato
sulla reazione tra acetilene e HCN, sia per il costo minore delle materie prime sia per i minori problemi di sicurezza. Ciò ha permesso di produrre l’acrilonitrile con
una notevole riduzione dei costi e con conseguente rapida espansione del suo mercato negli anni 1960-80. Il successo di questo prodotto ha determinato d’altra parte uno
sviluppo della ricerca sui catalizzatori utilizzati (ossidi
misti a base di Bi e Mo), portando a un loro progressivo miglioramento. La prima generazione di catalizzatori, basati su Bi9PMo12O52 supportato, dava una resa del
55%, passata al 65% con lo sviluppo della seconda generazione di sistemi contenenti ferro come elemento redox
e a circa il 75% con lo sviluppo della terza generazione
di catalizzatori multicomponente. L’attuale quarta generazione di catalizzatori, contenenti fino a 25 elementi,
permette di ottenere rese oltre l’80%. Lo sviluppo di
nuovi catalizzatori ha comportato un’analoga evoluzione nel tipo di reattori catalitici utilizzati, inizialmente a
letto fisso, poi a letto fluido ‘bollente’ e infine a letto
fluido ‘frenato’.
Nel periodo 1990-2005 lo sviluppo e l’innovazione
nel settore sono invece derivati dalla crescente attenzione verso i problemi ambientali e di sicurezza, sebbene
nell’ultimo decennio l’introduzione di nuovi processi sia
stata fortemente condizionata dalla riduzione degli investimenti nella petrolchimica, derivante dalla ristrutturazione di tutte le industrie del settore.
Nel seguito sono riassunte le principali direttrici di
sviluppo in quest’ultimo periodo (Centi e Perathoner,
2003b).
Utilizzo di nuove materie prime e di agenti ossidanti
alternativi. È stato progressivamente esteso l’utilizzo di
alcani come materia prima, al posto di aromatici e alcheni; per esempio, la sintesi di acrilonitrile da propano invece che da propilene e la sintesi di anidride maleica da
n-butano invece che da benzene, al fine di ridurre i costi
e/o migliorare l’ecosostenibilità del processo. Sono allo
617
PRODUZIONE DI INTERMEDI PER LA PETROLCHIMICA
tab. 1. Principali processi di ossidazione selettiva di idrocarburi utilizzanti catalizzatori solidi e tipici risultati
ottenuti (Arpentinier et al., 2001; Centi et al., 2002)
REAGENTE
PRODOTTO PRINCIPALE
TIPO DI CATALIZZATORI
SELETTIVITÀ*
(%)
Metano/O2/NH3
HCN
Rete di Pt-Rh
100
60-70
CH4 o (CH2)x /O2
Gas di sintesi (CO/H2)
Rh o Ni supportati
99
90-95
Metanolo/aria
Formaldeide
Ag su a-Al2O3, oppure
ossidi di Fe-Mo
97-99
91-98
92
Etilene/O2/acido acetico
Vinilacetato
Pd-Cu-K su a-Al2O3
8-12**
Etilene/O2
Ossido di etilene
Ag-K-Cl su a-Al2O3
13-18**
72-76
Etilene/aria o O2/HCl
1,2-dicloroetano
Ossicloruri di Cu-Mg(K)
su g-Al2O3
95
93-96
45-50**
94-96
Etanolo/O2
Acetaldeide
Ag, Cu
Propilene/aria
Acroleina
Ossidi supportati
di Bi-Mo-Fe-Co-K
92-97
80-88
Ossidi supportati
di Bi-Mo-Fe-Co-K
98-100
75-83
Propilene/aria/NH3
Acrilonitrile
Acroleina/aria
Acido acrilico
Ossidi di V-Mo-W
95
90-95
n-butano/aria
Anidride maleica
Ossidi di V-P
75-80
67-72
n-butano/aria
Buteni/butadiene
Ossidi di Bi-Mo-P
55-65
93-95
Alcol t-butilico
Metacroleina
Ossidi di Bi-Mo-Fe-Co-K
99
85-90
Isobutene/aria
Metacroleina
Ossidi di Bi-Mo-Fe-Co-K
97
85-90
Metacroleina/aria
Acido metacrilico
Ossidi di V-Mo-W
97-99
95-98
Benzene/aria
Anidride maleica
Ossidi di V-Mo
98
75
o-xilene/aria
Anidride ftalica
Ossidi di V-P-Cs-Sb su TiO2
98-100
81-87
Naftalene/aria
Anidride ftalica
Ossidi di V-K su SiO2
100
84
*
**
Conversione dei reagenti e selettività dei prodotti rispetto all’idrocarburo
Nei processi che operano con riciclo del reagente non convertito la conversione è per singolo passaggio
studio nuovi processi che utilizzano ossidanti alternativi,
ad esempio per la sintesi diretta di fenolo da benzene (invece del processo multistadio da benzene con cumene intermedio), con N2O come agente ossidante invece di O2, per
ridurre la complessità e i rischi del processo, evitare la
coproduzione di acetone e utilizzare un sottoprodotto quale
N2O (riducendo anche i costi per il suo smaltimento).
Sviluppo di nuove classi di catalizzatori e processi.
I processi che utilizzano catalizzatori solidi (eterogenei)
stanno progressivamente sostituendo quelli di tipo omogeneo, per ridurre i costi di separazione e l’impatto
ambientale e/o utilizzare nuove materie prime, per esempio nella sintesi diretta di acido acetico da etano. I processi di deidrogenazione ossidativa di alcani sono sempre
618
CONVERSIONE*
(%)
più competitivi rispetto a quelli di deidrogenazione di
alcheni. Sono allo studio anche processi che permettono di ridurre o eliminare la formazione di coprodotti e/o
la formazione di intermedi tossici o pericolosi; un esempio è la sintesi di acido metacrilico mediante ossidazione diretta di isobutano, come alternativa al processo commerciale aceton-cianidrina, che utilizza HCN come reagente e coproduce ammonio solfato.
Conversione dei processi basati sull’utilizzo di aria
in processi basati sull’alimentazione di ossigeno puro.
Tali processi consentono di ridurre le emissioni inquinanti; ne sono esempi la sintesi della formaldeide da
metanolo, l’epossidazione dell’etilene e l’ossiclorurazione dell’etilene a 1,2-dicloroetano.
ENCICLOPEDIA DEGLI IDROCARBURI
PROCESSI DI OSSIDAZIONE
Miglioramento della produttività dei processi. È dovuto allo sviluppo di nuove generazioni di catalizzatori con
proprietà migliorate e/o al miglioramento dell’ingegneria dei reattori (per esempio, l’introduzione di un reattore monolitico nella sintesi della formaldeide, o di reattori a letto strutturato nella sintesi dell’anidride ftalica).
Inoltre, nel periodo 2000-05 è cresciuto notevolmente
l’interesse per lo sviluppo di nuove tecnologie reattoristiche (quale per esempio quella dei reattori a membrana), che permettono una buona economia di processo
anche per produzioni medio-piccole (scale-down dei processi; Centi e Perathoner, 2003a), al fine di delocalizzare la produzione e ridurne l’impatto ambientale, in opposizione alla tendenza tipica del 20° secolo di migliorare
l’economia dei processi attraverso l’aumento di scala e
l’integrazione spinta in grandi siti petrolchimici. Ciò a
causa dell’elevato impatto ambientale e della forte opposizione sociale verso quest’ultima soluzione, oltre che
per problemi legati allo scarso adattamento a un mercato con forti fluttuazioni nella domanda.
I processi di ossidazione catalitica selettiva possono
essere divisi in tre classi. La prima riguarda l’ossidazione di molecole inorganiche (per esempio, l’ossidazione dell’ammoniaca a NO e di H2S a zolfo). La seconda classe riguarda la sintesi di prodotti chimici di base
(per esempio, l’ammonossidazione del metano a HCN
o l’ossidazione parziale del metano a gas di sintesi; miscele CO/H2). La terza classe infine riguarda la conversione di idrocarburi attraverso processi in fase liquida (principalmente in fase omogenea, anche se è crescente l’interesse verso quelli utilizzanti catalizzatori eterogenei)
e processi in fase vapore, i più applicati industrialmente (v. ancora tab. 1). Occorre rilevare che questa ultima
classe di processi utilizza aria od O2 come ossidanti (a
parte il citato processo di idrossilazione diretta del benzene a fenolo con N2O), mentre nei processi in fase liquida, oltre a O2, si utilizzano estensivamente anche altri
agenti ossidanti quali alchilperossidi e H2O2 (Centi e
Perathoner, 2003b).
Le differenti classi di processi di ossidazione selettiva in fase vapore (su catalizzatori solidi) e le relative
principali reazioni industriali sono riassunte nella tab. 2
(Arpentinier et al., 2001; Centi et al., 2002). Alcune importanti classi di reazioni, non incluse nella tabella in
quanto non ancora commerciali, sono: la deidrogenazione ossidativa di alcani C2-C5 alle corrispondenti olefine;
l’ossidazione selettiva di alcani quali la sintesi di anidride ftalica e maleica da n-pentano, di acido acrilico da
propano e di metacroleina o acido metacrilico da isobutano; l’ammonossidazione del propano ad acrilonitrile.
I catalizzatori utilizzati per queste reazioni possono
essere classificati in base al meccanismo di reazione che
li caratterizza.
Ossidazione allilica. Per questa reazione sono utilizzati catalizzatori a base di ossidi misti di metalli di
VOLUME II / RAFFINAZIONE E PETROLCHIMICA
transizione, capaci di estrarre selettivamente un atomo
di idrogeno rompendo un legame CH in posizione
allilica ed eventualmente inserendo un atomo di ossigeno nella stessa posizione. I catalizzatori industriali sono
generalmente multicomponente (per esempio, gli ossidi
di Bi-Mo, utilizzati nella sintesi dell’acrilonitrile da propilene, contengono vari promotori quali Fe, Cu, W, Te,
Sb, K), ma tipicamente si può identificare una fase principale (Bi-molibdato) capace di catalizzare differenti reazioni, quali: la sintesi di acroleina da propilene, l’ammonossidazione di propilene ad acrilonitrile, la dimerizzazione di propilene a cicloesene e la deidrogenazione
ossidativa di buteni a butadiene. Queste reazioni sono
caratterizzate da un primo stadio comune di ossidazione allilica (fig. 1), ove l’estrazione di un atomo di idrogeno in posizione allilica dà luogo a un complesso
p-allilico chemiadsorbito sul metallo di transizione. La
natura degli stadi successivi determina il tipo di reazione e di prodotto che si ottiene. L’ossidazione e l’ammonossidazione in catena laterale di alchilaromatici (per
esempio, l’ossidazione del toluene a benzaldeide o benzonitrile, rispettivamente) segue in linea di principio un
meccanismo di reazione analogo, ma l’interazione dell’anello aromatico con la superficie è differente e quindi si utilizzano differenti tipi di catalizzatori, come ossidi di vanadio supportati su TiO2 o catalizzatori a base di
molibdati di Fe-(V, P, K).
Ossidazione nucleofila al gruppo CO (deidrogenazione ossidativa di alcoli e ossidazione di aldeidi ad
acidi). Sebbene questo tipo di reazione abbia analogie
con il meccanismo descritto in precedenza, esistono vari
tipi di substrati quali alcoli (metanolo) o aldeidi (acroleina o metacroleina) che interagiscono troppo fortemente con la superficie del catalizzatore quando vengono utilizzati catalizzatori che appartengono alla prima
classe. Nella conversione del metanolo in formaldeide,
il catalizzatore più utilizzato a livello industriale è il
molibdato di ferro (contenente anche altri componenti
in piccola quantità), mentre catalizzatori multicomponente, a base di ossidi di Mo-V o di eteropoliacidi di
P-Mo-V, sono utilizzati per la conversione delle aldeidi
nei corrispondenti acidi.
Inserzione elettrofila di un atomo di ossigeno. I catalizzatori per questa classe di reazione sono altamente
specifici. Esempi sono i sistemi a base di Ag/a-Al2O3
per la sintesi di ossido di etilene da etilene (questo catalizzatore, per esempio, quando applicato alla sintesi dell’ossido di propilene da propilene non è selettivo) e
Fe/ZSM-5 per l’idrossilazione del fenolo con N2O come
ossidante.
Ossidazione (o ammonossidazione) di alcani. In questo caso, lo stadio lento è l’attivazione iniziale selettiva
dell’alcano, per esempio per estrazione concertata di un
atomo di idrogeno da parte di un sito superficiale di Lewis
(un metallo di transizione) e di un secondo atomo di
619
PRODUZIONE DI INTERMEDI PER LA PETROLCHIMICA
H
H
C
H
C
H
C
H
H
H
C
C
H
C
O
C
H
C
H
H
Me
H
Me O Me O Me O
O
H
H
H
Me
H
C
Me
O
H
Me O Me O
vacanza anionica
H
H
O
O
Bi
OH
O
Mo
O
O
Bi
O
OH
O
Mo
O
O
Bi
O
O
Mo
O
O
complesso p-allilico
fig. 1. Schema generale di meccanismo di ossidazione allilica ed esempio nel caso dell’ossidazione
del propilene su molibdato di bismuto per ottenere acroleina.
idrogeno da parte di un sito basico (atomi di ossigeno)
per dare un alchene, che immediatamente viene convertito a prodotti ossigenati mediante meccanismi di
ossidazione o ammonossidazione allilica. A causa della
debole interazione del substrato con la superficie e del
meccanismo di attivazione, sono necessari catalizzatori con proprietà differenti da quelle dei catalizzatori
appartenenti alla prima classe di reazioni. Sono utilizzati, per esempio, catalizzatori a base di pirofosfato di
vanadile per l’ossidazione del n-butano ad anidride
maleica, o a base di vanadio antimoniati per l’ammonossidazione di propano. In quest’ultimo caso, l’ossido di
antimonio è attivo nell’ammonossidazione di propilene, ma non è in grado di attivare la molecola di propano;
tab. 2. Differenti classi di processi di ossidazione selettiva in fase vapore (su catalizzatori solidi)
e relative principali reazioni industriali (Arpentinier et al., 2001; Centi et al., 2002)
TIPO DI REAZIONE
620
ESEMPI
Ossidazione allilica
– propilene ad acroleina o acido acrilico
– isobutene a metacroleina o acido metacrilico
La sintesi degli acidi può essere effettuata in un unico stadio dall’alchene,
ma commercialmente si preferisce utilizzare due stadi per le migliori selettività
possibili
Deidrogenazione ossidativa
– buteni a butadiene e isopentene a isoprene
– metanolo a formaldeide
– acido isobutirrico ad acido metacrilico
Inserzione di tipo elettrofilo
di un atomo di ossigeno
– epossidazione dell’etilene a ossido di etilene con O2
– sintesi diretta di fenolo da benzene con N2O
Acetossilazione
– sintesi dell’acetato di vinile da etilene e acido acetico
Ossiclorurazione
– sintesi dell’1,2-dicloroetano da etilene e HCl in presenza di O2
Ammonossidazione
– propilene ad acrilonitrile
– isobutene a metacrilonitrile
– a-metilstirene ad atroponitrile
Sintesi di anidridi
– n-butano ad anidride maleica
– o-xilene ad anidride ftalica
ENCICLOPEDIA DEGLI IDROCARBURI
PROCESSI DI OSSIDAZIONE
l’addizione di V conferisce al sistema la capacità di ossidare l’alcano.
Meccanismo di ossidazione tipo Wacker. L’acetato di
vinile è prodotto per acetossilazione dell’etilene con
acido acetico in presenza di ossigeno, con catalizzatori
a base di Pd/Au supportati. Il Pd supportato su
V2O5/Al2O3 o V2O5/TiO2 è selettivo nella sintesi in fase
vapore di acetaldeide da etilene o di metiletilchetone da
1-butene, con un meccanismo di reazione analogo.
Ossiclorurazione. 1,2-dicloroetano è prodotto commercialmente da etilene, HCl e O2 su catalizzatori a base
di cloruro di rame supportato. Il meccanismo consiste
in un’addizione diretta di atomi di cloro da parte del catalizzatore sull’olefina, piuttosto che in un’ossidazione di
HCl a cloro molecolare, seguita da clorurazione del doppio legame.
Addizione di ossigeno al nucleo aromatico, con apertura dell’anello. L’attacco elettrofilo di ossigeno a substrati idrocarburici porta tipicamente alla formazione di
ossidi di carbonio, ma nel caso dell’ossidazione del benzene si ottiene invece ossidazione selettiva ad anidride
maleica. Questo processo, che utilizza catalizzatori a
base di ossidi misti di vanadio e molibdeno, è stato in
parte soppiantato dalla sintesi mediante ossidazione di
n-butano. Catalizzatori analoghi sono utilizzati nell’ossidazione selettiva di composti poliaromatici.
Meccanismi di ossidazione non classici. L’etilbenzene può essere deidrogenato ossidativamente con alta
selettività a stirene su vari catalizzatori quali ossidi e
fosfati, ma la fase attiva è costituita dalla formazione
di un sottile superficiale di carbone contenente siti attivi nella reazione. Recentemente anche alcuni tipi di
carbone e nanotubi di carbonio hanno mostrato elevate selettività nella deidrogenazione ossidativa dell’etilbenzene a stirene. Un altro esempio è l’ammossimazione del cicloesanone (a cicloesanonossima) su
silice amorfa.
Caratteristiche dei processi di ossidazione
in fase vapore
nel meccanismo di riossidazione del catalizzatore ridotto, noto come meccanismo di Mars-van Krevelen (fig. 2).
L’ossidazione del catalizzatore da parte di O2 avviene attraverso la formazione di specie di ossigeno inter
medie quali O
2 e O , che hanno caratteristiche di elettrofilicità e tendono a dare addizione a molecole insature, con rottura dei doppi legami e formazione finale di
ossidi di carbonio; al contrario, l’ossigeno strutturale del
catalizzatore (O2) ha caratteristiche nucleofile (fig. 3).
Pertanto, per essere selettivo un catalizzatore deve non
solo possedere i siti di attivazione dell’idrocarburo e di
inserzione selettiva dell’ossigeno sul substrato, ma deve
anche essere velocemente riossidabile, in modo da evitare che le specie non selettive di ossigeno chemiadsorbito
H2O
catalizzatore ossidato
O2
VOLUME II / RAFFINAZIONE E PETROLCHIMICA
M1n
idrocarburo
catalizzatore ridotto
ossido (catalizzatore)
fig. 2. Meccanismo di Mars-van Krevelen di ossidazione
selettiva di idrocarburi su catalizzatori a base di ossidi.
O2
O2 M(n1)
Mn
O2
O2
Mn
O22
O
O2
O2
O2
Mn
O
2
O2
O2
O2 M(n1)
Mn
O2
A
specie elettrofile
di ossigeno
(O
2 , O , ...)
Aspetti generali
Sebbene nell’industria petrolchimica siano utilizzati
processi di ossidazione selettiva sia in fase vapore sia in
fase liquida, quelli in fase vapore sono i più diffusi. Si
impiega tipicamente ossigeno (o aria) come agente ossidante, sebbene le specie coinvolte nella reazione di ossidazione selettiva non siano solitamente costituite da ossigeno adsorbito sul catalizzatore, quanto piuttosto dall’ossigeno strutturale del catalizzatore (tipicamente ossidi
misti, v. ancora tab. 1). Lo ione ossigeno O2rimuove gli
atomi di idrogeno dall’idrocarburo con conseguente formazione di acqua oppure, inserito sulla molecola di reagente, dà luogo alla formazione di composti ossigenati
(v. ancora fig. 1). L’ossigeno gassoso interviene invece
M2m
prodotto
ossidato
prodotto con rottura
del legame C C e
formazione di COx
C
attivazione O2
B
specie
nucleofile
di ossigeno
(O2)
C
C
C
H
prodotti di
ossidazione selettiva
(per es. aldeidi)
fig. 3. A, meccanismo schematico di incorporazione
di ossigeno in catalizzatori a base di ossidi;
B, schema del differente tipo di attacco sull’idrocarburo
da parte di specie nucleofile ed elettrofile di ossigeno
(Centi et al., 2002).
621
PRODUZIONE DI INTERMEDI PER LA PETROLCHIMICA
abbiano tempi di vita sufficientemente lunghi da dare
luogo a reazioni di combustione. Questo meccanismo è
generalmente accettato per l’ossidazione di alcheni su ossidi misti, ma esistono dubbi sulla sua validità nel caso dell’ossidazione di substrati diversi, quali alcani.
Una caratteristica generale dei processi di ossidazione selettiva di idrocarburi è rappresentata dalla complessità delle reazioni coinvolte. Per esempio, l’ossidazione del n-butano ad anidride maleica è una reazione
che coinvolge 14 elettroni, la rimozione di 8 atomi di
idrogeno e l’inserzione di 3 atomi di ossigeno nel substrato, con il coinvolgimento di altri 4 atomi di ossigeno del catalizzatore per formare 4 molecole d’acqua.
Nonostante la complessità della trasformazione, la reazione avviene senza formazione di prodotti con grado di
ossidazione intermedio; si ottengono selettività comprese
tra il 70 e l’85%, in funzione delle condizioni di reazione. Il catalizzatore, costituito da un ossido misto di V e
P con composizione (VO)2P2O7, possiede quindi caratteristiche tali da evitare sia il desorbimento degli intermedi di reazione, sia la trasformazione non selettiva di
questi in ossidi di carbonio.
Infine, un’ulteriore caratteristica dei catalizzatori di
ossidazione selettiva è la multifunzionalità, necessaria per
la trasformazione dell’idrocarburo nel prodotto finale;
infatti, per realizzare il complesso meccanismo sopra indicato, è necessario che il catalizzatore sia in grado di attuare diversi tipi di trasformazioni sul substrato (Arpentinier
et al., 2001). Inoltre, è necessario che i diversi stadi coinvolti nella trasformazione abbiano velocità tra loro confrontabili. Velocità relative diverse potrebbero portare al
desorbimento dei prodotti intermedi o all’aumento della
velocità di reazioni parallele, con diminuzione della selettività al prodotto desiderato. Questo viene ben esemplificato dall’ossidazione selettiva di n-butano (fig. 4).
Progettazione accoppiata del catalizzatore
e del reattore
L’ottimizzazione di resa, produttività e selettività nelle
reazioni di ossidazione selettiva richiede non solo una
conoscenza dettagliata della natura del catalizzatore e
del meccanismo di interazione di reagenti e prodotti con
il catalizzatore stesso, ma anche l’ottimizzazione del reattore utilizzato. Recentemente nuove soluzione reattoristiche (che prevedono, per esempio, la separazione dei
due stadi di interazione del catalizzatore con idrocarburo e con ossigeno) hanno portato allo sviluppo di nuove
classi di catalizzatori; i due aspetti (sviluppo del catalizzatore e ingegneria del reattore) sono quindi strettamente correlati.
I reattori industriali utilizzati nell’industria petrolchimica per reazioni fortemente esotermiche, quali quelle di
ossidazione selettiva, sono tipicamente a letto fisso multitubolare o a letto fluido. Tuttavia, vi è un interesse crescente verso lo sviluppo di nuove soluzioni reattoristiche,
622
n-butano
COx, H2O
eliminazione concertata
di 2 atomi di idrogeno
buteni
⫹
isomerizzazione
estrazione di H allilico
butadiene
inserzione 1,4 di ossigeno
diidrofurano
O
5 H,
2-furanone
furano
O
O O
in fase adsorbita
(sul catalizzatore)
anidride
maleica
O
O
deidrogenazione allilica
e/o inserzione allilica
di ossigeno
inserzione di ossigeno
O
fig. 4. Schema del meccanismo di reazione nell’ossidazione
selettiva di n-butano ad anidride maleica su catalizzatori a
base di (VO)2P2O7, con indicazione del carattere
multifunzionale del catalizzatore.
quale per esempio il reattore a letto fluido circolante,
recentemente applicato dalla DuPont per la sintesi di anidride maleica da n-butano. Il ‘disaccoppiamento’ delle
due reazioni redox, di ossidazione dell’idrocarburo da
parte del catalizzatore e di riossidazione di quest’ultimo
da parte dell’ossigeno (v. ancora fig. 2), permette un
aumento della selettività ad anidride maleica rispetto alla
reazione condotta in presenza contemporanea di idrocarburo e di ossigeno. Ulteriori vantaggi di questo tipo
di reattore sono l’isotermicità e la diminuzione dei rischi
di esplosione. Tuttavia, il limite è costituito dalla bassa
produttività; è necessario infatti far circolare tra i due
reattori, ciascuno adibito a uno dei due stadi della reazione, elevate quantità del catalizzatore, pari a circa 1 kg
per g di anidride maleica prodotta.
Un altro esempio di nuova configurazione reattoristica, adottata per processi petrolchimici, è costituito dai
reattori di tipo monolitico; essi uniscono i vantaggi della
possibilità di conduzione autotermica della reazione e di
una ridotta perdita di carico. Le nuove generazioni di
processi per ossidazione di metanolo a formaldeide utilizzano uno stadio finale adiabatico (post-reattore), con
il catalizzatore strutturato in forma di monolito.
Risultati molto interessanti sono stati ottenuti con
reattori a bassissimo tempo di contatto (dell’ordine dei
millisecondi, rispetto a tempi di secondi nei reattori convenzionali), ove anche la configurazione del catalizzatore è di tipo non convenzionale (per esempio, in forma
di reti). Date le alte velocità spaziali utilizzate (cioè gli
elevati rapporti tra la portata dei reagenti e la quantità
dei catalizzatori) e il tipo di meccanismo coinvolto, è
ENCICLOPEDIA DEGLI IDROCARBURI
PROCESSI DI OSSIDAZIONE
possibile evitare le ossidazioni successive e ottenere quindi elevate selettività nei prodotti intermedi (per esempio,
nella deidrogenazione ossidativa di alcani ad alcheni).
Infine, occorre ricordare gli sviluppi nel settore dei
reattori a membrana catalitica, ove è possibile la rimozione continua di uno dei prodotti o l’addizione differenziata lungo il letto catalitico di uno dei reagenti (per
esempio, ossigeno). Ciò permette di mantenere un rapporto ottimale idrocarburo/O2 lungo tutto il profilo, di
limitare la formazione di punti caldi e di controllare lo
stato di ossidazione del catalizzatore. Tuttavia, uno dei
limiti attuali è la bassa produttività, oltre al costo elevato delle membrane stesse.
Anche i reattori convenzionali a letto fisso possono
essere migliorati con una maggiore integrazione tra la
progettazione del catalizzatore e quella del reattore. Nel
processo di sintesi dell’anidride ftalica da o-xilene vengono usati letti catalitici differenziati, contenenti cioè
diversi strati di catalizzatore con composizione differente tra loro, in modo da ottimizzare il profilo assiale
di attività e selettività del catalizzatore stesso.
Una nuova tecnica reattoristica in fase di sviluppo è
costituita dai sistemi con inversione periodica del flusso; ciò permette di rendere più uniforme il profilo di attività e temperatura nel reattore, pur se persistono alcuni
importanti problemi, costituiti dalla difficoltà di gestione delle operazioni non stazionarie e dalla loro potenziale pericolosità. Anche in questo caso, la progettazione del catalizzatore è differente da quella per operazioni in condizioni stazionarie.
Utilizzo di aria o di ossigeno puro come agenti
ossidanti
L’aria è attualmente il reagente più utilizzato nei processi di ossidazione in fase vapore, ma è crescente l’interesse per l’utilizzo di O2 puro, al fine di aumentare la
produttività e ridurre le emissioni inquinanti e i consumi energetici. Nella tab. 3 è illustrato un esempio delle
emissioni nel processo di ossiclorurazione dell’etilene,
nei casi di utilizzo di aria o di ossigeno come reagente
ossidante. Si può notare la significativa diminuzione dell’impatto ambientale nel secondo tipo di processo.
I seguenti processi in fase vapore utilizzano O2 puro,
oppure aria arricchita con ossigeno, in alternativa all’aria: a) ossidazione parziale (a gas di sintesi) di frazioni
pesanti ottenute dalla distillazione del petrolio; b) ossidazione del metanolo a formaldeide (aria o aria arricchita); c) ossidazione dell’etilene a ossido di etilene (aria
od ossigeno, quest’ultimo in particolare per i nuovi
impianti); d) ossiclorurazione dell’etilene a 1,2-dicloroetano (aria oppure ossigeno, quest’ultimo in particolare per i nuovi impianti); e) acetossilazione dell’etilene
a vinilacetato (ossigeno); f ) ossidazione del n-butano ad
acido acetico (aria od ossigeno); g) ossidazione dell’etilene ad acetaldeide (aria od ossigeno); h) ossidazione
dell’acetaldeide ad anidride acetica (aria od ossigeno);
i) ammonossidazione del propilene ad acrilonitrile (aria
arricchita con ossigeno).
Catalizzatori di ossidazione selettiva di idrocarburi
Caratteristiche dei catalizzatori di ossidazione
I catalizzatori di ossidazione appartengono alla classe più ampia dei materiali aventi caratteristiche di tipo
redox, od ossidoriduttive; a tale classe appartengono
anche i sistemi che catalizzano reazioni di idrogenazione, deidrogenazione, alogenazione e dealogenazione. Nella tab. 1 sono elencati i più importanti catalizzatori di ossidazione di idrocarburi nel campo della
petrolchimica per processi realizzati in fase gas. In
aggiunta a questi, è utile menzionare i catalizzatori per
ossidazione di composti inorganici, quali quelli per
tab. 3. Composizione delle emissioni nel processo di ossiclorurazione dell’etilene nei casi di utilizzo
di aria od ossigeno (Arpentinier et al., 2001). DCE: 1,2-dicloroetano; VCM: cloruro di vinile monomero
Processo utilizzante aria
Componente
Processo utilizzante O2
Contenuto (vol%); flusso (m3/h)
O2+Ar
4-8; 400-2.400
0,1-2,5; 25
Etilene
0,1-0,8; 10-24
2-5; 50
COx (CO2/CO3-4/1)
1-3; 100-900
15-30; 300
DCE e composti clorurati
0,02-0,2; 2-60
0,5-1; 10
resto
resto
10.000-30.000
1.000
N2
Spurgo (m3/h)*
*Approssimativamente 300-900 m3 per t di VCM prodotto
VOLUME II / RAFFINAZIONE E PETROLCHIMICA
623
PRODUZIONE DI INTERMEDI PER LA PETROLCHIMICA
ossidazione di SO2 a SO3 (a base di ossido di vanadio
supportato), di ammoniaca a NO (a base di Pt/Rh) e di
cloruro di idrogeno a cloro molecolare (a base di cloruro di rame supportato).
Nel seguito sono elencate le caratteristiche principali dei catalizzatori di ossidazione per reazioni in fase
gassosa.
Presenza di un metallo di transizione come componente attivo principale (V, Mo, Cu, Fe, Pd, Pt, Rh, Ag).
In questi casi, è spesso presente anche un secondo elemento, che può essere di transizione oppure di post-transizione (per esempio, P, Sb o Bi), il quale contribuisce a
determinare le caratteristiche di reattività del catalizzatore. Questo effetto si può esplicare attraverso la formazione di un ‘ossido misto’ (ovvero un composto specifico, quale per esempio Bi2Mo2O9, eventualmente solo
sulla superficie di un altro ossido, di una soluzione solida oppure di un ossido drogato dall’altro elemento), con
caratteristiche di reattività differenti da quelle dei singoli elementi, se presenti in fasi distinte. In taluni casi,
l’elemento è inizialmente presente nella forma metallica, ma in ambiente di reazione può generare il corrispondente ossido (oppure cloruro od ossicloruro).
Presenza di piccole quantità di elementi ‘promotori’
(o ‘droganti’). Questi elementi hanno lo scopo di ottimizzare le prestazioni degli elementi attivi principali. I
promotori possono essere di varia natura e giocare quindi ruoli diversi nella trasformazione dei reagenti. Gli elementi attivi e gli elementi promotori, costituiscono la
fase attiva, cioè la fase direttamente coinvolta nella trasformazione dei reagenti a prodotti.
Presenza di un supporto (solitamente silice, allumina o titania). Tale supporto nella formulazione del catalizzatore può avere diversi compiti. Un primo compito è
quello di disperdere gli elementi attivi, conferendo alla
fase attiva un’area superficiale più elevata rispetto a quella che avrebbe in assenza del supporto. È pertanto chiaro che il supporto deve avere caratteristiche dell’area
superficiale idonee per la reazione di interesse. Nelle
ossidazioni selettive, ove la selettività nella formazione
del prodotto di ossidazione parziale dipende significativamente dalle reazioni consecutive a prodotti non desiderati (per esempio ossidi di carbonio, che sono termodinamicamente favoriti), è necessario un supporto con
area superficiale non eccessivamente elevata. In questo
modo si limita la velocità delle reazioni indesiderate
secondarie, che dipendono anche dal tempo necessario
al prodotto per retrodiffondere dal centro attivo alla fase
gassosa. Un ulteriore compito del supporto è quello di
conferire resistenza alla fase attiva nei confronti di fenomeni abrasivi o di sgretolamento, soprattutto per quelle
applicazioni che implicano particolari sollecitazioni meccaniche sul catalizzatore (per esempio, in reattori a letto
fluidizzato), oltre a evitare fenomeni di spolveramento
durante il carico del catalizzatore in reattori a letti fissi
624
impaccati. Infine, in taluni casi il supporto serve per alterare le caratteristiche di reattività chimica intrinseca della
fase attiva, tramite effetti di interazione tra questa e il
supporto stesso. Questo avviene quando il supporto presenta dei gruppi funzionali alla sua superficie, in grado
di dare luogo a legami chimici con gli elementi della fase
attiva, oppure si verifica in conseguenza di particolari
similitudini cristallografiche tra la superficie e il supporto. Questi effetti di interazione possono risultare positivi per la reattività del catalizzatore stesso, alterandone
le caratteristiche di ossidoriducibilità o diminuendone la
volatilità; vengono così rallentati i fenomeni indesiderati di perdita dei componenti della fase attiva per sublimazione.
La combinazione opportuna tra tipo e quantità di fase
attiva (inclusi i promotori) e tipo di supporto è funzione
delle caratteristiche della reazione e del tipo di reattori
utilizzati. In particolare, sono di seguito citati i fattori che
maggiormente condizionano la formulazione e la morfologia del catalizzatore nelle reazioni di ossidazione.
Tipo di trasformazione chimica coinvolta e meccanismo attraverso cui si esplica. Più complessa è la trasformazione, più articolata diventa la composizione del
catalizzatore, in termini di numero di elementi che costituiscono la fase attiva, o di complessità strutturale (formazione di fasi cristalline aventi caratteristiche di multifunzionalità). Per esempio, catalizzatori per ossidazione o ammonossidazione allilica contengono sempre Mo
come elemento principale per la fase attiva, mentre catalizzatori per la sintesi di anidridi o di acidi contengono
quasi sempre V.
Ottimizzazione delle caratteristiche redox o delle proprietà acide o basiche del catalizzatore. I promotori (o
droganti) possono giocare un ruolo fondamentale nel
controllo di queste proprietà. Promotori con caratteristiche basiche (ossidi di metalli alcalini o alcalino-terrosi) possono diminuire l’acidità superficiale della fase
attiva, con conseguente miglioramento della selettività
tramite la soppressione delle reazioni acido-catalizzate
(cracking, formazione di oligomeri di composti insaturi). Promotori con caratteristiche di tipo acido possono
diminuire l’interazione tra la fase attiva e intermedi di
reazione con caratteristiche di tipo acido, favorendone
il desorbimento in fase gassosa e limitando il contributo delle reazioni consecutive indesiderate. Altri promotori possono ottimizzare le proprietà ossidoriduttive della
fase attiva, tramite una modificazione delle proprietà
elettroniche collettive del solido.
Schema della reazione. La presenza di reazioni consecutive (tipicamente, reazioni di combustione del prodotto desiderato, oppure reazioni che portano dal reagente al prodotto desiderato attraverso la formazione di
prodotti intermedi con stato di ossidazione via via crescente) implica l’utilizzazione di un catalizzatore con
caratteristiche tali da limitare (o, al contrario, favorire)
ENCICLOPEDIA DEGLI IDROCARBURI
PROCESSI DI OSSIDAZIONE
il contributo di tali reazioni. Questo può essere realizzato non solo mediante un controllo dell’attività intrinseca del catalizzatore, ma anche attraverso una modulazione della porosità della fase attiva (e quindi del supporto, se presente). Un valore elevato di area superficiale
e di porosità implica tempi di residenza intraparticellari effettivi ben superiori a quelli calcolabili dalla portata di alimentazione al reattore, e quindi un contributo
importante delle reazioni consecutive a parità di conversione del reagente. Ciò può influenzare considerevolmente la selettività al prodotto desiderato.
Tenore termico della reazione. Reazioni fortemente
esotermiche implicano la necessità di reattori catalitici
a letto fluidizzato, più efficienti nella rimozione del calore rispetto ai reattori multitubolari, e quindi di catalizzatori atti a operare in condizioni di forti sollecitazioni
meccaniche. In questi casi vengono utilizzati supporti
fluidizzabili, caratterizzati cioè da particelle aventi diametro medio compreso tra 50 e 150 mm, resistenza all’abrasione e densità opportuna. Per tenori termici mediobassi, possono essere utilizzati reattori tubolari o a fascio
tubiero (multitubolari). In questo caso i catalizzatori
hanno morfologia caratteristica per queste applicazioni
e vengono realizzati in forma di estrusi (o pellet). Quando possibile, vengono utilizzati supporti a elevata conducibilità termica, quale SiC, per favorire la dissipazione del calore di reazione.
Velocità spaziale nel reattore. Elevate velocità spaziali in letti catalitici impaccati possono portare a elevate perdite di carico, e quindi alla necessità di onerose compressioni della corrente a monte del reattore. È possibile minimizzare la perdita di carico aumentando il grado
di vuoto del letto catalitico, mediante l’utilizzazione di
particolari conformazioni delle particelle del catalizzatore. Questo aspetto può risultare determinante nel condizionare le prestazioni del processo, come nella deidrogenazione ossidativa di metanolo a formaldeide. In questo caso, l’utilizzazione di pellet cilindrici con foro assiale
permette di diminuire le perdite di carico e quindi di
aumentare, a parità di portata di alimentazione, la velocità lineare nel reattore. Questo implica tempi di contatto minori, miglior controllo della temperatura di reazione e minori effetti di disattivazione del catalizzatore.
Meccanismi della catalisi di ossidazione
in fase gassosa
I principali meccanismi dell’ossidazione catalitica
sono elencati nella tab. 2. Il meccanismo di tipo redox è
quello coinvolto nella maggior parte delle reazioni di
ossidazione. Esso si esplica attraverso una serie di stadi
successivi, che includono: l’adsorbimento del reagente
(il substrato da ossidare) sul centro attivo; il trasferimento di elettroni dal reagente al centro attivo e il contemporaneo trasferimento di ioni ossigeno da questo
al reagente (l’ossigeno viene incorporato nel substrato,
VOLUME II / RAFFINAZIONE E PETROLCHIMICA
o in alternativa rientra nella formazione del coprodotto
acqua); infine il desorbimento del prodotto. La medesima successione di stadi coinvolge la molecola di ossigeno per lo stadio di riossidazione del catalizzatore: coordinazione al centro metallico; trasferimento di elettroni
(fino a 4 per ogni molecola di ossigeno); dissociazione
della molecola in due specie atomiche in forma ionica;
infine incorporazione dell’ossigeno nella sua forma ionica all’interno della fase attiva.
Potranno essere coinvolti uno o più centri attivi per
ogni molecola di reagente, in funzione dei seguenti fattori: a) numero complessivo di elettroni trasferiti e quindi di ioni ossigeno coinvolti nel processo ossidoriduttivo; b) proprietà di conducibilità ionica ed elettronica del
solido, e quindi della fase attiva superficiale, nelle condizioni di reazione; c) grado di copertura della fase attiva da parte di molecole adsorbite (reagenti e prodotti);
d) mobilità superficiale degli intermedi di reazione; e) numero di centri attivi prossimi a quello in corrispondenza
del quale è avvenuta l’attivazione dell’idrocarburo.
Sulla base del modello redox, la selettività del processo, cioè il rapporto tra la quantità di prodotto formato e la quantità totale di reagente trasformato, può essere ricondotta a due differenti situazioni. Innanzitutto la
selettività dipende dalla natura degli ioni ossigeno presenti come specie adsorbite sulla fase attiva e dall’interazione tra queste e il reagente o gli intermedi di reazione. Come detto precedentemente, la specie O2, incorporata nel reticolo dell’ossido, è considerata la specie
selettiva, mentre le specie O2 e O hanno caratteristiche elettrofile e sono considerate specie non selettive.
Poiché la formazione della prima specie avviene attraverso la formazione intermedia di quelle elettrofile, è
chiaro che la velocità di trasformazione di ciascuna di
esse e la loro reattività nei confronti degli intermedi di
reazione ottenuti per attivazione del substrato determinano la selettività del processo (Bielanski e Haber, 1991).
La selettività del processo di ossidazione è inoltre
riconducibile alla concentrazione di specie O2 incorporate nel reticolo dell’ossido metallico, e quindi in definitiva allo stato di ossidazione medio del catalizzatore
(Grasselli, 2002). Un catalizzatore fortemente ossidato
possiede un’elevata densità di centri attivi in grado di
ricevere elettroni dal substrato e di cedere ioni O2, e
quindi è in grado di trasformare quel substrato in molecole con elevato stato di ossidazione (per esempio, in
prodotti di combustione). Al contrario, un catalizzatore
costituito da un ossido parzialmente ridotto possiede una
capacità ossidante discreta, e quindi è potenzialmente
più selettivo nei confronti dei prodotti di ossidazione
parziale. Secondo il modello redox, lo stato di ossidazione di un ossido metallico in condizioni stazionarie è
funzione delle condizioni di reazione; ciò implica che
la selettività è a sua volta funzione di parametri operativi, quali la composizione dell’alimentazione (cioè il
625
PRODUZIONE DI INTERMEDI PER LA PETROLCHIMICA
rapporto tra il substrato da ossidare e l’agente ossidante) o la temperatura di reazione.
Entrambi i modelli hanno avuto riscontri sperimentali per diverse reazioni di ossidazione, e rimangono ancora oggi validi per spiegare le selettività dei processi di
ossidazione in cui sono coinvolte reazioni con meccanismo di tipo redox.
Principali processi industriali e casi rilevanti
Deidrogenazione ossidativa del metanolo
a formaldeide
Tra i primi venti composti chimici prodotti su scala
mondiale, la formaldeide (HCHO) è utilizzata nella sintesi di varie resine (urea-formaldeide, fenolo-formaldeide, poliacetali) che trovano applicazione nei settori
delle costruzioni, automobilistico, dell’industria tessile
e della carta. Il metanolo può essere convertito in formaldeide sia per deidrogenazione ossidativa diretta:
CH3OH0,5O2 HCHOH2O
∆H°=155 kJ/mol
sia per deidrogenazione accoppiata a ossidazione dell’H2 prodotto:
CH3OH HCHOH2
H20,5O2 H2O
∆H°= 84 kJ/mol
∆H°=238 kJ/mol
I due processi differiscono per condizioni operative
e tipo di catalizzatori. Nel primo processo si utilizzano
basse concentrazioni di metanolo in alimentazione, per
evitare la formazione di miscele esplosive e per controllare la temperatura di reazione. I catalizzatori commerciali
sono a base di molibdato di ferro, ma contengono anche
un eccesso di molibdeno (Fe2(MoO4)3MoO3), in quanto la presenza di ossido di molibdeno è condizione necessaria per un’elevata selettività. Si utilizza tipicamente un
rapporto Mo/Fe compreso nell’intervallo 1,5-3,0; talvolta, vengono addizionati ossidi di Co e Cr come promotori. L’eccesso di molibdeno è necessario anche perché la sublimazione dell’ossido (soprattutto nei punti di
maggiore surriscaldamento) causa il progressivo impoverimento di Mo nel catalizzatore e la condensazione di
MoO3 nella parte più fredda del reattore. Ciò provoca
non solo la disattivazione del catalizzatore, ma anche un
progressivo aumento della perdita di carico.
Le temperature di reazione sono tipicamente comprese nell’intervallo 310-340 °C, con conversioni superiori al 98% e selettività pari a 92-95%. Si utilizzano
generalmente reattori multitubolari a letto fisso. Un recente sviluppo è rappresentato dall’introduzione di uno stadio finale (postreattore) adiabatico.
Nella deidrogenazione accoppiata a combustione parziale dell’H2 (il processo globale risulta parzialmente esotermico) si alimenta una corrente sottostechiometrica in
626
ossigeno, per operare nella regione superiore ai limiti di
infiammabilità. A causa dei limiti termodinamici della
deidrogenazione, occorre operare a temperature di reazione superiori rispetto a quelle della deidrogenazione
ossidativa. Si utilizzano catalizzatori a base di Ag supportato su allumina con bassa area superficiale, tipicamente nella forma di sfere con diametro di 1-5 mm. Se si
opera a temperature superiori a 600 °C (in particolare 680720 °C), si può ottenere una conversione quasi completa
del metanolo, mentre a temperature inferiori (500-550 °C)
le conversioni sono minori (65-75%) e occorre effettuare
il riciclo del metanolo che non ha reagito. Inoltre, è necessario utilizzare tempi di contatto brevi per evitare la decomposizione della formaldeide.
Si ottengono selettività a formaldeide pari al 98-99%,
con formazione dei seguenti sottoprodotti: dimetiletere
((CH3)2O), la cui formazione è dovuta alla presenza di
siti acidi nel catalizzatore; metilformiato (HCOOCH3),
ottenuto per disproporzionamento della formaldeide su
siti basici; ossidi di carbonio, derivanti da reazioni sia
parallele sia consecutive. Per limitare queste ultime è
necessario un rapido raffreddamento dei prodotti di reazione all’uscita dal letto catalitico. Selettività elevate si
conseguono tramite l’ottimizzazione delle proprietà acidobase del catalizzatore, la limitazione dell’ossidazione
della formaldeide ad acido formico (prodotto che decompone facilmente) e il controllo delle proprietà redox del
catalizzatore.
La fig. 5 illustra il meccanismo di reazione nel caso
dell’ossidazione diretta del metanolo su catalizzatori a
base di ossidi. La specie metossi è la prima specie chemiadsorbita che si forma per contatto del metanolo con
il catalizzatore; la sua successiva trasformazione dipende sia dalle condizioni di reazione sia dalle proprietà del
catalizzatore. Se la concentrazione del metanolo è alta e
la velocità di ossidazione consecutiva della specie metossi è bassa, avviene la reazione di condensazione che porta
a dimetiletere (tipica degli ossidi acidi contenenti cationi non riducibili, quale allumina). L’ossidazione della
specie metossi (estrazione di un atomo di H e trasferimento di un elettrone) porta a formaldeide coordinata,
che è in equilibrio con la specie diossimetilene. La reazione richiede un attacco nucleofilo da parte dell’ossigeno strutturale del catalizzatore. Se il legame MeO
ha un carattere covalente, l’equilibrio tra il diossimetilene e la formaldeide coordinata è spostato verso quest’ultima specie, a sua volta in equilibrio con la formaldeide in fase gas. Su ossidi ionici invece la formazione
della specie diossimetilene è favorita. Quest’ultima dà
luogo alle specie metossi e formiato per disproporzionamento di Cannizzaro; il formiato si può formare anche
per deidrogenazione ossidativa diretta del diossimetilene. Per reazione con metanolo, il diossimetilene forma
il dimetossimetano, che può desorbire in fase gas. La
specie formiato può anche reagire con il metanolo per
ENCICLOPEDIA DEGLI IDROCARBURI
PROCESSI DI OSSIDAZIONE
CH3OCH3⫹H2O
CH3OH
CH2
O
OH
⫺[H]
⫹CH3OH
H
CH2
O⫺
metossi
O
CH2O
formaldeide
OH
⫺[H]
dimetossimetano OCH3
CH2
OCH3
CH2
2CH3OH
O
O OH
diossimetilene
formiato di metile
O
acido formico
HCOOH
H COCH3
⫺H2O
disproporzionamento
⫹H2O
CH
COx
O
CH3OH
O
formiato
vacanza di ossigeno
fig. 5. Meccanismo di reazione nell’ossidazione del metanolo su catalizzatori a base di ossidi (Centi et al., 2002).
dare metilformiato; la formazione di questo prodotto
richiede che la velocità di desorbimento della formaldeide sia bassa e che la velocità di ossidazione/disproporzionamento sia relativamente elevata. Entrambi questi percorsi di reazione contribuiscono alla formazione
della specie formiato. Le velocità relative dipendono dal
grado di ricoprimento superficiale della specie diossimetilene e dalle condizioni di reazione. Tuttavia, la specie formiato può anche essere convertita e quindi la formazione selettiva del metilformiato richiede che la velocità di conversione della specie formiato sia bassa e la
concentrazione di metanolo sia relativamente elevata.
Lo schema semplificato dei processi commerciali di
conversione del metanolo a formaldeide che utilizzano
come catalizzatori ferro molibdato e Ag supportato è
riportato nella fig. 6.
La deidrogenazione ossidativa del metanolo su catalizzatori a base di ferro molibdato è effettuata in un reattore multitubolare raffreddato (v. ancora fig. 6 A). A causa
della progressiva disattivazione del catalizzatore (il tempo
di vita è pari a 1-2 anni), occorre aumentare a mano a
mano la temperatura del reattore per mantenere costante la produttività. La resa in formaldeide è pari al 9596%. I processi più vecchi operano alimentando il 6%
di metanolo in aria (concentrazione minore del limite
inferiore di infiammabilità), ma in questo caso le produttività sono basse, la purezza della formaldeide è scarsa a causa della formazione di acido formico, il tempo
di vita del catalizzatore è limitato e occorre operare con
grandi volumi di gas inerte. Per questa ragione, circa la
metà degli impianti è stata convertita ad alimentazione
con difetto di ossigeno (10%), e concentrazioni di metanolo più elevate (8,2%). A causa dell’elevata quantità di
calore generato, occorre diluire il catalizzatore e rendere
VOLUME II / RAFFINAZIONE E PETROLCHIMICA
più efficiente il sistema di raffreddamento del reattore.
In alcuni impianti si utilizza anche vapor d’acqua come
diluente.
I gas in uscita dal reattore, dopo il recupero del calore, sono inviati a una colonna di absorbimento, ove si
utilizza acqua come solvente. La soluzione di formaldeide, dal fondo della colonna di absorbimento, ha una
concentrazione del 50-60%; viene poi inviata a una colonna di scambio ionico per rimuovere l’acido formico. I
gas dalla testa della colonna vengono invece riciclati; la
corrente di spurgo mantiene costante la composizione
nel reattore.
Il processo che utilizza Ag supportato come catalizzatore (v. ancora fig. 6 B) ha il vantaggio, rispetto a quello di ossidazione diretta, di produrre una corrente di spurgo che può essere direttamente inviata all’incenerimento, in quanto contiene H2, metanolo e formaldeide, più
piccole quantità di N2 e CO2. La combustione di questa
corrente produce la maggior parte del vapore utilizzato
nel processo. Lo schema del processo è analogo a quello discusso in precedenza, ma è richiesta un’alimentazione più pura di metanolo (devono essere assenti carbonili di ferro e composti di zolfo che avvelenerebbero
il catalizzatore), è necessario uno scambiatore di calore
per scaldare il metanolo, il reattore deve operare con
tempi di contatto molto bassi e avere un sistema di raffreddamento rapido (tempi di raffreddamento del flusso
in uscita al letto catalitico inferiori a 0,02 s), al fine di
evitare reazioni consecutive sulla formaldeide, e infine
occorre utilizzare due colonne di assorbimento in serie.
Epossidazione dell’etilene a ossido di etilene
L’ossido di etilene è un prodotto intermedio sintetizzato su larga scala, essendo utilizzato nella produzione
627
PRODUZIONE DI INTERMEDI PER LA PETROLCHIMICA
riciclo
spurgo
H2 O
acqua di
raffreddamento
aria
metanolo
soluzione di
formaldeide
AA
riciclo
spurgo
catalizzatore
vapore
H2O
metanolo
aria
H2 O
rifiuti
BB
soluzione di
formaldeide
fig. 6. Schema semplificato del processo di sintesi della
formaldeide da metanolo: A, deidrogenazione ossidativa
diretta con catalizzatori a base di ferro molibdato;
B, processo utilizzante catalizzatori a base di Ag supportato
(Arpentinier et al., 2001).
del glicole etilenico e di poliglicoli, di etanolammine e
detergenti non ionici, e di esteri del glicole etilenico. Esistono due tecnologie: il processo via cloridrina, oggi non
più utilizzato, e l’ossidazione diretta dell’etilene con ossigeno su catalizzatori a base di Ag supportato
CH2CH20,5O2 H2CCH2
O
∆H°105 kJ/mol
Come promotori si utilizzano CsCl e BaCl2 (la concentrazione di questi droganti è di 0-10 ppm), in quanto sia i metalli alcalini sia gli ioni cloruro promuovono
la selettività.
Oltre a CO2, i sottoprodotti sono acetaldeide e formaldeide, ma in concentrazioni non superiori allo 0,1%.
Sebbene ancora vi siano opinioni contrastanti, numerosi
628
dati indicano che la specie attiva del catalizzatore è costituita da AgO, con caratteristiche elettrofile, mentre
atomi di ossigeno a ponte tra due atomi di argento
(AgOAg) hanno un carattere nucleofilo e non sono selettivi, al contrario di quanto avviene nel caso dell’ossidazione selettiva su ossidi (v. ancora fig. 3 B). Nel passato si riteneva che le specie selettive nell’epossidazione
fossero costituite da AgO2, che dopo inserzione dell’ossigeno sull’etilene lasciava sulla superficie O atomico
adsorbito e AgO, a sua volta responsabile dell’ossidazione non selettiva di etilene a CO2 e H2O. Sulla base di
questo modello, era stata ipotizzata una selettività massima pari a 85,7%, mentre i processi commerciali attuali operano con selettività (a bassa conversione) superiori, comprese nell’intervallo 88-94%.
Lo schema di reazione è di tipo ‘triangolare’, con due
reazioni parallele di trasformazione dell’etilene in ossido di etilene e in CO2, e una reazione consecutiva dell’ossido di etilene in CO2. Vengono qui riassunti i principali fattori che influenzano la cinetica di reazione e
quindi la scelta delle condizioni ottimali di reazione. La
velocità di formazione dell’ossido di etilene aumenta
con l’aumento della pressione parziale dell’ossigeno,
mentre si osserva un massimo rispetto alla concentrazione di etilene, a causa della competizione tra etilene e
ossido di etilene sugli stessi siti catalitici. La velocità di
formazione dell’ossido di etilene diminuisce aumentando la concentrazione di ioni cloruro utilizzati come drogante (oltre un certo valore, tuttavia, si formano come
sottoprodotti tracce di composti clorurati, quali vinilcloruro e dicloroetilene) e la concentrazione di CO2. Dal
punto di vista pratico, la concentrazione di etilene è determinata essenzialmente dai limiti di infiammabilità. Il
rapporto tra le velocità delle due reazioni parallele di formazione di ossido di etilene e di combustione, ovvero la
selettività iniziale, aumenta con la concentrazione di ioni
cloruro, con il contenuto dei promotori metalli alcalini
e con la pressione parziale di etilene.
I processi di ossidazione dell’etilene operano con aria
oppure con ossigeno puro. I primi sono ancora ampiamente diffusi, ma i nuovi impianti utilizzano principalmente ossigeno puro, che presenta vantaggi in termini
di rese e produttività più elevate, di maggiore selettività
(dovuta alla maggiore pressione parziale di etilene nel
reattore), di minore quantità di gas di spurgo, di possibilità di scegliere il tipo di gas diluente e di minori costi
del reattore e delle apparecchiature. D’altra parte, il processo con ossigeno puro presenta maggiori costi dovuti
al suo utilizzo e alla necessità di separare il CO2 prodotto. Lo schema semplificato dei due processi è illustrato in fig. 7. Nel processo con aria l’etilene è ossidato in una serie di reattori tubolari (due o tre, negli impianti più grandi), in modo da aumentare la conversione e
gestire più efficacemente il calore di reazione (nel primo
reattore la conversione è intorno al 40%). L’uscita dal
ENCICLOPEDIA DEGLI IDROCARBURI
PROCESSI DI OSSIDAZIONE
fig. 7. Schema
semplificato del processo
di sintesi dell’ossido
di etilene da etilene:
A, processo con aria;
B, processo con ossigeno
puro (Arpentinier
et al., 2001).
riciclo
ossido di
etilene
spurgo
leggeri
etilene
pesanti
aria
aria
vapore
A
riciclo
spurgo CO2
spurgo
inerte
vapore
ossido di
etilene
leggeri
etilene
O2
B
reattore viene raffreddata e quindi inviata a una colonna
di absorbimento con acqua, per il recupero dell’ossido
di etilene. Una parte dell’uscita gassosa dalla colonna di
absorbimento viene riciclata, mentre un’altra parte viene
inviata a un secondo reattore ove la conversione arriva
VOLUME II / RAFFINAZIONE E PETROLCHIMICA
vapore
pesanti
all’80% (95% nel caso di tre reattori in serie). La selettività è pari a circa il 70% nel primo reattore, ma si abbassa in quelli successivi.
Il processo con ossigeno puro (purezza 97%) è a
stadio singolo e utilizza reattori multitubolari. Il rapporto
629
PRODUZIONE DI INTERMEDI PER LA PETROLCHIMICA
etilene/O2 è tipicamente 3,0-3,5, mentre la concentrazione di O2 viene mantenuta inferiore al 9% per evitare
la formazione di miscele infiammabili. La conversione
per passaggio dell’etilene è compresa nell’intervallo 1015%, mentre quella globale è superiore al 97%. La selettività è tipicamente maggiore dell’80%. Dopo il raffreddamento, i gas in uscita dal reattore sono inviati alla
colonna di absorbimento dell’ossido di etilene, mentre i
gas in uscita dalla colonna sono compressi e riciclati.
Una parte dei gas è inviata a una colonna per eliminare
CO2 tramite absorbimento a caldo in soluzione acquosa
di carbonato di potassio. Una piccola frazione dei gas
(meno dell’1%) è inviata allo spurgo, per evitare l’accumulo di gas inerti. In alcuni processi si utilizza anche
un diluente, quale metano o etano. Sebbene il CO2 stesso possa essere un diluente efficace, esso ha un effetto
di avvelenamento sul catalizzatore e quindi è necessario
mantenere bassa la sua concentrazione.
Ossiclorurazione dell’etilene
La reazione di ossiclorurazione (ossidazione in presenza di HCl) dell’etilene a 1,2-dicloroetano (DCE)
CH2CH22HCl0,5O2 CH2ClCH2Cl
∆H°=238 kJ/mol
è la base per la produzione del cloruro di vinile monomero (CH2CHCl), utilizzato nella produzione di omoe copolimeri in PVC.
Sono possibili tre differenti opzioni di processo, a
seconda della tecnologia utilizzata e delle condizioni
operative: i reattori possono essere a letto fisso o fluidizzato; si può utilizzare aria oppure O2; si può impiegare un valore stechiometrico oppure un eccesso di etilene. In generale, si utilizza ossigeno puro quando si
opera in un reattore a letto fisso, con largo eccesso di
etilene (rispetto al valore stechiometrico) e l’etilene non
convertito viene riciclato, oppure quando si utilizzano
rapporti stechiometrici, con conseguimento di elevate
conversioni di etilene, ma si ricicla comunque la corrente gassosa al fine di ridurre l’impatto ambientale del
processo (v. ancora tab. 3).
L’utilizzazione di un eccesso di etilene, che possiede migliori caratteristiche di conducibilità termica rispetto all’azoto, permette di conseguire vantaggi quali un
profilo di temperatura più uniforme nel reattore (con
conseguenti migliori selettività dovute alla minore combustione e alla minore formazione di prodotti secondari quali tricloroetano), una migliore conversione di HCl
e una vita più lunga del catalizzatore (grazie a una minore sublimazione della fase attiva e a una ridotta formazione di carbone sulla superficie del catalizzatore). Poiché nei reattori a letto fisso la produttività è limitata dalla
capacità di trasferimento del calore al fluido di raffreddamento, una fase gassosa con migliore conducibilità
permette di aumentare la produttività.
630
Il principale problema connesso all’uso di O2 è rappresentato dal suo maggior costo rispetto all’aria e alla
necessità di sistemi più complessi per operare in condizioni di sicurezza. Tuttavia, molti impianti ad aria sono
stati opportunamente modificati per operare con ossigeno. Il tipo di reattore più utilizzato è quello multitubolare a letto fisso, in virtù delle maggiori produttività
conseguibili; tuttavia, gli elevati investimenti necessari
(occorre utilizzare acciaio resistente alla corrosione) portano a preferire la tecnologia a letto fluidizzato per la
costruzione di nuovi impianti.
Nella fig. 8 è riportato uno schema semplificato del
processo a letto fisso, alimentato ad aria. Si utilizzano
tre reattori multitubolari in serie; il catalizzatore viene
diluito con grafite, per ridurre i gradienti termici nel reattore; un quarto reattore è utilizzato per clorurare direttamente l’etilene residuo con Cl2. I gas vengono raffreddati per condensare il DCE (1,2-dicloroetano), che
poi è inviato alle colonne di purificazione: la prima rimuove l’acqua, la seconda i prodotti leggeri (cloruro di etilene, vinilcloruro, 1,1-dicloroetano e dicloroetilene) e la
terza i prodotti pesanti (tricloroetano, percloroetano, percloroetilene).
Per ottimizzare il rapporto locale etilene/O2 e ottenere un miglior controllo della temperatura nei reattori e quindi della selettività, si alimentano etilene e
HCl nel primo reattore, mentre l’alimentazione di aria
o di ossigeno viene distribuita nei tre reattori in serie.
Ciò permette anche di operare fuori dai limiti di infiammabilità, di ridurre la formazione di CO2, di avere un
profilo di temperatura più omogeneo e infine di aumentare il tempo di vita del catalizzatore. L’ossigeno e
l’etilene sono alimentati in leggero eccesso rispetto
alla quantità stechiometrica, per ottenere una conversione di HCl maggiore del 99,5%. Nei processi che
operano con ossigeno e con largo eccesso di etilene,
invece, l’idrocarburo non convertito viene separato e
riciclato.
I catalizzatori sono a base di cloruro di rame supportato su allumina; ruolo fondamentale hanno i componenti promotori, costituiti da metalli alcalini o alcalino-terrosi. Le temperature di reazione sono comprese tra
220 e 250 °C, con pressioni fino a 5 bar. La selettività a
DCE è compresa tra 93 e 97%.
Acetossilazione dell’etilene
L’acetossilazione (ossidazione in presenza di acido
acetico) in fase vapore dell’etilene con acido acetico e
O2 è il principale processo per produrre il vinilacetato
(CH3C(O)OCHCH2). Si utilizza Pd supportato su silice, promosso con oro e con metalli alcalini (acetato di
potassio); l’oro permette di ridurre la reazione secondaria di formazione di etilacetato. Si opera con O2 puro alla
temperatura di circa 150 °C, con pressioni comprese nell’intervallo 8-10 bar; in queste condizioni la reazione
ENCICLOPEDIA DEGLI IDROCARBURI
PROCESSI DI OSSIDAZIONE
Cl2
NaOH
H2O
etilene
HCl
aria
1,2-dicloroetano
leggeri
acqua
(al trattamento)
spurgo
pesanti
fig. 8. Schema semplificato del processo di ossiclorurazione dell’etilene in reattore a letto fisso
(processo basato sull’aria) (Arpentinier et al., 2001).
avviene in un film liquido, formatosi per condensazione capillare nei pori del catalizzatore.
Il meccanismo di reazione coinvolge la riduzione del
Pd acetato a Pd metallico per reazione con l’etilene e la
riossidazione del Pd0 da parte dell’ossigeno. Le selettività possono raggiungere il 98%, sebbene nei processi
industriali siano tipicamente comprese tra 92 e 95%. La
conversione per passaggio è intorno al 10%.
Dopo un preriscaldamento, l’etilene fresco, mescolato con quello di riciclo e con l’acido acetico, è inviato al reattore contenente il catalizzatore, previo mescolamento con O2. La composizione tipica è la seguente: 40-55% etilene, 10-20% acido acetico e 7-8% O2,
oltre a inerti (CO2, etano, Ar, N2 e H2O). Dopo la reazione, i gas vengono raffreddati, con condensazione
dell’acido acetico, dell’acqua e della maggior parte
dell’acetato di vinile. La corrente liquida viene frazionata mediante distillazione azeotropica per recuperare l’acido acetico e il vinilacetato. Sono tuttavia
necessarie ulteriori colonne di purificazione per raggiungere la purezza richiesta per il vinilacetato, in particolare per abbassare la concentrazione di etilacetato
sotto 150 ppm.
La fase vapore dalla prima colonna di condensazione è inviata a una colonna di absorbimento ove viene
VOLUME II / RAFFINAZIONE E PETROLCHIMICA
alimentato acido acetico, per rimuovere l’acetato di vinile, e poi a una seconda colonna alimentata con una soluzione di NaOH, per rimuovere il CO2. I gas vengono poi
riciclati al reattore principale.
Ossidazione del propilene ad acroleina e ossidazione
dell’acroleina ad acido acrilico
L’ossidazione del propilene ad acido acrilico (utilizzato nella produzione di esteri acrilici) avviene tramite
la formazione intermedia di acroleina:
C3H6O2 CH2CHCHOH2O
∆H° =339 kJ/mol
CH2CHCHO0,5O2 CH2
CHCOOHH2O ∆H° =255 kJ/mol
Sottoprodotti della reazione sono ossidi di carbonio,
acido acetico, acido propionico, formaldeide, acido maleico, acetaldeide e acetone. Per la prima reazione si utilizzano catalizzatori multicomponenti a base di molibdati di bismuto (per esempio Mo12BiFe3Co4,5Ni2,5Sn0,5
K0,1Ox), mentre per la seconda reazione i catalizzatori sono a base di ossidi di molibdeno e vanadio (per
esempio Mo12V3Cu2,5Fe1,25Mn0,1Mg0,1P0,1Ox). È possibile la sintesi in un unico stadio ma, a causa della
631
PRODUZIONE DI INTERMEDI PER LA PETROLCHIMICA
forte esotermicità della reazione, il tempo di vita dei
catalizzatori è ridotto. Inoltre, la selettività globale è maggiore nel processo a due stadi, essendo possibile ottimizzarli indipendentemente. Nel primo stadio la selettività ad acroleina è tipicamente maggiore dell’85% e la
conversione del propilene è superiore al 90%, mentre nel
secondo stadio la selettività ad acido acrilico è maggiore del 95%, con rese comprese tra 90 e 96%.
Sono utilizzati reattori a letto fisso multitubolari, in
serie. Il primo reattore opera con temperature nell’intervallo 330-400 °C, e velocità spaziali pari a 1.3002.600 h1 (la pressione è 2-2,5 bar), mentre il secondo
opera a temperature inferiori (250-300 °C), velocità spaziali più elevate (1.800-3.600 h1) e pressioni inferiori
(dovute principalmente alle perdite di carico del primo
reattore).
La concentrazione di propilene in entrata al primo
reattore è pari al 5-8% in aria. Come diluenti si utilizzano gas di ricircolo e/o vapor d’acqua, in modo da operare al di fuori dei limiti di esplosività. L’utilizzo del
vapor d’acqua permette anche di diminuire le reazioni
in fase omogenea, migliorare il trasferimento termico e
aumentare la selettività, favorendo il desorbimento dell’acroleina e dell’acido acrilico. Tuttavia, concentrazioni eccessive di vapor d’acqua abbassano la concentrazione della soluzione di acido acrilico.
I gas in uscita dal reattore, dopo il raffreddamento e
il recupero del calore, sono inviati a una colonna di absorbimento con acqua. Si addiziona un inibitore per evitare la polimerizzazione dell’acido acrilico. I gas in uscita sono poi inviati all’incenerimento e in parte riciclati,
dopo l’eliminazione dei composti condensabili. La soluzione di acido acrilico è inviata alla sezione di purificazione, costituita da una serie di colonne di distillazione
azeotropica (con metiletilchetone come terzo componente). Nel caso di soluzioni diluite si può, in alternativa, utilizzare una separazione per estrazione, usando
come solvente acetato di etile o composti aromatici. I
vari processi industriali differiscono nella composizione del catalizzatore e nella sezione di separazione.
Sintesi del metilmetacrilato
L’estere metilico dell’acido metacrilico, avente formula CH2C(CH3) COOCH3, è utilizzato nella produzione di polimeri vinilici. Il processo acetoncianidrina (che
consiste nella reazione tra acetone e HCN, seguita dalla
reazione di acetoncianidrina con acido solforico e dalla
idrolisi finale dell’addotto in presenza di metanolo) è
quello maggiormente utilizzato per la sintesi di metilmetacrilato e presenta molti inconvenienti, legati alla tossicità dell’HCN e alla coformazione di elevate quantità
di solfato di ammonio, che si genera in rapporto 2:1
rispetto al metilmetacrilato. Il processo alternativo è
l’ossidazione diretta in fase vapore dell’isobutene (con
stadio successivo o integrato di esterificazione); questo
632
processo tuttavia presenta rese e selettività troppo basse
per risultare competitivo.
Metodi di sintesi alternativi sono: a) l’ossidazione
diretta di isobutano (processo ancora in fase di studio),
che ha il vantaggio del minor costo della materia prima
e del minor impatto ambientale; b) l’ossidazione dell’aldeide isobutirrica ad acido isobutirrico, poi convertito in acido metacrilico per deidrogenazione ossidativa
(processo Mitsubishi Kasei/Asahi); c) l’ossidazione dell’alcol terbutilico a metacroleina, seguita dall’ossidazione ad acido metacrilico e dalla esterificazione; d) l’idroformilazione dell’etilene ad aldeide propionica, che
viene fatta poi condensare con formaldeide per dare metacroleina, la quale viene infine ossidata ad acido metacrilico ed esterificata (processo BASF). Tra queste alternative, la sintesi diretta da isobutano è la più interessante;
tuttavia, la selettività ottenuta e la stabilità dei catalizzatori non sono ancora sufficienti per consentirne lo sviluppo industriale.
La composizione media dei catalizzatori per quest’ultima applicazione è la seguente: (H mY 0,2-1,5)
(P1-1,2Mo12-nX0,4-1,5Ox), dove Y è lo ione di un metallo
alcalino e X un elemento quale V, As e Cu; sono inoltre presenti vari altri additivi. Occorre utilizzare elevate concentrazioni di isobutano e di vapor d’acqua (fino
al 65%) per ottenere buona selettività e stabilità dei
catalizzatori.
Sintesi dell’acrilonitrile per ammonossidazione
del propilene
L’acrilonitrile è prodotto su larga scala (oltre 5 milioni di t/a) mediante il processo di ammonossidazione (ossidazione in presenza di ammoniaca) catalitica del propilene in fase vapore:
CH2CHCH3NH31,5O2
CH2CHCN + 3H2O ∆H°=515 kJ/mol
L’acrilonitrile trova applicazione nella sintesi di vari
omo- e copolimeri utilizzati come fibre, resine ed elastomeri; è inoltre intermedio nella produzione di adiponitrile e acrilamide.
Sottoprodotti della reazione sono HCN, acetonitrile,
N2 (dalla combustione dell’ammoniaca) e ossidi di carbonio. La reazione è fortemente esotermica e per controllare la temperatura la maggior parte degli impianti
utilizza reattori a letto fluido. I catalizzatori commerciali
sono multicomponente, a base di molibdato di bismuto
e supportati su silice (per esempio, (K, Cs)0,1(Ni, Mg,
Mn)7,5(Fe, Cr)2,3Bi0,5Mo12Ox/SiO2).
Non è necessario riciclare il propilene, in quanto si
raggiungono conversioni superiori al 95%, pur mantenendo elevata selettività ad acrilonitrile (superiore
all’80%). Il reattore a letto fluido contiene quantità elevate di catalizzatore, fino a 70-80 t, in forma di particelle sferiche con diametro medio pari a 40-50 mm, al
ENCICLOPEDIA DEGLI IDROCARBURI
PROCESSI DI OSSIDAZIONE
fine di consentirne un’efficiente fluidizzazione. La purezza dell’alimentazione deve essere molto elevata (90%
per il propilene e 99,5% per NH3). Il rapporto di alimentazione ammoniaca/propilene è pari a 1,05-1,2 e il
rapporto O2/propilene è compreso nell’intervallo 10-15.
La temperatura di reazione è compresa tra 420 e 450 °C
e la pressione tra 1,5 e 3 bar. Pressioni superiori a 1 bar
sono negative per la selettività ad acrilonitrile, ma necessarie per ottenere una buona fluidizzazione e aumentare la produttività.
I reagenti sono alimentati al reattore indipendentemente, per minimizzare le reazioni in fase omogenea e
prevenire la formazione di miscele esplosive prima del
letto catalitico; la composizione della miscela nel reattore è entro i limiti di infiammabilità, ma la presenza del
letto fluido inibisce la propagazione delle reazioni radicaliche bloccando l’eventuale fronte di fiamma. Il reattore a letto fluido contiene vari serpentini e sistemi per
minimizzare la formazione di slug e ridurre i fenomeni
di retromiscelazione del fluido. La testa del reattore ha
sezione maggiore, per ridurre la velocità del gas e diminuire i fenomeni di trasporto pneumatico ed eluizione
del catalizzatore. Appositi cicloni permettono il recupero delle particelle di catalizzatore e la loro reintroduzione nel reattore.
Gli effluenti dal reattore sono inviati a una colonna di absorbimento con acqua, mentre l’ammoniaca
non convertita è neutralizzata con acido solforico. I
gas in uscita da questa colonna, contenti N2, ossidi di
carbonio e piccole quantità di propilene, vengono inviati all’incenerimento. La miscela acetonitrile/acrilonitrile forma un azeotropo con l’acqua che per smiscelazione dà luogo a una fase acquosa (riciclata all’assorbitore) e a una fase organica, ricca in acrilonitrile
e HCN, che è inviata alla purificazione. La soluzione
acquosa di acetonitrile è concentrata per distillazione
azeotropica. L’acrilonitrile viene purificato in due
colonne in serie, per recuperare l’acido cianidrico e le
impurezze (acetone, acetaldeide, propionaldeide, acroleina). Uno stadio finale di distillazione sotto vuoto
viene utilizzato per ottenere acrilonitrile con purezza
superiore al 99,4%.
Recentemente numerosi studi sono stati dedicati all’utilizzo di propano come reagente alternativo al propilene,
per il suo minore costo. Nuove classi di catalizzatori (per
esempio quelli sviluppati dalla Mitsubishi, costituiti da
ossidi quaternari di molibdeno, vanadio, tellurio e niobio,
MoV0,3Te0,23Nb0,12Ox) danno rese in acrilonitrile superiori al 50%. Questo valore potrebbe essere sufficiente per
giustificare lo sviluppo di un nuovo processo a partire dal
propano, sebbene sia auspicabile un ulteriore aumento
delle rese e della stabilità del catalizzatore.
Ammonossidazione di alchilaromatici
Numerosi nitrili aromatici quali benzonitrile, ftalonitrile, isoftalonitrile, tereftalonitrile e nicotinonitrile
trovano applicazione nella sintesi di prodotti per la chimica fine. Per esempio, il nicotinonitrile può essere idrolizzato alla corrispondente ammina o ad acido nicotinico, utilizzati nella sintesi della vitamina B. L’isoftalonitrile è utilizzato nella sintesi di erbicidi e funghicidi.
Lo ftalonitrile è un intermedio per pigmenti a base di
ftalocianine. Numerosi catalizzatori sono attivi nella
reazione: ossido di vanadio supportato su TiO2 (preferibilmente nella struttura cristallina anatasio), drogato
con Cs, P e W; catalizzatori multicomponente a base di
molibdati; vanadio-antimoniati drogati con Bi e Fe ed
eteropoliacidi supportati (PV3Mo12Ox su silice). Oltre
a massimizzare la selettività al nitrile, è importante anche
minimizzare la reazione di ossidazione dell’ammoniaca a N2. Sono generalmente possibili selettività superiori al 90% per conversioni comprese tra 50 e 80%, sebbene i risultati varino considerevolmente in funzione del
tipo di substrato.
Uno dei principali problemi nell’applicazione industriale del processo è la necessità di operare effettuando
campagne successive con diversi tipi di alchilaromatici,
in quanto la richiesta di mercato per questi prodotti non
è tale da giustificare un utilizzo dell’impianto dedicato
a una sola reazione. Anche le immidi aromatiche possono essere ottenute per ammonossidazione catalitica
(fig. 9), per esempio alimentando o-xilene e utilizzando
un catalizzatore a base di ossido di vanadio supportato
su titania.
fig. 9. Schema della sintesi
della ftalimmide
per ammonossidazione catalitica
in fase vapore dell’o-xilene.
O
ftalimmide
CH3
O2, NH3
CH3 V2Ox /TiO2
CH3 O2, NH3
CN V2Ox /TiO2
toluonitrile
ftalonitrile
VOLUME II / RAFFINAZIONE E PETROLCHIMICA
NH
O
COx
CN
CN
633
PRODUZIONE DI INTERMEDI PER LA PETROLCHIMICA
Anidride maleica da n-butano
L’anidride maleica è utilizzata come additivo nella
sintesi di vari polimeri, nella sintesi di prodotti chimici per l’agricoltura e degli acidi malico e fumarico, oltre
a essere intermedio per la sintesi di g-butirrolattone e
di tetraidrofurano. Oggi la maggior parte degli impianti per la produzione di anidride maleica utilizza n-butano come alimentazione; questo processo ha soppiantato quello da benzene, in virtù del minor numero di sottoprodotti, della migliore efficienza atomica e del minor
costo, e della non tossicità del reagente. Sottoprodotti
ottenuti nell’ossidazione di n-butano sono ossidi di carbonio e acido acetico, mentre numerosi sottoprodotti
si formano da benzene, o utilizzando buteni o butadiene come materia prima.
I vari processi commerciali differiscono nella tecnologia reattoristica (reattore a letto fisso, oppure a letto
fluido o circolante), nella percentuale di n-butano nell’alimentazione (meno del 2% nei processi con reattore
a letto fisso, compresa tra 2,6 e 5% per i processi con
reattore a letto fluido e più del 10% nel processo DuPont,
con reattore a letto circolante, analogo a quello utilizzato nel cracking catalitico) e nella metodologia di recupero e purificazione dell’anidride maleica (utilizzo di
solventi organici o acquosi nel recupero, modalità di purificazione). In tutti i processi il catalizzatore è costituito
da pirofosfato di vanadile (VO)2P2O7, eventualmente
promosso con elementi droganti, sebbene possano variare le modalità di preparazione, di attivazione e di formazione e le dimensioni delle particelle.
La composizione in alimentazione è connessa direttamente alla scelta del reattore, come evidenziato sopra.
Un aumento della concentrazione di n-butano aumenta
la produttività, ma richiede speciali precauzioni per lo
smaltimento del calore di reazione e per la riduzione dei
rischi di esplosività; n-butano non convertito generalmente non viene riciclato, ma utilizzato nella produzione di vapore ad alta temperatura, essendo il valore di
questo idrocarburo prossimo a quello dei combustibili.
La conversione di n-butano è compresa tra 80 e 90%
e la resa in anidride maleica tra 55 e 65%. Si opera a temperature pari a 400-450 °C. I principali processi sono
commercializzati da Denka/Scientific Design, Amoco,
BP-UCB, Lonza/Lummus, Mitsubishi Kasei, Mitsui
Toatsu, Monsanto e DuPont.
Il processo ALMA della Lonza utilizza un reattore a
letto fluido, mentre il processo DuPont un reattore a letto
circolante. La fig. 10 riporta lo schema semplificato dei
due processi.
Nel processo ALMA, dopo la separazione del catalizzatore mediante due cicloni in serie, gli effluenti dal
reattore vengono raffreddati a 200 °C, filtrati per rimuovere le particelle più fini e inviati alla sezione di recupero dell’anidride maleica; quest’ultima è basata sull’absorbimento in solventi cicloalifatici. I gas sono inviati
634
all’incenerimento per la produzione di vapore ad alta
temperatura, mentre la soluzione è inviata a un’unità di
stripping. L’anidride maleica è poi ulteriormente purificata per rimuovere i prodotti leggeri (inviati all’incenerimento), mentre il solvente viene riciclato.
Il processo permette elevate produttività, produzione di vapore ad alta temperatura, ridotta quantità di rifiuti, basse formazioni di acido fumarico e di prodotti pesanti. La produzione di vapore contribuisce all’economicità
del processo.
Il processo DuPont è caratterizzato dall’utilizzo di
un reattore innovativo per il settore dell’ossidazione selettiva, di derivazione dal cracking catalitico, che permette il contatto separato di idrocarburo e ossigeno con il
catalizzatore. Ciò porta a un aumento significativo della
selettività, ma implica la necessità di un’elevata ricircolazione del catalizzatore tra i due reattori (il reattore riser
per il contatto con l’idrocarburo e il reattore a letto fluido per la riossidazione del catalizzatore). Inoltre è necessaria un’elevata resistenza meccanica del catalizzatore.
Il processo DuPont di sintesi dell’anidride maleica è integrato con la sezione di idrogenazione a valle, per la produzione di tetraidrofurano. L’absorbimento dell’anidride maleica viene in questo caso effettuato con acqua.
Anidride ftalica da o-xilene
L’anidride ftalica è utilizzata nella preparazione di
diesteri (plasticizzanti per PVC), resine alchiliche, poliesteri e coloranti. Il processo originale utilizzava naftalene come materia prima, ma oggi la maggior parte degli
impianti utilizza o-xilene, in virtù dei minori problemi
ambientali e di sicurezza, oltre che per la maggiore purezza del prodotto.
I principali sottoprodotti da o-xilene sono o-tolualdeide e ftalide, piccole quantità di anidride maleica, acido
benzoico, acido toluico, oltre a ossidi di carbonio. La
formazione di ftalide è un aspetto critico del processo,
in quanto la concentrazione di questo composto nell’anidride ftalica, per applicazioni nel settore dei polimeri,
deve essere molto bassa. In un reattore multitubolare,
circa un terzo del letto catalitico permette di raggiungere oltre il 90% di conversione dell’o-xilene, mentre i
rimanenti due terzi del letto servono a ridurre la concentrazione di ftalide.
I catalizzatori sono a base di ossido di vanadio supportato su TiO2 (nella forma cristallina ottaedrica), con
area superficiale relativamente bassa (intorno a 10-20
m2/g). Come promotori si utilizzano K, Cs, Sb, Nb e P.
Le ultime generazioni di reattori caricano due o tre strati di catalizzatore con composizione tra loro diversa
(soprattutto per il tipo e la quantità di elementi promotori); in questo modo è possibile ottenere la massima resa e selettività, ottimizzando il profilo di attività
e minimizzando i ‘punti caldi’ lungo il reattore. Effetto positivo sulle prestazioni hanno anche i promotori
ENCICLOPEDIA DEGLI IDROCARBURI
PROCESSI DI OSSIDAZIONE
spurgo
filtro
a secco
reattore
anidride
maleica
solvente
fresco
vapore
n-butano
sottoprodotti
aria
AA
vapore
H2
aria
BB
reattore di
rigenerazione
a letto fluido
n-butano
tetraidrofurano
riciclo H2
spurgo
soluzione
acquosa
di acido
maleico
riciclo
n-butano
spurgo
fig. 10. Schema semplificato del processo di sintesi di
anidride maleica da n-butano: A, processo
ALMA; B, processo DuPont.
in fase gassosa, come SO2, che oggi però non vengono
più utilizzati.
Esistono vari processi, tra cui i principali sono quelli sviluppati da Wacker, BASF, Lonza-Alusuisse, Atochem e Nippon Shokubai. I processi differiscono nel tipo
di reattore (a letto fisso o fluido, sebbene il primo tipo
sia utilizzato nella maggior parte dei casi), nella composizione del catalizzatore e nella sezione di recupero/purificazione. Si utilizza aria come ossidante, sebbene l’utilizzazione di aria arricchita con ossigeno permetta di aumentare la produttività. La concentrazione
VOLUME II / RAFFINAZIONE E PETROLCHIMICA
di o-xilene non è superiore a 1,2% in aria, per evitare la
formazione di miscele infiammabili e per conseguire un
buon controllo del calore di reazione. Il recupero dell’anidride ftalica viene fatto per desublimazione e poi
per absorbimento in olio.
Il reattore a letto fisso opera a temperature comprese nell’intervallo 350-390 °C e con basse velocità spaziali, mentre il processo con reattore a letto fluido opera
a temperature più elevate (450-550 °C) e con tempi di
contatto più bassi. L’o-xilene e l’aria, dopo preriscaldamento, sono inviati a un reattore multitubolare operante a circa 380 °C e raffreddato con sali fusi; questi ultimi sono raffreddati esternamente in uno scambiatore di
calore, con produzione di vapore ad alta temperatura.
Si ottengono una resa in anidride ftalica superiore
all’80% e una conversione di o-xilene maggiore del
99%. Gli effluenti dal reattore sono raffreddati, con produzione di vapore a bassa pressione, e quindi inviati a
una colonna di absorbimento con acqua. La soluzione
è prima inviata a un sistema sotto vuoto per decomporre
le impurità (si addizionano inibitori della polimerizzazione) e poi a una colonna di distillazione (anch’essa
sotto vuoto) per separare l’anidride maleica e gli acidi
benzoico e toluico dalla testa. La soluzione raccolta al
fondo della colonna di distillazione è inviata a una seconda colonna, per separare anidride ftalica a elevata purezza (99,5% in peso).
Bibliografia citata
Arpentinier P. et al. (2001) The technology of catalytic
oxidations, Paris, Technip.
Bielanski A., Haber J. (1991) Oxygen in catalysis, New York,
Marcel Dekker.
Centi G., Perathoner S. (2003a) Catalysis and sustainable
green chemistry, «Catalysis Today», 77, 287-297.
Centi G., Perathoner S. (2003b) Selective oxidation. Section
E (Industrial processes and relevant engineering issues), in:
Horvath I.T. (editor in chief) Encyclopedia of catalysis, New
York, John Wiley, 6v.
Centi G. et al. (2002) Selective oxidation by heterogeneous
catalysis, New York, Kluwer Academic-Plenum.
Grasselli R.K. (2002) Fundamentals principles of selective
heterogeneous oxidation catalysis, «Topics in Catalysis»,
21, 79-88.
Fabrizio Cavani
Dipartimento di Chimica Industriale e dei Materiali
Università degli Studi di Bologna
Bologna, Italia
Gabriele Centi
Dipartimento di Chimica Industriale e
di Ingegneria dei Materiali
Università degli Studi di Messina
Messina, Italia
635
PRODUZIONE DI INTERMEDI PER LA PETROLCHIMICA
11.1.2 Processi di ossidazione
in fase liquida con ossigeno
Ossidazioni in fase liquida
con catalizzatore metallico omogeneo
e ossigeno molecolare
Introduzione
L’ossidazione in fase liquida è ampiamente utilizzata nell’industria chimica per la sintesi di intermedi destinati all’industria petrolchimica e alla produzione di specialità chimiche e farmaceutiche, oltre che per la depurazione delle acque di scarico.
L’ossidazione in fase liquida viene preferita alla catalisi eterogenea in fase gassosa nei seguenti casi: quando
i prodotti sono termicamente instabili (come nella produzione di idroperossidi e di acidi carbossilici, a eccezione dei composti b-insaturi); quando i prodotti sono
così reattivi da potersi ulteriormente ossidare ad alta temperatura (cioè epossidi, aldeidi e chetoni, a eccezione di
composti b-insaturi, ossido di etilene e formaldeide);
nella chimica fine, dove l’ossidazione in fase liquida è
particolarmente indicata, a causa dell’instabilità termica e/o della reattività degli stessi reagenti (come nell’ossidazione di poliidrossialcoli).
Oltre a rappresentare l’esempio più diffuso di catalisi omogenea, l’ossidazione in fase liquida ha un’importanza superiore ai processi eterogenei di ossidazione in fase gassosa sul piano della quantità e della varietà
dei prodotti (Prengle e Barona, 1970a; Lyons, 1980;
Sheldon e Kochi, 1981). Tra i problemi tecnici posti
dalla catalisi omogenea, i principali sono la selettività,
la rimozione del calore di reazione e le condizioni di
sicurezza.
Le ossidazioni in fase liquida possono essere distinte in cinque classi di processi catalitici, sulla base del
meccanismo utilizzato e del relativo catalizzatore: a)
ossidazione a catena via radicali liberi (con o senza
catalizzatore), con ossigeno molecolare come agente
ossidante; b) meccanismo di ossidoriduzione con complessi di palladio o rame, e ossigeno molecolare; c) trasferimento catalitico di ossigeno, con alchilidroperossido o H2O2 come agenti ossidanti e catalizzatori di
tipo omogeneo o eterogeneo; d) deidrogenazione ossidativa con ossigeno molecolare e catalizzatori supportati, a base di metalli di transizione; e) processi fotocatalitici.
La prima classe è la più importante dal punto di vista
industriale e pertanto i suoi aspetti tecnologici più rilevanti saranno dettagliatamente esaminati.
636
L’ossidazione dei substrati organici:
substrato donatore di ossigeno substrato ossidato
donatore ridotto
ha una notevole importanza in campo industriale e svolge un ruolo fondamentale in diversi processi biologici.
Le ossigenazioni di substrati organici (principalmente
alcani e alcheni) per trasferimento di gruppi osso, utilizzate in alcuni processi, sono state oggetto di molte
ricerche. L’elenco dei possibili donatori di ossigeno comprende: ossigeno molecolare, peracidi, alchilidroperossidi, perossido di idrogeno, iodosilareni, N-ossidi, ipoclorito e persolfato di ammonio. Vengono impiegati anche
diversi catalizzatori, quali metalloporfirine, metalloftalocianine, complessi di sali solubili di metalli di transizione con leganti chelanti e basi di Schiff. Tra i sistemi
che hanno suscitato maggiore interesse negli ultimi anni
i più efficaci sembrano essere i poliossometallati.
L’ossidazione di un substrato con ossigeno molecolare può coinvolgere due elettroni (con il coinvolgimento di un solo atomo di ossigeno), o quattro elettroni (con
il coinvolgimento di entrambi gli atomi di ossigeno). La
coordinazione con un metallo modifica le caratteristiche dell’ossigeno (cioè la sua basicità e il suo carattere
radicale), rendendolo più suscettibile a reagire con un
substrato organico. La tab. 1 presenta uno schema sintetico dei possibili complessi tra ossigeno molecolare e
ioni metallici (Sheldon e Kochi, 1981).
Oltre alle specie superosso e perosso saranno discusse
anche le specie metallo-osso, prodotte dal trasferimento di
due elettroni dall’atomo di metallo a quello di ossigeno.
La formazione di specie idroperosso si può verificare per idrolisi dei complessi perosso o per inserzione di
ossigeno molecolare nei metallo idruri:
M H
O
M
O
OH
O
MOOMH MOOHM
MHO2 MOOH
La formazione di specie metallo-osso si verifica se
il metallo è in grado di fornire due elettroni; i metalli di
questo tipo comprendono le coppie redox Mn/M(n2):
ENCICLOPEDIA DEGLI IDROCARBURI
PROCESSI DI OSSIDAZIONE
tab. 1. Possibili specie formate dalla complessazione
di ossigeno a ioni metallici
MnO2 M(n1)O2 (superosso)
M(n1)O2 Mn M(n1)(OO)2
M (n1)(m-perosso)
M(n1)(OO)2M(n1) 2 M(n2)O2(osso)
M(n2)O2Mn M(n1)O2M(n1) (m-osso)
MOH2O2 M(OH)OOH (metallo-peracido)
M(OH)OOH H2OM (perosso)
M(n1)O perosso
2
Co(I)/Co(III), Ir(I)/Ir(III), Pd(0)/Pd(II), Pt(0)/Pt(II). I
metalli negli stati di ossidazione più alti (III e IV) non
possono trasferire elettroni all’ossigeno molecolare e
non formano addotti stabili. In questo meccanismo, la
formazione di specie metallo-osso ad alta valenza avviene attraverso la scissione del legame OO di un complesso intermedio dinucleare m-perosso, con trasferimento di elettroni dal metallo e appaiamento di spin nell’ossigeno molecolare. Una descrizione più accurata
dovrebbe tener conto delle due strutture di risonanza:
M(IV)O2 M(II)O
Il modo più comune di rappresentare questo gruppo è
MO.
Si possono distinguere diverse classi di ossidazioni
con O2 e catalizzatore metallico, in base al complesso
formato con l’ossigeno e agli stati di ossidazione del
metallo (cioè al ruolo svolto dall’atomo metallico nell’attivazione dell’ossigeno; Sheldon e Kochi, 1981; Drago
e Beer, 1992). Una particolare attenzione sarà rivolta alle
ossigenazioni con specie metallo-osso, che ricoprono
una particolare importanza nella funzionalità dei substrati organici.
Specie metallo-osso formate per interazione
con perossidi e ossigeno molecolare
Il meccanismo che presiede la formazione delle specie MO può essere diviso in due stadi: la reazione di
formazione del perossido e la reazione del perossido con
il complesso metallico per formare le specie metalloosso. L’ossidazione con catalizzatore metallico non avviene in conseguenza dell’attivazione dell’ossigeno molecolare da parte del metallo, dato che le caratteristiche
del metallo non permettono il trasferimento elettronico
all’ossigeno. La presenza di un agente riducente permette di convertire l’ossigeno molecolare in H2O2 o in
un alchilidroperossido (che hanno maggior potere ossidante dell’ossigeno), il quale reagirà a sua volta con il
complesso metallico per produrre le specie metallo-osso
VOLUME II / RAFFINAZIONE E PETROLCHIMICA
ad alta valenza. In effetti, nelle ossidazioni omogenee in
fase liquida in condizioni blande, quando si fa uso di
ossigeno molecolare la generazione di specie metalloosso richiede la presenza di un agente riducente, necessaria per fornire elettroni al sistema. Inoltre, l’azione
catalitica delle specie metallo-osso nell’ossigenazione
del legame CH deve sempre competere con processi
di autossidazione rapidissimi, che causano reazioni radicaliche a catena non selettive e indiscriminate. L’obiettivo è pertanto quello di sviluppare sistemi in grado di
operare in assenza di altri agenti riducenti e che possano competere cineticamente con le autossidazioni iniziate da radicali liberi.
Tra gli agenti riducenti in grado di ridurre l’ossigeno molecolare a H2O2 si possono citare i derivati dell’antrachinolo, NADH e BH 4 . I complessi metallo-perosso M(n2)O2
possono
reagire con l’acqua o con un
2
acido, portando alla formazione di H2O2 o di specie
MOOH:
M(n2)2eO2 M(n2)O2
2 (complesso perosso)
M(n2) H O
M(n2)O2
2H
2
2 2
(n2)OOH
M(n2)O2
2 H M
Allo stesso modo, gli addotti superossidici metalloO2 (cioè quelli in cui si è verificato il trasferimento della
carica di un singolo elettrone dal metallo all’ossigeno
molecolare) possono essere ridotti a specie metallo-perosso in presenza di un agente riducente monoelettronico
(agente riducente sacrificale):
M(n1)OO e M(n1)O2
2
(complesso perosso)
Il secondo stadio è l’ossidazione dei complessi metallici in specie metallo-osso con H2O2, che può procedere nel modo seguente:
M(II)(H2O) H2O2 M(IV)O 2H2O
oppure mediante sostituzione del legante e formazione
del complesso dinucleare m-perosso, che si decompone
in seguito nelle specie metallo-osso.
Quanto sopra equivale alla ben nota reazione tra perossido di idrogeno (o alchilidroperossidi) e ioni metallici,
con ossidazione dello ione metallico e riduzione di H2O2,
catalizzata da ioni quali Fe2 o Cu:
2M22HH2O2 2M32H2O
2M3H2O2 2M2O2 2H
In questo caso, tuttavia, si genera anche ossigeno
molecolare, dato che lo ione metallico nello stato di ossidazione più elevato formato dalla reazione catalizza l’ossidazione di H2O2 a O2. Ciò avviene perché lo ione metallico ha due stati di ossidazione stabili – cioè M(II)/M(III) –,
e il disproporzionamento del perossido di idrogeno è preferito alla formazione di uno stato di ossidazione ancora più alto, M(IV).
637
PRODUZIONE DI INTERMEDI PER LA PETROLCHIMICA
In teoria, la for0mazione delle specie metallo-osso
può implicare una rottura omolitica o eterolitica del legame OO nell’idroperossido. Il processo eterolitico comporta il trasferimento di due elettroni dal metallo (aumentandone lo stato di ossidazione da Mn a M(n2)), mentre ovviamente il processo omolitico causa l’ossidazione
a M(n1). In questo caso, si genera anche un radicale
HO (o RO nel caso degli alchilidroperossidi), la cui
elevata reattività intrinseca può originare reazioni secondarie indesiderate, come accade nel caso delle autossidazioni innescate dal metallo.
È stata ipotizzata la formazione di specie metalloosso ad alta valenza negli enzimi monossigenasi, il
più studiato e conosciuto dei quali è il citocromo P-450.
Tali enzimi catalizzano le reazioni in cui un atomo di
ossigeno è incorporato in un substrato organico, mentre
il secondo atomo di ossigeno è ridotto e forma acqua
(Hayaishi, 1974):
RH O2 2e2H ROH H2O
I complessi Fe-porfirine, analoghi del citocromo P-450
(sistemi biomimetici), danno luogo alla formazione di
specie Fe-osso previa riduzione dell’ossigeno molecolare per mezzo di un agente coriducente sacrificale, come
NaBH4, LiBH4, acido ascorbico, o Pt/H2 (Groves, 1985;
Ortiz de Montellano, 1985; Dawson, 1988; Mansuy e
Battioni, 1989; Shilov, 1989). Il meccanismo comporta
la riduzione dell’ossigeno molecolare e la formazione di
un complesso Fe(III)-perosso, che si decompone a
(P )Fe(IV)O (dove P è la porfirina), che, a sua volta,
svolge la funzione di agente ossidante attivo. Dopo l’ossidazione, il Fe(III) formato è ridotto di nuovo a Fe(II).
L’impiego di H2O2, in luogo di O2, rende inutile l’agente riducente sacrificale, dato che il perossido di idrogeno forma direttamente le specie metallo-osso (nel campo
degli enzimi, questo fenomeno è noto come shunt del
perossido di idrogeno).
I centri metallo-osso sono stati proposti come siti attivi ossidanti nei catalizzatori Fe(TFPP)N3, {Fe(TFPP)}2O
e Mn(TFPP)N3 (TFPP, meso-tetrafenilporfirinato) per
l’ossidazione di isobutano ad alcol t-butilico con ossigeno molecolare (Ellis e Lyons, 1989a e 1989b). Si è
anche affermato che le caratteristiche dei complessi utilizzati rendono inutile la presenza dell’agente coriducente.
Nella reazione di ossidrilazione del legame CH
negli alcani o in altri substrati contenenti legami CH,
possono intervenire diversi meccanismi (Hill, 1989), in
rapporto alla natura della specie intermedia che si è formata. Il tipo del percorso di reazione è in genere una funzione delle proprietà dell’accettore di elettroni del legame metallo-osso. Sono possibili i seguenti meccanismi:
• estrazione di H:
MnO2RH [M(n1)OH R]
638
con la formazione di una coppia di radicali, che evolve poi a:
[M(n1)