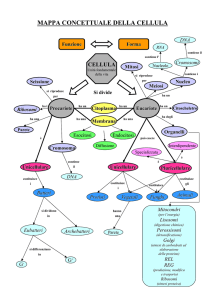
LA CELLULA
E’ noto che gli organismi viventi sono costituiti da cellule e che:
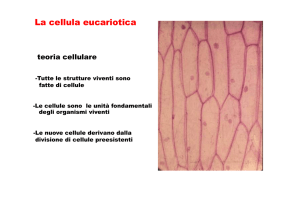
La cellula è l’unità fondamentale dei viventi.
Tuttavia questa asserzione riguarda l’inizio dei ragionamenti che hanno portato alla teoria cellulare. La
cellula è stata intesa per lungo tempo, nel senso classico, provvista di un nucleo, senza considerare
diverse eccezioni che riguardano cellule plurinucleate (fibre muscolari, elementi dei canali secretori, ife,
ecc.) o strutture derivanti da cellule. La teoria venne pertanto riformulata da Schwann e Schleiden:
Gli organismi viventi sono costituiti da cellule o prodotti di cellule.
Ma anche questa asserzione può non essere appropriata per i microrganismi più semplici (Virus).
Un’altra affermazione importante che riguarda l’essenza delle cellule venne enunciata da Wirchow:
Le cellule producono altre cellule in continuità nel tempo.
In base a ciò, si comprende come tutte le cellule derivino da altre cellule.
Attualmente la teoria cellulare mette in evidenza due punti:
1. Cellule o prodotti di cellule sono le unità di struttura e funzione degli organismi
2. Tutte le cellule derivano da cellule preesistenti
Si è accennato in precedenza al fatto che le cellule prive di nucleo non possono avere introni. Abbiamo
dato perciò per scontato che esistano cellule con nucleo e cellule prive di nucleo. Anzi per la verità
dovremmo parlare di organismi con cellule nucleate e organismi con cellule non dotate di nucleo che
corrispondono a due gruppi fondamentali: Eucarioti e Procarioti.
Le cellule degli Eucarioti hanno una compartimentazione ben definita, con sistemi di membrane, un
nucleo delimitato da membrana e veri e propri cromosomi, i procarioti mancano di ciò.
MODALITÀ DI VITA (ASSUNZIONE DI ENERGIA E RELAZIONI)
La distinzione degli organismi viventi in regni varia a seconda che si vogliano privilegiare i caratteri discriminanti, attualmente
osservabili, o valorizzare i dati filogenetici (relativi alla discendenza effettiva avvenuta nel corso dell’evoluzione). Inizialmente
distinti in due regni (piante ed animali), alcuni anni fa furono distinti in 5 regni: Plantae, Animalia, Monera, Protisti, Fungi.
Non mancano però ora distinzioni in due soli regni: Procarioti ed Eucarioti che esaltano le somiglianze tra diversi animali e
vegetali. Indipendentemente dalla classificazione che si voglia seguire, già esaminando i regni più primitivi abbiamo occasione
di distinguere i tipi principali di vita e di nutrizione degli organismi.
Gli esseri viventi subiscono una costante perdita d’energia, in quanto le loro attività vitali generano forme d’energia in buona
parte inutilizzabili a fini metabolici (per esempio calore) e devono pertanto rifornirsi d’energia prelevandola dal mondo
esterno, pena la morte.
Nell’ambiente sono presenti svariate forme d’energia, ma solo quella luminosa e quella chimica contenuta in un numero
limitato di sostanze possono essere utilizzate direttamente dagli organismi viventi.
Autotrofi: organismi che ricavano energia dalla luce (fotoautotrofi) o da alcuni composti inorganici in grado di entrare in
reazioni biologiche (chemioautotrofi). Questo apporto energetico consente agli autotrofi di organicare l’anidride carbonica
dell’aria e l’azoto dei nitrati e dei sali ammoniacali prelevati dal terreno.
Eterotrofi: organismi, incapaci di sfruttare luce o sostanze inorganiche, costretti ad assumere carbonio ed eventualmente azoto
in combinazioni già organiche, utilizzando composti altamente energetici sintetizzati da altri esseri viventi. L’esistenza degli
eterotrofi è perciò condizionata dai produttori di materia organica. Gli eterotrofi possono essere saprofiti, parassiti e simbionti.
La distinzione tra autotrofia e eterotrofia non è però netta: molti organismi sono solo parzialmente autotrofi perché necessitano
di sostanze in tracce (vitamine, ormoni) per catalizzare reazioni biologiche importanti. Altri (per esempio le Euglene) in
assenza di luce e su substrati organici diventano eterotrofi saprofiti.
I fotoautotrofi si riforniscono d’energia attraverso la fotosintesi: il più grandioso fenomeno d’energia dal mondo inorganico a
quello della vita.
L’energia luminosa, grazie all’azione di pigmenti fotosensibili, viene convertita in energia chimica, utilizzata per trasformare
composti poveri di energia (CO2 e H2O) in composti ad elevato livello energetico (carboidrati).
Un caso particolare è rappresentato dai solfobatteri che svolgono la fotosintesi utilizzando, tramite batterioclorofille, la luce
come fonte energetica e l’acido solfidrico come donatore d’elettroni; ma altri batteri (purpurei non sulfurei) utilizzano invece
alcooli, acidi grassi, chetoacidi, ecc.
I chemioautotrofi ricorrono alla CO2 dell’aria, ma ricavano energia demolendo composti minerali presenti nell’ambiente (sali
ferrosi, ammoniaca, nitriti, ecc.) che vengono trasformati in sostanze a minore contenuto energetico (reazioni esoergoniche);
l’energia liberata viene utilizzata per elaborare composti organici altamente energetici.
La fotosintesi arricchisce il patrimonio energetico della Terra poiché l’energia ha origine esterna, cosmica. La chemiosintesi,
invece, trasforma energia già presente nel nostro pianeta.
La suddivisione degli eterotrofi in saprofiti, parassiti e simbionti deriva non tanto da una differente impostazione delle reazioni
chimiche svolte, quanto dalla loro ecologia, cioè dai rapporti con le loro fonti di nutrizione.
Saprofiti: utilizzano residui organici privi di vita, presenti nell’ambiente. Possiedono enzimi specifici che scindono questi
residui in sostanze più semplici (ammoniaca, CO2, H2S, ecc.) con liberazione di energia per l’organicazione di C e N. Alcuni
sono eterotrofi per l’organicazione del C, ma autonomi per quella dell’azoto (a partire da sali azotati minerali): in questo caso
si tratta di una autotrofia limitata e dipendente (necessita di energia ottenuta demolendo sostanze organiche). Molti invece
necessitano di sostanze organiche sia per il carbonio sia per l’azoto. Saprofiti obbligati sono la maggior parte dei batteri e dei
funghi.
Esistono saprofiti facoltativi (Euglena) o temporanei (batteri del tifo e del colera) che si comportano come saprofiti solo in
determinate condizioni ambientali.
I saprofiti sono importantissimi per chiudere i cicli degli elementi restituendo i composti organici all’ambiente.
Parassiti: si nutrono a spese di organismi viventi e sono eterotrofi per il carbonio e per l’azoto, possono essere facoltativi
(flora intestinale) oppure obbligati; oloparassiti (Cuscuta) o emiparassiti (Vischio).
Simbiosi: convivenza tra due esseri vantaggiosa per entrambi in quanto ognuno utilizza l’attività dell’altro per sopperire a
proprie deficienze (parassitismo bilanciato) conseguendo un equilibrio costante, obbligato (licheni) o temporaneo (con
vantaggi in una fase per un organismo ed in un’altra per l’altro; batteri azotofissatori e leguminose.
Frequenti e particolarmente importanti per le piante superiori sono le simbiosi tra eterotrofi ed autotrofi a livello radicale,
definite micorrize.
CENNI SUI PROCARIOTI
Abbiamo già accennato che i Procarioti non hanno un vero nucleo e nemmeno dei veri cromosomi. Il
DNA non è organizzato in complessi insieme con proteine e non è racchiuso in un involucro
membranoso, ma costituisce un “cromosoma” primitivo centrale, circolare ed eventuali altre molecole
d’informazione, più piccole e circolari (plasmidi). I procarioti inoltre non hanno organuli specializzati e
delimitati da membrane, atti a funzioni specifiche, seppure possano presentare regioni particolari
(centroplasma, flagelli, ecc.). I movimenti cellulari, in particolare quelli citoplasmatici, sono primitivi,
anche se si rilevano movimenti delle cellule per scivolamento o mediante flagelli.
Tra i procarioti possiamo annoverare batteri e alghe azzurre (cianobatteri), ma vedremo meglio in seguito
quali altre categorie comprendano.
Normalmente la cellula procariotica ha dimensioni minori di quella eucariotica, ma, poiché l’attività
metabolica è inversamente proporzionale alle dimensioni cellulari, la cellula procariotica è assai più attiva
di quella eucariotica. Per esempio, molti batteri presentano tempi di raddoppiamento inferiori ad un’ora
(in condizioni ottimali) e ciò rappresenta un vantaggio decisivo nella competizione e nella sopravvivenza.
Ad eccezione dei micoplasmi, le cellule dei procarioti sono delimitate da una parete più o meno rigida,
variabile nella composizione.
Tutte le cellule procariotiche possiedono una categoria di sostanze chimiche propria: le mureine o
mucopeptidi, eteropolimeri costituiti da amminoacidi e amminozuccheri. Le mureine possono essere
periferiche o protette da altri costituenti più esterni. Esse sono sensibili a due antibatterici: la penicillina
che blocca la loro biosintesi nelle cellule giovani e il lisozima che idrolizza alcuni legami procedendo alla
loro demolizione nelle cellule adulte.
Molti organismi procarioti vivono in ambienti ipotonici; se non fossero dotati di una robusta difesa
meccanica come la parete cellulare, le soluzioni esterne tenderebbero ad entrare nei microrganismi
gonfiando irreparabilmente le cellule. Esiste pertanto un meccanismo di difesa passivo. In molte cellule
procariotiche, però, la parete non è lo strato più esterno, poiché essa è ricoperta da una capsula mucosa
(costituita da polisaccaridi o polipeptidi) che rappresenta una ulteriore barriera nei confronti dei pericoli
esterni. La capsula può mancare in diversi batteri (Gram positivi), ma è quasi sempre presente nelle Alghe
azzurre.
Le cellule procariotiche hanno un numero elevatissimo di ribosomi (20.000-30.000). Essi sono molto più
piccoli ed hanno una velocità di sedimentazione minore (70 Svedberg) rispetto a quelli delle cellule
eucariotiche.
Più volte abbiamo pronunciato il termine “specie”, ma che cosa è una specie? esistono diverse definizioni
di specie, la maggior parte delle quali fa riferimento a complessi di individui interfecondi fra loro (che
danno luogo a prole fertile). Non si ha intenzione di affrontare quest’argomento perché richiederebbe un
corso apposito, tuttavia si nota che questa comune accezione di specie non può essere riferita ad
organismi come i procarioti dove è assente una sessualità definita, quantunque esista uno scambio genico
fra individui. Per i batteri ed altri microrganismi si usa parlare di “ceppi” riferendosi a gruppi che
derivano da un unico individuo ben caratterizzato morfologicamente e fisiologicamente limitando il
termine specie a raggruppamenti di ceppi distinti da un alto grado di analogia fenotipica interna e che
differiscono da altri aggruppamenti per un gran numero di caratteri loro propri.
Anche se l’argomento verrà sviluppato nel corso di Microbiologia è bene anticipare alcune nozioni sulle
principali categorie di procarioti.
Questi comprendono: Micoplasmi, Batteri e Cianobatteri.
I MICOPLASMI vennero scoperti alla fine del XIX secolo e chiamati PPLO (Pleuro-Pneumoniae Like
Organism). Sono tra le più piccole e semplici forme cellulari, con una dimensione variabile da 0,1 a 0,3
µm; hanno un DNA circolare costituito da 600-1.500 geni con circa 5.000 paia di basi (per confronto si
tenga presente che il batterio Escherichia coli possiede 3 milioni di paia di basi). Possiedono membrane,
ribosomi, molecole proteiche e lipidiche. Sono eterotrofi parassiti, ma occasionalmente anche saprofiti ed
utilizzano come fonti energetiche esosi, grassi o amminoacidi.
La mancanza di parete cellulare ha come conseguenza una bassa patogenicità, ma rappresenta anche uno
scarso stimolo alla produzione di anticorpi, per cui l’uso di antibiotici è inefficace.
Hanno affinità coi batteri (soprattutto con quella che viene chiamata fase L dei batteri) e per molti di essi
si ipotizza un’origine dai batteri dei generi Bacillus e Lactobacillus.
Affini ai Micoplasmi sono alcuni microrganismi chiamati MLO (Micoplasm Like Organism) che sono
responsabili di numerose malattie delle piante, spesso evidenziate dal sintomo dell’ingiallimento, ed altri
chiamati Spiroplasmi, lunghi sino a 10 µm ed esistenti solo in coltura.
Le caratteristiche dei BATTERI sono quelle già elencate per i procarioti in generale. Hanno una
dimensione media di 1 µm, con un’ampia variabilità da 0,1 a 30 µm. Si distinguono circa 2.500 specie,
ma la variabilità è molto alta e in microbiologia si usa parlare soprattutto di ceppi. Hanno un’origine
molto antica: batteri sono stati ritrovati in rocce di circa 4 miliardi di anni e recentemente pare siano stati
rinvenuti anche su Marte.
Possono essere Anaerobi o Aerobi; i primi possono essere facoltativi o obbligati. Sono in grado di vivere
in habitat con caratteristiche molto varie: da -20° a circa 300 °C. In condizioni estreme entrano in stato di
quiescenza mantenendo le loro potenzialità vitali per periodi lunghissimi. Sono favoriti dalla alcalinità del
mezzo in cui sono immersi, riuscendo a vivere anche con pH 11-12 ; al contrario sono inibiti dall’acidità
(ciò è uno dei motivi per cui diversi prodotti vengono conservati nell’aceto. Insieme coi funghi svolgono
un importante ruolo di decompositori negli ecosistemi e possono essere utilizzati come demolitori di
sostanze indesiderate (pesticidi, nylon, petrolio, ecc.). I batteri sono utilizzati per svariate produzioni: per
l’estrazione di oli combustibili da materiali rocciosi, per la produzione di farmaci e di alimenti (aceto,
alcuni formaggi, yogurt, crauti, ecc.). Alcuni batteri svolgono un ruolo importantissimo fissando l’azoto
atmosferico.
Le principali forme di batteri sono quelle a bastoncello (bacilli), sferette (cocchi), molla (spirilli).
Hanno una parete cellulare talora avvolta esternamente da uno strato più periferico di lipopolisaccaridi.
La parete può essere evidenziata con la colorazione di Gram (1880) utilizzando cristal violetto, soluzione
di iodio e lavaggio in etanolo. I batteri gram negativi non si colorano perché provvisti di una capsula
esterna che impedisce la colorazione della parete e sono pertanto più difficili da combattere in caso di
malattie. La capsula può comunque essere rimossa con diversi procedimenti.
Possiedono una membrana cellulare, possono avere anche flagelli (lunghi, concentrati o distribuiti su
buona parte della superficie esterna) e pili (estroflessioni che intervengono in scambi di materiale
genetico). Mancano i mitocondri e la catena respiratoria è situata sulla membrana plasmatica della cellula.
La moltiplicazione dei batteri avviene per scissione: una invaginazione della membrana porta alla
strozzatura della cellula e alla sua divisione in due cellule figlie. Il DNA è legato ad un punto della
membrana e si duplica all’atto della divisione. In alcune occasioni si possono evidenziare forme di
resistenza, come endospore e cisti che presentano ingrossamento cellulare ed ispessimento della parete e
possono conservarsi per decine o centinaia di anni per poi germinare.
Un fenomeno importante che determina la continua variazione dei caratteri è il trasferimento di segmenti
di DNA da una cellula all’altra (ricombinazione del DNA). Il cromosoma batterico è spesso
accompagnato da altri frammenti circolari di DNA chiamati plasmidi che possono diventare poi parte
integrante del cromosoma (episomi). Ciò viene utilizzato per l’inserimento di geni nel corredo genetico
dei batteri a con tecniche bioingegneristiche. Altri fenomeni che riguardano le modificazioni del materiale
genetico sono la coniugazione, la trasduzione (mediante i batteriofagi), la trasformazione (per effetto di
fattori esterni come calore, radioattività, ecc.), mutazione (nel corso della duplicazione).
Il metabolismo dei batteri è piuttosto vario e si osservano:
Fotoautotrofismo: attuato da batteri provvisti di batterioclorofilla (4 tipi: a, b, c, d) e carotenoidi; questi
batteri possono avere colore verde o purpureo. Si distinguono solfobatteri verdi, solfobatteri purpurei e
batteri purpurei non sulfurei. I batteri fotoautotrofi richiedono anaerobiosi e un donatore diverso
dall’acqua, per cui vivono in sorgenti solforose, stagni, laghi stretti e profondi. Assorbono lunghezze
d’onda nel rosso lontano e nell’infrarosso, non utilizzabili da altri organismi; in certi casi sono in grado di
utilizzare la luce azzurra e azzurro-verde.
Chemioautotrofismo: è attuato da batteri aerobi distinguibili, in base alle fonti utilizzate,
Idrogenobatteri (facoltativi)
2H2+O2 → 2H2O + 113.000 cal /mole
alcuni riescono anche a utilizzare CO
2CO+O2 → 2CO2
Nitrificanti nitrosatori: (NH4)2CO3+3O2 → 2HNO2+CO2+3H2O
(= sali d’ammonio → acido nitroso ovvero nitriti di Ca o Mg)
Nitrificanti nitratatori: Ca(NO2)2+O2 → Ca(NO3)2 (=nitriti → nitrati)
Solfobatteri: 2H2S+O2 → 2H2O + S2 (Thiobacillus nei fondi d’acqua stagnante) (= acido
solfidrico → acqua e zolfo inorganico)
Ferrobatteri: ossidano ioni ferrosi in ioni ferrici (pellicole superficiali argentate o iridate)
2FeCO3 + 3H2O + ½ O2 → 2Fe (OH)3 + 2CO2 (Fe bivalente → Fe trivalente; lo stesso tipo di
reazione può avvenire col Mn)
Eterotrofi attuano la respirazione utilizzando normalmente zuccheri come substrato, ma in qualche
caso particolare anche metano (metanobatteri):
CH4+2O2 → CO2+H2O
Nella respirazione anaerobia si può citare anche il caso dei batteri denitrificanti che utilizzano come
accettore di elettroni non l’ossigeno, ma un nitrato che si riduce a nitrito; questo processo prosegue poi
sino ad N atmosferico.
I CIANOBATTERI (o Alghe azzurre) hanno una parete pectocellulosica ed una capsula mucillaginosa che
spesso riunisce più individui in colonie. Evidenziano un centroplasma, piccoli vacuoli, clorofilla a,
carotenoidi, ficobiline (ficobiliproteine che sono proteine coniugate con tetrapirroli lineari, pigmenti
biliari) come le ficoeritrine che assorbono la luce verde 550 nm e le ficocianine che assorbono la luce
gialla 625 nm.
Vivono in ambienti con buona disponibilità idrica: acque dolci o salate, stagnanti o correnti, rocce e
terreni umidi, ecc. Alcune specie sono adattate a basse temperature (colonizzando ghiacci e nevi) altre ad
alte temperature (sorgenti termali).
Diverse sono in grado di svolgere la fissazione dell’azoto atmosferico e si presentano in simbiosi con
piante superiori.
LA CELLULA DEGLI EUCARIOTI
FORMA E DIMENSIONI
Forma e dimensioni della cellula sono legate alla funzione che essa deve svolgere. Tra le cellule vegetali,
la forma sferica è assai rara, mentre più frequente è quella poliedrica. Ciò dipende soprattutto dal fatto che
la forma sferica non è conveniente perché unisce il maggior volume alla minore superficie; la superficie
di una cellula è di importanza vitale poiché determina la capacità di scambio tra ambiente esterno ed
interno alla cellula stessa (anche fra cellule adiacenti). Negli organismi pluricellulari la forma delle cellule
dipende anche dalla mutua pressione fra esse. Al microscopio si distinguono cellule a sezione ellittica,
quadrangolare, poligonale, stellata, allungata, ecc.; ognuna di queste forme è determinata dalle modalità
di genesi della cellula e soprattutto dalla funzione a cui questa è deputata.
In una sfera o in un cubo la superficie aumenta con legge quadratica, ma il volume con legge cubica; poiché le esigenze
metaboliche sono proporzionali al volume di una cellula mentre le sue potenzialità di assumere energia dipendono dalla
superficie, si comprende l’importanza del rapporto tra superficie e volume.
Le dimensioni variano per lo più tra 10 e 40 µm, tuttavia vi sono cellule che raggiungono dimensioni
notevoli (le fibre del lino e dell’ortica raggiungono i 6-7 cm e quelle del ramiè 50 cm, e tra gli animali
basti pensare alle dimensioni d’alcune cellule uovo). L’aumento del volume porta, come conseguenza,
una maggiore necessità d’energia e, quasi sempre, ad un certo limite, la cellula si divide o muore. Nel
caso dei vegetali pluricellulari, la morte cellulare non significa necessariamente che viene a mancare lo
svolgimento della funzione; anzi in diversi casi (tessuti di conduzione e meccanici) la morte della cellula
è programmata affinché gli elementi che succedono all’evento possano svolgere meglio le funzioni
previste. La presenza del nucleo nelle cellule è, in parte, motivata dalle maggiori esigenze organizzative
che si evidenziano con l’aumento delle dimensioni cellulari degli eucarioti rispetto ai procarioti. Nelle
cellule vegetali la presenza di un grosso vacuolo contribuisce a risolvere il problema derivante da un
rapporto sfavorevole superficie/volume. La forma stessa di alcune cellule, inoltre, tende a stabilire un
rapporto superficie/volume, laddove sono necessari intensi scambi con l’esterno (cellule del tessuto di
trasfusione nelle foglie aghiformi di conifere; cellule renali, ecc.).
Tabella 8 – Componenti della cellula vegetale (* assenti da quella animale)
I. Parete cellulare*
A. Lamella mediana (pectine) spessore 0,1µm
B. Parete primaria (cellulosa) spessore 0,1-3µm
C. Parete secondaria (cellulosa) spessore >4-5µm
D. Plasmodesmi (diametro 20-40nm)
E. Punteggiature
II. Protoplasto
A. Citoplasma (citosol)
1. Membrana plasmatica (plasmalemma) spessore 0,01µm (10 nm)
2. Sistema di endomembrane
a. Reticolo endoplasmatico (ER) spessore 6-7,5nm
b. Apparato di Golgi (dittiosomi) diametro 0,5-2µm spessore membrane 7,5nm
c. Involucro nucleare (vedi sotto)
d. Tonoplasto (membrana del vacuolo, vedi sotto)
e. Microcorpi (perossisomi, gliossiomi) diametro 0,3-1,5µm
f. Sferosomi e corpi proteici (delimitati da mezza unità di membrana) diametro 0,52µm
3. Citoscheletro
a. Microtubuli (diametro interno 14nm, esterno 30nm)
b. Microfilamenti (spessore 5-7nm)
c. Filamenti intermedi (spessore 7-11nm)
4. Ribosomi (diametro 15-25nm, costituiti da due subunità)
5. Mitocondri (organuli delimitati da membrana) 0,5-1 x 1-4 µm
6. Plastidi* (organuli delimitati da membrana)
a. Proplastidi (plastidi immaturi)
b. Leucoplasti (plastidi incolori: amiloplasti, proteoplasti, elaioplasti)
c. Cloroplasti (pigmentati fotosintetizzanti, spessore 2-4 x 5-10 µm)
d. Cromoplasti (pigmentati non fotosintetizzanti)
7. Citosol (fluido contenente in sospensione le strutture sopra elencate)
B. Nucleo (diametro 5-15µm – 0,6 mm)
1. Involucro nucleare (due unità di membrana) spessore 25-57µm
2. Nucleoplasma (sostanza granulare e fibrillare)
3. Cromatina (durante la divisione cellulare appaiono i cromosomi)
4. Nucleolo (diametro 0,5-5µm)
C. Vacuoli* (da numerosi e piccoli ad unico con volume sino a 95% del volume cellulare)
1.Tonoplasto (spessore 6-7,5nm)
2. Succo vacuolare (fluido acquoso)
D. Ergastoplasma (inclusione di materiali ± puri spesso in plastidi e vacuoli)*
1. Cristalli (es.: ossalato di calcio)
2. Tannini*
3. Grassi e oli (globuli lipidici o negli elaioplasti)
4. Granuli di amido (negli amiloplasti e nei cloroplasti)*
5. Corpi proteici
F. Flagelli e ciglia (spessore 0,2µm, lunghezza 2-150µm)
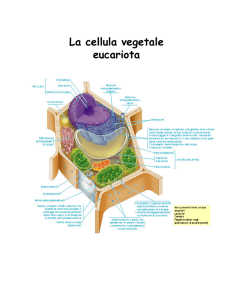
STRUTTURA GENERALE
Se si osserva una cellula eucariotica vegetale al microscopio, si nota immediatamente una struttura
complessa, ben delimitata esternamente: accanto ad organuli evidenti (nucleo, mitocondri, eventuali
cloroplasti), è evidente un sistema di compartimenti realizzato da membrane. Il sistema di membrane
costituisce il reticolo endoplasmatico (ER): esso circonda il nucleo ed è connesso, tramite un flusso di
vescicole, all’apparato di Golgi (dittiosomi); inoltre partecipa alla realizzazione del vacuolo ed è in
comunicazione col ER di cellule adiacenti. Secondo Schnepf le membrane interne (endomembrane)
suddividono la cellula in compartimenti (fasi): ogni membrana separa una fase acquosa da una fase
plasmatica. Le fasi acquose occupano gli spazi tra le membrane del ER e quelli tra le membrane interne
ed esterne dei mitocondri e dei cloroplasti, oltre che lo spazio interno al vacuolo. le fasi plasmatiche sono
rappresentate da citosol e nucleoplasma (fase mista nucleo-citoplasmatica), stroma dei cloroplasti
(plastoplasma) e dei mitocondri (mitoplasma). Il sistema di membrane non è rigido, ma evidenzia
continue variazioni, scissioni e flussi; tutto ciò avviene, però, senza che si assista a fenomeni di fusione
tra fase acquosa e fase plasmatica.
Oltre a queste “fasi”, la cellula è attraversata da un intreccio di strutture filamentose e tubulari che
rappresentano il citoscheletro.
L’origine di tale organizzazione è da ricercarsi, secondo alcuni autori in una ancestrale simbiosi tra
cellula procariotica eterotrofa e cellule procariotiche autotrofe, documentata anche da altri caratteri che
vedremo più avanti.
Uno schema della cellula vegetale è riportato nella Tabella 8. Si distinguono alcuni componenti che sono
proprie della cellula vegetale: parete cellulare, plastidi, vacuoli ed ergastoplasma. Nella cellula animale,
vi sono però alcune strutture particolari come i centrioli, assenti da quella vegetale, ed i lisosomi (in
sostituzione dei vacuoli).
IL CITOSOL
Nella cellula vegetale adulta, il volume tra la membrana plasmatica o plasmalemma e il tonoplasto (che
delimita il vacuolo) viene definito protoplasma esso è costituito da citoplasma o citosol, organuli e sistemi
di membrane.
Il citosol, composto per circa 70% di acqua e 20% di proteine, occupa solo il 10% circa del volume. Al
microscopio ottico appare scarsamente differenziato, tuttavia esso contiene un’elevatissima varietà di
proteine enzimatiche (associate al metabolismo intermedio, ad es.: gli enzimi per la glicolisi), è
attraversato dal citoscheletro e dal sistema di endomembrane (osservabili al microscopio elettronico, ed
ospita organuli, microcorpi e ribosomi.
Il termine citosol è relativamente improprio poiché si possono distinguere stadi più liquidi (sol) e più
consisitenti (gel) talora coesistenti. Con la collaborazione del citoscheletro si realizzano correnti
citoplasmatiche, veri e propri spostamenti di massa citoplasmatica con movimenti circolari che trascinano
mitocondri, cloroplasti, ecc.
LE MEMBRANE CELLULARI. IL PLASMALEMMA
Il plasmalemma delimita il citoplasma separando l’interno citoplasmatico (definito simplasto) dalla fase
acquosa esterna (apoplasto). Poiché il plasmalemma di ogni cellula è in comunicazione con quello delle
cellule adiacenti mediante i plasmodesmi, nei tessuti si realizza un continuum simplastico. Il
plasmalemma non è una membrana “specializzata” come quella di cloroplasti e mitocondri, tuttavia ha
una struttura composita corrispondente alla struttura fondamentale comune a tutte le membrane. Tale
struttura non è fissa e passiva, ma è fluida e assolve a compiti importanti:
a) permeabilità selettiva (ingresso di molecole utili e uscita di molecole di rifiuto o in eccesso)
b) mantenimento dell’omeostasi del pH e della composizione ionica
c) ancoraggio di sistemi enzimatici per il trasporto di ioni e sostanze polari, di e-, sintesi di
macromolecole, cellulosa
d) ancoraggio del citoscheletro
e) riconoscimento e scambio di segnali chimici extracellulari
Le membrane costituiscono per le cellule un “banco di lavoro” sul quale svolgere reazioni biochimiche e
contemporaneamente una superficie di scambio per assumere ed espellere sostanze.
Il modello di membrana attualmente più accreditato è quello di “mosaico fluido” proposto da Singer e
Nicolson: le membrane sono strutture appiattite formate da proteine e lipidi, nelle quali le proteine sono
immerse nel doppio strato lipidico in una o nell’altra faccia (proteine periferiche o estrinseche) o lo
attraversano completamente (proteine integrali o intrinseche). Le proteine presenti sulla superficie
esterna, così come alcuni lipidi, possono presentare brevi catene di carboidrati (oligosaccaridi). Nella
membrana si distingue una parte idrofobica interna, compresa fra due parti idrofiliche. Sia i lipidi sia le
proteine possono muoversi nella porzione idrofobica, lungo il piano della membrana, o compiere
occasionalmente migrazioni trasversali (flip-flop) fra le superfici. Proteine e lipidi sono assemblati grazie
a legami covalenti, ma diverse proteine estrinseche sono trattenute alla superficie idrofilica dei lipidi
mediante cariche ioniche.
In media le membrane plasmatiche sono costituite da 60% di proteine e 40% di lipidi in peso; ciò
significa che, in media, per ogni molecola proteica vi sono circa 25 molecole di lipidi.
La composizione lipidica delle membrane varia da cellula a cellula e da organulo ad organulo. I
fosfolipidi sono i lipidi di membrana più abbondanti in assoluto. Essi esibiscono regioni idrofiliche (teste
polari costituite dal gruppo fosfato con carica negativa e spesso un gruppo amminico positivo) orientate
verso le superfici delle membrane e regioni idrofobiche (code costituite dalle catene di acidi grassi)
rivolte all’interno. Altri lipidi frequenti nelle membrane di cellule vegetali sono i cardiolipidi e i
glicolipidi (soprattutto nei cloroplasti) e in minore misura gli steroli; negli animali sono frequenti anche
gli sfingolipidi.
La fluidità del modello dipende in parte dalla possibilità di movimento delle code idrocarburiche dei
lipidi; esse possono: ruotare attorno al proprio asse (salvo in corrispondenza di doppio legame),
diffondere all’interno del proprio strato, flettersi, ma non passare da un monostrato all’altro, se non in casi
eccezionali (flip-flop), spesso indotti artificialmente. La fluidità dipende dai tipi di acidi grassi: catene
corte e doppi legami favoriscono la fluidità; la presenza di grassi saturi o di steroli stabilizza la
membrana.
E’ stato dimostrato che la composizione lipidica delle membrane è asimmetrica: i glicolipidi sono
chiaramente rivolti verso i lato esterno a contatto con l’ambiente extracellulare.
Le proteine di membrana contribuiscono maggiormente a conferire specificità alle membrane; esse sono
distinte, come detto, in estrinseche (periferiche), fortemente idrofiliche, legate debolmente alla superficie
e facilmente distaccabili con soluzioni in condizioni chimiche blande, e in intrinseche (integrali), immerse
nello strato idrofobico, separabili dalla membrana solo con detergenti o solventi organici in condizioni
chimiche drastiche. In una proteina intrinseca, la sequenza idrofobica, di contatto con la superficie della
membrana (esterna o interna), è definita dominio: la maggior parte delle proteine intrinseche è bitopica o
politopica, cioè hanno due o più domini, attraversando due o più volte le superfici, mentre solo un numero
scarso è monotopica, con un solo dominio.
Come per i glicolipidi, le glicoproteine si trovano solo sulla superficie esterna della membrana; anzi, in
realtà, la maggior parte delle proteine che si affacciano all’esterno è glicosilata, particolarmente nelle
piante, dove le membrane possono avere circa il 20% in peso di zuccheri (in forma di glicoproteine);
questi zuccheri sono rappresentati da singoli monosaccaridi (galattosio, mannosio) sino a catene di
qualche centinaio di unità.
Anche le proteine possono muoversi nel modello fluido, seppure con movimenti più lenti (rispetto a quelli
dei lipidi), soprattutto per rotazione o per diffusione laterale. Inoltre l’asimmetria delle proteine è una
delle principali caratteristiche delle membrane: le proteine sono sistemate nel modello in modo peculiare.
Quelle che sporgono verso l’esterno contengono carboidrati, mentre quelle rivolte all’interno sono spesso
collegate a strutture citoplasmatiche.
Le membrane non sono statiche, ma col tempo vengono rinnovate: i singoli componenti sono degradati e
rimpiazzati con nuove molecole, identiche o diverse da quelle originarie. Alcune membrane sono più
stabili ed altre (per esempio quelle dei mitocondri) hanno un ricambio più veloce. In molti casi si hanno
scambi di fosfolipidi tra membrane o tra membrane e proteine che trasportano lipidi. La variazione della
composizione in acidi grassi del doppio strato lipidico delle membrane può avvenire come risposta rapida
a cambiamenti ambientali.
L’assemblaggio dei componenti lipidici e proteici delle membrane avviene per gran parte nel reticolo
endoplasmatico e nell’apparato di Golgi.
La presenza di una porzione idrofobica (code) rende le membrane virtualmente impermeabili al passaggio
di molecole polari o cariche ed, in generale, quanto più una molecola è piccola ed apolare (solubile in
solventi organici) tanto più velocemente diffonderà nel doppio strato. L’acqua permea molto velocemente
per la sua natura di dipolo e per il basso peso molecolare; inoltre esistono dei veri e propri “pori” (pori
acquosi) che aumentano la velocità di flusso dell’acqua attraverso le membrane.
I movimenti attraverso le membrane possono avvenire secondo tre diverse modalità:
• diffusione
• trasporto facilitato (secondo gradiente di concentrazione)
• trasporto attivo (contro gradiente di concentrazione)
La diffusione è un meccanismo passivo ed avviene nelle zone idrofile (per lo più corrispondenti a
proteine che attraversano la membrana) per le sostanze idrofile e nelle zone lipofile per le sostanze
lipofile. Nel primo caso la permeabilità dipende soprattutto dalle dimensioni delle molecole, nel secondo
dalla solubilità nei lipidi. La diffusione passiva avviene sempre dalla fase ad alta concentrazione verso
quella a bassa concentrazione (o meglio ciò è il risultato dei due flussi in senso opposto); nel caso di
molecole elettricamente neutre la diffusione cessa (ovvero i flussi nelle due direzioni si eguagliano)
quando il gradiente di concentrazione è uguale a zero. Nel caso di ioni il gradiente riguarda anche le
cariche elettriche; lo spostamento è quindi il risultato di un potenziale chimico e di un potenziale elettrico
Il trasporto facilitato e quello attivo avvengono grazie alla presenza di proteine trasportatrici (carrier =
trasportatori) specifiche (per una molecola o una classe di molecole) che aumentano (catalizzano) la
velocità di diffusione di numerose molecole, anche di grosse dimensioni (zuccheri, aminoacidi,
nucleotidi). La specificità del trasporto è importante perché permette l’assorbimento e l’espulsione
selettiva di soluti e permette di costituire ambienti a concentrazioni ioniche diverse (segregazione di ioni)
e, in definitiva, creare potenziali elettrici transmembrana che rappresentano una forma d’accumulo di
energia (pompa H+ nei vegetali). La cinetica del trasporto facilitato è simile alla cinetica enzimatica
(specificità del substrato, saturazione del substrato, inibizione competitiva, ecc.). Il trasporto facilitato
opera con gradiente di concentrazione favorevole, è bidirezionale e non richiede energia; il trasporto
attivo opera contro gradiente di concentrazione, è unidirezionale e richiede energia.
In molti casi una molecola trasportatrice attua contemporaneamente la diffusione lungo gradiente di una
sostanza al trasporto di un’altra sostanza contro gradiente. Tale accoppiamento (che si ritrova anche per
reazioni di diverso tipo (reazione che rilascia energia + reazione che richiede energia) viene definito
“cotrasporto”. Nelle cellule animali il cotrasporto di diverse molecole (aminoacidi, glucosio, ecc.)
coinvolge soprattutto lo ione Na+, mentre in cellule vegetali sono per lo più coinvolti K+ e H+.
Nel plasmalemma e nel tonoplasto si trovano proteine che scindono l’ATP (ATPasi) trasformando
l’energia dell’ATP in un trasporto di protoni dal citoplasma all’esterno (per il plasmalemma) o nel
vacuolo (per il tonoplasto). Ciò rappresenta una vera e propria “pompa protonica” che stabilisce un
gradiente elettrochimico di protoni ∆µH+ da una parte all’altra delle membrane. Poiché il trasporto di
protoni è direttamente accoppiato al trasporto di energia di ATP, si parla di trasporto attivo primario. E’
probabile che il significato evolutivo iniziale dell’ATPasi del plasmalemma e del tonoplasto fosse legato
alla regolazione del pH. Nelle cellule vegetali il citosol ha pH 7,5-8, mentre il succo vacuolare e
l’ambiente esterno sono nettamente più acidi.
In diversi casi si assiste all’accoppiamento di un cotrasporto derivante dalla pompa protonica dell’ATPasi
con il trasporto di cationi (uniport); un esempio riguarda il cotrasporto H+-glucosio associato all’uscita di
K+. Nel caso del plasmalemma la pompa protonica, promuovendo l’uscita di H+ acidifica la parete e
permette l’allungamento cellulare (crescita acida) indotto da ormoni. Meccanismi simili alla pompa
H+ATPasi si hanno per altri cationi (K+, Na+, Ca++).
Un’altra via di trasporto attraverso le membrane sono i “canali” rappresentati per lo più da proteine
integrali (differenti dai carrier) che si aprono e si chiudono temporaneamente ed, in stato d’apertura,
lasciano diffondere ioni indirizzandoli secondo il potenziale elettrico.
Un altro sistema di attraversamento delle membrane è il trasporto di massa che riguarda soprattutto grandi
molecole o gruppi di molecole. Ciò avviene per mezzo di vescicole: nell’endocitosi, la membrana
cellulare si invagina e si richiude fondendosi attorno ad una sostanza extracellulare che viene così
trasferita nel citoplasma; nell’esocitosi una vescicola intracellulare contenente una sostanza destinata
all’esterno si fonde con il plasmalemma e rilascia la sostanza al di fuori della cellula. Nelle cellule
vegetali fenomeni di esocitosi riguardano il trasporto di materiali elaborati nel reticolo endoplasmatico e
riversati all’esterno per formare la matrice della parete cellulare.
Il plasmalemma ha anche un importante ruolo nelle interazioni tra cellule, sia dirette, sia mediate da
sostanze chimiche come gli ormoni. I meccanismi d’interazione coinvolgono i residui oligosaccaridici
presenti sulle membrane.
Durante la citodieresi, frammenti di reticolo endoplasmatico rimangono intrappolati nella piastra cellulare
di separazione fra le cellule “figlie”: da questi si originano canalicoli citoplasmatici circondati da
membrane in continuità con il plasmalemma e il reticolo endoplasmatico. Essi attraversano la parete e
mettono in comunicazione cellule adiacenti. Sono definiti plasmodesmi ed hanno la configurazione di
aperture con diametro di 20-40nm; all’interno di ciascuno di essi decorre un fascio di reticolo
endoplasmatico (desmotubulo) circondato da citoplasma (annulus). Nel momento di maggior crescita, la
cellula possiede un alto numero di plasmodesmi, al termine della differenziazione la densità dei
plasmodesmi diminuisce.
IL SISTEMA DI ENDOMEMBRANE. RETICOLO ENDOPLAMATICO. APPARATO DI GOLGI. MICROCORPI.
Il sistema di endomembrane che distinguono le diverse fasi plasmatiche è costituito da: reticolo
endoplasmatico, apparato di Golgi, involucro nucleare, tonoplasto, membrane dei microcorpi
(microsomi), degli sferosomi e dei corpi proteici; involucro nucleare e tonoplasto saranno trattati
rispettivamente col nucleo e col vacuolo.
Il reticolo endoplasmatico (RE) è il più esteso sistema di membrane della cellula: esso è rappresentato
da tubuli interconnessi, costituiti da membrane che delimitano cisterne; queste hanno un diametro di circa
30 nm, mentre lo spessore delle membrane è di circa 6 nm. Il RE manifesta uno sviluppo molto esteso ed
è in continuità con l’involucro nucleare. In questo modo il lume del RE è in continuità con lo spazio fra le
due membrane nucleari. Si tratta di una struttura dinamica, con tubuli che si allungano e si accorciano e
con disposizioni spaziali che si modificano.
Si distinguono un RE ruvido, caratterizzato da ribosomi ancorati, mediante forze idrofobiche, alla
superficie esterna (citoplasmatica), ed un RE liscio, privo di ribosomi; il primo è più sviluppato nelle
cellule maggiormente impegnate nella sintesi proteica. Il RE liscio, connesso alla porzione ruvida, ha un
aspetto più vescicolare e partecipa alla sintesi dei fosfolipidi e degli steroli che formano le membrane e
probabilmente di diversi pigmenti (è infatti abbondante nelle cellule dei petali; inoltre, da esso si
distaccano le vescicole che trasportano le proteine (sintetizzate a livello del RE ruvido) all’apparato di
Golgi.
In laboratorio, la disgregazione delle cellule porta alla frammentazione del RE in vescicole, dette
microsomi, che possono essere separate dal resto ed analizzate. I due tipi di RE possono essere distinti su
base biochimica, in quanto sulle membrane del RE ruvido, privato dei ribosomi con detergenti, sono
presenti proteine peculiari, le riboforine (implicate nel legame tra ribosomi e membrane) ed una proteina
di attracco, impiegata nel riconoscimento del segnale. La composizione lipidica del RE favorisce i
fosfolipidi (per gran parte con acidi grassi insaturi), mentre scarsi o assenti sono gli steroli; per ogni
molecola proteica si contano circa 35 molecole di lipidi. Tra le oltre trenta proteine isolate dalle
membrane e dal lume del RE, la maggior parte è rappresentata da enzimi ed alcune sono stabilmente
localizzate nel RE.
I ribosomi, ancorati al RE ruvido, partecipano alla sintesi di proteine che debbono essere segregate dal
citoplasma; ciò avviene con un meccanismo di “estrusione vettoriale” cotraduzionale che inserisce
(“infila”) le proteine nel lume del RE, dove vengono glicosilate (con l’aggiunta di oligosaccaridi mediante
legami covalenti). Nella maggior parte dei casi, ciò avviene secondo questa sequenza: 1) inizio della
sintesi proteica su ribosomi liberi con aminoacidi iniziali che rappresentano un segnale idrofobico,
costituito da circa 20 aminoacidi, 2) interruzione della sintesi e migrazione del complesso ribosomamRNA-sequenza segnale verso il RE, 3) immersione della sequenza segnale nella membrana esterna del
RE e ripresa dell’assemblaggio degli aminoacidi, 4) orientamento della catena polipeptidica con la
sequenza segnale affacciata sul lato citoplasmatico della membrana, 5) distacco della sequenza segnale da
parte di enzimi della membrana, 6) aggiunta delle catene di carboidrati alla catena in costruzione
all’interno del lume del RE, 7) completamento della proteina, 8) rilascio del ribosoma e dell’mRNA e
ripiegamento della proteina con costituzione dei ponti solfuro.. In questo processo intervengono una
particella di riconoscimento del segnale (SRP) che blocca la traduzione, mantiene distesa la catena e,
dopo aver legato il complesso alla proteina d’attracco (DP), è rilasciata nel citosol, un recettore (SSR) che
legatosi alla sequenza segnale, determina la ripresa della traduzione ed, infine l’enzima segnalepeptidasi
che distacca la sequenza segale dal resto della catena. Nella parte finale, inoltre, intervengono enzimi
disposti sul lato interno della membrana o nel lume del RE che favoriscono la formazione dei ponti
solfuro ed altre modificazioni. Una proteina “maturata”, secondo le tappe illustrate, è irreversibilmente
segregata nella fase acquosa ed assume una configurazione globulare che impedisce il riattraversamento
della membrana. Nel lume avviene peraltro anche la oligomerizzazione, cioè un corretto assemblaggio
delle subunità che
L’apparato di Golgi consta di un complesso di cisterne appiattite di forma discoidale (“dittiosomi”
diametro 0,5-2 µm) dai bordi ingrossati, in numero variabile da 6 ad oltre 30 (nelle piante sono in media
20). Esso si trova associato alle zone di transizione del reticolo endoplasmatico liscio. Presenta una faccia
“cis”, prossima al reticolo ed una faccia “trans” sul lato opposto, rivolto verso il plasmalemma. Le due
facce hanno caratteri diversi così che l’apparato di Golgi è polarizzato. Le cisterne sono fisiologicamente
distinguibili in tre gruppi quelle della zona cis, quelle della zona mediana e quelle della zona trans. La
faccia cis riceve le vescicole contenenti proteine, glicoproteine, polisaccaridi, ecc. sintetizzati e segregati
nell’ambito del RE; tali molecole, all’interno delle cisterne vengono modificate con l’aggiunta di
oligosaccaridi, gruppi solfato, gruppi fosfato, acidi grassi, ecc., con legame covalente. Tali azioni si
esplicano in maniera specifica per ciascun gruppo di cisterne (cis, mediana e trans) e per la destinazione
finale delle sostanze modificate (lisosomi, plasmalemma, ecc). Il trasporto delle sostanze da una cisterna
all’altra avviene per mezzo di vescicole che gemmano dai bordi delle cisterne stesse. Dalla faccia trans
gemmano infine le vescicole di secrezione che si fondono col plasmalemma per poi riversare il secreto
all’esterno o che vanno a costituire i lisosomi. Vescicole del Golgi e del RE possono inoltre unirsi in
strutture, definite GERL, responsabili, secondo alcuni autori, della costituzione del vacuolo. La funzione
principale dell’apparato di Golgi è la modifica e lo smistamento selettivo delle macromolecole
sintetizzate a livello del reticolo. Lo smistamento selettivo può avvenire grazie alla presenza di recettori
specifici presenti sulle membrane delle vescicole che riconoscono il tipo di sostanza da trasportare e la
sua destinazione. Nei vegetali, l’apparato di Golgi ha un ruolo importante nella formazione della parete,
in particolare nella sintesi di protopectine, emicellulose e precursori della cellulosa che, per esocitosi,
sono riversate all’esterno del plasmalemma in modo da costituire lamella mediana e parete primaria.
Nelle cellule vegetali, tra i microcorpi (o microsomi) si possono distinguere perossisomi (soprattutto
nelle foglie) e gliossisomi (nei semi). Nelle cellule animali si riconoscono invece lisosomi e perossisomi.
I lisosomi, pressoché sferici (con diametro di 0,2-0,8µm) e delimitati da membrana (spessore circa 10nm)
provvista di ATPasi, confinano al loro interno, separandoli dal resto della cellula, enzimi idrolitici
(demolitori) impiegati per la degradazione di proteine, polisaccaridi e acidi nucleici. Nelle cellule animali
i lisosomi rivestono un ruolo importante di difesa della cellula da agenti esterni mediante l’eterofagia, ma
anche di rinnovo costante delle componenti molecolari proprie della cellula mediante l’autofagia. Per
certi aspetti anche il vacuolo delle cellule vegetali può essere considerato un compartimento lisosomiale I
perossisomi sono organuli sferici di piccolissime dimensioni (0,3-1,5µm), delimitati da membrana
(spessore circa 7nm) ed originati dal RE liscio. Sotto il profilo evolutivo, sono forse precursori dei
mitocondri, poiché effettuano reazioni di ossidazione. Queste portano alla formazione di H2O2, che è un
potente ossidante e in quanto tale necessita di essere segregato, ma non alla formazione di ATP. La
reazione è catalizzata dalle perossidasi ed è normalmente seguita dalla liberazione di ossigeno dall’H2O2,
catalizzata dalle catalasi:
RH2 + O2 → R + H2O2 perossidasi
2 H2O2 → 2 H2O + O2 catalasi
L’azione dei perossisomi può avvenire come meccanismo di detossificazione (per esempio nei confronti
di etanolo che è ossidato ad acetaldeide negli epatociti) ed appare particolarmente esaltata in condizioni di
stress (per esempio in casi di inquinamento). Inoltre nelle piante è anche associata al fenomeno della
fotorespirazione.
L’attività dei gliossisomi si rileva solo per un breve periodo, soprattutto nei semi in fase di germinazione:
essi sono implicati nel metabolismo dei grassi ed in particolare nel ciclo dell’acido gliossilico,
indispensabile tappa della conversione degli acidi grassi a zuccheri (attraverso la formazione di
acetilCoA, succinato, e PEP) da indirizzare all’embrione.
IL CITOSCHELETRO
All’interno della maggior parte delle cellule vi è un continuo flusso citoplasmatico; questo movimento, è
mediato dal citoscheletro, una complessa struttura che riveste ruoli importanti anche nel determinare e
mantenere la forma della cellula e nell’organizzare il citoplasma. Nel citoscheletro si distinguono
microtubuli, microfilamenti e filamenti intermedi: strutture di tipo polimerico soggette a cicli di
polimerizzazione e depolimerizzazione, che rappresentano altri “banchi di lavoro”, unitamente alle
endomembrane, ma anche i “nastri trasportatori” che collegano diversi “banchi” nella “fabbrica”
cellulare. Il citoscheletro appare collegato fisicamente ad alcuni siti del plasmalemma.
I microtubuli appaiono come lunghi tubicini, che, in sezione, presentano 13 subunità (negli eucarioti).
Ogni subunità è un protofilamento, cioè una serie impilata di dimeri di tubulina (coppie di molecole di αe β- tubulina, una proteina del p.m. di 55.000 con caratteri costanti in tutti gli eucarioti). I diametri esterno
ed interno del microtubulo sono rispettivamente 30 e 14 nm; la lunghezza varia enormemente e nelle
cellule vegetali sono state rilevate lunghezze da 0,3 a 3,5µm, ma persino di 1 cm. Nelle cellule animali i
microtubuli si irraggiano da una zona centrale vicino al nucleo, mentre nelle cellule vegetali sono disposti
alla periferia della cellula, in prossimità del plasmalemma. Vi sono diverse sostanze endogene ed esogene
capaci di legarsi alla tubulina: la colchicina (un alcaloide estratto dalle piante di colchico), gli ioni calcio
e magnesio, il glicerolo, il nucleotide GTP, ecc. L’assemblaggio dei microtubuli avviene per aggiunta di
dimeri di tubulina (polimerizzazione) con velocità straordinarie (diversi µm al minuto) che permettono
rapidi allungamenti; allo stesso modo può avvenire il disassemblaggio (smontaggio) tramite la sottrazione
di dimeri di tubulina (depolimerizzazione) che porta all’accorciamento. Si stabilisce pertanto un rapporto:
tubulina libera nel pool solubile ℑ tubulina legata ai microtubuli
La colchicina, legandosi alla tubulina libera in corrispondenza di una delle due estremità di ciascun
microtubulo, blocca l’assemblaggio dei microtubuli e addirittura ne provoca il disassemblaggio. In molti
casi le subunità di tubulina aggiunte ad una estremità provengono soprattutto dalla depolimerizzazione
dell’altra estremità tubulina, così che il microtubulo funziona da “nastro trasportatore”. Sono stati
proposti diversi modelli che spiegano assemblaggio e disassemblaggio dei microtubuli, alcuni dei quali
evidenziano il ruolo del GTP (e del corrispondente GDP), del Ca2+ e del Mg2+; la combinazione di elevate
concentrazioni di Mg2+ e basse concentrazioni di Ca2+ o la presenza di policationi, (come la polilisina e
gli istoni) promuovono la formazione dei microtubuli, così come la presenza di taxolo (un alcaloide
diterpenico). Il disassemblaggio è favorito da elevate concentrazioni di Ca2+, basse temperature, e
alcaloidi come colchicina, vinblastina, podofillotossina.
I microtubuli sono importantissimi nel trasporto sia veloce, sia lento di organuli da una zona all’altra della
cellula. Ciò può avvenire per l’esistenza di un “motore microtubulare” (proteico) che stabilisce il legame
temporaneo fra l’organulo ed uno o due microtubuli, processo catalizzato da ATPasi, ma è probabile che
esistano meccanismi diversi. I microtubuli “fissano” anche le direzioni secondo le quali avvengono i
trasporti delle vescicole provenienti dall’apparato di Golgi.
Uno dei ruoli importanti dei microtubuli è nel mantenimento della struttura cellulare; ciò può essere
evidenziato, per esempio, nel processo che porta alla differenziazione degli elementi delle trachee, dove i
microtubuli sono inizialmente disposti in modo casuale, ma finiscono per disporsi in senso perpendicolare
all’asse in corrispondenza delle fibrille di cellulosa (e della lignina) dell’elemento maturo. Nella cellula
vegetale è dimostrato che i microtubuli corticali (periferici) hanno un ruolo fondamentale nella corretta
disposizione della cellulosa nei diversi strati della parete.
Nel periodo interfasico (tra una divisione e l’altra), la cellula vegetale presenta i microtubuli con una
disposizione prevalentemente parallela, come un manicotto periferico, un poco all’interno rispetto al
plasmalemma; nel corso della divisione essi partecipano alla costituzione del fuso mitotico e,
successivamente del fragmoplasto.
Infine, i microtubuli sono responsabili, in alcune cellule, dei movimenti di ciglia e flagelli.
I microfilamenti (1-2 µm di lunghezza e 5-7 nm di diametro) sono costituiti essenzialmente da polimeri
di actina, una proteina globulare il cui monomero ha peso molecolare di 45.000; essi sono coinvolti in
funzioni strutturali e di movimento dell’intera cellula o di parti interne ad essa (flusso citoplasmatico).
Anche per i microfilamenti si verificano fenomeni di polimerizzazione e depolimerizzazione dipendenti
da ioni calcio e da numerose proteine regolatrici con cui l’actina interagisce. I microfilamenti di actina
rivestono particolare importanza nelle cellule muscolari degli animali, ma anche nelle cellule vegetali
hanno un ruolo importante nella ciclosi, cioè nella movimentazione degli organuli e delle vescicole.
I filamenti intermedi, con diametro compreso di 7-11 nm, possono essere di vario tipo; pur essendo
presenti anche nei vegetali, sono maggiormente conosciuti quelli delle cellule animali
Il citoscheletro è completato da un reticolo microtrabecolare costituito da una rete di filamenti proteici,
più densa in periferia (reticolo citoplasmatico) e nel nucleo (reticolo e lamina nucleare).
I RIBOSOMI
I ribosomi sono particelle ribonucleoproteiche, costituite da acido ribonucleico (rRNA) e proteine, del
diametro di circa 20-25 nm. Quelli del citoplasma degli eucarioti sono più grandi e sedimentano in
centrifugazione analitica a 80 S (Svedberg), mentre quelle dei procarioti, più piccoli, si sedimentano a 70
S, tuttavia nei mitocondri e nei cloroplasti delle cellule eucariotiche vi sono ribosomi 70S. I ribosomi
sono composti da due subunità diverse (L [large], maggiore, e S [small], minore,) assemblate. tale
assemblaggio è condizionato dalla presenza di ioni Mg2+; con basse concentrazioni di Mg2+ le due
subunità si separano. Negli eucarioti, l’unica molecola di RNA della subunità minore ha un coefficiente di
sedimentazione 18S ed ha dimensioni simili in tutti i vegetali ed animali; nella subunità maggiore ci sono
tre molecole di RNA (28S, 5,8S e 5S). Le proteine ribosomiali, globulari, sono fortemente basiche, perché
ricche di lisina, e sono rappresentate in media da 33 molecole nella subunità minore e 49 in quella
maggiore. I legami, di tipo ionico, che si instaurano tra rRNA e proteine ribosomiali non sono sufficienti
a neutralizzare la carica negativa globale. I ribosomi si presentano spesso collegati fra loro, in numero
variabile da due a dieci, per mezzo del filamento di RNA messaggero, che stanno “trascrivendo”; questi
ribosomi costituiscono i poliribosomi o polisomi.
La struttura tridimensionale dei ribosomi è particolare determinante per la loro funzione. Le catene di
rRNA sono fortemente ripiegate e con numerose basi appaiate; le interazioni tra proteine e molecole di
rRNA sono fortemente specifiche (proteine che si uniscono all’rRNA della subunità minore non possono
legarsi a quello della subunità maggiore e viceversa); l’assemblaggio delle proteine e dell’rRNA avviene
secondo una sequenza determinata. La genesi dei ribosomi avviene tramite la sintesi di rRNA e il loro
assemblaggio con proteine in quella zona del nucleo definita nucleolo; i geni che codificano gli rRNA 18,
5,8 e 28 S sono disposti in sequenza sullo stesso filamento di DNA, mentre il gene 5S è sul DNA di un
altro cromosoma; tutti questi geni sono fortemente ripetuti e costituiscono il DNA ribosomiale. Le
proteine ribosomiali sono sintetizzate nel citoplasma, assunte selettivamente nel nucleo ed indirizzate
verso il nucleolo. La sintesi di rRNA e di proteine ribosomiali avviene in misura tale che non si riscontri
eccesso di una delle due categorie. L’assemblaggio di rRNA e proteine avviene inizialmente nel nucleo;
successivamente i ribosomi immaturi sono esportati nel citoplasma dove vengono completati con
l’aggiunta delle ultime proteine. Le cellule “fabbricano” continuamente ribosomi in grandi quantità,
soprattutto in rapproto alle loro esigenze metaboliche. In qualche caso, quando è prevedibile una sintesi
proteica estremamente elevata, il nucleo è in grado di “prepararsi” amplificando selettivamente i geni
ribosomiali (moltiplicando il DNA ribosomiale ed il numero dei nucleoli).
In base alla localizzazione ed alla funzione, i ribosomi possono essere distinti in:
• ribosomi citoplasmatici che sintetizzano alcune proteine dei plastidi e dei mitocondri (non codificate
dal DNA dell’organello), proteine destinate al nucleo e ai microcorpi, proteine destinate alla
superficie interna del plasmalemma e proteine che resteranno nel citoplasma
• ribosomi legati al RE che sintetizzano proteine destinate alla secrezione, proteine di membrana,
proteine che restano nel RE, nei lisosomi e nell’apparato di Golgi
• ribosomi dei mitocondri e dei plastidi che sintetizzano proteine codificate dal DNA di questi organuli.
La funzione è in definitiva la medesima: facilitare la traduzione dell’RNA messaggero attraverso tre
tappe: inizio, traslocazione e terminazione.
L’inizio avviene con la formazione, sulla subunità minore del ribosoma, del complesso derivante dal
tRNA iniziatore col proprio aminoacido (metionina) e il corrispondente codone (AUG) sull’mRNA; a
questo segue l’associazione della subunità maggiore.
La traslocazione si realizza con il movimento del ribosoma sull’mRNA (in direzione 5’→3’) in modo da
coinvolgere il secondo codone di quest’ultimo, sul quale si dispone il corrispondente tRNA col proprio
aminoacido; segue la formazione del legame peptidico fra gli aminoacidi del primo e del secondo tRNA e
il rilascio del primo di questi; la traslocazione si ripete con altri scorrimenti e interventi di altri tRNA sino
ad un codone di terminazione (tripletta Stop).
La terminazione avviene con il rilascio delle due subunità ribosomiali, dell’mRNA e della proteina
sintetizzata.
L’intero processo avviene con consumo di ATP e GTP e grazie all’intervento di fattori proteici, alcuni dei
quali localizzati sul ribosoma. Se, durante la traslocazione, il tRNA pervenuto al ribosoma non
corrisponde al codone in lettura al momento e non si possono stabilire legami idrogeno corretti fra le paia
di basi, il tRNA “sbagliato” fuoriesce dal ribosoma; tuttavia sono possibili errori (nei procarioti con una
frequenza media di 1 su 2.500 aminoacidi). Sul ribosoma si identificano con sicurezza due siti di legame
del tRNA al ribosoma: uno per ogni tRNA che appaiandosi permettono di trasferire il legame esistente tra
tRNA e aminoacido fra i due aminoacidi della costituenda catena polipetidica. Alcuni autori identificano
anche un terzo e/o un quarto sito, con funzioni non ancora ben definite. In media, la lettura di un
filamento di mRNA da parte di un ribosoma avviene nell’arco di 1-2 minuti, tempo medio corrispondente
di sintesi di una proteina.
L’attività dei ribosomi è inibita da diversi antibiotici che possono bloccare uno o più passaggi della sintesi
proteica; molti antibiotici sono specifici per i ribosomi di organismi procariotici.
IL NUCLEO
Il nucleo è considerato il centro di controllo e di organizzazione delle attività cellulari, ma in realtà il
controllo risiede negli acidi nucleici. Esso è presente in tutte le cellule eucariotiche metabolicamente
attive (vive), tranne i casi degli eritrociti maturi (globuli rossi) e degli elementi dei tubi cribrosi (nel
floema); questi ultimi, tuttavia dipendono strettamente per la sopravvivenza da cellule compagne nucleate
adiacenti. Negli eucarioti, il nucleo determina sia la sopravvivenza, sia l’attività del citoplasma specifica
della cellula in cui risiede.
La necessità del nucleo, inteso come compartimento separato dal citosol, deriva dal fatto che numerosi
ioni presenti nel citoplasma potrebbero alterare il DNA, così come diverse proteine citoplasmatiche
potrebbero legarsi al DNA modificandolo in modo irreparabile.
Nella cellula vegetale, il nucleo è localizzato di solito alla periferia, come gli altri organuli, a causa del
particolare sviluppo del vacuolo; nel caso di cellule allungate, come i peli radicali, è disposto all’estremità
in accrescimento, dove vi è maggiore esigenza di sintesi. E’ solitamente uno per cellula, ma vi sono casi
di cellule o derivati cellulari plurinucleati (le ife a dicarion, con due nuclei, dei funghi e gli apocizi e
sincizi dei tessuti laticiferi). Ha un diametro variabile da pochi µm sino a 0,6 mm.
Il nucleo è costituito da: involucro nucleare, carioplasma (nucleoplasma), cromatina, matrice nucleare,
uno o più nucleoli.
L’involucro nucleare è costituito da due membrane (ciascuna con spessore di 6,5nm) separate da uno
spazio di 10-30nm. La superficie dell’involucro rivolta verso il nucleoplasma è rivestita da uno strato
proteico fibroso più o meno denso dello spessore di circa 100nm, la lamina nucleare, probabilmente
derivante da filamenti intermedi del citoscheletro. Si suppone che tale lamina rivesta un ruolo nel “legare”
la cromatina all’involucro. La superficie della membrana esterna rivolta verso il citosol è cosparsa di
ribosomi, talora in intensa attività di sintesi. Lo spazio intermembrana (perinucleare) è in continuità col
lume del reticolo endoplasmatico ruvido; in definitiva l’involucro nucleare potrebbe essere inteso come se
fosse costituito dal RE. La continuità tra involucro nucleare e RE e tra RE di cellule adiacenti, mediante i
plasmodesmi, permette la comunicazione fra nuclei di cellule diverse e la sincronizzazione di alcuni
eventi. L’involucro nucleare è cosparso di numerose aperture, i pori nucleari; essi hanno una densità
variabile, ma in media occupano circa il 5% della superficie. La struttura dei pori è complessa; il bordo
(anello) è rialzato e presenta 8 “granuli del complesso del poro”; questi si collegano ad un granulo
centrale tramite una spicola o filamento radiale; i granuli sono costituiti essenzialmente da RNA ed il
granulo centrale potrebbe rappresentare RNA o particelle ribonucleoproteiche nell’atto di uscire dal
nucleo. Il diametro esterno di ciascun poro è di circa 100 nm. L’involucro nucleare si dissolve durante la
mitosi.
Il nucleoplasma contiene DNA, proteine e RNA in rapporto di massa 1:3:0,5. Il DNA è il principale
costituente della cromatina, la quale deriva il proprio nome dall’intensa colorabilità con coloranti
specifici per gli acidi nucleici. Nella cromatina, il DNA è associato ad istoni, proteine basiche, ricche di
lisina o arginina, con carica positiva, che “tamponano” l’acidità del DNA stesso. Altre proteine non
istoniche sono presenti nel nucleoplasma ed alcune di esse hanno il compito di “compattare” il DNA.
Nella maggior parte dei casi, la lunghezza notevole del DNA porta alla necessità di un suo
compattamento all’interno del nucleo: ciò viene attuato grazie alla particolare configurazione della
cromatina. Se isolata e distesa, la cromatina presenta granuli collegati fra loro da un sottile filo: i granuli,
definiti nucleosomi. I nucleosomi costituiscono il primo stadio di compattamento del DNA: ognuno di
essi è costituito da 4 coppie di istoni diversi sulle quali è avvolto il DNA (come un filo su un rocchetto)
ed è collegato, a distanza costante, ad un altro nucleosoma tramite un tratto di DNA (DNAlinker),
offrendo un aspetto simile ad una “collana di perle”. Il DNA è associato agli istoni elettrostaticamente
come un polianione ad un policatione. La configurazione del nucleosoma ostacola la trascrizione del
tratto di DNA interessato, pertanto dal nucleosoma si scioglie di volta in volta, per un breve momento,
quel tratto di DNA interessato alla trascrizione. Lo spessore del filamento o fibrilla di cromatina distesa è
di circa 11 nm, ma nel ciclo cellulare si susseguono avvenimenti che portano ad un maggior
compattamento della cromatina sino ad arrivare alla formazione dei cromosomi metafasici (che
rappresentano la forma di trasporto della cromatina): i nucleosomi si addensano così che lo spessore
raggiunge i 30 nm, poi i filamenti di DNA ed istoni si ripiegano e si avvolgono più volte passando a stadi
di spessore progressivamente maggiore (300, 700 ed infine 1400 nm). I cromosomi appaiono come
strutture a bastoncello, nelle quali si distinguono i cromatidi appaiati, i bracci, il centromero ed eventuali
satelliti.
La matrice nucleare è rappresentata da un reticolo di fibrille, una intelaiatura che mantiene la forma del
nucleo; essa contiene circa il 20% delle proteine nucleari, ma non gli istoni. Alla matrice nucleare è
attaccato gran parte del DNA nucleare, che è normalmente organizzato in anse (loops) durante la
trascrizione. La matrice nucleare ha pertanto un ruolo importante nella regolazione della trascrizione, e
della replicazione, esercitato, forse, attraverso particolari siti di collegamento col DNA (MARS).
Il nucleolo è la massima espressione dell’organizzazione del nucleo; si tratta di un dominio specializzato,
non delimitato da membrana, ma strutturalmente distinto dal resto del nucleo, associato ad una regione
specifica dei cromosomi (organizzatore nucleolare) comprendente le sequenze di DNA che codificano gli
rRNA. Ogni nucleolo ha un diametro di 0,5-4 µm; in ogni nucleo vi possono essere uno o più nucleoli ed
il volume totale dei nucleoli è spesso maggiore nelle cellule con maggiore attività di sintesi proteica.
Durante le fasi della mitosi, il nucleolo non è visibile. Spesso i nucleoli sono disposti in prossimità
dell’involucro nucleare, una posizione strategica per facilitare il passaggio nel citosol delle particelle
ribonucleoproteiche. Nel nucleolo si distingue una componente granulare con particelle di 15-20 nm e una
componente fibrillare; si suppone anche che il nucleolo sia provvisto di uno scheletro d’ancoraggio
costituito da proteine residenti (non ribosomiali). La composizione del nucleolo è fortemente proteica da
75 a 90%. Al microscopio elettronico si osservano fibre brevi attaccate a fibre lunghe con una
disposizione simile a “scovolini” che rappresentano rispettivamente filamenti di rRNA attaccati al tratto
“ribosomiale” del DNA.
GLI ORGANULI
Gli organuli sono compartimenti cellulari delimitati da membrane singole o doppie, che separano le
diverse fasi plasmatiche;
a) essi permettono di confinare reazioni chimiche che avvengono contemporaneamente alle reazioni
(anche antagoniste) svolte nel citosol,
b) aumentano la superficie delle membrane specializzate (per esempio per il trasporto di e- e
segregazione di H+ nei mitocondri e nei cloroplasti) costituendo un indubbio vantaggio (rispetto al
rapporto volume/superficie di scambio).
Gli organuli principali sono mitocondri e plastidi.
I MITOCONDRI
I mitocondri hanno una forma variabile, da allungata a quasi sferica, di 0,5-1 x 1-4 µm, delimitati da due
membrane che evidenziano tra loro uno spazio intermembrana, e circondano una camera interna occupata
dalla matrice mitocondriale. Le due membrane hanno costituzione e permeabilità selettiva differente.
Quella esterna presenta lipidi insaturi ed è relativamente rigida; ha proteine che formano pori acquosi,
liberamente permeabili da piccole molecole (<10kDa), ed enzimi che agiscono su substrati lipidici
ricavandone forme da destinare alla matrice. La membrana interna, particolarmente ricca di cardiolipina,
ha una superficie enormemente sviluppata grazie alla presenza di estroflessioni rivolte verso la matrice, le
creste mitocondriali (in alcune specie tubuli); la presenza di grassi insaturi la rende più fluida e le
permette di partecipare a cicli di espansione e contrazione. Essa è altamente selettiva, è impermeabile alla
maggior parte degli ioni più piccoli e non può essere attraversata da molecole se non grazie a proteine
specifiche di trasporto; presenta le ATPasi, sporgenti verso la matrice, che “pompano ioni H+, ed i
trasportatori di elettroni che attuano la fosforilazione ossidativa (ultima tappa della respirazione). Lo
spessore di ogni membrana è 10 nm, quello dello spazio intermembrana, occupato da fluido simile al
citosol, è di 8 nm. Nella matrice mitocondriale si ritrova una miscela di numerosi enzimi, che effettuano
l’ossidazione del piruvato, il ciclo dell’acido citrico, tappa intermedia della respirazione, partecipano alla
degradazione degli acidi grassi; inoltre sono presenti ribosomi 70S, tRNA, diverse copie di DNA
circolare che codifica parte delle proteine utilizzate dai mitocondri.
I mitocondri sono più numerosi nelle cellule con intenso lavoro metabolico; sono parzialmente autonomi
ed in grado di dividersi per scissione. Essi modificano regolarmente la propria forma e si muovono
all’interno della cellula. Durante la riproduzione, nella maggior parte dei casi, essi sono trasmessi alla
prole per via materna.
Alcuni caratteri dei mitocondri (doppia membrana, ribosomi 70S, DNA circolare, duplicazione per
scissione) portano ad un collegamento evolutivo con le cellule procariotiche e depongono a favore di una
ipotetica antica origine simbiontica, tuttavia esistono anche evidenze a sfavore di questa ipotesi (presenza
di introni nel DNA
PLASTIDI
I plastidi sono organuli esclusivi della cellula vegetale, con una zona centrale (stroma) delimitata da
doppia membrana, specializzati in funzioni differenti, situati nel citoplasma; i plastidi maggiormente
specializzati sono i cloroplasti. Questi hanno caratteri comuni con i mitocondri (doppia membrana,
sviluppo eccezionale della superficie interna di membrana, ribosomi 70S, DNA e RNA, capacità di
dividersi per scissione e di essere trasmessi al momento della divisione) e pure per essi è stata ipotizzata
un’origine simbiontica.
Esistono diversi tipi di plastidi per forma e funzioni, tuttavia essi derivano tutti dai proplastidi e in
differenti condizioni possono modificarsi da un tipo all’altro. Essi possono essere classificati nel modo
seguente:
•
proplastidi (plastidi immaturi)
•
plastidi pigmentati
• fotosintetizzanti
• cloroplasti
• rodoplasti
• feoplasti
• non fotosintetizzanti
• cromoplasti
plastidi non pigmentati (leucoplasti)
• amiloplasti
• elaioplasti
• proteoplasti
•
•
ezioplasti (plastidi anomali)
Esistono rapporti strettissimi fra i diversi tipi di plastidi; tutti possono formare pigmenti ed amido. Le
modificazioni da una classe all’altra sono determinate da fattori genetici, da fattori ambientali (in
particolare presenza o meno di luce, disponibilità di sali), da variazioni interne all’organismo
(maturazione dei frutti, caduta delle foglie, ecc.). Il tipo di plastidio è collegato anche alla localizzazione
nell’ambito della pianta: in parti superficiali esposte alla luce (foglie) prevalgono i cloroplasti, in parti più
interne (radici, fusto) prevalgono gli amiloplasti. L’insieme dei plastidi di una pianta è definito
plastidioma.
I proplastidi sono piccoli organuli scarsamente differenziati di 0,5-1 µm, presenti nelle cellule
meristematiche; rappresentano i precursori di tutti i plastidi. Sono già presenti nei gameti, ma in
particolare, nelle piante più evolute con gameti maschili ridotti, sono trasmessi solo dai gameti femminili,
che hanno dimensioni atte a contenerli. Lo stroma è privo di strutture lamellari, contengono
protoclorofilla (precursore della clorofilla), DNA, RNA e ribosomi 70S; sono in grado di svolgere la
sintesi proteica necessaria ad evolvere nei plastidi più evoluti.
I cloroplasti sono specializzati per la fotosintesi; forma, dimensioni e numero sono molto variabili a
seconda del gruppo sistematico. Le alghe verdi ne hanno pochi o addirittura uno solo per cellula, il tessuto
a palizzata delle piante superiori anche un centinaio. Nei vegetali inferiori, quando il cloroplasto è unico,
esso è particolarmente grande (100 µm); nelle piante superiori la media è 2-3 x 4-6 µm. Forma e
dimensioni sono pressoché costanti ed ereditarie; nelle cellule poliploidi i cloroplasti hanno dimensioni
maggiori. Il numero dei cloroplasti in una pianta è notevole; per esempio è stato calcolato che in una
foglia di ricino sono presenti circa 400.000 cloroplasti per mm3. La forma dei cloroplasti nelle alghe può
variare da quella a stella, a coppa, a spirale, a nastro, a reticolo, ecc.; nelle piante superiori è a disco o
lenticolare. La localizzazione all’interno della cellula non è casuale: sono per lo più addossati alla parete
nei punti dove vi sono spazi intercellulari che facilitano scambi gassosi; correnti citoplasmatiche
movimentano i cloroplasti che possono essere orientati rispetto alla fonte di luce, grazie al citoscheletro.
La struttura dei cloroplasti è complessa: la duplice membrana, che forma uno spazio intermembrana di
circa 3 nm, circonda lo stroma particolarmente ricco d’enzimi, nel quale si evidenzia un sistema lamellare
costituito da membrane, chiamate tilacoidi. La membrana esterna ha una componente lipidica maggiore
ed è relativamente permeabile, mentre quella interna svolge un particolare ruolo selettivo e presenta
proteine di trasporto; le due membrane sono tra le più ricche di lipidi in assoluto ed in particolare
abbondano di glicolipidi. Questo involucro esterno dei cloroplasti presenta anche enzimi, come la nitrato
reduttasi che partecipazione al metabolismo dell’azoto.
Lo stroma ha aspetto granulare, con granuli di amido primario, plastoglobuli (goccioline lipidiche),
enzimi deputati allo svolgimento della fase oscura della fotosintesi (ma anche per la sintesi di acidi grassi,
acidi nucleici, riduzione del solfato, ecc.), DNA, RNA, ribosomi 70S.
Il sistema lamellare è probabilmente derivato dalla membrana interna per invaginazioni che hanno dato
origine a sacculi o cisterne chiuse appiattite, i tilacoidi, in parte impilate le une sulle altre; le pile di
cisterne o sacculi sono definite grana (ogni pila è un granum), sono formate da tilacoidi granari e
collegate fra loro da tilacoidi intergrana o stromatici. Ogni granum è costituito da 2 a 200 tilacoidi
impilati ed ha un diametro di 0,3-1 µm, ma si tratta di un sistema dinamico con variazioni continue di
formazione e disaggregazione dei grana. Esistono alcune eccezioni (certe piante tropicali C4) nelle quali
mancano i grana. Le membrane tilacoidali amplificano enormemente la superficie di scambio e
delimitano uno spazio interno, il lumen tilacoidale o spazio intratilacoidale. Esse partecipano alla fase
luminosa e sono fortemente specializzate, con il 50% di lipidi (per la maggior parte glicolipidi insaturi) e
50% di proteine. Le membrane tilacoidali sono configurate in un modo peculiare: le porzioni intergrana
presentano ATPasi che esporta H+ dal lumen (con pH5) allo stroma (con pH 8), pigmenti accessori, il
complesso proteico del fotosistema I con clorofilla a e la catena di trasporto del citocromo b6f, mentre
sulle porzioni granari sono localizzati pigmenti accessori e il complesso proteico del fotosistema II con
clorofilla a. La disposizione delle molecole proteiche e dei pigmenti sulle membrane è visibili con
tecniche di criodecappaggio. I pigmenti sono rappresentati prevalentemente da clorofilla a (75%),
clorofilla b (25%), carotenoidi e derivati (xantofille, luteina); nelle alghe rosse i rodoplasti (corrispondenti
dei cloroplasti) hanno clorofilla a, clorofilla d, carotenoidi e ficoeritrina; nelle alghe brune i feoplasti
contengono clorofilla a, clorofilla c e fucoxantina.
Gli amiloplasti sono i leucoplasti più diffusi. Localizzati nei tessuti profondi (soprattutto in parenchimi di
riserva), non presentano pigmenti, ma amido secondario derivante dagli zuccheri solubili allontanati dai
luoghi di fotosintesi verso luoghi di deposito. Hanno l’aspetto di granuli, nei quali l’amido è cristallizzato
attorno ad uno o più punti di accrescimento (ilo). La forma dei granuli è una caratteristica costante per
ogni specie e rappresenta un carattere di importanza merceologica per il riconoscimento di farine o altri
derivati vegetali. Si distinguono amiloplasti semplici e composti (aggregati di granuli più piccoli); alcuni,
come quelli della patata, si presentano con una struttura sferocristallina, con tanti “aghi” d’amido disposti
in senso radiale, in zone concentriche d’accrescimento (discontinuità nelle fasi d’accumulo), attorno
all’ilo. Al microscopio, con luce polarizzata, gli amiloplasti offrono un’immagine con una tipica croce di
malta nera. Gli amiloplasti con il loro contenuto glucidico rappresentano la maggior fonte alimentare
dell’uomo.
Un ruolo particolare è rivestito dagli amiloplasti presenti nella cuffia radicale, all’interno di vescicole
chiamate statoliti; questi sedimentando, per il loro peso, alla base delle cellule permettono alla pianta la
percezione della gravità e il conseguente geotropismo positivo della radice.
Gli amiloplasti in condizioni di luce possono modificarsi in cloroplasti; un esempio è l’inverdimento dei
tuberi di patata.
Gli elaioplasti si differenziano per il contenuto lipidico e sono particolarmente abbondanti nei parenchimi
dei frutti di alcune specie oleifere.
I proteoplasti o granuli di aleurone o corpi proteici (protein bodies) sono incolori e contengono proteine
per lo più cristallizzate; essi presentano all’interno o sulla superficie di una massa proteica una o più
piccole masse differenziate di forma poliedrica (cristalloidi) o arrotondata (globoidi). In corrispondenza di
questi si ritrovano sali dell’acido fitico particolarmente ricchi di elementi nutritivi inorganici. Essi sono
localizzati maggiormente nei tessuti di riserva dei semi; la membrana che li riveste deriva dal tonoplasto;
in seguito alla germinazione le loro riserve vengono utilizzate e destinate all’embrione.
I cromoplasti sono plastidi pigmentati ricchi di carotenoidi con funzione prevalentemente vessillifera nei
fiori e nei frutti (per l’attrazione di pronubi atti alla impollinazione e alla dispersione) o con funzioni non
del tutto note in altri organi (per esempio nelle carote). La presenza di cromoplasti nei vegetali di
interesse alimentare ha assunto particolare rilevanza negli ultimi anni per la funzione antiossidante di
molti pigmenti. Hanno forma tendenzialmente sferoidale o allungata o ricalcante la l’aspetto cristallizzato
dei pigmenti. Presentano inoltre uno stroma con vescicole e lamelle o tubuli scarsamente organizzati, che
in diversi casi derivano dalla disgregazione dei tilacoidi dei cloroplasti, dei quali i cromoplasti possono
rappresentare lo stadio senescente (per esempio all’inizio della stagione sfavorevole); anche la
componente lipidica è elevata e può derivare anch’essa dalla disgregazione delle membrane.
Gli ezioplasti sono plastidi anomali che si ritrovano quando la differenziazione da proplastidi a
cloroplasti è interrotta per sopravvenuta mancanza di luce. Si tratta di un processo, definito eziolamento,
presnte in natura in alcuni embrioni, ma che può anche essere indotto artificialmente per vantaggi
commerciali, dal momento che alcune piante eziolate presentano caratteristiche organolettiche pregiate
(per esempio nei cardi, sedani, finocchi, lattughe). Il fenomeno può essere interrotto allorché è disponibile
nuovamente la luce; in questo caso dagli ezioplasti si riprende il differenziamento verso i cloroplasti. Gli
ezioplasti sono caratterizzati da corpi prolamellari, tubuliformi semicristallini ( con celle disposte in
reticolo cubico o esagonale) che originano i tilacoidi alla ripresa della luce. Negli ezioplasti è bloccata la
trasformazione da protoclorofilla a clorofilla (la prima manca di 2 atomi di H nell’anello porifirinico)
perché la riduzione con acquisizione dell’H mancante è l’unica tappa di sintesi della clorofilla che
necessita di luce. In alcuni ezioplasti si ritrovano accumuli di fitoferritina con funzioni di riserva di ferro.
In alcune specie gli ezioplasti si formano nel giro di pochi minuti dall’arresto della disponibilità di luce,
mentre in altre occorrono giorni.
proplastidi
cloroplasti
buio
ezioplasti
LA PARETE
amilopasti
cromoplasti
La parete cellulare negli eucarioti è esclusiva di funghi e vegetali; solo alcune alghe flagellate, i
mixomiceti ed i gameti e le zoospore di molte alghe e funghi ne sono privi. I costituenti chimici della
parete sono sintetizzati nel citoplasma e trasferiti all’esterno del plasmalemma: la parete rappresenta
perciò un prodotto del citoplasma e non una parte di esso. Essa viene definita anche come matrice
extracellulare, al pari di strati esterni della cellula animale costituiti da collagene, elastina, fibrillina,
proteoglicani, ecc., ma differisce enormemente da questi nella composizione chimica, nella struttura e
nelle funzioni.
Le funzioni della parete sono essenzialmente:
• morfogenetica (strutturale) in quanto costituisce uno scheletro rigido dei vegetali,
• protettiva, come barriera difensiva nei confronti di agenti esterni
• limitazione dell’espansione cellulare e contributo al mantenimento del turgore cellulare (esercitando
una resistenza alla pressione esercitata verso l’esterno dal vacuolo)
• riserva di carboidrati
• assorbimento selettivo e attività enzimatiche (funzioni ancora poco conosciute e non del tutto
accertate)
Il modello generale della parete comprende, dall’esterno verso l’interno della cellula diversi strati:
• lamella mediana
• parete primaria
• parete secondaria
La genesi della parete inizia ancora quando una cellula non ha completato la citodieresi (ultima tappa
della divisione); pertanto i costituenti iniziali della parete derivano dalla sintesi o dal riutilizzo di sostanze
presenti nella cellula madre, quando ancora le cellule figlie non sono completamente distinte. queste
sostanze, elaborate dall’apparato del Golgi, vengono convogliate in vescicole, grazie al citoscheletro
verso il setto divisorio del fragmoplasto.
La lamella mediana inizia a formarsi nell’anafase con la costituzione del fragmoplasto ed è costituita
prevalentemente da pectine, cioè da lunghe catene di acido poligalatturonico con corte catene laterali
formate prevalentemente da zucheri quali ramnosio, galattosio, arabinosio. Legami ionici determinano
una configurazione di fitta rete tridimensionale; si tratta di legami deboli che permettono facilmente
modificazioni della struttura, così che la lamella mediana ha un aspetto di gel plastico, amorfo, con forte
potere “cementante”. La lamella mediana è costituita anche da emicellulose e glicoproteine. Tutti i
costituenti, provenendo dall’apparato di Golgi si depositano sul fragmoplasto dalla zona centrale di
questo verso la periferia con direzione centrifuga. Lo spessore della lamella mediana è di 0,1µm (ma varia
molto in dipendenza del suo grado di rigonfiamento); essa costituisce una strato comune fra due cellule
adiacenti, tenendole fortemente unite, ma non rappresenta un isolamento totale per ciascuna cellula
poiché presenta soluzioni d continuità di circa 1µm, attraverso le quali passano i plasmodesmi. Queste
discontinuità, punteggiature, si formano a causa dell’ingabbiamento, nella placca cellulare (derivante dal
fragmolasto ispessito), di microtubuli e tratti del RE. La degradazione della lamella mediana isola le
cellule le une dalle altre, disgregando i tessuti: ciò è quanto avviene durante la maturazione di certi frutti.
Negli ultimi anni alla lamella mediana è stato attribuito anche un ruolo metabolico.
La parete primaria ha uno spessore di 0,1-3µm ed è costituita per 10-15% di cellulosa, 20% di pectine,
emicellulose e glicoproteine, 5% di lipidi ed enzimi; il resto (circa 60%) è acqua. Nei funghi la cellulosa è
sostituita dalla micosina. La costituzione della parete primaria inizia a carico della cellula madre ed è
completata dalle cellule figlie; i suoi componenti, provenendo dall’apparato di Golgi si depositano sulla
placca cellulare dalla periferia verso la zona centrale (direzione centripeta). Le fibrille di cellulosa hanno
una tessitura dispersa e si associano fra loro in modo reversibile legandosi nei siti di incrocio (punti di
aderenza) probabilmente grazie a proteine di parete. L’integrità e la stabilità della parete è mantenuta da
ioni calcio e da un corretto pH. L’aumento dei protoni provoca l’acidificazione della parete e permette la
distensione della parete stessa. Anche la parete primaria presenta soluzioni di continuità, punteggiature, in
corrispondenza di quelle della lamella mediana.
Lamella mediana e parete primaria sono presenti in tutte le cellule vegetali, la parete secondaria si forma
solo dopo che è cessato l’accrescimento cellulare in cellule differenziate, come strato più interno. La
funzione principale della parete secondaria è soprattutto meccanica ed è particolarmente sviluppata nelle
cellule dei tessuti di sostegno e di conduzione. Essa ha uno spessore >4-5 µm ed è costituita
essenzialmente di cellulosa disposta in modo compatto con tessitura parallela in tre strati (S1, S2, S3);
l’orientamento delle fibrille di cellulosa di ciascun strato è perpendicolare a quello nello strato adiacente.
In tale orientamento sono coinvolti i microtubuli. Soluzioni di continuità della parete secondaria
completano le punteggiature in corrispondenza delle discontinuità degli altri strati della parete. Ogni
punteggiatura può presentare più porocanali, che rappresentano le vie di passaggio dei plasmodesmi e
permettono la continuità del simplasto. Si distinguono punteggiature semplici e punteggiature areolate: in
queste ultime la parete secondaria costituisce un bordo anulare ispessito e rialzato. In queste
punteggiature, particolarmente diffuse nelle tracheidi delle gimnosperme, la porzione centrale
dell’apertura (poro) è parzialmente occupata da un ispessimento lenticolare che può funzionare da
valvola.
La parete primaria si accresce per distensione permettendo l’accrescimento della cellula, mentre la parete
secondaria si accresce nel senso dello spessore rinforzando la struttura dell’intera cellula e nel complesso
dell’intero organismo. Ciò si verifica per l’apporto di nuove fibrille di cellulosa; precursori della cellulosa
sono probabilmente sintetizzati nell’apparato di Golgi ed esportati in vescicole all’esterno (per esocitosi),
ma il completamento della molecola avviene nella parete stessa con meccanismi non chiariti.
Il modello comune di parete conferisce elevata resistenza, ma anche flessibilità, tuttavia molte cellule
necessitano di maggiore rigidità o impermeabilità; in questi casi la parete può subire modificazioni.
Queste sono realizzate secondo due meccanismi alternativi: impregnazione (deposito di sostanze negli
spazi tra le fibrille di cellulosa) ed incrostazione (deposito di sostanze tra gli strati di cellulosa).
Le principali modificazioni della parete sono:
• lignificazione (deposito di lignina per impregnazione a partire dalla lamella mediana verso la parete
primaria e secondaria)
• suberificazione (deposito di suberina per incrostazione, soprattutto nella parete secondaria, che
favorisce la difesa e l’impermeabilizzazione)
• cutinizzazione (deposito di cutina, per impregnazione e/o per incrostazione, che favorisce la difesa e
l’impermeabilizzazione)
• cerificazione (deposito di cere, frequentemente associate alla cutina, come nel caso della pruina sugli
acini d’uva o della sporopollenina nel polline)
• mineralizzazione (deposito di silice, carbonato di calcio, ossalato di calcio, o altri minerali per
impregnazione e/o incrostazione)
• gelificazione (deposito per incrostazione di mucillagini e/o gomme, altamente idrofile che possono
facilitare una funzione di adsorbimento e riserva idrica della parete; frequenti in piante adattate ad
ambienti aridi e in semi)
• pigmentazione (deposito di pigmenti diversi).
Le modificazioni interessano soprattutto la parete secondaria nel caso d’incrostazione, ma anche lamella
mediana e parete primaria, soprattutto nel caso di impregnazione.
Molte di queste modificazione, se estese a tutta la parete, portano alla morte della cellula, che tuttavia,
proprio con la parete permanente dopo la morte, continua a svolgere la sua funzione: è il caso del
sughero, del legno, dello sclerenchima.
IL VACUOLO
Il vacuolo non è un vero e proprio organulo, ma un compartimento della cellula vegetale, rappresentato da
una cisterna tondeggiante ripiena di un succo vacuolare e delimitata da una membrana, chiamata
tonoplasto. Nelle cellule giovani i vacuoli sono piccoli e numerosi, mentre nel corso del differenziamento
il numero diminuisce e nella cellula adulta vi è, nella maggior parte dei casi, un unico grosso vacuolo, che
occupa 80-90% del volume cellulare. Il complesso dei vacuoli costituisce il vacuoma.
Le ipotesi sulla genesi del vacuolo sono diverse: dalla semplice idratazione di zone del citoplasma alla
degenerazione di organuli, ad invaginazioni del plasmalemma. Le ipotesi più accreditate attualmente sono
due e consistono (1) nell’ingrandimento e successivo distacco di vescicole del reticolo endoplasmatico o
dell’apparato di Golgi, (2) nella formazione ed evoluzione di strutture particolari, chiamate GERL (GolgiEndoplasmic Reticulum Layer), derivanti dalla fusione di RE e apparato di Golgi. Dai GERL
deriverebbero provacuoli che ingabbiandosi, avvolgerebbero porzioni di citoplasma; successivamente si
formerebbe un vacuolo lisosomiale nel quale la membrana interna e il citoplasma ingabbiato sarebbero
digeriti; infine i piccoli vacuoli derivati si fonderebbero fra loro. Nei semi esiste una relazione tra vacuolo
e corpi proteici; pare che la smobilitazione delle riserve proteiche porti all’utilizzo delle membrane dei
corpi proteici per la formazione del vacuolo, mentre, al contrario, durante la formazione del seme, il
vacuolo si suddivide in numerosi corpi proteici.
Le funzioni del vacuolo sono molteplici:
ridurre il volume metabolicamente attivo rendendo più favorevole alla vita della cellula il rapporto
superficie/volume.
• risolvere il problema della estrusione di metaboliti
• segregare prodotti secondari o di rifiuto
• risolvere problemi meccanici, contribuendo al turgore cellulare
• accantonare sostanze di riserva e nutrienti
Il contributo del vacuolo al turgore cellulare deriva principalmente dalle proprietà osmotiche delle
sostanze contenute nel succo vacuolare che richiamando acqua favoriscono un aumento della pressione
rivolta verso l’esterno, bilanciata dalla resistenza opposta dalla parete. Nel caso in cui la soluzione esterna
alla cellula abbia concentrazioni di soluti maggiori di quelle del vacuolo (ambiente ipertonico), l’acqua,
anziché entrare, esce. Ciò provoca la diminuzione della pressione di turgore esercitata verso l’esterno, il
collassamento del vacuolo e il distacco del citoplasma dalla parete: questo fenomeno si chiama plasmolisi
ed entro certi limiti può essere reversibile (appassimento), ma oltre una soglia è irreversibile
(avvizzimento) e porta alla morte della cellula. La variazione delle condizioni di turgore, determinate dal
tenore idrico del vacuolo, è importante anche in diversi movimenti delle foglie e nella regolazione degli
stomi.
La presenza di enzimi idrolitici nel vacuolo permette la decomposizione di macromolecole garantendo il
turnover continuo dei componenti cellulari.
L’accumulo dei prodotti di riserva nel vacuolo è generalmente reversibile e spesso si alternano fasi di
accumulo e fasi di utilizzo.
Il tonoplasto presenta la struttura lipoproteica tipica delle membrane, con una ATPasi che pompa protoni
nella fase acquosa del vacuolo e determina l’abbassamento del pH del succo vacuolare intorno a 4-5.
Il succo vacuolare varia nella sua composizione in modo considerevole, in rapporto alla specie, al tipo di
cellula e della sua localizzazione ed in base allo stadio di sviluppo e al momento rispetto al ritmo
circadiano della pianta.
Le sostanze in esso contenute possono essere suddivise in tre categorie:
a) inclusi idrofili
• acidi organici (es.:, acido citrico, acido malico; che conferiscono il sapore acido)
• sali minerali (per lo più dissociati in ioni; es.: cloruri, solfati, fosfati, nitrati di Na, K, Ca, Mg)
• glucidi (es.: fruttosio in diversi frutti, glucosio nell’uva, saccarosio nella barbabietola e nella canna
da zucchero, ecc.)
• aminoacidi (soprattutto asparagina e glutammina)
• alcaloidi (con funzione di difesa contro erbirvori o parassiti, rifiuto o riserva di azoto; es.: caffeina,
nicotina, atropina, papaverina, ecc.)
• glucosidi (es.: digitossina)
• tannini (derivati dall’acido gallico o della pirocatechina, con funzione antiputrefattiva, di difesa
contro attacchi da microrganismi)
• pigmenti antocianici e flavonici (che conferiscono colore ai fiori e alle foglie)
b) inclusi idrofobi
• lipidi (trigliceridi soprattutto, come in molti semi e frutti)
• oli essenziali (derivati isoprenici, molto volatili, con funzioni diverse)
• resine, balsami e latici (soluzioni oleose varie di prodotti terpenici, soprattutto con funzione
antiputrefattiva e di difesa)
c) inclusi insolubili
• ossalato di calcio (in forma cristallina con cristalli isodiametrici –druse- o aghiformi –rafidi-,
probabilmente rappresentano un mezzo per precipitare l’acido ossalico, inibitore di diversi
complessi enzimatici)
• silice (per esempio in alcune graminacee, in aggiunta alla silice che mineralizza la parete)
• gesso (solfato di calcio idrato, per esempio in alcune alghe)
• aleurone (corpi con matrice proteica e una massa cristallina –cristalloide- ed una o più particelle
globose –globoidi- contenenti fitina, cioè derivato dell’acido fitico salificato contemporaneamente
con fosforo, calcio e magnesio)
CICLO CELLULARE
CICLO MITOTICO
G1→S→G2→Mitosi
MITOSI: ripartizione in 2 cellule identiche: 2n→2n,2n; n→n,n
CICLO MEIOTICO
G1→S→G2→Meiosi = G1→S→G2→I divisione→intercinesi→II divisione
MEIOSI: dimezzamento in 4 cellule diverse: 2n→n,n,n,,n
_____
DIVERSITA’ DELLE CELLULE RISPETTO AL CICLO CELLULARE
A: CELLULE PERENNI
B: CELLULE STABILI
C: CELLULE IN CICLO DI DIVISIONE CONTINUA
START
G2
S
M
C
START
Gz
G1
A
Go
B
____________________
CICLINE: regolatori del ciclo cellulare
APOPTOSI: uscita dal ciclo cellulare (morte programmata della cellula)
NECROSI: morte accidentale della cellula
GENI ONCOSOPPRESSORI: promuovono apoptosi
ONCOGÉNI: promuovono proliferazione cellulare
MITOSI
Profase→Metafase→Anafase→Telofase-----Citodieresi (citocinesi)
_________
MEIOSI
I divisione: riduzionale →separazione di cromosomi omologhi
II divisione: equazionale →separazione di cromatidi fratelli
TIPI DI MEIOSI DISTINGUIBILI PER PRODOTTO
GAMETICA→ gameti (aploidi, destinati alla fecondazione)
INTERMEDIA→ spore (aploidi, generalmente destinati alla “germinazione dovuta
a divisioni mitotiche)
ZIGOTICA→ individui aploidi (immediata dopo la fecondazione e la formazione
dello zigote)
EFFETTI DELLA MEIOSI
Assortimento casuale di cromosomi omologhi alla I divisione e dei cromatidi alla II
divisione → nuove combinazioni di cromosomi nei gameti o nelle spore
Eventuale scambio di parti fra cromatidi omologhi (mediante crossing-over) →
nuove combinazioni di alleli in ogni cromosoma
FASI MEIOTICHE
I DIVISIONE:
PROFASE
LEPTOTENE→ evidenziazione cromosomi
ZIGOTENE→ appaiamento di cromosomi omologhi
PACHITENE→ complesso sinaptinemale (inizio crossing-over)
DIPLOTENE→ crossing-over (chiasmi)
DIACINESI→ spostamento chiasmi
METAFASE I
ANAFASE I
TELOFASE I
Risultato: separazione dei cromosomi omologhi (modificati dal crossing-over)
II DIVISIONE
PROFASE II
METAFASE II
ANAFASE II
TELOFASE II
Risultato: cromatidi separati
CICLI DI GENERAZIONE
APLONTE: prevale la generazione aploide (nei vegetali il gametofito)
DIPLONTE: prevale la generazione diploide (nei vegetali lo sporofito)
APLODIPLONTE: con alternanza più o meno equivalente delle due generazioni
aploide (gametofito) e diploide (sporofito)
DICARIONTE: con dominanza dello stadio a dicarion (con due nuclei separati per
ciascun elemento cellulare; es. funghi)
APLONTE
APLO-DIPLONTE
Meiosi
S
G
Z
Gamia
S
G
Z
Meiosi
DIPLONTE
G = gameti
S = Spore
Z = Zigote
Gametofito (Aplofito n)
G
S
Z
Gamia
Meiosi
Sporofito (Diplofito 2n)
Gamia