Altre leggi
Nel periodo in cui Dalton formulava la sua teoria atomica, Joseph Louis Gay-Lussac, un chimico francese
appassionato di voli in mongolfiera, eseguiva numerosi e accurati esperimenti su reazioni tra gas. Lo scienziato
osservò, sempre nel 1808, che:
“l’interazione delle sostanze gassose ha luogo sempre nei rapporti più semplici,
in modo che con un volume di una sostanza gassosa si combina sempre un
volume uguale o doppio o al massimo triplo di un’altra sostanza gassosa”.
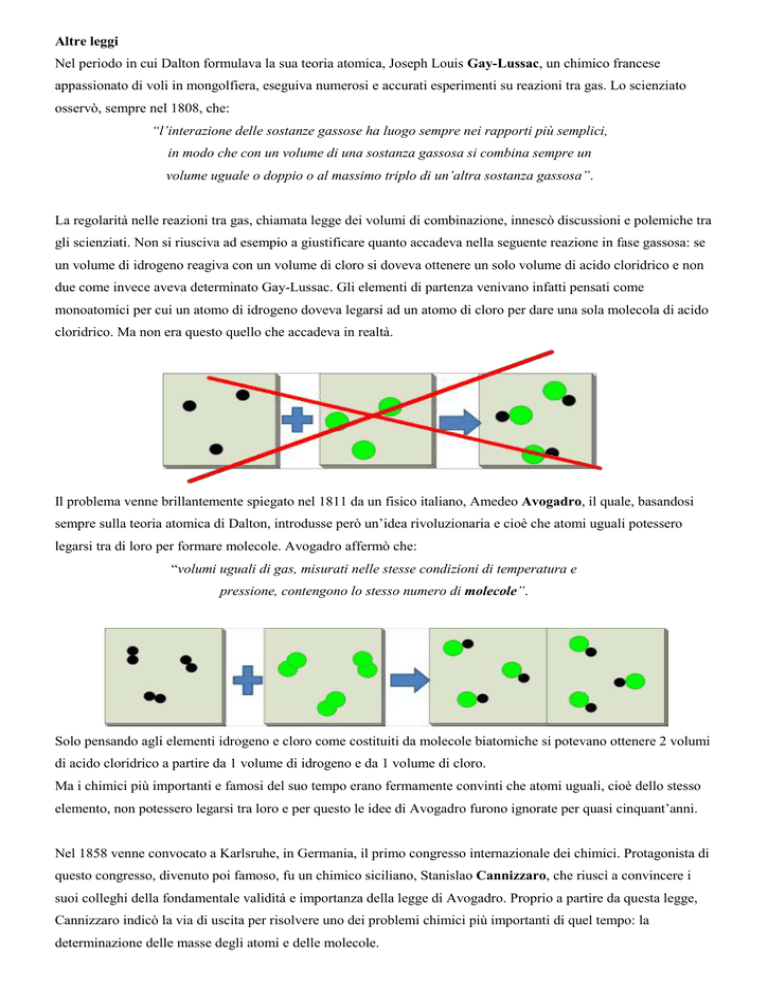
La regolarità nelle reazioni tra gas, chiamata legge dei volumi di combinazione, innescò discussioni e polemiche tra
gli scienziati. Non si riusciva ad esempio a giustificare quanto accadeva nella seguente reazione in fase gassosa: se
un volume di idrogeno reagiva con un volume di cloro si doveva ottenere un solo volume di acido cloridrico e non
due come invece aveva determinato Gay-Lussac. Gli elementi di partenza venivano infatti pensati come
monoatomici per cui un atomo di idrogeno doveva legarsi ad un atomo di cloro per dare una sola molecola di acido
cloridrico. Ma non era questo quello che accadeva in realtà.
Il problema venne brillantemente spiegato nel 1811 da un fisico italiano, Amedeo Avogadro, il quale, basandosi
sempre sulla teoria atomica di Dalton, introdusse però un’idea rivoluzionaria e cioè che atomi uguali potessero
legarsi tra di loro per formare molecole. Avogadro affermò che:
“volumi uguali di gas, misurati nelle stesse condizioni di temperatura e
pressione, contengono lo stesso numero di molecole”.
Solo pensando agli elementi idrogeno e cloro come costituiti da molecole biatomiche si potevano ottenere 2 volumi
di acido cloridrico a partire da 1 volume di idrogeno e da 1 volume di cloro.
Ma i chimici più importanti e famosi del suo tempo erano fermamente convinti che atomi uguali, cioè dello stesso
elemento, non potessero legarsi tra loro e per questo le idee di Avogadro furono ignorate per quasi cinquant’anni.
Nel 1858 venne convocato a Karlsruhe, in Germania, il primo congresso internazionale dei chimici. Protagonista di
questo congresso, divenuto poi famoso, fu un chimico siciliano, Stanislao Cannizzaro, che riuscì a convincere i
suoi colleghi della fondamentale validità e importanza della legge di Avogadro. Proprio a partire da questa legge,
Cannizzaro indicò la via di uscita per risolvere uno dei problemi chimici più importanti di quel tempo: la
determinazione delle masse degli atomi e delle molecole.
Sappiamo che atomi e molecole sono particelle incredibilmente piccole per cui è impensabile poterle pesare
direttamente su di una bilancia seppur sensibilissima. Se però misuriamo la massa di volumi uguali di sostanze
gassose diverse, nelle stesse condizioni di temperatura e di pressione, in base alla legge di Avogadro misuriamo le
diverse masse dello stesso numero di molecole (o, in generale, particelle). Ora, scegliendo un elemento di
riferimento, si possono esprimere le masse degli altri elementi facendo il semplice rapporto con la massa
dell’elemento di riferimento scelto. Il rapporto tra le due masse di elementi diversi contenenti lo stesso numero di
particelle si semplifica e diventa il rapporto tra le masse delle singole particelle dei due elementi.
massa elemento A
N particelle di A
massa 1 particella A
x
massa 1 particella A
=
massa elemento B
massa 1 particella B
N particelle di B
= massa 1 particella B
x
Dato che:
Già nel XIX secolo i chimici scelsero come elemento di riferimento l’idrogeno e ad esso assegnarono in modo
arbitrario il valore di massa uguale a 1. Facciamo un esempio: il rapporto tra le masse di uguali volumi di ossigeno
e idrogeno permise di stabilire che una molecola di ossigeno pesa 16 volte più di una molecola di idrogeno.
I chimici poterono in questo modo determinare le masse relative (all’idrogeno) di moltissime molecole di sostanze
allo stato gassoso o facilmente trasformabili allo stato gassoso. Il valore della massa relativa degli atomi fu
chiamato peso atomico (PA) e quello delle molecole peso molecolare (PM). In sintesi, in un PA o in un PM
espresso in grammi di qualsiasi sostanza è contenuto lo stesso numero di particelle.
La “regola di Cannizzaro” per la determinazione del peso atomico di un elemento è la
seguente:
a) si considera un grande numero di composti contenenti l’elemento in questione;
b) si determina per ogni composto il peso molecolare;
c) si ricavano dalle diverse quantità dei composti (pari alla massa in grammi dei rispettivi
pesi molecolari) le corrispondenti quantità dell’elemento;
d) si assume come peso atomico dell’elemento il valore più basso tra quelli trovati.
Facciamo proprio uno degli esempi di Cannizzaro (vedi tabella sotto presa dal “Sunto di
un corso di filosofia chimica” tenuto nella Reale Università di Genova nel 1858) che si
propose di determinare il peso atomico del carbonio. Analizzò il metano (gas delle
paludi), l’anidride carbonica (acido carbonico) e l’etilene (eterene), tutti composti gassosi contenenti carbonio. Di
ciascun composto prese in esame una quantità in grammi pari al suo peso molecolare. I pesi molecolari PM
corrispondenti alle tre sostanze erano 16, 44 e 28 e determinò, attraverso l’analisi chimica, le quantità di carbonio
in esse presenti. In 16 g di metano la quantità di carbonio era 12; in 44 g di anidride carbonica era ancora 12 mentre
nei 28 g di etilene era 24.
Il peso atomico del carbonio poteva essere proprio 12, a meno che non si trovasse un altro composto contenente un
sottomultiplo di 12 in una massa in grammi pari al suo peso molecolare.
Ultima domanda a cui cercheremo di dare una risposta in questo percorso epistemologico è la seguente: come
furono sono state ricavate le formule chimiche delle sostanze? Lo stesso Dalton riteneva che la formula chimica
dell’acqua fosse HO e non H2O. Infatti, dato che la quantità di ossigeno che si combinava con la stessa quantità di
idrogeno era doppia nell’acqua ossigenata rispetto a quella non ossigenata (i rapporti erano rispettivamente 16 e 8),
la formula chimica dell’acqua ossigenata doveva essere HO2 e quella dell’acqua HO.
massa ossigeno
massa ossigeno
O
O
= 8 nell’acqua NON
massa idrogeno
ossigenata
= 16 nell’acqua
massa idrogeno
H
ossigenata
H
Ma per conoscere la formula chimica di una sostanza non era sufficiente il rapporto di combinazione tra le masse:
era indispensabile conoscere anche il valore dei pesi atomici, così come erano stati determinati da Cannizzaro.
L’ossigeno aveva infatti peso atomico di 16 e l’idrogeno di 1 per cui nella molecola di acqua il numero di atomi di
idrogeno doveva essere pari a 2. Se il peso atomico dell’ossigeno fosse stato 8, come pensava Dalton,
effettivamente nell’acqua non ossigenata 1 atomo di O si combinava con 1 atomo di H.
Nella tabella che segue viene proposto un confronto sintetico tra l’ipotesi di Dalton e quella di Cannizzaro per la
determinazione della formula dell’acqua e dell’acqua ossigenata.
PA ossigeno
Formula acqua NON
Formula acqua
ossigenata
ossigenata
Ipotesi Dalton
8
HO
HO2
Ipotesi Cannizzaro
16
H2O
H2O2
In realtà le formule ricavate con questo metodo sono le sole formule minime, che indicano il rapporto minimo tra
gli atomi che costituiscono la molecola. Per scrivere l’effettiva composizione atomica di una molecola, cioè la sua
formula molecolare, è necessario ricavare sperimentalmente il valore del peso molecolare. Se il peso molecolare è
lo stesso di quello ricavabile dalla formula minima, allora la formula molecolare coincide con quella della formula
minima (è il caso dell’acqua NON ossigenata), altrimenti è un suo multiplo intero. Per esempio, l’acqua ossigenata
ha formula minima HO ma peso molecolare 34, che è esattamente doppio della somma dei pesi atomici di H e O,
per cui la formula molecolare è H2O2. L’acqua NON ossigenata ha invece formula minima H2,O che corrisponde
esattamente al peso molecolare di 18.
Nella tabella che segue vengono sinteticamente confrontate formule e pesi dell’acqua ossigenata e non.
Acqua ossigenata
Acqua NON
ossigenata
Formula minima
Peso molecolare
Formula molecolare
HO
34
H2O2
H2 O
18
H2O
Struttura
Esercizi
1) A partire dai valori dei pesi atomici degli elementi PA, così come indicati nella tavola periodica degli elementi,
determina il peso molecolare PM (o peso formula PF se il composto è ionico e non molecolare) delle seguenti
sostanze:
a) acido nitrico HNO3, b) solfato rameico CuSO4, c) iodio molecolare I2, d) anidride nitrosa N2O3, e) ossido
rameoso Cu2O, f) cobalto Co, g) idruro di litio LiH
……………………………………………………………………………………………………………………..
2) Determina la % in massa di ciascuno degli elementi presenti nei seguenti composti, ovviamente sempre a partire
dalla loro formula chimica e dai PA riportati nella tavola periodica.
PM = ……… %Cl = ……… %O = ………
a) anidride clorica Cl2O5
b) carbonato di magnesio MgCO3
PF = …….…
%Mg = …….. %C = ……… %O = ………………
c) ammoniaca NH3
PM =………
%N = ……… %H = ………
d) metano CH4
PM = ……..
%C = …..….. %H = ………..
3) commenta per iscritto la mappa concettuale presentata di seguito utilizzando le righe a disposizione.
1789
1806
1808
Lavoisier
Legge di
conservazione
della massa
Proust
Legge delle
proporzioni definite
Dalton
Legge delle
proporzioni multiple
Dalton
1808
1811
Gay-Lussac
Esistenza
molecole
Regola di
Cannizzaro
Teoria atomica
Legge dei
volumi di
combinazione
Avogadro
Cannizzaro
1858
…………………………………………………………………………………………………………………………
…………………………………………………………………………………………………………………………
…………………………………………………………………………………………………………………………
…………………………………………………………………………………………………………………………
…………………………………………………………………………………………………………………………
…………………………………………………………………………………………………………………………
…………………………………………………………………………………………………………………………
…………………………………………………………………………………………………………………………
…………………………………………………………………………………………………………………………
…………………………………………………………………………………………………………………………
Soluzioni: 1) a) 63,02 b) 159,61 c) 253,8 d) 76,02 e) 143,1 f) 58,93 g) 7,95 2) a) 150,9 47% b) 84,32, 29%, 14% c) 17,03,
82% d) 16,04, 75%












