Istituto Professionale Servizi per l’Enogastronomia e l’Ospitalità Alberghiera
“Carlo Porta”
MIRH02000X
Via Uruguay 26/2 - 20151 Milano - Tel. 02.38.00.36.86 r.a. - Fax
02.30.84.472
sito web www.carloportamilano.it - e-mail: [email protected]
MOD/UD 163
PROGRAMMAZIONE ANNUALE
A.S. 2016-2017
Scienze Integrate Chimica
Classi Seconde
LIBRO DI TESTO
Autore: Paolo Pistarà
Titolo : Chimica di base
Editore: Atlas
OBIETTIVI GENERALI
Elenco completo degli obiettivi declinati secondo la bipartizione conoscenze-abilità.
N.B.: in (*) gli obiettivi minimi
Conoscenze:
La materia ed il mondo particellare.
Le sostanze pure (*). Le proprietà delle sostanze pure.
Le miscele eterogenee e le miscele omogenee (*).
I colloidi in cucina.
Concentrazione di una soluzione: percentuale in massa, percentuale in volume.
La separazione delle miscele in sostanze pure (*): filtrazione, distillazione, estrazione
con solvente.
Elementi e composti (*).
Atomi e molecole (*).
Modelli molecolari. Formule chimiche (*).
Bilanciamento di semplici reazioni chimiche.
Le particelle subatomiche: elettroni, protoni e neutroni (*).
Il numero atomico e numero di massa. Gli isotopi.
La massa atomica e la massa molecolare.
La mole (*). Il numero di Avogadro. La massa molare (*).
Semplici calcoli stechiometrici sulla mole(*).
Il modello di Bohr dell’atomo di idrogeno (*).
La tavola periodica di Mendeleev.
APPROVATO IL :15.06.2012
EMESSO IL: 07/09/2012
1
Istituto Professionale Servizi per l’Enogastronomia e l’Ospitalità Alberghiera
“Carlo Porta”
MIRH02000X
Via Uruguay 26/2 - 20151 Milano - Tel. 02.38.00.36.86 r.a. - Fax
02.30.84.472
sito web www.carloportamilano.it - e-mail: [email protected]
MOD/UD 163
La tavola periodica moderna. I gruppi ed i periodi della tavola periodica (*). Metalli, non
metalli, semimetalli(*).
I simboli di Lewis. L’elettronegatività.
I legami chimici (*): il legame covalente puro, il legame covalente polare, il legame
ionico.
Relazione tra la forma di una molecola e la sua polarità.
Le forze intramolecolari (*): le forze dipolo-dipolo, le forze di London, il legame
idrogeno.
Classificazione dei composti chimici in binari e ternari.
Elementi di nomenclatura di ossidi, idracidi, ossiacidi e idrossidi.
Gli idrocarburi (*): cenni su nomenclatura e formula di struttura di alcani, alcheni e
alchini.
Struttura del benzene.
I principali gruppi funzionali (*): alcoli, aldeidi, chetoni, acidi carbossilici, ammine.
ABILITÀ:
Identificare gli stati fisici della materia secondo il modello particellare.
Distinguere le proprietà fisiche dalle proprietà chimiche di una sostanza pura.
Distinguere le soluzioni dalle sostanze pure.
Classificare le sostanze pure in elementi e composti.
Saper riconoscere e classificare le miscele in omogenee ed eterogenee.
Riconoscere i principali colloidi utilizzati in campo alimentare.
Conoscere i diversi modi per esprimere la concentrazione di una soluzione.
Saper eseguire semplici problemi su calcolo di percentuale in massa, percentuale in
volume.
Saper scegliere la tecnica corretta per separare le sostanze di una miscela.
Saper distinguere le trasformazioni fisiche dalle trasformazioni chimiche della materia.
Classificare e descrivere le principali particelle presenti in un atomo.
Distinguere il concetto di numero atomico e numero di massa.
Calcolare la massa molecolare di un composto.
Utilizzare la mole come unità di quantità di sostanza.
Calcolare la massa molare di un elemento e di un composto.
Saper risolvere semplici problemi sul calcolo delle moli.
Comprendere la struttura dell’atomo di Bohr.
Spiegare la relazione esistente tra proprietà degli elementi e la loro posizione nella
tavola periodica.
Distinguere le proprietà chimiche e fisiche degli elementi in base agli elettroni di
valenza.
Distinguere un legame covalente da un legame ionico.
Confrontare la polarità degli atomi utilizzando i valori di elettronegatività.
Rappresentare la struttura di Lewis di una molecola.
Spiegare l’origine delle forze tra le molecole.
Assegnare il nome a semplici composti conoscendo la formula chimica e viceversa.
Scrivere e bilanciare semplici reazioni chimiche.
Distinguere gli idrocarburi in base al legame covalente (singolo, doppio, triplo) presente
in una molecola.
Assegnare il nome IUPAC ad un idrocarburo data la sua formula e viceversa.
Mettere in relazione la struttura e le proprietà degli idrocarburi.
Comprendere la struttura del benzene.
APPROVATO IL :15.06.2012
EMESSO IL: 07/09/2012
2
Istituto Professionale Servizi per l’Enogastronomia e l’Ospitalità Alberghiera
“Carlo Porta”
MIRH02000X
Via Uruguay 26/2 - 20151 Milano - Tel. 02.38.00.36.86 r.a. - Fax
02.30.84.472
sito web www.carloportamilano.it - e-mail: [email protected]
MOD/UD 163
Assegnare il nome dalla formula di struttura di un composto.
Mettere in relazione la struttura di un gruppo funzionale con le proprietà di un
composto.
METODI:
Lezioni frontali dialogate
Lezioni con l’utilizzo di materiale multimediale
Lavori individuali o di gruppo utilizzando materiale e/o indicazioni fornite dall’insegnante
Coinvolgimento degli studenti al fine di renderli protagonisti attivi del processo di
apprendimento
Dimostrazione di semplici esperienze di laboratorio
STRUMENTI:
Libro di testo
Modelli molecolari
Audiovisivi
Lim
Tic
Laboratori virtuali
Materiale di approfondimento fornito dall’insegnante
NUMERO MINIMO VERIFICHE PREVISTE:
Orali o scritto pre orale: almeno 2 per quadrimestre (verifiche orali e/o test scritti strutturati
e/o semistrutturati)
Milano, 8 settembre 2016
APPROVATO IL :15.06.2012
EMESSO IL: 07/09/2012
3
Istituto Professionale per i Servizi Alberghieri e della Ristorazione
“Carlo Porta”
MIRH02000X
Via Uruguay 26/2 - 20151 Milano - Tel. 02.38.00.36.86 r.a. - Fax 02.30.84.472
sito web www.carloportamilano.it - e-mail: [email protected]
N.
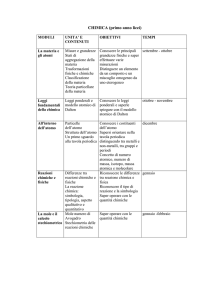
MODULO
0
1
2
TITOLO DEL MODULO
Misure e calcoli
(richiami di fisica e
matematica)
OBIETTIVI
(PRESCELTI TRA TRA QUELLI ELENCATI A PAG. 1)
Conoscere le principali grandezze del S.I. e le loro unità
di misura. Conoscere il concetto di massa, peso,
volume, densità, pressione e temperatura.
Saper descrivere i passaggi di stato.
Conoscere le operazioni inverse e la notazione scientifica
Saper identificare gli stati fisici della materia secondo il
modello particellare.
Saper distinguere le proprietà fisiche dalle proprietà
chimiche di una sostanza pura.
Saper distinguere le soluzioni dalle sostanze pure
Saper riconoscere e classificare le miscele in omogenee
ed eterogenee.
Le trasformazioni fisiche della
Riconoscere i principali colloidi utilizzati in campo
materia
alimentare.
Conoscere i diversi modi per esprimere la concentrazione
di una soluzione
Saper classificare le sostanze pure in elementi e
composti.
Saper scegliere la tecnica corretta per separare le
sostanze di una miscela.
Le trasformazioni chimiche
della materia e le reazioni
chimiche
Saper distinguere le trasformazioni fisiche dalle
trasformazioni chimiche della materia.
Classificare le sostanze pure in elementi e composti,
saper distinguere gli atomi dalle molecole.
MOD/UD 163
CONTENUTI/UNITÀ DIDATTICHE
CAPITOLO
1
CAPITOLO
2
CAPITOLO
2
N. ORE
PREVISTE
SETTEMBRE
Approfondimento: i colloidi
in cucina
CAPITOLO
3
CAPITOLO
9
OTTOBRE
NOVEMBRE
APPROVATO IL : 15.06.2012
EMESSO IL: 07/09/2012
- 4-
Istituto Professionale per i Servizi Alberghieri e della Ristorazione
“Carlo Porta”
MIRH02000X
Via Uruguay 26/2 - 20151 Milano - Tel. 02.38.00.36.86 r.a. - Fax 02.30.84.472
sito web www.carloportamilano.it - e-mail: [email protected]
Comprendere e saper riconoscere modelli molecolari,
formule chimiche.
Saper scrivere e bilanciare semplici reazioni chimiche
3
4
La struttura dell’atomo ed il
sistema periodico
La mole
Classificare e descrivere le principali particelle presenti in
un atomo
Distinguere il concetto di numero atomico e numero di
massa
Calcolare la massa molecolare di un composto.
Comprendere la struttura dell’atomo di Rutherford.
Comprendere la struttura dell’atomo di Bohr.
Spiegare la relazione esistente tra proprietà degli
elementi e la loro posizione nella tavola periodica.
Riconoscere le proprietà chimiche e fisiche degli elementi
in base agli elettroni di valenza.
Utilizzare la mole come unità di quantità di sostanza
Calcolare la massa molare di un elemento e di un
composto
Saper risolvere semplici problemi sul calcolo delle moli e
sulla molarità
MOD/UD 163
Approfondimento:
la cottura degli alimenti
CAPITOLO
4
CAPITOLO
6
DICEMBRE
Approfondimento: i metalli
in cucina
CAPITOLO
5
GENNAIO
APPROVATO IL : 15.06.2012
EMESSO IL: 07/09/2012
- 5-
Istituto Professionale per i Servizi Alberghieri e della Ristorazione
“Carlo Porta”
MIRH02000X
Via Uruguay 26/2 - 20151 Milano - Tel. 02.38.00.36.86 r.a. - Fax 02.30.84.472
sito web www.carloportamilano.it - e-mail: [email protected]
I legami chimici
5
6
9
I composti chimici e la
nomenclatura
Chimica organica: gli
idrocarburi
Rappresentare la struttura di Lewis di un atomo e di
semplici molecole.
Distinguere un legame covalente da un legame ionico
Confrontare la polarità degli atomi utilizzando i valori di
elettronegatività
Spiegare l’origine delle forze tra le molecole e come
queste ultime influenzano le proprietà delle sostanze
Assegnare il nome a semplici composti conoscendo la
formula chimica e viceversa
Distinguere gli idrocarburi in base al legame covalente
(singolo, doppio, triplo) presente in una molecola
Assegnare il nome IUPAC ad un idrocarburo data la sua
formula e viceversa
Mettere in relazione la struttura e le proprietà degli
idrocarburi
Comprendere la struttura del benzene
MOD/UD 163
CAPITOLO
7
Approfondimento: la
sferificazione ed il legame
ionico
CAPITOLO
FEBBRAIO
8
FEBBRAIO
CAPITOLO
13
MARZO /APRILE
APPROVATO IL : 15.06.2012
EMESSO IL: 07/09/2012
- 6-
Istituto Professionale per i Servizi Alberghieri e della Ristorazione
“Carlo Porta”
MIRH02000X
Via Uruguay 26/2 - 20151 Milano - Tel. 02.38.00.36.86 r.a. - Fax 02.30.84.472
sito web www.carloportamilano.it - e-mail: [email protected]
10
I gruppi funzionali
Assegnare il nome dalla formula di struttura di un
composto a partire dal suo gruppo funzionale.
Mettere in relazione la struttura di un gruppo funzionale
con le proprietà di un composto.
MOD/UD 163
CAPITOLO
14
APRILE/MAGGIO
Approfondimento: l’alcol
etilico in cucina
RECUPERO
SE RITENUTO NECESSARIO VERRA’ EFFETTUATO IL RECUPERO IN ITINERE CON IL METODO EDUCATION PEER CON GRUPPI ETEROGENEI
APPROVATO IL : 15.06.2012
EMESSO IL: 07/09/2012
- 7-