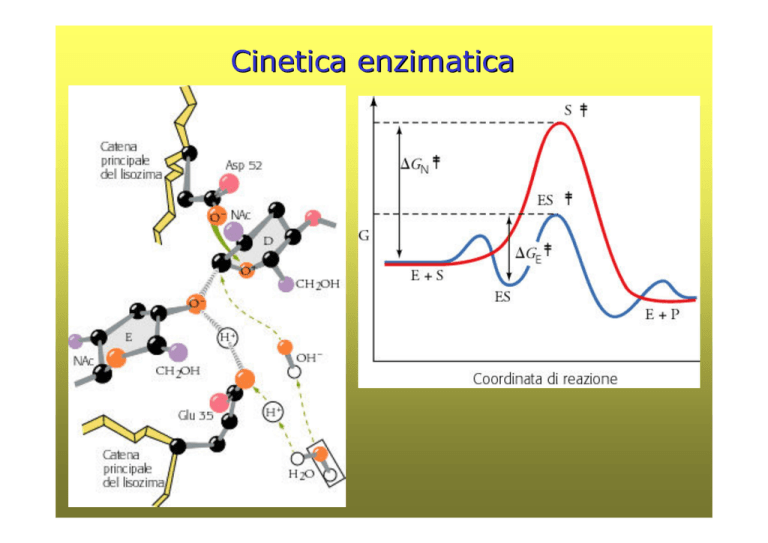
Cinetica enzimatica
Gli enzimi sono catalizzatori nelle reazioni dei sistemi
biologici
Essi non sono gli unici catalizzatori biologici, esistono
infatti:
ribozimi e abzimi
Quasi tutti gli enzimi sono proteine (ad eccezione di piccoli
gruppi di molecole di RNA catalitico) con masse molecolari
variabili (12000-1.000.000)
L’attività catalitica dipende dall’integrità conformazionale della
proteina nativa
Molti enzimi necessitano di componenti chimici addizionali
detti cofattori
ioni inorganici (Fe2+, Mg2+,
I cofattori possono essere
Zn2+)
coenzimi (molecole organiche o
metallo-organiche)
I cofattori legati covalentemente all’enzima
vengono chiamati gruppi prostetici
La parte proteica di un enzima è detta
apoenzima l’insieme dell’apoenzima, dei
coenzimi o degli ioni metallici costituisce
l’oloenzima
Esempi di enzimi che contengono come cofattori
ioni inorganici
Fe2+ o Fe3+
Cu2+
Zn2+
Mg2+
Catalasi
Perossidasi
Citocromo ossidasi
Anidrasi carbonica
Alcol deidrogenasi
Glucosio-6-fosfatasi
Piruvato chinasi
Mn2+
Ribonucleotide reduttasi
Ni2+
Ureasi
Mo
Dinitrogenasi
Se
Glutatione perossidasi
Esempi di enzimi e coenzimi che trasferiscono gruppi chimici
coenzima
gruppi trasferiti
enzimi
nucleotidi fosfato
P, B-Rib, B-Rib-P
fosfotransferasi
coenzima A
gruppi acilici
acil-transferasi
tiamina pirofosfato
gruppi idrossialchil.
decarbossilasi
piridossalfosfato
gruppo amminico
amminotransferasi
biotina
CO2
carbossilasi
tetraidrofolato
formil, metilen, metil
transferasi C1
Gli enzimi sono catalizzatori speciali, favorendo le
reazioni nelle condizioni biologiche (pH = 7.4; t = 37°
C; ambiente acquoso intracellulare)
Una caratteristica delle reazioni
enzimatiche è proprio quella di
avvenire all’interno di una
particolare tasca, detta sito
attivo; la molecola che si lega in
maniera specifica al suo interno
è detta substrato
Specificità di substrato
Le forze non covalenti attraverso le quali i substrati e le altre
molecole si legano agli enzimi sono lo stesso tipo di forze
che regolano le conformazioni delle proteine.
In entrambi i casi sono coinvolte:
1. forze di Van der Waals
2. forze elettrostatiche
3. legami idrogeno
4. interazioni idrofobiche
9
In generale, un sito che lega il substrato è una cavità o una
fessura sulla superficie di una molecola di enzima
complementare, come forma, al substrato (complementarietà
geometrica).
I residui aminoacidici che formano il sito di legame
interagiscono specificatamente con il substrato mediante forze
attrattive (complementarietà elettrostatica).
Nella maggior parte degli enzimi, i siti di legame per il
substrato sono quasi sempre preformati, ma subiscono
alcuni cambiamenti conformazionali in seguito al legame
con il substrato (adattamento indotto)
Gli enzimi modificano la velocità di reazione e non gli equilibri
E + S ES E + P
K 'eq =
[ P]
[S ]
∆G°' = − RT ln K 'eq
La velocità di reazione dipende dalla concentrazione del
reagente ( o dei reagenti) e dalla costante di velocità
v = K [S ]
Cinetica I° ordine
v = K [ S ' ][ S ' ' ] Cinetica II° ordine
L’equazione di Michaelis-Menten
v
0
=
v
K
max
m
S
+ [S ]
Km = costante di Michaelis-Menten
Vo = velocità iniziale
Vmax= velocità allo stato stazionario
Se v
0
=
1
;
2 vmax
[S ] ;
1
=
2 K m + S
K m = [S ] = mol/l
1
1
K m + [S ] = [S ]
2
2
Equazione di Michaelis -Menten
Tutti gli enzimi possono essere analizzati in modo da quantificare
sia la velocità di reazione, sia la efficienza enzimatica
PRIMA ASSUNZIONE
La reazione complessiva è costituita da due reazioni elementari
nelle quali il substrato forma un complesso con l’enzima che
successivamente si decompone formando i prodotti e l’enzima
libero:
E + S
K1
K-1
ES
K2
P+E
Seconda assunzione
La tappa che limita la velocità la conversione del
substrato in prodotto è la scissione del complesso ES in
E + P.
In queste condizioni la velocità iniziale diventa:
Velocità iniziale = V0 = k2 [ES]
Quando tutto l’enzima ha legato a sè il substrato,
[Et] = [ES]
e
v0 =Vmax
v0 = Vmax = k2 [Et]
Terza assunzione
La velocità complessiva di produzione di ES è data dalla
differenza tra la velocità delle reazioni elementari che
portano alla sua formazione e la velocità delle reazioni
che ne determinano la scomparsa:
Si assume che la concentrazione di ES si trovi in uno
stato stazionario e resti costante durante la misura
della velocità iniziale.
La velocità di produzione del complesso ES da E e da S
è semplicemente uguale alla velocità di demolizione del
complesso ES in E + P ed E + S.
Significato della costante di Michaelis
La costante di Michaelis, Km, puo’ essere definita in
modo semplice come:
la concentrazione di substrato in cui [S] = Km,
v0 = Vmax1/2,
Km corrisponde alla concentrazione di substrato in
cui la velocità della reazione è metà della velocità
massima.
Km è una misura dell’affinità dell’enzima
Fattori che influenzano la Km
Nella maggior parte dei casi il valore della Km è indipendente
dalla quantità di enzima che viene usata per determinarla.
Qualsiasi variazione dei parametri che influenzano il legame del
substrato all’enzima produrrà un’alterazione del valore di Km
Variazioni di questo tipo possono essere costituite da:
1. alterazioni dei permanenti della struttura dell’enzima o del
substrato (cioè variazioni dei legami covalenti),
2. variazioni reversibili della distribuzione delle cariche
3. variazioni della conformazione dell’enzima che influenzano
l’orientamento o l’accessibilità dei gruppi di legame.
4. Interferenze a livello della formazione del complesso enzimasubstrato da parte di sostanze presenti nella miscela di reazione.
5. Variazioni dello stato di ionizzazione dell’enzima e del substrato
costituita principalmente dalle variazioni di pH.
Dall’equazione di Michaelis-Menten, utilizzando i doppi
reciproci, otteniamo l’eq. di Lineweaver-Burk (dipendenza
lineare della velocità di reazione e la concentrazione del
substrato)
1
1
K
m
=
+
v0 [S ] vmax v max
I tipi di meccanismi catalitici utilizzati dagli enzimi sono stati
classificati come:
catalisi acido-basica
catalisi covalente
catalisi favorita da ioni metallici
catalisi elettrostatica
catalisi favorita da effetti di prossimità e di orientamento
catalisi favorita dal legame preferenziale del complesso
dello stato di transizione
Catalisi acido-basica
1) processo in cui il trasferimento di un protone da un acido
abbassa l’energia libera dello stato di transizione di una
reazione (catalisi acida generale).
2) Una reazione può essere stimolata aumentandone la velocità
dalla sottrazione temporanea di un protone da parte di una
base (catalisi basica generale).
Catalisi covalente
con la catalisi covalente si aumenta la velocità della
reazione mediante la formazione transitoria di un
legame covalente
La catalisi covalente si svolge in 3 tappe:
1) reazione nucleofilica tra il catalizzatore e il substrato
con la formazione di un legame covalente
2) perdita di elettroni dal centro di reazione ad opera
del catalizzatore elettrofilico
3) eliminazione del catalizzatore, una reazione che è
essenzialmente l’inverso della prima tappa
Esempi di gruppi nucleofilici e gruppi elettrofilici
coinvolti nella catalisi covalente
Catalisi favorita da ioni metallici
. Quasi un terzo di tutti gli enzimi conosciuti richiede la presenza di ioni metallici per
poter esprimere la sua attività catalitica
1. I metallo-enzimi, che contengono, come cofattori, ioni metallici saldamente
legati, la maggior parte dei quali sono metalli di transizione come Fe2+, Fe3+, Cu2+,
Zn2+, Mn2+ o Co2+..
2. Gli enzimi attivati da metalli, viceversa, legano debolmente gli ioni metallici
presenti in soluzione, di solito gli ioni di metalli alcalini o alcalini-terrosi come Na+,
K+, Mg2+ o Ca2+.
14
Gli ioni metallici partecipano ai processi catalitici
in 3 modi diversi:
1) si
legano al substrato in modo da orientarlo
correttamente per la reazione
2) partecipano a reazioni redox mediante il cambiamento
reversibile del numero di ossidazione del metallo
3) stabilizzano
elettrostaticamente o proteggono le
cariche negative
14
Catalisi elettrostatica
1. Il legame del substrato di solito esclude l’acqua dal sito attivo di
un enzima, che possiede quindi le caratteristiche di polarità di un
solvente organico, in cui le interazioni elettrostatiche sono molto
più forti che nelle soluzioni acquose.
2. I valori di pK delle catene laterali degli aminoacidi presenti nelle
proteine possono variare di alcune unità rispetto ai loro valori
normali.
3.
Le distribuzioni di carica intorno al sito attivo degli enzimi
sembrano essere determinate in modo da stabilizzare gli stati di
transizione delle reazioni catalizzate
Catalisi favorita da effetti di prossimità e di
orientamento:
Gli enzimi, nonostante utilizzino meccanismi catalitici che assomigliano a
quelli delle reazioni organiche modello, sono cataliticamente molto più
efficienti di questi modelli.
Questa efficienza è data in relazione alla prossimità e orientamento dei
substrati.
Catalisi favorita dal legame preferenziale
dello stato di transizione
un enzima può legare lo stato di transizione della reazione che
catalizza con un’affinità maggiore rispetto a quello dei suoi
substrati o dei suoi prodotti.
Gli enzimi possono essere inibiti in modo reversibile o irreversibile
competitivi
Gli inibitori possono essere:
non competitivi
incompetitivi
Inibizione competitiva
E + S
ES
E + I
E+I
L’inibitore competitivo si
lega all’enzima nel sito
catalitico
impedendo
il
legame con il substrato.
Generalmente
l’inibitore
competitivo spesso è una
molecola che assomiglia al
substrato. Questo tipo di
inibizione diventa reversibile
quando aumenta la concentrazione di substrato poiché
aumenta la probabilità che
l’enzima
incontri
il
substrato.
Vmax è invariata
Km aumenta
-1/Km
-1/Km
6a reazione: sintesi di fumarato
• il malonato inibisce l’enzima in modo
competitivo, dovuto alla notevole somiglianza
strutturale col succinato
Gli inibitori non competitivi
Un inibitore non competitivo si lega reversibilmente sia
all’enzima libero sia al complesso enzima substrato:
E + I
EI
ES + I
ESI
Il substrato si può legare anche al complesso EI:
EI + S
ESI
I complessi EI ed ESI sono cataliticamente inattivi. Se una
data concentrazione di inibitore inattiva una certa frazione
delle molecole totali di enzima, un inibitore non competitivo
abbassa il valore della Vmax.
Le molecole di enzima che non legano l’inibitore hanno
un’affinità normale per il substrato e quindi presentano una
Km altrettanto normale.
Inibizione non competitiva
Vmax diminuisce
Km invariata
Inibizione incompetitiva
Gli inibitori incompetitivi si
legano ai complessi enzimasubstrato, ma non agli enzimi
in forma libera:
E + I
Vmax diminuisce
Km diminuisce
ES + I
Nessuna reazione
ESI
Il
complesso
ESI
è
cataliticamente inattivo e
quindi il valore della Vmax
diminuisce
in
presenza
dell'inibitore e il valore di
Km tende a diminuire, dato
che la reazione E + S ES
viene spinta verso destra
man mano che l'inibitore
rimuove il complesso ES
FATTORI CHE
INFLUENZANO
L’ATTIVITA’
ENZIMATICA
Attività di un enzima in funzione del pH
Una tipica curva di attività di un enzima in funzione della
temperatura.
A temperature inferiori a quella ottimale la velocità della reazione catalizzata è
ridotta in quanto il contenuto energetico delle molecole di substrato è troppo basso
perché queste possano superare la barriera dell'energia di attivazione;
A temperature superiori a quella ottimale la velocità è bassa perché diviene
sensibile l'inattivazione termica delle molecole di enzima.
Regolazione dell’attività enzimatica
Modificazioni allosteriche (non covalenti) (enzimi
allosterici)
Modificazioni covalenti
a) covalenti reversibili:
b) covalenti irreversibili:
Fosforilazione
Proteolisi (zimogeni)
Adenilazione
Uridililazione
ADP-Ribosilazione
Metilazione
Regolazione dell’attività enzimatica
Enzimi allosterici (modificazione non covalente)
Gli enzimi allosterici sono quelli che possiedono conformazioni
indotte dal legame con modulatori (positivi o negativi).
Se il modulatore è lo stesso substrato essi vengono denominati
omotropici.
Se il modulatore è una molecola diversa dal substrato, l’enzima
viene detto eterotropico.
Oltre ai siti catalitici, gli enzimi allosterici possiedono uno o più siti
regolatori.
Alcuni enzimi oligomerici possiedono delle subunità regolatrici che
non possiedono di per sè attività catalitiche
Fattori che influenzano le attività enzimatiche nel
plasma negli stati patologici:
• l’organo o il tessuto interessato dalla malattia
• la natura della lesione
• la distribuzione degli enzimi nel tessuto interessato
• effetti secondari su altri organi
• la velocità del rilascio dell’enzima da parte delle cellule
danneggiate
• la scomparsa dell’enzima dal circolo sanguigno
Significato clinico dell’attività degli enzimi presenti nei
materiali biologici
Lo studio dell’attività enzimatica trova la sua applicazione nei
laboratori di chimica clinica per l’accertamento di lesioni e/o
alterazioni della funzionalità di organi e per la diagnostica di
alcune malattie del metabolismo sostenute da enzimopatie per lo
più congenite. Queste ricerche sono condotte su diversi materiali
biologici:
• siero
• urina
• succhi digestivi e feci
• emolisati di emazie e preparati di leucociti
• altri materiali
Enzimi di interesse clinico che si presentano in
forme multiple
Lattico deidrogenasi
Isocitrico deidrogenasi
Glucosio-6-fosfato deidrogenasi
Glutammico deidrogenasi
Aspartico transaminasi
Creatina chinasi
Acetilcolinesterasi
Colinesterasi
Fosfatasi alcalina
Isoenzimi
Con il termine di isoenzimi o isozimi vengono
indicate proteine che catalizzano la stessa
reazione ma presentano diverse proprietà
molecolari, cioè diversa carica elettrica,
diversa solubilità, diversa resistenza ad agenti
chimici e fisici.
In alcuni casi gli isozimi differiscono tra di loro
anche sotto il profilo funzionale e presentano
differenze quanto ad optimum di pH, ad affinità,
espressa in termini di costante di Michaelis per il
substrato o i coenzimi.
Nel siero, dove sono presenti enzimi provenienti
da localizzazioni cellulari e tissutali diverse,
alcune attività enzimatiche sono sostenute da
più isoenzimi.
Esochinasi:
inibita dal glucosio 6-P
Isoenzima tipo I: nel cervello
(attivato dal Pi)
Isoenzima tipo II: nel muscolo
Deficienza ereditaria di
esochinasi (anemia emolitica)
Nel fegato sono presenti
entrambi gli enzimi.
Glucochinasi
1. Presente nel fegato
2. Specificità per il glucosio
3. Bassa affinità
4. Inducibile (dieta, insulina)
Fosfofruttochinasi II o enzima bifunzionale PFK/FBPasi
Fegato e cuore contengono differenti isoenzimi
dell’enzima bifunzionale PFK/FBPasi che danno
differente risposta allo stesso ormone (adrenalina).
adrenalina
glucagone
Fegato:
(inibizione della glicolisi)
Cuore:
(attivazione glicolisi)