studio di singoli geni, tramite il loro effetto fenotipico, e delle modalità di trasmissione in famiglie e nelle popolazioni
studio dei geni, della struttura molecolare, delle funzioni e delle loro interazioni con il patrimonio genico e con i fattori ambientali Rilevanza clinica delle malattie genetiche
• circa il 25% di tutti i pazienti in età pediatrica manifestano problemi associati a malattie genetiche/ereditarie
• alcune malattie ereditarie si manifestano molto tempo dopo la nascita (vengono chiamate “ad esordio tardivo”, per esempio il morbo di Alzheimer, la malattia di Huntington)
• alcune malattie ereditarie sono molto più frequenti in alcune popolazioni (per esempio: la fibrosi cistica tra gli Europei, l’anemia falciforme nel Mediterraneo ed in Africa, il Tay­Sachs negli Ebrei askenaziti)
Malattie genetiche
•Non tutte le malattie genetiche sono ereditarie
•Non tutte le malattie genetiche ereditarie sono congenite
•Non tutte le malattie congenite sono ereditarie
Tumori
malattie genetiche NON ereditarie
Corea di Huntington
malattie genetiche ereditarie NON congenite
Coroido­retinite necrotizzante
Cataratta congenita rosolia malattie congenite NON genetiche
Idrocefalo
congenito
toxoplasmosi
Malattie genetiche
•Geniche semplici (monofattoriali)
•Geniche complesse (poligeniche o polifattoriali)
•Cromosomiche
malattie geniche semplici (monofattoriali)
•Ereditarie
•Modalità di trasmissione mendeliana
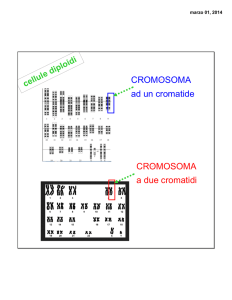
Il DNA è presente in due sedi: nel nucleo e nei mitocondri
Cromosomi: autosomici
sessuali (X)
Trasmissione mendeliana classica
Trasmissione non classica
E r e d it a r ie t à m e n d e lia n a c la s s ic a
•
•
a u t o s o m ic a v s . X ­ lin k e d
d o m in a n t e v s . r e c e s s iv a
Malattie Autosomiche Dominanti
I
1
2
3
4
II
1
2
1
2
3
4
5
6
7
8
III
3
4
5
6
7
8
Malattie Autosomiche Dominanti
• Gli eterozigoti per un allele mutante sono affetti
• Individui affetti in generazioni multiple
• Affetti in ugual misura maschi e femmine
• Rischio di ricorrenza 50%
• Possibilità di nuove mutazioni
Malattie Autosomiche Recessive
Fibrosi Cistica
Fibrosi Cistica
Fibrosi Cistica
Fibrosi Cistica
Sordità, AR
Sordità, AR
Malattie Autosomiche Recessive
•
•
•
•
•
Richiedono due copie dell’ allele mutante
Gli eterozigoti sono portatori sani (“carriers”)
Individui affetti di solito in una sola generazione
Affetti in ugual misura maschi e femmine
Rischio di ricorrenza 25%
Malattie X­linked recessive
Daltonismo
Da nonno a nipote attraverso le femmine
M a la t t ie X ­ lin k e d r e c e s s iv e
• Trasmissione da madri “carrier” a figli maschi
• Tutte le figlie di maschi affetti sono “carriers”
• Penetranza e espressività nelle femmine influenzata dall’inattivazione della X
• 1/3 dei caratteri genetici letali, nuove mutazioni
Rachitismo Vit D resistente
Malattie X­linked recessive
Rachitismo Vit D resistente
Malattie X­linked recessive
M a la t t ie X ­ lin k e d d o m in a n t i
• Trasmissione da femmine a figli di entrambi I sessi
• Tutte le figlie di maschi affetti sono affette
• Penetranza e espressività nelle femmine influenzata dall’inattivazione della X
G e n o t ip o v s . F e n o t ip o
• Una mutazione, una malattia
anemia “sickle cell”, acondroplasia
• Molte mutazioni, una malattia
fibrosi cistica:
sufficienza pancreatica
età alla diagnosi
concentrazione del Cl nel sudore • Mutazioni diverse, malattie differenti
RET proto­oncogene:
malattia di Hirschsprung vs. sindromi cancerose
• Geni multipli, una malattia
cancro non­poliposico del colon (diversi geni)
Fattori di complicazione-1
Penetranza:
frequenza (probabilità) che un genotipo esprima il fenotipo (clinico)
– la penetranza incompleta di un carattere si manifesta in una proporzione di figli affetti minore di quella attesa dalle proporzioni mendeliane (comunemente il 50% e 25% nei casi di caratteri autosomici rispettivamente dominanti e recessivi)
– molte malattie autosomiche dominanti sono a penetranza incompleta: vengono all’osservazione come fenotipi che saltano una generazione
– si esprime come una percentuale o una frazione di uno
Esempio: Ritardo mentale da sindrome dell’X
fragile: penetranza del 80% (8 su 10 con il
genotipo della malattia esprimono il fenotipo)
Penetranza incompleta, AD
Espressività:
gravità del fenotipo a parità di genotipo
– individui differenti, pur avendo lo stesso genotipo, possono essere affetti
in misura più o meno grave
Esempio: la Neurofibromatosi 1 si può manifestare solo con chiazze caffè
latte, neurofibromi multipli, neurofibromi plessiformi o tumori cerebrali
Pleiotropia:
un gene si manifesta con una varietà di effetti fenotipici
– anomalie morfologiche, biochimiche, fisiologiche, o cliniche multiple
Esempio: la sindrome di Marfan, si manifesta con un ampio spettro di
gravità clinica:
difetti a carico dello scheletro, del cuore e
degli occhi
Infatti la S. di Marfan è un disordine del
connettivo ed essendo questo tessuto diffuso in
tutto l’organismo, possono risultare affetti ossa,
legamenti, occhio cuore a grandi vasi.
Se ad essere interessata è l’aorta, la malattia
può assumere un decorso fatale.
Eterogeneità genica:
lo stesso fenotipo causato da mutazioni in geni diversi
– mutazioni in geni che codificano per diverse unità o subunità di una
proteina, o per proteine che interagiscono con altre proteine, o che
agiscono a stadi diversi di un processo metabolico
Esempio: Osteogenesis Imperfecta (OI), La tripla elica
del collagene di tipo I è formata da 2 catene α1
(codificate sul cromosoma 17) e 1 catena α2 (codificata
sul cromosoma 7). Mutazioni nei geni che modificano la
produzione o la struttura di queste catene danno luogo a
diversi tipi clinici di OI.
Eterozigosi composta:
fenotipo causato da eterozigosi per mutazioni diverse nello
stesso gene
- Esempio: Emocromatosi (HFE) più spesso sostenuta dalla mutazione C282Y,
con decorso severo senza terapia, può anche essere dovuta ad eterozigosi
composta per C282Y/H63D: in tal caso l’espressione è lieve e a bassa
penetranza
Manifestazione tardiva:
gene mutato presente nel genoma ma con manifestazione in
età avanzata
- Esempio: Corea di Huntington, malattia neurodegenerativa a lenta ma
inesorabile progressione che inizia a manifestarsi mediamente attorno alla 4°
decade di vita pur essendo autosomica dominante
Anticipazione:
il gene mutato, che di norma si manifesta in età avanzata,
tende ad anticipare la sua manifestazione con il passare
delle generazioni
- Esempio: Corea di Huntington, tipica condizione che presenta anticipazione*
soprattutto se a trasmetterla è il padre.
*Vedremo come questo fenomeno abbia una ben precisa base
molecolare
Geni modificatori
geni che influenzano* l’espressione di altri geni.
- Esempio: il carattere “fossetta” delle guance
o del mento è ereditato come carattere
autosomico dominante ma è sotto l’effetto di
un gene modificatore che ne condiziona
l’espressione. Il carattere si manifesta solo in
opportuni genotipi.
Se M è il gene modificatore dominante e C è il gene per la
fossetta, vi saranno solo tre genotipi compatibili con la
manifestazione del carattere.
* v. penetranza
MC
Mc
mC
mc
MC
MMCC
MMCc
MmCC
MmCc
Mc
MMCc
MMcc
MmCc
Mmcc
mC
MmCC
MmCc
mmCC
mmCc
mc
MmCc
Mmcc
mmCc
mmcc
“Genomic imprinting”
Rappresenta un’altra modalità di controllo epigenetico
dell’espressione genica e gioca un ruolo fondamentale nello
sviluppo animale e vegetale, dove è essenziale ottenere una
stabile repressione di geni in specifiche cellule e in epoche
ben definite dello sviluppo.
Si dicono soggetti ad
“imprinting” quei geni
la cui espressione
dipende dal fatto che
siano ereditati del
padre o dalla madre.
Negli ultimi anni è divenuto chiaro che l’effetto “silenziamento”
dei geni sottoposti ad “imprinting” è per la maggior parte
dovuto alla metilazione del DNA. Gli alleli materni e paterni dei
loci “imprinted” possiedono regioni caratterizzate da una
metilazione differenziale (differentially methylated regions' - DMRs), dove
l’allele non espresso generalmente è maggiormente metilato.
metile
L’imprinting è essenziale per il normale sviluppo dei mammiferi
ed è ora noto che rappresenta un fattore determinante per un
crescente numero di malattie e neoplasie. Per un normale
sviluppo o per una fisiologica funzione i geni “imprinted”
devono essere espressi come segue:
Se questo meccanismo viene alterato in modo che sia
rappresentato solo l’allele materno o quello paterno, si
manifesta una patologia.
Al momento sono noti almeno una cinquantina di geni
sottoposti ad imprinting sia nell’uomo che nel topo, la cui
errata trascrizione determina patologie più o meno severe.
-Esempio: nell’uomo la
regione 15q11-13 è
sottoposta ad imprinting.
In caso di delezione* della
regione, si avrà la
Sindrome di Prader-Willi
(PWS) oppure la
Sindrome di Angelman
(AS) a seconda della
provenienza materna o
paterna dell’unico allele
allele solo
paterno
allele solo
materno
Prader-Willi
* Delezione = perdita (v. oltre)
Angelman
Disomia uniparentale (UPD)*
Nel caso in cui vi siano due copie dell’allele materno e
l’assenza del trascritto paterno (assenza degli alleli paterni),
ci si trova di fronte alla disomia uniparentale materna. Nel
caso in cui siano assenti gli alleli materni e vi sia doppia dose
dell’allele paterno si avrà la disomia uniparentale paterna, in
entrambi i casi si avrà una iperespressione degli alleli attivi
con conseguenze patologiche simili a quelle determinate da
difettoso “imprinting”.
-Esempio: per quanto
riguarda la regione
15q11-13, la PWS per
UPD materna e la AS
per l’UPD paterna (2030% dei casi)
.
*tre possibili meccanismi (v. oltre)
UPD
Meccanismi:
•Perdita di un cromosoma da parte di uno zigote
trisomico ("trisomic rescue“).
•Duplicazione di un cromosoma in uno zigote
monosomico ("monosomic rescue“).
•Fecondazione di un gamete con due copie di un
cromosoma da parte di un gamete privo di quel
cromosoma (“gamete complementation”).
Tutti questi meccanismi richiedono due errori consecutivi.
•
“Trisomic rescue” in seguito a errore in meiosi I
zigote trisomico
Cromosomi giallo e blu di origine
materna, verde di origine paterna
rescue
Tre possibilità:
•Il cromosoma giallo può venire perso, lasciando quello blu (materno) e quello
verde (paterno), Normale
•Il cromosoma blu può venire perso, lasciando quello giallo (materno) e
quello verde (paterno), Normale, oppure
•Il cromosoma verde può venire perso , lasciando quello giallo (materno) e
quello blu (materno), UPD*
•
“Trisomic rescue” in seguito a errore in meiosi I
zigote trisomico
Cromosomi giallo e blu di origine
materna, verde di origine paterna
Tre possibilità:
rescue
Disomia
uniparentale
materna
monosomia
•Il cromosoma giallo può venire perso, lasciando quello blu (materno) e quello
verde (paterno), Normale
•Il cromosoma blu può venire perso, lasciando quello giallo (materno) e
quello verde (paterno), Normale, oppure
•Il cromosoma verde può venire perso , lasciando quello giallo (materno) e
quello blu (materno), UPD*
•
“Trisomic rescue” in seguito a errore in meiosi I
zigote trisomico
Cromosomi giallo e blu di origine
materna, verde di origine paterna
Tre possibilità:
rescue
Disomia
uniparentale
materna
monosomia
•Il cromosoma giallo può venire perso, lasciando quello blu (materno) e quello
verde (paterno), Normale
•Il cromosoma blu può venire perso, lasciando quello giallo (materno) e
quello verde (paterno), Normale, oppure
•Il cromosoma verde può venire perso , lasciando quello giallo (materno) e
quello blu (materno), UPD*
* In questo caso si parla di eterodisomia uniparentale
•
“Trisomic rescue” in seguito a errore in meiosi II.
zigote trisomico
Cromosomi blu di origine materna,
verde di origine paterna
•
“Trisomic rescue” in seguito a errore in meiosi II.
zigote trisomico
Cromosomi blu di origine materna,
verde di origine paterna
rescue
Disomia
uniparentale
materna
Tre possibilità, di cui due identiche:
monosomia
•2 volte un cromosoma blu può venire perso, lasciando un blu (materno) e
quello verde (paterno), Normale.
•Il cromosoma verde può venire perso, lasciando i due blu (materni), UPD*
•
“Trisomic rescue” in seguito a errore in meiosi II.
zigote trisomico
Cromosomi blu di origine materna,
verde di origine paterna
rescue
Disomia
uniparentale
materna
Tre possibilità, di cui due identiche:
monosomia
•2 volte un cromosoma blu può venire perso, lasciando un blu (materno) e
quello verde (paterno), Normale.
•Il cromosoma verde può venire perso, lasciando i due blu (materni), UPD*
* In questo caso si parla di isodisomia uniparentale
Mosaico
definizione:
contemporanea presenza di due (o più) linee
cellulari con diverso patrimonio genetico nello
stesso individuo
mosaico
Cellula indifferenziata
(embrionale)
Linea germinale
Linea somatica
M
Mosaicismo germinale
Mosaicismo germinale
AD
Cellula indifferenziata
(embrionale)
Linea germinale
Linea somatica
M
Mosaicismo somatico
Linee di Blaschko
Eredit ariet à mendeliana
classica
•
•
Eredit à mit ocondriale
Pat ologia da DN A repeat s
non
Eredit ariet à Non- Mendeliana : il
Genoma Mit ocondriale
•Ereditarietà strettamente materna
•Elevato numero di copie di mtDNA nella maggior parte delle
cellule
•La maggior parte delle copie identiche: omoplasmia
•Mutazioni ritrovate solo in alcune copie: eteroplasmia
•Disordini dei tessuti fortemente dipendenti dalla
fosforilazione ossidativa (cuore, muscoli scheletrici, SNC)
•Variabilità clinica dovuta all’eteroplasmia nei tessuti bersaglio
•Esempi: neuropatia ottica ereditaria di Leber
•Encefalomiopatia mitocondriale con “ragged-red muscle
fibers” (MERRF)
Eredità mitocondriale
Atrofia nervo ottico di Leber
Patologia da “DNA repeats”
Malattie associate ad espansioni ripetute
di trinucleotidi
NB = Mutazioni instabili o dinamiche
Patologia da “DNA repeats”
Le espansioni ripetute di trinucleotidi interferiscono
con l’espressione del gene o della proteina codificata
Patologia da “DNA repeats”
Le espansioni ripetute di trinucleotidi interferiscono
con l’espressione del gene o della proteina codificata
Patologia da “DNA repeats”
Le espansioni ripetute di trinucleotidi interferiscono
con l’espressione del gene o della proteina codificata
Patologia da “DNA repeats”
Le espansioni ripetute di trinucleotidi interferiscono
con l’espressione del gene o della proteina codificata
Mutazione instabile o dinamica
Il numero di triplette è soggetto a “espansione”, cioè ad
aumentare con il passare delle generazioni
•Premutazione (fenotipo normale)
•mutazione piena
Es. Sindrome X fragile
(FRAX o Sindrome di Martin-Bell)
La più comune causa di ritardo mentale dopo la
Sindrome di Down
Numero normale di alleli: ~ 20-40 (stabili)
Numero intermedio: premutazione ~55-200, (instabili):
possono espandersi fino a mutazione piena (>200)
solo se trasmessi per via materna