Gennaio-Marzo 2012 • Vol. 42 • N. 165 • pp. 37-42
OCULISTICA
La cataratta congenita:
iter diagnostico-terapeutico
Adriano Magli*, Elena Piozzi**, Eduardo Maselli***, Giovanni Marsico* **,
Francesco Matarazzo*, Luca Rombetto*
Dipartimento di Scienze Oftalmologiche, Area Funzionale di Oftalmologia Pediatrica, Università degli Studi di Napoli Federico II; ** SC Oculistica Pediatrica Ospedale “Niguarda Ca’ Granda”, Milano; *** AO Sondrio, Primario Emerito Oftalmologia
* Riassunto
L’articolo si propone di approfondire le tappe fondamentali del percorso diagnostico e terapeutico della cataratta congenita, focalizzando l’attenzione sulla
collaborazione tra pediatra ed oculista. Dal punto di vista diagnostico, screening e diagnosi precoce sono essenziali ai fini dell’efficacia della terapia, così
come critica appare la scelta del tipo e del timing dell’intervento prescelto. Il raggiungimento di un outcome visivo soddisfacente viene assicurato grazie
ad un attento follow-up e ad un trattamento antiambliopico aggressivo.
Summary
The article deals with the main stages of the congenital cataract management, focusing on diagnosis and therapy. We underline the importance of screening process and early diagnosis for a successful visual outcome. We also discuss the surgical options and the timing of surgery and the relevance of visual
rehabilitation, patching and spectacles correction as an essential part of therapy.
Introduzione
La cataratta congenita, definita come opacità del cristallino che si
manifesta in un tempo compreso tra la nascita e il 12° mese di
vita, ha un’incidenza di 1-6 casi su 10.000 nati vivi, e rappresenta
un’importante causa di cecità nel mondo (Foster et al., 1992; Abrahamsson et al., 1999).
Essa, se non adeguatamente trattata, compromette in maniera permanente lo sviluppo visivo del bambino, determinando un deficit che
va dall’ambliopia fino alla cecità. L’ambliopia è infatti curabile ma
solo se diagnosticata e trattata precocemente. Per questo motivo, la
collaborazione pediatra-oculista per l’individuazione precoce e per
la pianificazione di un corretto iter diagnostico-terapeutico è cruciale nella gestione della cataratta congenita. (You et al., 2011)
Metodologia
Per la revisione della letteratura è stato utilizzato il motore di ricerca Pubmed (http://www.ncbi.nlm.nih.gov/pubmed). L’argomento
oggetto di questa revisione è stato selezionato tra gli articoli delle riviste specializzate in Oftalmologia Pediatrica, in particolare dal
gennaio 2007 al marzo 2011.
Eziologia
L’eziologia della cataratta congenita è molteplice (Tab. I): per circa
un terzo è ereditaria, per un terzo associata ad altre malattie o sindromi, e per il rimanente terzo è idiopatica (Haargaard et al., 2004).
La cataratta ereditaria isolata rappresenta circa il 25% dei casi e
la modalità di trasmissione più frequente è quella autosomica dominante; 26 dei 39 loci mappati sono stati associati a mutazioni
in specifici geni, che codificano nel 50% dei casi per α-crystallin,
β-crystallin, γ-crystallin (proteine “chaperone-like” importanti per
il mantenimento della trasparenza del cristallino), nell’altro 25%
per connessine (proteine costituenti delle gap-junction), nel restante 25% per altre proteine quali “heat shock transcription factor-4”
(HSF4), “aquaporin-0” (AQP0), “beaded filament structural protein-2” (BFSP2).
Tra le altre cause più frequenti di cataratta congenita vi sono poi
le anomalie cromosomiche (in particolare la sindrome di Down), i
disturbi del metabolismo e l’infezione da rosolia (Kanski, 2007).
La cataratta può presentarsi mono- o bilateralmente. Le cataratte congenite monolaterali, a differenza di quelle bilaterali, sono più
spesso legate a disgenesie locali oculari e non a patologie sistemiche/ereditarie. Tuttavia la cataratta congenita si manifesta nei 2/3
dei casi bilateralmente. (Hejtmancik, 2008).
Lo screening
Selezionare i bambini che hanno bisogno di una visita oftalmologica approfondita è il primo passo nell’iter diagnostico della cataratta
congenita. Questo deve essere realizzato il più precocemente possibile, già dai primi giorni di vita.
I fattori da prendere in considerazione nello screening sono:
1) un’anamnesi familiare positiva per cataratta congenita o per altre malattie che si associano a cataratta congenita (Tab. I);
2) basso peso alla nascita (Haargaard, 2005);
3) anomalie del riflesso rosso.
Quest’ultimo è usato per valutare la trasparenza dei mezzi diottrici. Viene eseguito puntando una mira luminosa in ciascun occhio,
oppure con un oftalmoscopio diretto che illumina simultaneamente
le due pupille (Bruckner test). L’esaminatore deve rispondere alle
seguenti domande:
- il riflesso rosso è presente in entrambi gli occhi?
- i riflessi sono simmetrici nei due occhi?
- la qualità del riflesso è da considerarsi normale nel bambino
37
A. Magli et al.
Tabella I.
Cataratta congenita – classificazione eziologica (Wilson, 2005).
Isolata
Ereditaria
Autosomica dominante
Autosomica recessiva
X- linked
Sporadica
(1p36, 2p12, 15q21-q22, 20p12-q12)
(3p22-p24.2, 19q13.4, 9q13-q22)
(Xp22.13)
Parte di una sindrome o di una
patologia sistemica
Ereditaria
Associata a patologie renali
Sindrome di Alport
Sindr. oculocerebrorenale di Lowe
Associata a patologie del sistema nervoso
centrale
Sindrome di Smith-Lemli-Opitz
Sindrome di Laurence-Moon-Bardet-Biedel
Associata a patologie scheletriche
Sindrome di Marfan
Sindrome di Conradi
Sindrome epifisi punteggiate
Associata ad anomalie cranio-facciali
Sindrome di Hallermann-Streiff
Sindrome di Pierre Robin
Malattia di Crouzon
Sindrome di Apert
Oxicefalia
Associata alla polidattilia
Sindrome di Rubinstein-Taybi
Associata a patologie della cute
Sindrome di Siemen
Dermatite atopica
Sindrome di Marshall
Sindrome di Cockayne
Associata a cromosomopatie
Trisomia 13
Trisomia 18
Trisomia 21
Sindrome di Turner
Associata a patologie metaboliche
Galattosemia
Deficit di galattochinasi
Malattia di Fabry
Mannosidosi
Cause pre-natali
Rosolia
Toxoplasmosi
Varicella
CMV
HSV
Ipossia intrauterina
Cause post-natali
Retinopatia del prematuro
Ipoglicemia
Ipocalcemia
Radiazioni
Traumi
Uveiti croniche
Diabete mellito
Insufficienza renale
Associata ad altre anomalie oculari
Microftalmo
Aniridia
Retinite pigmentosa
Coloboma
Lenticono
Non
ereditaria
esaminato (tenendo conto della sua etnia e colore della pelle)?
Se la risposta ad una delle domande è “no” il riflesso rosso è da considerarsi anormale ed il bambino dovrà essere visitato da un oculista
esperto in oftalmologia pediatrica.
La visita oculistica e la morfologia della cataratta
La visita oculistica, durante l’esame di un bambino con sospetta cataratta congenita, ha due obiettivi principali: accertare la diagnosi e
valutare il grado di compromissione che la cataratta determina.
38
Gli esami necessari per confermare la diagnosi sono l’esame alla
lampada a fessura e l’oftalmoscopia binoculare indiretta (Lloyd et
al., 2007).
Una volta riscontrata la presenza di cataratta, è importante distinguerne la morfologia. Difatti per i chirurghi la classificazione morfologica è dirimente, poiché la decisione di intervenire dipende largamente dalla densità della cataratta (Taylor et al., 2005). I diversi
pattern di presentazione sono:
– Cataratta congenita polare: l’estensione è molto variabile; consiste in una opacità coinvolgente la zona polare anteriore o po-
La cataratta congenita: iter diagnostico-terapeutico
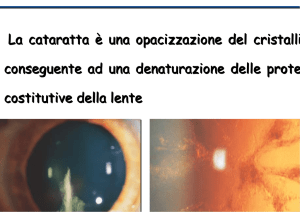
Figura 1.
Cataratta congenita lenticolare (zonulare).
La cataratta congenita di tipo lenticolare è spesso bilaterale e non si
associa frequentemente ad altre anomalie oculari congenite.
– Cataratta congenita subtotale/totale: sono opacità che coinvolgono tutto il cristallino, e possono essere bilaterali. Talvolta da
subtotali alla nascita possono evolvere rapidamente in totali
dopo pochi mesi e sono spesso associate a sublussazione della
lente. Sono associate a gravi sofferenze fetali e altre patologie
oculari come il microftalmo. (Wilson et al., 2005).
È importante sottolineare come la maggior parte dei tipi di cataratte,
se non trattate, diventeranno in maniera graduale cataratte totali.
Un passaggio decisivo, inoltre, è la valutazione dell’impegno visivo. Nei
bambini in età preverbale la misurazione dell’acuità visiva si limita alla
valutazione qualitativa della fissazione, dei movimenti di inseguimento e dalla fissazione preferenziale, attirando l’attenzione del bambino
verso il viso dell’esaminatore o di un genitore. Dato che i bambini con
un deficit visivo monolaterale si oppongono all’occlusione dell’occhio
sano, l’occlusione alternata degli occhi è una tecnica utilizzata per
giudicare il grado di resistenza opposto, valutando la qualità visiva
relativa in entrambi gli occhi. Una valutazione attendibile è però molto
difficile da ottenere nei bambini al di sotto dei 3 mesi di vita e nella maggior parte dei pazienti le informazioni più importanti derivano
dall’esame obiettivo e dalla valutazione morfologica della cataratta. La
scarsa visualizzazione del fundus fornisce importanti dati sulla significatività clinica, in termini di riduzione della capacità visiva. Inoltre alterazioni oculari quali strabismo e nistagmo suggeriscono una scarsa
capacità visiva (Fan et al., 2006).
steriore del cristallino. Alcune forme di cataratta polare anteriore
possono assumere un aspetto protrudente in camera anteriore
e presentare connessioni filamentose con la cornea (associate
a glaucoma). Le forme polari posteriori, invece, possono essere
suddivise in due tipologie, stabile e progressiva: la prima non
tende a progredire nel tempo ed è un residuo dell’arteria ialoidea, la seconda tende ad aumentare nel tempo estendendosi
verso l’equatore senza mai coinvolgere il nucleo.
– Cataratta congenita lenticolare: coinvolgono lo stroma del cristallino. Ne esistono forme differenti: suturale, assiale, zonulare
(o lamellare, Fig. 1), nucleare, corticale.
– Opacità congenita capsulare: possono coinvolgere la capsula
anteriore o posteriore (Fig. 2). Nel primo caso non superano
il millimetro di diametro, sono disposte ad anello alla media
periferia del cristallino, sono di aspetto biancastro, spesso
pigmentate. Nel secondo caso, invece, sono difficili da identificare sia per la localizzazione sulla faccia posteriore del
cristallino, sia per le piccoli dimensioni e per l’assenza di
pigmento.
I pazienti a rischio di sviluppare ambliopia da deprivazione e conseguente perdita della visione necessitano di intervento chirurgico. Le
opacità presenti sull’asse visivo maggiori di 3 mm, visibili con pupilla
non dilatata (Fig. 3), le cataratte posteriori e le cataratte omogeneamente dense sono associate a riduzione visiva maggiore. Per questi
pazienti è sicuramente indicato il trattamento chirurgico. Bambini
Figura 2.
Cataratta congenita polare posteriore.
La cataratta congenita polare posteriore è di solito unilaterale, può
associarsi a persistenza della vascolarizzazione fetale, microftalmo ed
anomalie della capsula. A causa di queste alterazioni associate, la rimozione chirurgica può risultare più difficoltosa.
Figura 3.
Cataratta nucleare densa in neonato con pupilla miotica.
La cataratta congenita nucleare è spesso evidente sin dai primi giorni
di vita, è densa, coinvolge l’asse visivo, ed i neonati che ne sono affetti
sono ad alto rischio di sviluppare ambliopia. Pertanto la terapia chirurgica va attuata precocemente.
Il trattamento chirurgico
Selezionati i pazienti da operare chirurgicamente, la problematica
verte intorno alla tempistica ed alla tecnica chirurgica da adoperare.
Quali pazienti operare?
39
A. Magli et al.
con opacità disomogenee e subcliniche, invece, non sempre richiedono un approccio chirurgico precoce, ma necessitano comunque di
uno stretto follow-up (Zetterström et al., 2007).
Tabella II.
Complicanze post-operatorie.
Precoci
Tardive
Qual è la tempistica operatoria?
Attualmente il timing dell’intervento chirurgico è oggetto di un intenso dibattito scientifico. Sebbene non vi sia ancora una scelta univoca, è largamente condivisa l’opinione che la cataratta bilaterale
densa va operata entro i 2-3 mesi di vita nella stessa seduta simultaneamente (Totan et al., 2009; Magli et al., 2009; Dave et al., 2010),
che la cataratta monolaterale densa deve essere operata entro 1-2
mesi di vita (Fan et al., 2006) e che le cataratte unilaterali e bilaterali
possono essere operate verso i 2-3 anni d’età (Chak et al., 2006).
L’attenzione deve essere rivolta al raggiungimento del giusto equilibrio tra un approccio chirurgico precoce, che permette un migliore
outcome visivo (Kim et al., 2010) e le complicanze che invece sono
annesse alla precocità stessa dell’intervento chirurgico (Zetterström
et al., 2007).
• Infiammazione intraoculare
• Opacizzazione della capsula
posteriore
• Edema corneale
• Formazione di membrane fibrose
• Endoftalmite
• Pigmentazione della IOL
Quali sono le tecniche chirurgiche e quando impiantare la
Lente Intraoculare?
Le tecniche chirurgiche adoperate sono varie e dipendono dall’età
del bambino e dall’esperienza del chirurgo. La chirurgia standard
della cataratta congenita in bambini con meno di sei mesi comprende aspirazione del cristallino, capsulectomia posteriore primaria e
vitrectomia anteriore (Lambert et al., 2006).
Il paziente, operato di cataratta, è reso a questo punto afachico
dall’intervento primario; il cristallino rimosso deve quindi essere
sostituito artificialmente tramite Lente Intraoculare (IOL). L’impianto
della IOL rimane ancora controverso e materia attuale di studi e discussioni. Questo può essere primario, nella stessa seduta dell’aspirazione della cataratta, oppure secondario, dopo un periodo di correzione con lenti a contatto (LAC).
Nei piccoli operati di cataratta congenita monolaterale, è da preferire l’impianto primario. Nei casi operati bilateralmente e simultaneamente, si preferisce l’impianto secondario (Magli et al., 2008).
Perché è importante la scelta della IOL?
È ben documentato che i bambini alla nascita sono ipermetropi, e
raggiungono gradualmente l’emmetropia durante i primi anni di vita.
Questo processo, chiamato emmetropizzazione, riflette cambiamenti della crescita oculare finemente regolati, in cui all’aumento della
lunghezza assiale (dai 16,8 mm alla nascita ai 23,6 mm nell’adulto)
corrisponde una diminuzione del potere refrattivo del cristallino (dai
34,4 D a 18,8 D) (Gordon et al., 1985).
Per garantire un adeguato stato refrattivo, bisogna tener conto di questi cambiamenti e dell’effetto che la IOL stessa ha nel
processo dell’emmetropizzazione quando si sceglie il potere del
cristallino artificiale. La IOL, a differenza del cristallino, ha un
potere refrattivo che non varia nel tempo e quindi con l’aumentare fisiologico della lunghezza dell’asse visivo determinerà una
miopia di entità tanto maggiore quanto più precocemente è stato
eseguito l’impianto, con il risultato di uno stato refrattivo inadeguato e la necessità di sostituire la IOL con una di minor potere
(Hoevenaars et al., 2010; Lloyd et al., 2007). Per questo motivo,
in base all’età del bambino, si preferisce impiantare una IOL che
lascia l’occhio inizialmente ipermetrope ma che nel tempo risulterà emmetrope.
Altri Autori, invece, preferiscono garantire un adeguato stato refrattivo con l’uso di LAC di alto potere diottrico ed impiantare secondariamente la IOL verso i tre anni d’età. Questa strategia terapeutica
40
• Decontrazione della IOL
• Glaucoma
• Distacco di retina
permette di adattare più facilmente la correzione ottica ai cambiamenti della refrazione, ma espone ad importanti effetti collaterali e
spesso il risultato è compromesso da una scarsa compliance (Magli
et al., 2008).
Per evitare il rischio di ambliopia è, inoltre, importante correggere
l’errore refrattivo residuo con l’uso di occhiali o lenti a contatto progressivamente adeguati nel corso del follow-up alle esigenze imposte dallo sviluppo refrattivo.
Il trattamento antiambliopico e il follow-up postoperatorio
Un attento follow-up dei bambini operati è essenziale per il raggiungimento di un buon risultato, rendendo possibile riconoscere
rapidamente eventuali complicanze post-operatorie (Tab. II). Poiché il primo mese, e la prima settimana in particolare, sono periodi ad alto rischio si raccomanda il seguente schema di controllo:
dopo 1 giorno, dopo 1 settimana, dopo 1 mese, dopo 3 mesi, infine ogni 6 mesi. Tali scadenze possono essere aumentate laddove
si riscontri la presenza di complicanze. Qualora il bambino, data
l’età, risulti non essere collaborante, si può effettuare una osservazione in narcosi.
La gestione della cura dell’ambliopia prevede un bendaggio occlusivo dell’occhio sano in caso di cataratta monolaterale e un bendaggio
alternato nei due occhi in caso di cataratta bilaterale. Il bendaggio
viene effettuato per stimolare l’uso dell’occhio ambliope (Li et al.,
2009; Suttle, 2010).
Nel caso di scarsa compliance, come terapia di seconda scelta si
prende in considerazione la terapia farmacologica con atropina. (Li
et al., 2009)
Il controllo dello stato rifrattivo è anch’esso di primaria importanza nel bambino operato di cataratta congenita, poiché un difetto
rifrattivo non adeguatamente corretto potrebbe essere un fattore
contribuente allo sviluppo dell’ambliopia, specie se tale situazione
si verifica nell’ambito di una cataratta congenita monolaterale (Fan
et al. 2006).
La rimozione del cristallino, inoltre, determina la perdita della capacità di accomodazione. Nei primi tre anni di vita, questa assenza
non necessita di correzione, successivamente, si effettua invece la
correzione tramite l’uso di lenti bifocali.
Prognosi
La diagnosi precoce, l’adeguato trattamento chirurgico e antiambliopico, il perfezionarsi di tecniche di microchirurgia e lo sviluppo di
nuove IOL ha contribuito in maniera determinante al miglioramento
della prognosi dei bambini con cataratta congenita (Lundvall et al.,
La cataratta congenita: iter diagnostico-terapeutico
2002). Tuttavia l’outcome visivo non supera i 5/10 di acuità visiva
con scarsa stereopsi in più della metà dei pazienti (Hussin et al.,
2009). I fattori che si associano ad un outcome visivo peggiore sono:
una diagnosi tardiva, nistagmo e strabismo pre-operatori, lo sviluppo di complicanze post-operatorie (Kim et al., 2008).
Conclusioni
La cataratta congenita è una patologia che necessita di una stretta
collaborazione tra pediatra ed oculista, soprattutto nella fase di scre-
ening e diagnosi, nonché nei casi di bambini affetti da altre malattie
associate. È inoltre ampiamente documentato il ruolo centrale della
diagnosi precoce per il raggiungimento di migliori outcome visivi.
I numerosi avanzamenti in ambito chirurgico e nello sviluppo di
nuove IOL hanno permesso migliori risultati terapeutici ed una diminuzione delle complicanze. Nonostante la chirurgia sia in primo
piano per il trattamento della cataratta congenita, il follow-up postoperatorio riveste un ruolo altrettanto fondamentale, richiedendo la
compartecipazione costante del pediatra e dell’oftalmologo pediatra
nel seguire l’evoluzione clinica del paziente.
Box di orientamento
• Negli ultimi anni la classificazione eziologica della cataratta congenita si è presentata come alternativa alla classificazione morfologica.
• Una diagnosi tardiva ed un intervento tardivo possono compromettere irreversibilmente lo sviluppo visivo del bambino.
• Per ottenere buoni outcome visivi l’intervento chirurgico da solo non è sufficiente ma bisogna effettuare un trattamento antiambliopico ed un
follow-up a lungo termine.
• Nonostante i progressi nel management della cataratta congenita l’outcome visivo non supera i 5/10 di acuità visiva con scarsa stereopsi in più
della metà dei pazienti.
• Lo sviluppo di nuove lenti intraoculari che si adattano alle esigenze refrattive del bambino in crescita è uno dei più promettenti campi di ricerca.
Bibliografia
Abrahamsson M, Magnusson G, Sjostrom A, et al. The occurrence of congenital
cataract in western Sweden. Acta Ophthalmol Scand 1999;77:578-80.
Awad AH, Mullaney PB, Al-Hamad A, et al. Secondary posterior chamber intraocular lens implantation in children. J AAPOS 1998;2:269-74.
Chak M, Wade A, Rahi JS. British Congenital Cataract Interest Group. Long-term
visual acuity and its predictors after surgery for congenital cataract: findings of the
British congenital cataract study. Invest Ophthalmol Vis Sci 2006;47(:4262-9.
** Studio che valuta l’outcome visivo in un campione di 153 bambini con un
follow-up medio di 7 anni. Sottolinea l’importanza dello screening nei neonati e
del follow-up post-chirurgico.
Dave H, Phoenix V, Becker ER, et al. Simultaneous vs sequential bilateral cataract
surgery for infants with congenital cataracts: Visual outcomes, adverse events,
and economic costs. Arch Ophthalmol 2010;128:1050-4.
DeVaro JM, Buckley EG, Awner S, et al. Secondary posterior chamber intraocular
lens implantation in pediatric patients. Am J Ophthalmol 1997;123:24-30.
Fan DS, Yip WW, Yu CB, et al. Updates on the surgical management of paediatric
cataract with primary intraocular lens implantation. Ann Acad Med Singapore
2006;35:564-70.
** Review che approfondisce il management chirurgico della cataratta congenita
e che sottolinea l’importanza del timing e del follow-up.
Foster A, Gilbert C. Epidemiology of childhood blindness. Eye 1992;6:173-6.
Gordon RA, Donzis PB. Refractive development of the human eye. Arch Ophthalmol 1985;103:785-9.
Haargaard B, Wohlfahrt J, Fledelius HC, et al. A nationwide Danish study of 1027
cases of congenital/infantile cataracts: etiological and clinical classifications.
Ophthalmology 2004;111:2292-8.
Haargaard B, Wohlfahrt J, Rosenberg T, et al. Risk factors for idiopathic congenital/infantile cataract. Invest Ophthalmol Vis Sci 2005;46:3067-73.
Hejtmancik JF. Congenital cataracts and their molecular genetics. Semin Cell
Dev Biol 2008;19:134-49.
* Articolo che propone una classificazione dei geni implicati nella patogenesi
della cataratta congenita.
Hoevenaars NE, Polling JR, Wolfs RC. Prediction error and myopic shift after
intraocular lens implantation in paediatric cataract patients. Br J Ophthalmol
2011;95:1082-5.
Hussin HM, Markham R. Long-term visual function outcomes of congenital cataract surgery with intraocular lens implantation in children under 5 years of age.
Eur J Ophthalmol 2009;19:754-61.
Kanski JJ. Clinical Ophthalmology – A systematic approach. 6th ed/. Edinburgh,
UK: Elsevier Masson 2007.
Kim KH, Ahn K, Chung ES, et al. Clinical outcomes of surgical techniques in
congenital cataracts. Korean J Ophthalmol 2008;22:87-91.
Kim DH, Kim JH, Kim SJ, et al. Long-term results of bilateral congenital cataract
treated with early cataract surgery, aphakic glasses and secondary IOL implantation. Acta Ophthalmol 2010 Sep 2 [Epub ahead of print].
Lambert SR, Drack AV. Infantile cataracts. Surv Ophthalmol 1996;40:427-58.
Li T, Shotton K. Conventional occlusion versus pharmacologic penalization for
amblyopia. Cochrane Database Syst Rev 2009;(4):CD006460.
Lloyd IC, Ashworth J, Biswas S, et al. Advances in the management of congenital
and infantile cataract. Eye (Lond) 2007;21:1301-9.
Lundvall A, Kugelberg U. Outcome after treatment of congenital bilateral cataract. Acta Ophthalmol Scand 2002;80:593-7.
Magli A, Fimiani F, Bruzzese D, et al. Congenital cataract extraction with primary
aphakia and secondary intraocular lens implantation in the posterior chamber.
Eur J Ophthalmol 2008;18:903-9.
Magli A, Fimiani F, Passaro V, et al. Simultaneous surgery in bilateral congenital
cataract. Eur J Ophthalmol 2009;19:24-7.
Muen W, Hindocha M, Reddy M. The role of education in the promotion of red
reflex assessments. JRSM Short Rep 2010;1:46.
Suttle CM. Active treatments for amblyopia: a review of the methods and evidence base. Clin Exp Optom 2010;93:287-99.
Taylor D, Hoyt CS. Pediatric Ophthalmology and Strabismus. 3rd ed. London: Elsevier Saunders 2005.
Totan Y, Bayramlar H, Yilmaz H. Bilateral paediatric cataract surgery in the same
session. Eye (Lond) 2009;23:1199-2009.
* Studio dettagliato che amplia i dati di un precedente lavoro dello stesso gruppo
di studio; dimostra la validità dell’approccio chirurgico simultaneo.
Wilson ME, Trivedi RH., Pandey SK. Pediatric Cataract Surgery. Philadelphia, PA:
Lippincott Williams & Wilkins 2005.
You C, Wu X, Zhang Y, et al. Visual impairment and delay in presentation for surgery
in chinese pediatric patients with cataract. Ophthalmology 2011;118:17-23.
** Studio retrospettivo su un campione di 196 bambini con cataratta congenita che
dimostra l’importanza della diagnosi precoce per una migliore funzionalità visiva.
Zetterström C, Kugelberg M. Paediatric cataract surgery. Acta Ophthalmol Scand
2007;85:698-710.
* Review che affronta le tematiche chirurgiche principali, le complicanze ed i
fattori associati ad un miglior risultato terapeutico.
41
A. Magli et al.
Glossario
Afachico: occhio privo di cristallino, privato di conseguenza sia della sua capacità rifrattiva che accomodativa.
Ambliopia: riduzione unilaterale o raramente bilaterale dall’acuità visiva, dopo
la correzione ottica migliore, in cui non sia evidenziabile un’alterazione patologica organica dell’occhio o delle vie ottiche. Può essere infatti determinata da
una interazione binoculare anomala e/o da una deprivazione visiva (ad esempio
cataratta congenita). Il termine deriva dal greco, “ops” (“visione”) e “amblyos”
(“ottusa, pigra”): il suo nome comune è occhio pigro.
Aniridia: assenza dell’iride.
Coloboma: assenza di parte di una struttura oculare come risultato di
un’incompleta chiusura della fessura embrionale, che può coinvolgere l’intera
lunghezza della fessura (coloboma completo) o solo parte di essa (per esempio
l’iride, corpo ciliare, retina e coroide, o disco ottico).
Emmetropia: condizione normale dell’occhio in stato di riposo per cui i raggi paralleli provenienti da un oggetto posto a grande distanza (teoricamente all’infinito)
hanno il loro fuoco esattamente sulla retina e formano immagini nitide.
IOL: Lente Intraoculare.
Stereopsi: percezione della profondità. Ciascun occhio coglie immagini lievemente differenti di un oggetto, e la fusione di queste immagini diverse dà come
risultato una percezione visiva singola dell’oggetto in profondità.
Immagini da: Zetterström C, Kugelberg M. Paediatric cataract surgery. Acta Ophthalmol Scand 2007 Nov; 85(7):698-710
Corrispondenza
Prof. Adriano Magli, Dipartimento di Scienze Oftalmologiche, Facoltà di Medicina e Chirurgia, Università degli Studi di Napoli Federico II, via Sergio
Pansini 5, 80100 Napoli. Tel. +39 081 7462467. Fax: +39 081 7462467. E-mail: [email protected]
42