CORSO DI FORMAZIONE E AGGIORNAMENTO
A.S. 2012/2013
Aspettando le Olimpiadi delle Neuroscienze 2013
“I misteri del cervello malato”
una introduzione teorico-pratica allo studio delle patologie cerebrali.
In collaborazione con l’Università degli Studi di Trento, il Centro per la Biologia Integrata (CIBIO) ,
il Centro Mente/Cervello (CIMeC) di Rovereto, la Fondazione Museo Civico di Rovereto, l’Università
di Trieste, BRAIN, Life Learning Center UNITS e Science Centre Immaginario Scientifico di Trieste.
INTERVENTO
Lunedi 17/12/2012
Laboratorio Biotecnologie UniTN Povo
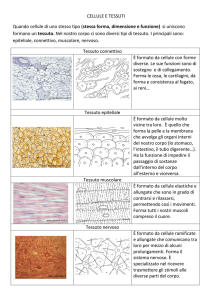
Colorazioni istologiche di tessuto nervoso
A cura di :Dr. Yuri Bozzi, CIBIO – Università di Trento e Istituto di Neuroscienze del CNR;
Dott.ssa Paola Sgadò e Dott. Giovanni Provenzano, CIBIO – Università di Trento
PROTOCOLLO DELL’ESERCITAZIONE DI LABORATORIO
COLORIAMO I NEURONI CON IL BLU DI METILENE E L’EOSINA
INTRODUZIONE
Il protocollo che verrà utilizzato è semplicissimo e serve per colorare i neuroni di un tessuto
cerebrale come ad esempio quello di coniglio. Tutto il necessario per eseguire l'esperimento è
facilmente reperibile nei laboratori didattici, in farmacia, macelleria o supermercato.
L’allestimento dei preparati istologici da osservare al microscopio o allo stereoscopio implica
una serie di operazioni che possono essere, a grandi linee, riassunte così:
- Prelievo
- Fissazione con alcool etilico al 95% per 48 ore
- Taglio del tessuto cerebrale
- Idratazione mediante scala discendente di alcooli (alcool etilico 95° 3 minuti; alcool etilico
70° 3 minuti; alcool etilico 50° 3 minuti, acqua 1 minuto)
- Colorazione con blu di metilene (soluzione madre all’1-2% diluita 1/3 in acqua)
- Se necessario togliere l’eccesso di colorante immergendo il tessuto in alcool etilico 70° per 2
minuti
- Un lavaggio in acqua
- Colorazione con eosina (soluzione madre all’1-2% diluita 1/5 in acqua)
- Se necessario togliere l’eccesso di colorante immergendo il tessuto in alcool etilico 70° per 2
minuti
- Montaggio
- Osservazione
DESCRIZIONE DELLA PROCEDURA:
Una volta procurati i cervelli di coniglio, facilmente reperibili in macelleria, la prima
operazione da compiere è quella di fissare i tessuti. Questa fase deve avvenire nel più breve
tempo possibile, per evitare la comparsa di alterazioni autolitiche che porterebbero alla
distruzione delle cellule. La fissazione consiste quindi nel trattamento del tessuto con
procedimenti chimici o fisici capaci di preservare e stabilizzare i costituenti dei tessuti. Nella
nostra esperienza di laboratorio come liquido fissativo useremo dell’alcool etilico al 95%, nel
quale verranno immersi i cervelli per 48 ore. Successivamente il cervello di coniglio indurito
dal processo di fissazione potrà essere sezionato utilizzando delle lamette o dei bisturi.
L’osservazione al microscopio ottico necessita di sezioni talmente sottili da poter permettere il
passaggio dalla luce posta al di sotto dell’apparato oculare, che in ultima analisi rende
possibile l'osservazione del preparato. A questo punto, si procede con la idratazione del
tessuto e con le successive colorazioni. In ambito istologico e citologico vengono detti
“coloranti” quelle sostanze chimiche che si legano ai componenti cellulari permettendone così
la loro visualizzazione. Nel nostro esperimento useremo in modo sequenziale due differenti
tipi di coloranti, il blu di metilene e l’eosina che colorano rispettivamente i nuclei di blu e le
rimanenti zone della cellula in rosa. Al termine della colorazione si adageranno le fettine
colorate su un vetrino portaoggetto a cui successivamente verrà fatto aderire un coprioggetto,
si potranno quindi esaminare i preparati al microscopio ottico o allo sterescopio.
MATERIALI
•
•
•
•
•
•
•
•
•
•
•
Alcool etilico al 95% in alternativa può essere usato quello denaturato.
Acqua corrente
Blu di metilene 1-2% ed Eosina 1-2% (comunemente acquistabili in farmacia)
Bisturi
Forbici
Lamette da barba (Gillette Silver Blue)
Becker
Cilindri graduati
Piastre petri
Vetrini portaoggetto e coprioggetto
Stereoscopio / Microscopio