I COMPONENTI ELEMENTARI
DELLA MATERIA VIVENTE
L’acqua ed il carbonio
Psicobiologia – Lezione nr. 2
I componenti elementari della materia vivente
23 Bioelementi
Microelementi
Oligoelementi
Scarse percentuali ma
componenti obbligati
ed ubiquitari
Presenti solo in parte
nella materia vivte ma
compiti essenziali
(es. Fosforo, Calcio etc..)
(es. Ferro nel corpo
umano)
Macroelementi
•
•
•
•
Idrogeno
Carbonio
Ossigeno
Azoto
L’acqua
L’acqua è l’elemento più presente in
natura e la totalità degli esseri viventi
sono composti d’acqua in una buona
percentuale
Umani 70%
Neonato 80%
Medusa 90%
La convinzione che l'acqua fosse un elemento primitivo e indivisibile si protrasse fino agli
ultimi decenni del XVIII secolo, quando gli scienziati Lavoisier e Cavendish scoprirono che
questa sostanza è formata in realtà da due costituenti: idrogeno e ossigeno.
Nel 1742, Anders Celsius definì la scala di temperatura che prende il suo nome, ponendo il
punto di fusione dell'acqua (alla normale pressione atmosferica) a 0 gradi ed il punto di
ebollizione a 100 gradi.
La prima scomposizione dell'acqua in
idrogeno e ossigeno (i suoi componenti
elementari) fu eseguita nel 1800 dal chimico
inglese William Nicholson, tramite il processo
di elettrolisi.
Struttura molecolare dell’acqua
L’acqua è un dipolo con la carica negativa interamente posizionata verso l’atomo di ossigeno
e le cariche positive verso i due atomi di idrogeno.
Questo fa si che l’acqua possa legare facilmente legami a idrogeno.
Per via della debolezza dei legami idrogeno le molecole
dell’acqua allo stato liquido sono tenute insieme fra loro
ma allo stesso tempo si dividono fra loro costantemente,
formando nuovi legami con altre molecole d’acqua.
All’aumentare della temperatura i legami idrogeno
vengono invece totalmente eliminati e l’acqua passa
allo stato gassoso.
All’abbassarsi della temperatura le molecole si fermano
per via della mancata agitazione termica ed i legami
idrogeno rimangono stabili fra loro, portando alla
formazione del ghiaccio.
Poiché la lunghezza dei legami idrogeno «cristallizzati»
del ghiaccio è superiore a quella dei legami durante lo
stato liquido, il ghiaccio risulta essere meno denso
dell’acqua allo stato liquido.
Figura 1.10
Libro basi biologiche
Il gran numero di legami idrogeno è anche il responsabile di altre due importanti caratteristiche
dell’acqua:
La coesione consente alle masse d’acqua di muoversi insieme, anche in direzione antigravitazionale
La tensione superficiale dovuta all’orientamento dei legami H della superfice acquosa, consente alla
superfice dell’acqua di avere uno strato molecolare più compatto
Struttura molecolare dell’acqua
guscio di idratazione potere solvente di molecole polari
potere ionizzante, i.e. capacità di scindere i legami ionici liberando i
singoli ioni che diventano così ioni idratati
Sostanze idrofobe e legami idrofobi
Dissociazione dell’acqua
In una soluzione acquosa, raramente può accadere che un legame H, vince la forza di un
legame covalente, rubando il protone di un H, portando alla formazione di:
Ione Idronio H3O+ H+
Ione Ossidrile OH-
In una soluzione acquosa la reazione di dissociazione si mantiene in equilibrio, ovvero la
concentrazione degli ioni positivi e negativi è uguale fra loro e risponde al valore di 10 elevato alla -7,
tale valore può essere riportato tramite il suo logaritmo in base 10, cambiato di segno… e quindi
uguale a 7!
Tale valore viene definito pH e definisce la condizione di neutralità assoluta di una soluzione acquosa.
Figura 1.12
Libro basi biologiche
Il pH, le soluzioni acide e basiche
Se però nell’acqua vengono disciolte sostanze (dette acidi) capaci di rilasciare ioni idrogenioni H+ allora il
valore degli H+ supererà il valore degli OH- ed il valore del pH diverrà minore di 7.
Al contrario, se verranno introdotte sostanze (dette basi o basiche) che rilasciano OH- o in grado di
abbassare la concentrazione degli H- il pH salirà a valori maggiori di 7.
Di norma l’interno delle cellule è mantenuto in condizione di leggera basicità (pH 7,2-7,4)
Figura 1.12
Libro basi
biologiche
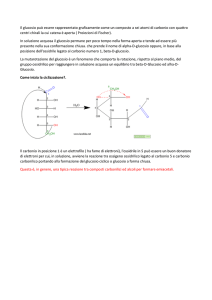
Il carbonio
È un elemento non metallico, insolubile nei solventi, inodore e insapore.
Le sue differenti forme (o più precisamente "allotropi") includono uno dei più morbidi (grafite) e dei più duri
(diamante) materiali conosciuti.
Inoltre, ha una grande affinità per i legami chimici con atomi di altri elementi a basso peso atomico (tra cui
il carbonio stesso) e le sue piccole dimensioni lo rendono in grado di formare legami multipli (proprietà che
viene definita "desmalusogenia"). Queste proprietà permettono l'esistenza di 10 milioni di composti del
carbonio.
Il carbonio si trova in tutte le forme di vita organica ed è la base della chimica organica.
Sebbene l'isotopo più comune sia il carbonio-12 (il cui nucleo è formato da 6 protoni e 6 neutroni), l'isotopo
carbonio-14 è anch'esso di fondamentale importanza per le sue applicazioni pratiche, essendo
comunemente usato per la datazione radioattiva di antichi reperti.
Il carbonio
Struttura atomica del carbonio
Legami covalenti rotazionali
Macromolecole
La prima forma strutturale corretta fu proposta nel 1865 dal chimico tedesco Friedrich August Kekulé von
Stradonitz.
Nel 1984 i biochimici John Wotiz, dell'Università dell'Illinois, e Susanna Rudofsky, dell'Università di Chicago,
vollero tuttavia approfondire il motivo che aveva spinto Kekulé a un silenzio di 25 anni sul suo metodo di
ricerca. Avuta l'autorizzazione da Klaus Hafner, direttore degli archivi di Kekulé all'Università di Darmstadt, i
due biochimici trovarono una lettera scritta nel 1854 ad un editore tedesco, in cui lo scienziato proponeva
la traduzione e la pubblicazione di un saggio del chimico francese Auguste Laurent. Inoltre, trovarono una
pubblicazione del 1858 in cui sempre Kekulé citava di nuovo il saggio di Laurent, ed in particolare pagina
408: il saggio non verrà più citato in alcun modo dallo scienziato tedesco.
Wotiz e Rudofsky cercarono il saggio di Laurent, lo trovarono, e a pagina 408 scoprirono che il chimico
francese proponeva per il cloruro di benzoile una formula di struttura esagonale. Quindi, quando nel 1866
Kekulé rese pubblica la formula, in realtà già la conosceva da 12 anni. Ciò non toglie nulla alla grandezza
dello scienziato tedesco, ma di sicuro rende la storia del "serpente di Kekulé" solamente una leggenda
edificante
Il carbonio
La grande versatilità del C fa si che molecole policarboniose formate dagli stessi atomi possa
esistere in diverse forme dette isomeri
Le forme isomeriche possono essere:
• Di struttura
• Ottica
• Geometrica
Isomeri di struttura
Le molecole sono costituite dagli
stessi atomi, ma differiscono per
la loro diversa disposizione
Figura 1.18
Libro basi biologiche
•
Di struttura
•
Ottica
•
Geometrica
Isomeri ottici
enantiomeri
•
Di struttura
•
Ottica
•
Geometrica
L’atomo di carbonio si lega a 4 atomi tutti differenti fra loro e per ragioni
puramente geometriche si dispongono in maniera l’una speculare all’altra.
Essi sono distinguibili l’uno dall’altro per la capacità di ruotare verso destra
(isomero destrogiro D) o verso sinistra (isomero levogiro L)
Isomeri gemometrici
•
Di struttura
•
Ottica
•
Geometrica
Isomero cis ed isomero trans. Cis ha i sostituenti sullo stesso piano,
trans su piani opposti.
I gruppi funzionali
Data la grandezza delle molecole biologiche, è bene definire alcuni gruppi molecolari molto frequenti,
che costituiscono spesso lo scheletro delle macromolecole. In genere questi gruppi si formano grazie
all’aggiunta di ossigeno ed azoto a delle catene policarboniose.
Il gruppo funzionale spesso «dona» le sue caratteristiche chimiche alla molecola che va a costituire. E
cosa ancora più importante, può costituire delle estremità reattive sulla molecola che le consentono di
legarsi ad altre molecole ad essa complementari portando a strutture sempre più complesse.
•
L’ossidrile –OH
•
Il carbonile >C=O
•
Il carbossile –COOH
•
Il gruppo fosfato –H2PO4
•
Il gruppo amminico –NH2
•
Il sulfidrile –SH
•
I gruppi idrofobi –CH
•
L’ossidrile –OH
•
Il carbonile >C=O
•
Il carbossile –COOH
•
Il gruppo fosfato –H2PO4
•
Il gruppo amminico –NH2
•
Il sulfidrile –SH
•
I gruppi idrofobi –CH
ALCOLI
Gli alcoli derivano dagli idrocarburi per sostituzione di un idrogeno con
un gruppo ossidrile (—OH) che ne diventa il gruppo funzionale.
La formula generale degli alcoli è R—OH.
ALCOLI
Gli alcoli si classificano in primari, secondari e terziari a seconda che
l’atomo di carbonio a cui è legato l’ossidrile sia unito rispettivamente a
uno, due o tre atomi di carbonio.
Secondo la nomenclatura IUPAC, il nome dell’alcol deriva da quello
dell’idrocarburo corrispondente a cui si aggiunge la desinenza -olo.
Se presentano due o tre gruppi ossidrili, gli alcoli prendono il nome di
dioli e trioli.
ALCOLI
Gli alcoli sono acidi molto deboli
ALCOLI
Il metanolo (CH3OH) è una sostanza altamente tossica: 30 mL provocano la morte di un essere umano
adulto.
È un importante intermedio dell’industria chimica, inoltre viene impiegato come carburante per
autotrazione e nelle celle a combustibile.
L’etanolo (CH3CH2OH) è il costituente di tutte le bevande alcoliche. Si ottiene per
fermentazione degli zuccheri da parte di microorganismi.
Viene adoperato come combustibile al posto della benzina e trova impiego nell’industria dei
solventi, dei profumi e dei cosmetici.
Il glicerolo, più noto come glicerina, è un triolo.
Trova impiego nell’industria dei cosmetici e delle vernici.
Il derivato nitrato del glicerolo, la nitroglicerina, è un potente esplosivo che viene impiegato anche, in
soluzione alcolica molto diluita, nella terapia dell’angina pectoris.
•
L’ossidrile –OH
•
Il carbonile >C=O
•
Il carbossile –COOH
•
Il gruppo fosfato –H2PO4
•
Il gruppo amminico –NH2
•
Il sulfidrile –SH
•
I gruppi idrofobi –CH
L’unione di un atomo di ossigeno ad un atomo di
carbonio, forma il carbonile, tipico di due composti:
gli aldeidi ed i chetoni.
Nei chetoni il carbonile è posto all’interno di una
catena policarboniosa e le due valenze libere sono
entrambe occupate da altri atomi di carbonio, la
desinenza delle sue molecole è –one
Negli aldeidi il carbonile è posto alla fine di una
catena policarbniosa ed una delle due valenze
libere è sempre occupata da un atomo di idrogeno.
•
L’ossidrile –OH
•
Il carbonile >C=O
•
Il carbossile –COOH
•
Il gruppo fosfato –H2PO4
•
Il gruppo amminico –NH2
•
Il sulfidrile –SH
•
I gruppi idrofobi –CH
Il carbossile è definito dalla presenza di due atomi di
ossigeno entrambi legati allo stesso atomo di
carbonio, e conferisce alla molecola che lo
contiene una forte idrofolia.
In ambiente acquoso tendono a perdere facilmente
l’atomo di idrogeno, con la seguente formazione di
uno ione idrogeno ed uno ione carbossile.
Il carbossile è quindi un donatore di ioni idrogeni e
conferisce qualità acide alle molecole che lo
contengono (i.e. acidi organici)
Il carbossile è un acido debole, cioè incapace di
dissociarci in ambienti già fortemente acidi
IL CARBOSSILE
La nomenclatura degli acidi carbossilici prevede
l’aggiunta del suffisso -oico al nome dell’alcano
corrispondente.
Alla nomenclatura IUPAC ne è affiancata una
corrente tutt’ora in uso.
IL CARBOSSILE
Gli acidi carbossilici tendono a formare legami a
idrogeno intermolecolari; pertanto presentano
punti di ebollizione abbastanza alti.
In acqua sono solubili solo gli acidi formico, acetico
e propionico.
IL CARBOSSILE
Gli acidi carbossilici sono acidi deboli, ma sono più
forti dei fenoli e degli alcoli.
Reagiscono con basi forti formando dei sali.
IL CARBOSSILE
A partire dagli acidi carbossilici, con reagenti adeguati, si
ottengono diversi derivati, tutti caratterizzati dalla
presenza del gruppo acilico —RCO.
IL CARBOSSILE
Gli esteri si ottengono per reazione fra un acido
carbossilico e alcol ad alta temperatura.
IL CARBOSSILE
Esteri naturali ad alto peso molecolare sono le
cere, i grassi e gli oli.
Le cere sono esteri di un acido carbossilico e di un
alcol entrambi a lunga catena.
IL CARBOSSILE
I grassi (solidi e saturi) e gli oli (liquidi e insaturi) sono
esteri del glicerolo (trigliceridi) con acidi carbossilici
a lunga catena sia saturi sia insaturi.
•
L’ossidrile –OH
•
Il carbonile >C=O
•
Il carbossile –COOH
•
Il gruppo fosfato –H2PO4
•
Il gruppo amminico –NH2
•
Il sulfidrile –SH
•
I gruppi idrofobi –CH
A differenza del carbossile si tratta di un gruppo
acido forte.
In biologia i gruppi fosfati rivestono una grande
importanza come vedremo in seguito nel caso dei
nucleotidi.
Un gruppo fosfato riesce a legarsi in maniera
covalente ad uno (pirofosfato) o due altre molecole
di acido fosforico.
La sintesi di legami fosfato-fosfato richiede una
grande spesa energetica, e queste molecole
possono fungere a loro volta da veri e propri depositi
energetici.
•
L’ossidrile –OH
•
Il carbonile >C=O
•
Il carbossile –COOH
•
Il gruppo fosfato –H2PO4
•
Il gruppo amminico –NH2
•
Il sulfidrile –SH
•
I gruppi idrofobi –CH
A differenza dei gruppi funzionali acidi visti in
precedenza, il gruppo amminico conferisce alle
molecole proprietà basiche, ovvero tendono a
catturare ioni H dall’ambiente acquoso circostante,
diventando così la formazione –NH3
Presente in molte molecole biologiche che devono
mantenere un ambiente basico
LE AMMINE
Le ammine derivano dall’ammoniaca (NH3) per
sostituzione di uno, due o tutti gli atomi di idrogeno
con altrettanti gruppi alchilici.
Il gruppo funzionale delle ammine è il gruppo
amminico.
LE AMMINE
La nomenclatura delle ammine prevede che si
indichino i nome dei gruppi alchilici legati all’azoto
con la desinenza -ammina.
LE AMMINE
Le ammine primarie e secondarie formano legami
a idrogeno intermolecolari, per cui i loro punti di
ebollizione sono più alti di quelli degli alcani a
uguale massa molecolare.
Le ammine con pochi atomi di carbonio sono
solubili in acqua.
Le ammine sono composti basici (deboli) in
virtù del doppietto elettronico libero dell’azoto.
•
L’ossidrile –OH
•
Il carbonile >C=O
•
Il carbossile –COOH
•
Il gruppo fosfato –H2PO4
•
Il gruppo amminico –NH2
•
Il sulfidrile –SH
•
I gruppi idrofobi –CH
Solitamente presente nelle proteine, il sulfiidrile è un
gruppo funzionale a base di zolfo e va facilmente
incontro all’ossidazione che conduce alla unione di
due atomi di zolfo mediante un legame chiamato
ponte disolfuro
•
L’ossidrile –OH
•
Il carbonile >C=O
•
Il carbossile –COOH
•
Il gruppo fosfato –H2PO4
•
Il gruppo amminico –NH2
•
Il sulfidrile –SH
•
I gruppi idrofobi –CH
Una serie di gruppi che per via della loro apolarità,
tendono ad essere fortemente idrofobici ed a
conferire quindi, tale proprietà alle molecole che li
contengono.
Anch’essi possono essere riscontrati nelle proteine.