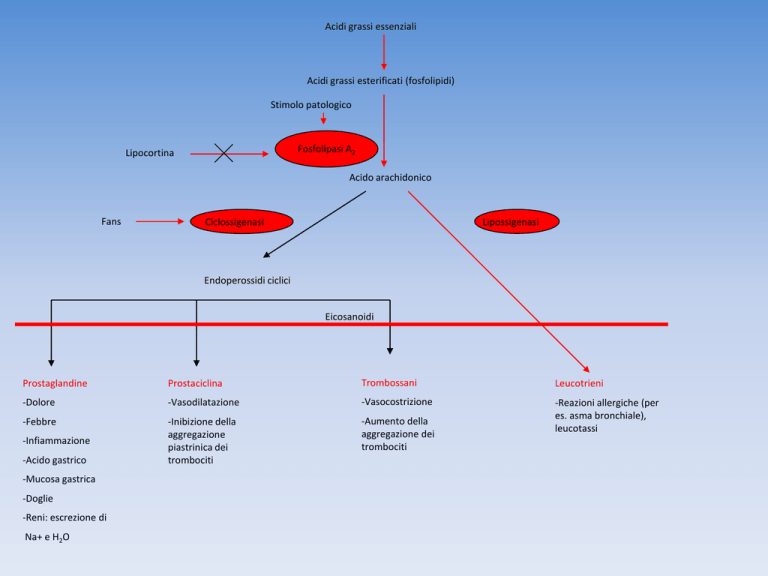
Acidi grassi essenziali
Acidi grassi esterificati (fosfolipidi)
Stimolo patologico
Fosfolipasi A2
Lipocortina
Acido arachidonico
Fans
Ciclossigenasi
Lipossigenasi
Endoperossidi ciclici
Eicosanoidi
Prostaglandine
Prostaciclina
Trombossani
Leucotrieni
-Dolore
-Vasodilatazione
-Vasocostrizione
-Febbre
-Inibizione della
aggregazione
piastrinica dei
trombociti
-Aumento della
aggregazione dei
trombociti
-Reazioni allergiche (per
es. asma bronchiale),
leucotassi
-Infiammazione
-Acido gastrico
-Mucosa gastrica
-Doglie
-Reni: escrezione di
Na+ e H2O
Fattori di crescita
• Sono dei polipeptidi liberati nell’ambiente
extracellulare in grado di stimolare la
proliferazione.
Vengono distinti in :
fattori di competenza
fattori di progressione
reclutano le cellule
quiescenti nel ciclo
cellulare
sono indispensabili
per la transizione
dalla fase G1 alla fase S
L’attività biologica dei fattori di crescita è
mediata da:
• Recettori proteici di membrana in grado di
catalizzare il trasferimento di gruppi fosfato
dall’ATP a substrati proteici a livello del gruppo
ossidrilico di residui di tirosina
• Tra i substrati proteici che sono in grado di
fosforilare ci sono essi stessi; è proprio
l’autofosforilazione che inducendo un
cambiamento conformazionale della molecola
recettoriale promuove l’attività chinasica nei
confronti di altre proteine
Recettori di membrana il cui meccanismo
coinvolge l’attività Tirosino-chinasi
Un’ampia classe di recettori di membrana sembra
attivare eventi cellulari attraverso l’attivazione di una
attività enzimatica di tipo chinasico su residui di
tirosina
L’attività può tanto essere:
1. intrinseca alla molecola recettoriale
2. reclutata dal recettore utilizzando specifiche
proteine accessorie
Utilizzano questa via di segnalazione numerosi
ormoni come:
•l’insulina
•Il fattore di crescita simile all’insulina (IGF)
•Il fattore di crescita epidermico (EGF)
•Il fattore di crescita dell’endotelio vascolare
(VEGF)
•Il fattore neurotrofico di derivazione cerebrale
(BDNF)
•Il fattore di crescita nervoso (NGF)
•Il fattore di crescita derivato dalle piastrine
(PDGF)
•Alcune citochine (interleuchine , interferoni)
•…. E molti altri
Figura 3.17. Attivazione dei recettori ad attività tirosino-chinasica. L’agonista si lega alla porzione extracellulare del recettore,
determinandone la dimerizzazione e l’attivazione della sua funzione enzimatica, con conseguente autofosforilazione del recettore
stesso. Tale processo consente ad alcune proteine adattatrici di legarsi al recettore fosforilato, attraverso moduli strutturali specifici. Tra
queste, le proteine adattatrici tipo Grb2 e SoS, nonché proteine favorenti lo scambio GDP-GTP quali la GAP, determinano la conversione di
Ras nella sua forma attiva legata al GTP, seguita dall’attivazione di Raf, la prima di una lunga catena di proteine ad attività chinasica su residui
di serina/treonina (Mek, MAPKK), che porta all’attivazione della MAP chinasi (chinasi attivata da mitogeni). Questa chinasi fosforila numerosi
fattori trascrizionali determinandone l’attivazione, che trasducono così il segnale al nucleo della cellula.
da Annunziato L. e Di Renzo G. “Trattato di Farmacologia capitolo 2 , Idelson-Gnocchi 2010
• I fattori di crescita
• I loro recettori
• I loro trasduttori
sono i prodotti dei cosidetti protooncogeni od
oncogeni cellulari.
• Questi geni, in condizioni fisiologiche sono
deputati al controllo della proliferazione.
• Se sono mutati (oncogeni attivati) sono capaci di
indurre trasformazione neoplastica e sono
associati all’insorgenza di alcune patologie
oncologiche spontanee
Dominio extracellulare contiene:
•Siti di glicosilazione
•Residui di cisteina
•Motivi strutturali peculiari
Dominio transmembrana: Residui idrofobici
residui basici di ancoraggio alla membrana
Membrana plasmatica
Dominio iuxta -membrana :sede di importanti funzioni
regolatorie
Dominio catalitico: responsabile dell’attività chinasica
In alcuni casi è interrotto da una regione a funzione
regolatoria
Coda C-terminale: ha lunghezza e funzione variabile nei vari recettori;
nel recettore attivato lega i trasduttori intracellulari del segnale
Nei vari recettori ad attività
tirosin-chinasica
Il dominio extracellulare è la porzione
più variabile tanto è che in base a
questa è possibile distinguere 15
sottofamiglie recettoriali caratterizzate
ciascuna da questi motivi strutturali.
Questi motivi strutturali
Hanno la funzione di determinare
delle strutture tridimensionali che
assicurano :
stabilità
specificitàal sito di legame
Sono necessari per il
processo di dimerizzazione
che è fondamentale per la
trasduzione del segnale
Dominio Transmembrana
Sebbene abbia sopratutto un ruolo
strutturale è stato osservato che basta la
sostituzione di un aminoacido per alterare
drammaticamente l’attività tirosin chinasica
del recettore. Ciò vuol dire che potrebbe
essere implicato nella modulazione
dell’attività recettoriale
Dominio iuxta-membrana
• È costituito da aminoacidi che separano il
dominio transmembrana da quello
catalitico.
• È molto ben conservato
• È coinvolto nella modulazione della attivita’
recettoriale da parte di stimoli estrinseci al
recettore stesso (Transmodulazione)
Ad es.nel caso del recettore per
EGF il dominio iuxta-membrana
contiene
• Residui di treonina e di serina che vengono
fosforilati dalla PKC.
• La fosforilazione di tali residui spegne
l’attività catalitica dell’adiacente dominio
chinasico
• Inibisce il legame del dominio extracellulare con il fattore
Esistono due tipi di trasduttori:
• Proteine con attività enzimatica
• Proteine prive di attività catalitica intrinseca
che fungono da regolatori di enzimi
citoplasmatici
Il legame con il trasduttore ha tre
conseguenze:
• Induce modificazioni conformazionali del
trasduttore modulandone l’attività
• Favorisce l’interazione del trasduttore con il
dominio catalitico del recettore
• Recluta il trasduttore alla membrana in
modo che possa legare certi substrati ad
essa associati
3
2
FOSFOLIPASI C
Interazione con q
1N
X
2N
X
SH2
1N
1N
Y
C
SH2 SH3
X
SH2
2N
C
Y
Y
C
Y
C
SH2 SH3
X
X
Y
C
I recettori ad attività tirosino-chinasica hanno
un ruolo farmacologico molto importante
anche perché sono coinvolti in processi
biologici alterati in importanti patologie quali:
•L’infiammazione
•La risposta immune
•La trasformazione, progressione ed invasione
neoplastica
•La desensitizzazione dei recettori per i fattosri di
crescita avviene per l’internalzzazione del recettore
attivato con i suoi diversi trasduttori
(downregulation);
•Se la fosforilazione è persistente il recettore è
riconosciuto da particolari proteine (es Nexin I per
l’EGF) che lo trasportano nei lisosomi dove viene
distrutto.
NB nella condizioni di normale funzionamento nella maggior
parte dei casi l’attivazione di attività tirosinchinasica funge
da segnale di internalizzazione ma la riduzione dei recettori
sulla membrana è transitoria perché i recettori vengono
defosforilati e riciclati
Recettori intracellulari per sostanze liposolubili
•I recettori localizzati a livello intracellulare sono
sensibili a sostanze lipofile che attraversano per
diffusione semplice lamembrana plasmatica
•Il loro meccanismo trasduzionale non
coinvolge secondi messageri soluili
•Il meccanismo avviene per interazione diretta
con l’efettore (il DNA) determinando modifiche
dell’attività trascrizionale che promuovono le
conseguenze biologiche ormono-dipendenti
Figura 3.18. Meccanismi di segnalazione da parte di recettori per ormoni liposolubili. Pannello A, organizzazione funzionale
e strutturale della superfamiglia dei recettori nucleari, che, sulla base del grado di conservazione di sequenza e di funzione, permettono
l’identificazione di sei domini distinti (A-F). (da Germain P, et al. Pharmacol Rev 58:685-704, 2006). Pannello B, segnalazione di membrana e
nucleare da parte dei recettori per gli ormoni sessuali. Oltre alle classiche azioni genomiche, gli ormoni sessuali possono esercitare effetti
acuti non-genomici, forse attraverso l’interazione con recettori di membrana quali canali ionici o GPCRs (da Wierman, Advan. Physiol. Edu.
31: 26-33, 2007).
Si riconoscono 6 sottofamiglie di recettori intracellulari
per molecole liposolubili ma solo 3 d’importanza
farmacologica.
La classe 1 comprende recettori per:
• ormoni tiroidei (TRs)
• l’acido retinoico (RARs)
• la vitamina D (VDR)
• alcuni acidi grassi e prostaglandine (PPARs)
•sostanze tossiche di origine industriale (ARX o CAR)
La classe 2 comprende recettori per:
•L’acido 6 transretinoico (RXRs)
La classe 3 comprende recettori per:
•Glucocorticoidi (GRs)
•Mineralcorticoidi (MRs)
•Estrogeni (Ers)
•Progestinici (PRs)
•Androgeni (Ars)
Nella sequenza primaria e possibile identificare 5 sequenze
analoghe A/B-F
•Il legame dell’ormone al recettore avviene attraverso il dominio E
che forma una tasca idrofobica
•Questo legame libera proteine inattivanti tra cui una Hps 90
•Il recettore derepresso dimerizza
•Il complesso ormone-recettore dimerizzato viene trasportato nel
nucleo
•Interagisce con sequenze specifiche di DNA attraverso la regione C
ove sono presenti 2 anse ricche di cisteine in grado di complessare
con lo Zn formando strutture Zinc fingers, mediante queste si
posiziona nel solco maggiore del DNA
•La funzione di regolazione della trascrizione è ascrivibile alla
regione A/B
La regolazione può essere bidirezionale:
•Attivazione di geni specifici come quelli per :
ola lipocortina nel caso di ligandi glucocorticoidi
oI canali di riassorbimento del Na nel caso dei
mineralcoricoidi
•Soppressione di geni specifici come quelli per:
ola ciclossigenasi 2
La regolazione si esercita a livello
di discrete regioni genomiche
localizzate a livello del 5’ dei siti di
inizio trascrizionali chiamati
elementi responsivi per gli
ormoni (HRE)
•La desensitizzazione dei recettori intracellulari è
omologa
•Avviene per downregulation (distruzzione del
Recettore)
•La riduzione dei recettori è legata strettamente al
controllo dell’espressione genica del mRNA
•La prima fase della downregulation è
caratterizzata dalla riduzione della
trascrizione del mRNA
•Nella seconda la trascrizione ritorna normale ma
aumenta la degradazione del mRNA