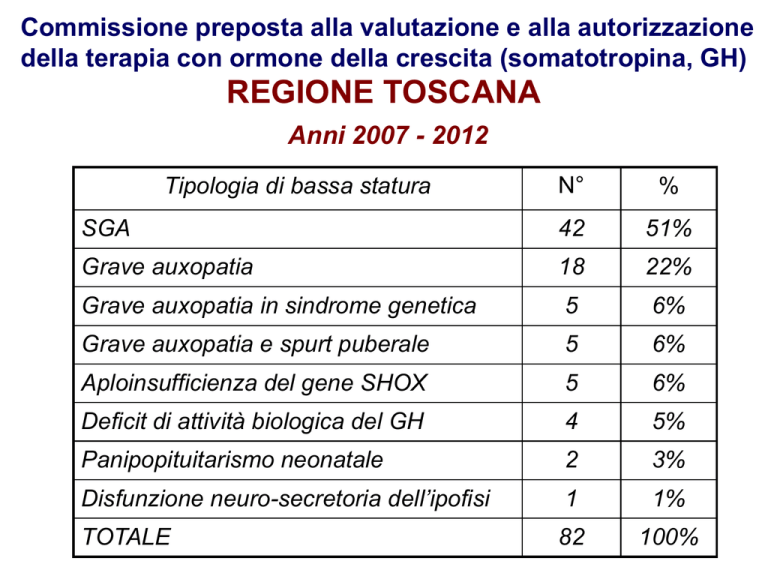
Commissione preposta alla valutazione e alla autorizzazione
della terapia con ormone della crescita (somatotropina, GH)
REGIONE TOSCANA
Anni 2007 - 2012
N°
%
SGA
42
51%
Grave auxopatia
18
22%
Grave auxopatia in sindrome genetica
5
6%
Grave auxopatia e spurt puberale
5
6%
Aploinsufficienza del gene SHOX
5
6%
Deficit di attività biologica del GH
4
5%
Panipopituitarismo neonatale
2
3%
Disfunzione neuro-secretoria dell’ipofisi
1
1%
TOTALE
82
100%
Tipologia di bassa statura
Commissione preposta alla valutazione e alla autorizzazione
della terapia con ormone della crescita (somatotropina, GH)
REGIONE TOSCANA
Anni 2007 - 2012
6%
5%
3% 1%
6%
51%
6%
22%
SGA
Grave auxopatia
Grave auxopatia in sindrome genetica
Grave auxopatia e spurt puberale
Aploinsufficienza del gene SHOX
Deficit di attività biologica del GH
Panipopituitarismo neonatale
Disfunzione neuro-secretoria dell'ipofisi
Commissione preposta alla valutazione e alla autorizzazione
della terapia con ormone della crescita (somatotropina, GH)
REGIONE TOSCANA
Anno 2011 (dicembre) - 2012 (aprile)
Tipologia di bassa statura
N°
SGA
7
Grave auxopatia
6
Grave auxopatia in sindrome genetica
-
Grave auxopatia e spurt puberale
1
Aploinsufficienza del gene SHOX
1
Deficit di attività biologica del GH
-
Panipopituitarismo neonatale
-
Disfunzione neuro-secretoria dell’ipofisi
-
TOTALE
15
La
Commissione per il GH
della Regione Veneto
Modalità di monitoraggio dell’aderenza
alla normativa e/o controllo della spesa
Margherita Andretta
Servizio Farmaceutico Territoriale
Azienda ULSS 20 Verona
Coordinamento Unico sul Farmaco
Regione Veneto
Casi valutati dalla
Commissione dal 2009 ad oggi
4
2 1
SGA
8
ISS
Silver Russell
Noonan
11
40
anomalie cromosomiche
Rubenstein Taybi
Nell’81% dei casi è stato autorizzato l’utilizzo di GH
Spesa per GH nella
Regione Veneto – anno 2011
Azienda di
Erogazione
a
b
c
d
e
f
g
h
i
l
m
n
o
p
q
r
s
t
u
v
z
VENETO
Spesa
72.777
124.735
173.668
234.957
215.278
285.131
255.038
200.637
385.274
206.688
200.941
166.319
128.129
206.008
434.200
141.636
143.024
91.642
1.306.485
391.934
781.759
6.146.263
11%
età evolu va
età di transizione
28%
61%
età adulta
Data 29/06/2012
| Protocollo N° 302391/64.00.03.01.00
| Class.:
Prat.
Fasc. | Allegati N°
Oggetto: I ndagine conoscitiva regionale sui Centri per la prescrizione dell’ormone della crescita.
La struttura è già autorizzata?
sì
no
Se no, si chiede di motivare la richiesta di autorizzazione (allegare relazione)
Presenta uno specialista endocrinologo con almeno un’unità semplice di endocrinologia?
sì
no
Numero totale di pazienti in trattamento nel 2012 con Piano Terapeutico attivo ___________
Si chiede di ripartire il numero di pazienti in base alla patologia e alla provenienza, specificando per i pazienti intraregione
l’Azienda ULSS di residenza
Risultati
indagine conoscitiva regionale
577 pazienti pediatrici suddivisi in 4 Centri autorizzati
310 pazienti adulti suddivisi in 16 Centri autorizzati
7 Centri hanno in trattamento meno di 10 pazienti
4 Aziende Sanitarie hanno più di un Centro
Nuovi criteri di
autorizzazione proposti dalla Commissione
Nessun nuovo Centro viene al momento autorizzato
I Centri che mantengono l’autorizzazione:
devono avere in organico uno o più specialisti endocrinologi
devono avere almeno10 pazienti in trattamento
Le Aziende con più Centri devono riorganizzare l’attività in
un unico Centro entro 12 mesi
Indicazioni di registrazione
delle specialità/biosimilari in commercio
I ndicazione nel bambino/adolescente
Insufficiente secrezione di GH
Sindrome di Turner
Sindrome di Prader Willi
Alterato gene SHOX
Insufficienza renale cronica
SGA
I ndicazione nell’adulto
Insufficiente secrezione di GH
Specialità che presentano l’indicazione
Tutte le specialità
Tutte le specialità
®
®
®
GENOTROPIN MINI , GENOTROPIN , OMNITROPE
®
HUMATROPE
®
Tutte le specialità ad eccezione di ZOMACTON
®
®
Tutte le specialità ad eccezione di NUTROPIN e ZOMACTON
Specialità che presentano l’indicazione
®
Tutte le specialità ad eccezione di ZOMACTON
Confronto dei costi
delle specialità/biosimilari in commercio
Formulazione farmaceutica
Confezionamento
€/mg
(I VA
esclusa)
0,2 mg
0,4 mg
0,6 mg
0,8 mg
1,0 mg
1,2 mg
1,4 mg
1,6 mg
1,8 mg
2,0 mg
5,3 mg
12 mg
6 mg
12 mg
22,88
24,84
21,89
23,24
24,19
22,76
23,99
24,42
24,83
25,17
26,55
23,89
19,33
18,82
OMNITROPE
5 mg
10 mg
15,19
14,58
SAIZEN
®
CLICKEASY
8 mg
26,16
ZOMACTON
4 mg
25,95
NORDITROPIN®
5 mg
15 mg
24,60§
24,60§
NUTROPIN®
10 mg
19,82§
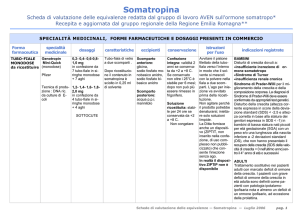
Specialità
Prodotti aggiudicatari di gara – DDR 1/2012 e DDR 4/2012
Tubo-fiala monodose da ricostruire e
somministrare direttamente.
GENOTROPIN
®
MINI
Tubo-fiala o cartuccia multidose da
ricostruire e somministrare attraverso
penna.
GENOTROPIN
Cartuccia multidose contente una
soluzione già pronta da somministrare
attraverso penna.
Cartuccia multidose da ricostruire e
somministrare attraverso penna (con o
senza ago).
Flacone multidose da ricostruire e
somministrare attraverso siringa o penna
(con o senza ago).
®
®
HUMATROPE
®
®
Prodotti non aggiudicatari di gara
Cartuccia multidose contente una
soluzione già pronta da somministrare
attraverso penna.
Impiego delle specialità/biosimilari contenenti GH
Indirizzi espressi dalla Commissione Regionale
Pertanto, alla luce della sovrapponibilità in termini di efficacia e sicurezza dei medicinali
contenenti somatropina, la Commissione Regionale ritiene necessario privilegiare, in assenza di
motivazioni clinicamente rilevanti legate alle specifiche indicazioni di registrazione, alla compliance
del paziente, alla continuità terapeutica o alla tollerabilità ad uno specifico eccipiente/conservante,
l’utilizzo di quei prodotti che presentano un prezzo unitario per mg inferiore a 20 €, soprattutto in un
ottica di razionalizzazione della spesa farmaceutica e di rispetto dei nuovi tetti imposti a livello
nazionale, come previsto dal DL n.95/2012 convertito, con modificazioni, nella Legge n.135/2012.
I Centri autorizzati alla prescrizione sono tenuti al rispetto delle presenti raccomandazioni.
A tal fine è necessario che le Direzioni Sanitarie, in collaborazione con i Responsabili dei
Centri autorizzati e i Responsabili delle Farmacie ospedaliere/Servizi Farmaceutici territoriali,
effettuino periodici audit finalizzati al controllo dell’appropriatezza prescrittiva e alla rilevazione
dei seguenti indicatori: numero totale di pazienti trattati nel periodo di riferimento; numero di
pazienti che nel periodo di riferimento hanno ricevuto un trattamento con prodotti che presentano
un prezzo unitario per mg superiore a 20 €.