
Corso di Laurea in Chimica e Tecnologie
Farmaceutiche
Insegnamento di Patologia Generale e
Terminologia Medica
Dr. Marco Cei e Dr. Alberto Genovesi Ebert
UO Medicina 1 - Cardiologia e UTIC
Azienda USL 6 di Livorno
Neoplasia
AGENDA
definizioni
benignità e malignità
cancerogenesi e cancerogeni
basi molecolari
crescita neoplastica
metastasi
definizioni
● neoplasia: letteralmente “nuova crescita”.
Tessuto di origine clonale, caratterizzato da
alterazioni genetiche ereditabili, la cui
crescita supera in modo scoordinato quella
dei tessuti normali anche dopo la cessazione
degli stimoli che l’hanno determinata
● tumore, cancro: sinonimi di neoplasia
● scirro: tumore con dura componente
stromale
● metastasi: diffusione a distanza per via
linfatica o ematica
3
neoplasie benigne
● caratteristiche micro- e macroscopiche
relativamente differenziate
● possibile mantenimento di un certo grado di
specializzazione
● crescita relativamente lenta
● restano localizzate e spesso incapsulate
● si prestano alla facile asportazione
chirurgica
● sintomi prevalentemente di massa
● buona prognosi
● raramente gravi manifestazioni cliniche
4
neoplasie benigne
in genere si aggiunge il suffisso -oma
fibromi: originano in tessuti fibrosi
adenomi: originano in tessuti ghiandolari
cistoadenomi: formazione di masse cistiche
papillomi: proiezione della superficie
epiteliale simile a una digitazione o verruca
● polipi: proiezioni sessili o peduncolate a
livello di una superficie mucosa con aggetto
nel lume
●
●
●
●
●
5
A
C
B
D
A = papilloma congiuntivale; B = papilloma cutaneo
C = polipo sessile; D = polipo peduncolato
6
neoplasie maligne: caratteristiche fenotipiche cellulari
● instabilità genetica
● deregulation proliferativa: incremento fattori
di crescita e decremento fattori di controllo
● incapacità a differenziarsi
● perdita delle normali vie per l’apoptosi
● perdita della senescenza
● induzione della neoangiogenesi
● capacità invasiva
● capacità di metastatizzare
● evasione dal sistema immune
7
neoplasie maligne
● caratteristiche micro- e macroscopiche di
mancata o alterata differenziazione
● crescita tendenzialmente rapida
● tendenza alla necrosi tessutale
● tendenza a infiltrare, invadere e distruggere
● di regola metastatizzano a distanza
● sintomi molto variabili e generalmente prima
o poi gravi
● prognosi generalmente infausta
8
KK
Kmetastasi
tumore del pancreas che ingloba la arteria splenica; metastasi epatiche
9
Kmetastasi
k pancreas (caso precedente): metastasi polmonari
10
neoplasie maligne
● sarcomi: originano nel tessuto
mesenchimale
● carcinomi: origine epiteliale
● adenocarcinomi: origine da epitelio
ghiandolare
11
eccezioni
● tumori misti o adenomi pleomorfi:
componente epiteliale, stroma mixoide, isole
di cartilagine o di osso
● teratomi: contengono cellule mature e
immature rappresentative di più di un
foglietto embrionale
● neoplasie ematologiche: difficile
applicabilità dei concetti di benignità e
malignità
● carcinoma in situ:citologia maligna senza
superamento della membrana basale
12
fibroadenoma della mammella
13
carcinoma della mammella
14
carcinoma in situ intraduttale della mammella
15
neoformazione pelvica con ascite massiva (TC addome, osservazione personale)
16
17
differenziazione e anaplasia
● differenziazione: grado di somiglianza
morfologica e funzionale tra le cellule
neoplastiche e le corrispondenti cellule
normali
● metaplasia: sostituzione di un tipo cellulare
con un altro
● displasia: perdita di uniformità cellulare e
dell’orientamento architettonico
● anaplasia: apparente regressione della
differenziazione fino alla sua completa
assenza
18
displasia e anaplasia
● polarità: crescita anarchica e disorganizzata
● pleomorfismo: variazioni di forma e
grandezza delle cellule, gigantismo
● anomalie nucleari: cromatina aumentata e
grossolanamente azzollata, presenza di
nucleoli, alterazioni del rapporto nucleo
citoplasma (da 1:4-1:6 a 1:1)
● mitosi: numerose e bizzarre
19
20
cancerogenesi
●
●
danno genetico (mutazione) non letale:
acquisito per effetto di agenti ambientali
ereditato dalla linea germinale
spontaneo o stocastico
a carico di 4 classi di geni regolatori
espansione monoclonale: a partire dalla
cellula che ha subito la mutazione
● crescita e accumulo di nuove mutazioni:
prevalgono varianti cellulari più adatte a
eludere le difese dell’ospite o resistere ai
farmaci (cd. “pressione selettiva”)
21
elettroforesi delle proteine plasmatiche normale e con componente M
22
fasi della cancerogenesi
●
●
-
iniziazione:
esposizione a cancerogeno
danno permanente al DNA
irreversibile, non letale, trasmissibile
necessaria ma non sufficiente
promozione:
non coinvolge direttamente il DNA
reversibile
promuove la proliferazione di cellule
“iniziate”
23
agenti cancerogeni - 1
●
●
-
chimici:
alchilanti
acilanti
idrocarburi aromatici
amine aromatiche, ammidi, azidi
prodotti da microrganismi
fisici:
radiazioni ultraviolette
radiazioni ionizzanti
24
agenti cancerogeni - 2
● virus:
- a RNA (HTLV-1)
- a DNA (HPV, EBV, HBV, HCV)
● batteri:
- Helicobacter pylori
25
26
la regolazione del ciclo cellulare normale
27
regolazione della trasduzione dei segnali
● fosforilazione: la aggiunta o la rimozione di
un gruppo fosfato gioca sempre un ruolo
fondamentale
● chinasi: enzimi deputati alla fosforilazione
- recettoriali e non recettoriali
- tirosin-chinasi: agiscono su residui di
tirosina, generalmente attivatrici
- serin/treonin-chinasi: agiscono su residui di
serina o treonina e generalmente disattivano
● fosfatasi: rimuovono un gruppo fosfato
28
attivazione delle chinasi del dominio citoplasmatico di recettori transmembrana
29
proto-oncogeni
● oncogeni: geni che promuovono la crescita
autonoma della cellula tumorale
● proto-oncogeni: controparti fisiologiche
degli oncogeni, partecipano a molte funzioni
cellulari, strettamente regolate, connesse
alla crescita e proliferazione
● oncoproteine: prodotti degli oncogeni che
garantiscono alla cellula l’autosufficienza per
la crescita; generalmente hanno le stesse
funzioni delle loro controparti naturali
30
targeted therapy
erlotinib, gefitinib
imatinib
vemurafenib
31
fattori di crecita (FDC) e recettori
● azione paracrina: un tipo cellulare produce un FDC
che agisce su una cellula adiacente per stimolarne la
proliferazione
● azione autocrina: cellule tumorali producono lo stesso
FDC al quale sono sensibili
● iperespressione: il gene del FDC può essere non
mutato ma indotto ad iperesprimersi dal prodotto di altri
oncogeni (RAS)
● esempi: PDGF da parte di glioblastoma; TGF-alfa da
parte di sarcomi
● mutazioni nel recettore per FDC: c-KIT, PDGF (GIST,
imatinib
cancro a cellule renali)
sunitinib
32
ruolo del JAK2 mutato nelle malattie mieloproliferative croniche
33
didascalia figura 31
Mechanism of activation of JAK2 kinase activity by mutations in the JAK2
signalling pathway.
a | Cytokine ligands normally bind cytokine receptors, which results in Janus
kinase 2 (JAK2) phosphorylation, recruitment of signal transducer and activator
of transcription (Stat) signalling proteins and phosphorylation and activation of
downstream signalling pathways including Stat transcription factors, mitogen
activated protein kinase (MAPK) signalling proteins, and the
phosphotidylinositol 3-kinase (PI3K)–Akt pathway.
b | The JAK2V617F and JAK2 exon 12 mutant kinases bind cytokine receptors
and are phosphorylated in the absence of ligand, and lead to ligandindependent activation of downstream signalling pathways.
c | By contrast, MPLW515L/K mutant thrombopoietin receptors are able to
phosphorylate wild-type JAK2 in the absence of thrombopoietin, and result in
the activation of signalling pathways downstream of JAK2. Negative regulation
of JAK2 signalling is normally mediated by suppressor of cytokine signalling
(Socs) proteins, most notably SOCS1 and SOCS3; recent data indicate that the
JAK2V617F allele might escape negative feedback by SOCS3.
34
ruxolitinib
35
oncogeni di proteine trasduttrici del segnale
● le mutazioni puntiformi dei geni della famiglia
RAS sono la singola anomalia più frequente
dei proto-oncogeni umani
● K-RAS: carcinomi di colon e pancreas
● H-RAS: tumori della vescica
● N-RAS: neoplasie del tessuto emopoietico
36
37
38
alterazioni delle tirosin-chinasi non recettoriali: t(9:22)(q34.1;q11.21)
39
40
imatinib
dasatinib
nilotinib
41
fattori di trascrizione (FDT)
● i FDT sono proteine che contengono
specifiche sequenze amminoacidiche che
permettono loro di legarsi al DNA
(direttamente o previa formazione di dimeri)
● il loro legame a specifiche sequenze del
DNA genomico attiva la trascrizione
● i proto-oncogeni MYC, MYB, JUN, FOS e
REL codificano per fattori di trascrizione
● mutazioni di questi geni conducono alla
replicazione autonoma e svincolata
42
la traslocazione t(8;14)(q24;q32) nel linfoma di Burkitt
43
didascalia figura 41
The t(8;14)(q24;q32) translocation, the most common translocation
in Burkitt lymphoma, leads to the deregulation of the MYC gene at
8q24 through its juxtaposition with regulatory elements of the
immunoglobulin heavy chain (IGH) gene at 14q32; that is, the MYC
gene is constitutively activated because its expression is driven by
immunoglobulin enhancers (E).
The MYC gene has three exons, and is oriented with its 5' end
towards the centromere. The breaks show considerable variability
and might be scattered over an area larger than 200 kb at the 5' part
of the gene upstream of exon 2, the first coding exon. As a
consequence, the two protein-encoding exons are always spared and
are translocated to the IGH locus in 14q32.
The breaks in the IGH gene usually take place within switch regions,
but can also involve joining regions; occasionally the breaks take
place in a variable or a constant region. The IGH gene is oriented
with its 5' part towards the telomere, so the translocation leads to a
5'–5' (head-to-head) fusion of MYC with sequences from the IGH
locus.
44
cicline e chinasi ciclino-dipendenti
● la progressione ordinata del ciclo cellulare
dipende dalle chinasi ciclino-dipendenti
(CDK)
● le CDK sono attivate dal legame con le
cicline, proteine così chiamate a causa
della natura ciclica della loro produzione e
degradazione
● i complessi ciclina-CDK fosforilano
proteine bersaglio che guidano il ciclo
cellulare
● gli inibitori delle CDK (CDKI) esercitano un
controllo negativo sul ciclo cellulare
45
46
melanomi
pancreas
glioblastoma
esofago
LLA
NSCLC
mammella
esofago
fegato
linfomi
melanoma
sarcomi
glioblastoma
47
i check-point
● check-point G1-S:
- tutto è pronto per la
replicazione?
- la macchina
riparativa è pronta?
- gli enzimi replicativi
sono disponibili?
- ci sono sufficienti
nucleotidi?
- c’è sufficiente
energia?
● check-point G2-M:
- tutti i cromosomi
sono stati
completamente
duplicati?
- ci sono copie
eccessive di
qualunque
segmento di DNA?
48
geni oncosoppressori
● azione tipica: le proteine da essi codificate
frenano la proliferazione cellulare e
prevengono la crescita incontrollata
● altre azioni: promozione dell’ingresso delle
cellule in pool postmitotici differenziati
● esempi: RB e p53
49
Knudson A. Two genetics hits (more or less) to cancer. Nat rev Cancer 2001;1;157
50
51
didascalia figura 49
The role of RB in regulating the G1-S checkpoint of the cell cycle.
Hypophosphorylated RB in complex with the E2F transcription factors
binds to DNA, recruits chromatin-remodeling factors (histone
deacetylases and histone methyltransferases), and inhibits
transcription of genes whose products are required for the S phase of
the cell cycle. When RB is phosphorylated by the cyclin D–CDK4,
cyclin D–CDK6, and cyclin E–CDK2 complexes, it releases E2F. The
latter then activates transcription of S-phase genes. The
phosphorylation of RB is inhibited by CDKIs, because they inactivate
cyclin-CDK complexes. Virtually all cancer cells show dysregulation of
the G1-S checkpoint as a result of mutation in one of four genes that
regulate the phosphorylation of RB; these genes are RB1, CDK4, the
genes encoding cyclin D proteins, and CDKN2A(p16). EGF, epidermal
growth factor; PDGF, platelet-derived growth factor; TGF-g,
transforming growth factor-beta.
52
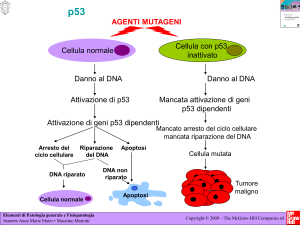
p53, il “guardiano” del genoma
● più del 50% dei tumori umani ha mutazioni di
questo gene
● sindrome di Li-Fraumeni: mutazione di un
allele di p53 ereditaria, aumenta di 25 volte il
rischio di tumore entro i 50 anni (double hit)
● azioni di p53: contrasta la trasformazione
neoplastica per
- induzione arresto temporaneo del ciclo (quiescenza)
- arresto permanente del ciclo (senescenza)
- induzione della morte cellulare programmata (apoptosi)
53
54
didascalia figura 52
A, The role of p53 in maintaining the integrity of the genome.
Activation of normal p53 by DNA-damaging agents or by hypoxia
leads to cell cycle arrest in G1and induction of DNA repair, by
transcriptional up-regulation of the cyclin-dependent kinase
inhibitorCDKN1A (p21) and the GADD45 genes. Successful repair of
DNA allows cells to proceed with the cell cycle; if DNA repair fails,
p53 triggers either apoptosis or senescence. In cells with loss or
mutations of p53, DNA damage does not induce cell cycle arrest or
DNA repair, and genetically damaged cells proliferate, giving rise
eventually to malignant neoplasms.
B, p53 mediates gene repression by activating transcription of
miRNAs. p53 activates transcription of the mir34 family of miRNAs.
mir34s repress translation of both proliferative genes, such as
cyclins, and anti-apoptotic genes, such as BCL2. Repression of these
genes can promote either quiescence or senescence as well as
apoptosis.
55
genoma del papilloma virus umano (HPV)
56
cancerogenesi - 3
● evasione dall’apoptosi: in conseguenza
della inattivazione di p53 o dell’attivazione di
geni antiapoptotici
● potenziale replicativo illimitato: le cellule
tumorali evitano la senescenza e l’inibizione
delle mitosi (via della telomerasi)
● neoangiogenesi: i tumori soidi non possono
crescere oltre 1-2 mm senza essere
vascolarizzati (aumento di fattori
angiogenetici e riduzione di inibitori)
57
BCL2 nei linfomi
- 85% dei linfomi follicolari
ha una t(14;18)(q32;q21)
- che provoca
iperespressione di BCL2
- che protegge i linfociti
dalla apoptosi
- la proteina BCL2 può
essere ricercata (FISH)
- questi linfomi si sviluppano
più per diminuzione della
apoptosi che per aumento
della proliferazione
- risentono poco della
terapia
58
59
didascalia figura 57
Replication of somatic cells, which do not express telomerase, leads
to shortened telomeres. In the presence of competent checkpoints,
cells undergo arrest and enter nonreplicative senescence.
In the absence of checkpoints, DNA-repair pathways are
inappropriately activated, leading to the formation of dicentric
chromosomes. At mitosis the dicentric chromosomes are pulled
apart, generating random double-stranded breaks, which then
activate DNA-repair pathways, leading to the random association of
double-stranded ends and the formation, again, of dicentric
chromosomes. Cells undergo numerous rounds of this bridge-fusionbreakage cycle, which generates massive chromosomal instability
and numerous mutations.
If cells fail to re-express telomerase, they eventually undergo mitotic
catastrophe and death. Re-expression of telomerase allows the cells
to escape the bridge-fusion-breakage cycle, thus promoting their
survival and tumorigenesis.
60
bevacizumab
VEGFR:
Vascular Endothelial
Growth Factor
Receptor
61
schema riassuntivo della cancerogenesi e della progressione neoplastica
62
crescita dei tumori - 1
una cellula di 10 micron deve andare incontro a
30 cicli per produrre 109 cellule, pari a 1 cm3 e
1 g di peso (slatentizzazione clinica)
solo altri 10 cicli sono necessari per produrre
1012 cellule e 1 kg di peso (letale)
alla diagnosi quindi la maggior parte dei
tumori si trova verso la fine del loro ciclo vitale
nell’ospite
63
modello gompertziano della crecita tumorale
64
crescita dei tumori - 2
la velocità di crescita di un tumore è
determinata da:
● tempo di raddoppiamento delle cellule
● frazione di crescita: frazione di cellule che
sono nel pool replicativo (2-3% o meno
abitualmente, pari a quella del midollo e
delle mucose intestinali)
● velocità con cui le cellule vengono liberate o
perdute
65
crescita dei tumori - 3
● in generale la produzione supera la perdita
cellulare (accumulo)
● una elevata frazione di crescita si
accompagna a maggiore malignità clinica e
maggiore chemiosensibilità
● terapie combinate (radio + chemio,
chirurgia + chemio) hanno lo scopo di
spostare le cellule residue dalla fase G0
riportandole nel pool proliferativo
66
metàstaṡi s. f. [dal gr. μετάστασις «spostamento»,
comp. di μετα- «meta-» e tema di ἵστημι «porre,
collocare»]
● i tumori benigni non metastatizzano mai
● i tumori maligni possono metastatizzare
precocemente o, più frequentemente,
tardivamente
● il 30% dei tumori maligni ha metastasi alla
diagnosi
● la metastatizzazione dipende da numerosi
fattori relativi al tumore e all’ospite
● gliomi e basaliomi cutanei metastatizzano
molto raramente
67
68
vie di diffusione delle metastasi
● attraverso le cavità e le superfici del corpo:
pleura, peritoneo, pericardio
● attraverso le vie linfatiche, secondo le
naturali vie di drenaggio
● per via ematica: al fegato, al polmone, alle
ossa, secondo la sede di partenza e il suo
particolare apporto sanguigno
● a qualunque organo
● secondo particolari localizzazioni tessutospecifiche: ossa, encefalo, cuore, surreni
69
Floating Heart Metastasis. Nicola Mumoli, MD, Marco Cei, MD, et al. J Am Soc Echocardiogr 2006; 19:1293.e1-1293.e2
70



![mutazioni genetiche [al DNA] effetti evolutivi [fetali] effetti tardivi](http://s1.studylibit.com/store/data/004205334_1-d8ada56ee9f5184276979f04a9a248a9-300x300.png)







