CAPITOLO 1
L’atomo
La parola atomo deriva dal greco e significa indivisibile, ma oggi sappiamo che essi sono divisibili. Fin
dall’antichità si sapeva che essi contenevano cariche elettriche che se di segno opposto si attraevano, mentre se
dello stesso segno si respingevano (c’è attrazione anche tra una oggetto neutro, senza carica e uno con una
carica attraverso l’induzione), ma fino XX secolo non si sapeva da cosa erano composti gli atomi. Il primo fu J.
Thomson che tramite il tubo catodico riuscì a scoprire le particelle dell’atomo cariche negativamente: gli
elettroni. Nel tubo catodico privo d’aria venivano posizionati due placche una con una carica negativa, catodo e
una con una carica negativa, anodo; Dando corrente dal catodo partivano dei raggi luminosi sparsi che
colpivano l’anodo e si trasformavano in un fascio luminoso ordinato che andava verso la fine del tubo. Verso la
fine del tubo erano sistemate due placche una negativa in alto e una positiva in basso. Questo fascio di luce
tendeva ad andare verso il basso per cui le particelle del fascio di luce dovevano essere cariche negativamente.
Thomson chiamò queste particelle elettroni. Per scoprire la particella carica positivamente, il protone fu fatto
un esperimento simile da Goldstein, ma invertì la posizione dell’anodo e del catodo facendo partire i raggi
dall’anodo, raggi anodici. Però le particelle positive non partivano dalle placche ma provenivano dai gas
contenuti nel tubo a bassissima pressione. Goldstein capì che gli atomi dei gas, bombardati dagli elettroni che
partivano dalle placche venivano divisi dagli elettroni e rimanevano solo le parti positive, ovvero i protoni. Gli
atomi sono formati quindi da protoni e neutroni, senza carica (scoperti nel 1932) nel nucleo e dagli elettroni.
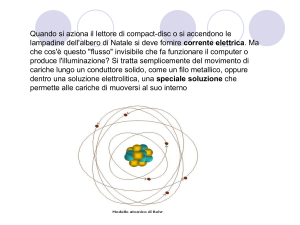
Fino al 1909 non si sapeva come fossero fatti gli atomi, ma grazie all’esperimento di Rutherford si scopri che
erano composti da un nucleo formato dalle cariche positive e da uno spazio vuoto intorno al nucleo che
conteneva gli elettroni. Rutherford si servi di un raggio α (formati da nuclei positivi di elio) con cui bombardò
un sottilissimo foglio d’oro. Egli notò che gran parte del raggio attraversava il foglio e una piccola parte veniva
rimbalzata indietro (colpivano i protoni) e una piccolissima parte veniva deviata (colpiva gli elettroni).
In passato si pensava che le parti dell’atomo fossero fondamentali, cioè non erano formate da niente, invece
oggi sappiamo che protoni e neutroni sono formati da quark.
Esiste un tipo di atomo per ogni elemento e alcuni elementi hanno degli isotopi ovvero degli atomi dello stesso
elemento aventi le stesse proprietà chimiche che hanno gli stessi protoni e elettroni ma hanno un diverso
numero di neutroni. Ogni elemento è classificato in base al:
Numero atomico: numero dei protoni (che è sempre uguale a quello degli elettroni
Numero di massa: numero dei protoni più quello dei neutroni-numero delle particelle presenti nel nucleo
Peso atomico: media ponderale del numero di massa degli isotopi di un elemento
© Federico Ferranti S.T.A.
www.quartof.com