Università degli Studi di Messina
Facoltà di Medicina e Chirurgia
CATTEDRA DI CHIRURGIA GENERALE
Titolare: Prof. Salvatore Gorgone
Corso di Laurea in Infermieristica
Anno Accademico 2008 – 2009
Anatomia
della
parete
toracica
La
gabbia
toracica
è
costituita
da
una
cavità
espandibile
con
gli
atti
respiratori
costituita
da
12
vertebre
toraciche,
da
12
paia
di
coste
e
dallo
sterno.
Ha
la
forma
di
un
tronco
di
cono
ad
apice
rivolto
in
alto.
La
parete
anteriore,
che
si
estende
per
circa
18
cm
dal
giugolo
all’apofisi
xifoidea,
è
costituita
dallo
sterno
e
dalle
cartilagini
costali
delle
prime
10
coste.
Le
pareti
laterali
sono
formate
dalle
ultime
10
coste.
La
parete
posteriore
è
costituita
dalle
12
vertebre
toraciche
e
dalle
12
coste.
È
chiusa
in
alto
dalla
clavicola,
dall’articolazione
della
spalla,
posteriormente
dalla
scapola.
L’apertura
superiore
è
delimitata
dalle
prime
coste,
dal
manubrio
dello
sterno
e
dal
corpo
della
prima
vertebra
toracica.
L’apertura
inferiore,
occupata
dal
diaframma,
è
circoscritta
dalla
dodicesima
vertebra
e
dalle
coste,
anteriormente
dalle
cartilagini
VII
‐
XII
costali
e
dal
processo
xifoideo.
Le
pareti
toraciche
delimitano
all’interno
un
ampio
spazio,
che
è
suddiviso
nelle
due
cavità
pleuriche
separate
dal
mediastino1.
La
parete
toracica
comprende
due
gruppi
muscolari
suddivisi
in
estrinseci,
che
collegano
il
torace
allo
scheletro
degli
arti
superiori
(muscoli
grande
e
piccolo
pettorale,
dentato
anteriore;
trapezio,
gran
dorsale,
romboide,
dentato
posteriore,
lunghi
del
dorso),
ed
intrinseci,
i
muscoli
intercostali
(esterni,
medi
e
interni).
Gli
spazi
intercostali
sono
percorsi
dall’arteria,
dalla
vena
e
dal
nervo
intercostale,
che
dopo
l’angolo
costale
si
portano
sotto
il
margine
inferiore
delle
coste.
Nella
gabbia
toracica
sono
contenuti:
i
polmoni,
il
cuore,
i
grossi
vasi,
l’esofago
e
importanti
tronchi
nervosi.
Nel
suo
insieme
la
gabbia
toracica
gode
di
una
notevole
elasticità.
Nel
maschio
l’altezza
del
torace
è
nel
complesso
maggiore
che
nella
femmina.
Le
coste
sono
più
oblique
in
basso,
lo
sterno
è
più
verticale.
Nella
donna
il
torace
è
meno
alto,
le
coste
sono
più
orizzontali,
lo
sterno
è
più
proiettato
in
avanti;
in
complesso
è
simile
alla
gabbia
toracica
di
età
infantile.
1
Il mediastino anteriore contiene il timo, i linfonodi mediastinici, l’aorta ascendente e trasversa, i vasi toracici; il mediastino medio è
occupato da cuore, trachea, ili polmonari, nervi frenici e linfonodi ilari; il mediastino posteriore contiene le catene simpatiche, i
nervi vaghi, l’esofago, il dotto toracico e l’aorta discendente.
2
CHIRURGIA
CARDIACA
Anatomia
e
fisiologia
cardiaca
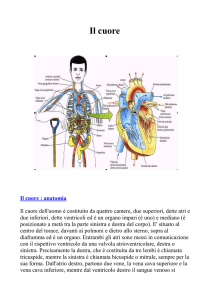
Il
cuore
è
un
organo
muscolare
cavo
con
quattro
cavità,
che
genera
un
flusso
continuo
di
sangue
per
mantenere
un
livello
pressorio
nell’albero
circolatorio.
Il
cuore
è
rivestito
da
una
membrana
fibroelastica
il
pericardio,
tra
pericardio
e
miocardio
vi
è
una
cavità
virtuale,
la
cavità
pericardica,
che
in
condizioni
normali
contiene
sino
a
50
cc.
di
liquido
pericardico,
distribuito
in
maniera
da
costituire
un
velo
liquido
lubrificante
che
permette
al
cuore
di
muoversi
liberamente
durante
la
contrazione
e
il
rilasciamento.
In
alcune
malattie
la
quantità
di
liquido
aumenta
fortemente
ostacolando
la
funzione
del
cuore.
Anatomia
Chirurgica
del
cuore
Il
cuore,
all’apertura
del
pericardio,
si
presenta
come
un
cono
appiattito
antero‐
posteriormente
con
l’asse
della
punta
diretto
in
basso,
indietro
ed
a
sinistra.
Si
distinguono:
•
•
•
•
•
•
La
faccia
anteriore,
convessa,
corrisponde
prevalentemente
alla
parete
libera
del
ventricolo
destro,
al
cono
d’efflusso
polmonare,
ad
una
piccola
porzione
del
ventricolo
sinistro
ed
all’origine
dell’aorta
e
dell’arteria
polmonare.
Il
solco
interventricolare
anteriore
divide
le
superfici
dei
due
ventricoli,
mentre
il
solco
atrioventricolare
anteriore
divide
la
superficie
ventricolare
da
quella
atriale.
Separata
dal
pericardio,
tale
faccia
è
in
rapporto
con
la
parete
sternocostale
e
la
porzione
mediastinica
pleuropolmonare.
La
faccia
infero‐posteriore
poggia
per
buona
parte
sul
diaframma
ed
è
costituita
dai
due
ventricoli
e
dai
due
atri.
Il
solco
interventricolare
posteriore
divide
le
superfici
dei
ventricoli,
il
solco
atrioventricolare
posteriore
i
ventricoli
dagli
atri
ed
il
solco
interatriale
i
due
atri.
Separata
dal
pericardio,
questa
faccia
è
in
stretto
rapporto
con
alcune
strutture
del
mediastino
posteriore:
l’esofago
e
l’aorta
discendente
toracica.
Il
margine
acuto
corrisponde
ad
una
porzione
del
ventricolo
destro;
è
in
rapporto
con
la
superficie
del
diaframma.
Il
margine
ottuso,
più
ampio,
costituisce
la
parete
laterale
del
ventricolo
sinistro
ed
è
in
stretto
rapporto
con
la
parete
mediale
del
polmone
sinistro.
La
base
del
cuore
è
formata
dalle
pareti
atriali,
dallo
sbocco
della
vena
cava
superiore
in
atrio
destro
e
dallo
sbocco
delle
quattro
vene
polmonari
in
atrio
sinistro.
L’apice
cardiaco
appartiene
esclusivamente
al
ventricolo
sinistro
e
corrisponde
all’itto
della
punta.
3
L’atrio
destro
riceve
lo
sbocco
del
seno
coronarico
e
delle
vene
cave
superiore
ed
inferiore
che
portano
il
sangue
refluo
dalla
circolazione
generale.
L’auricola
è
ad
ampia
base
d’impianto.
L’atrio
sinistro
riceve
le
vene
polmonari
che
portano
il
sangue
refluo
dal
circolo
polmonare.
L’auricola
è
allungata.
Il
setto
interatriale
è
costituito
dalla
fossa
ovale
ovvero
dall’accollamento
dei
due
foglietti
primitivi,
che
in
età
neonatale
collabiscono
chiudendo
il
forame
ovale.
Il
ventricolo
destro
è
ampiamente
trabecolato
dai
muscoli
papillari,
la
sua
struttura
muscolare
non
è
molto
sviluppata
e
durante
la
sistole
spinge
il
sangue
nel
circolo
polmonare.
Il
ventricolo
sinistro,
più
liscio,
ha
una
struttura
muscolare
parietale
che
consente
una
adeguata
contrazione
durante
la
sistole
per
pompare
il
sangue
nel
circolo
generale.
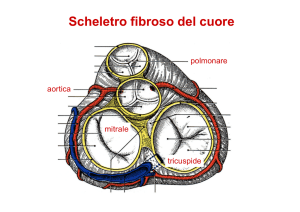
Il
setto
interventricolare
è
costituito
da
una
ampia
porzione
muscolare
e
da
una
porzione
membranosa.
Questa
superiormente
si
continua
nella
parte
fibrosa
del
cuore
(scheletro)
che
supporta,
circondandole,
le
valvole
mitrale,
aortica
e
tricuspide.
Gli
atri
e
i
ventricoli,
infatti,
sono
in
comunicazione
reciproca
per
mezzo
di
due
orifizi
atrio‐ventricolari
forniti
di
valvole
che
ne
regolano
la
chiusura
(nel
ventricolo
destro
la
tricuspide,
nel
sinistro
la
mitrale).
La
valvola
mitrale
è
costituita
da
due
lembi
con
ampia
superficie
di
collabimento
e
questo
può
consentire
un
certo
grado
di
prolasso
di
uno
di
essi.
Le
corde
tendinee
nascono
in
gran
parte
dai
muscoli
papillari
e
si
inseriscono
sia
nella
porzione
marginale
che
nella
porzione
ventricolare
dei
lembi.
La
valvola
tricuspide
è
più
ampia
della
mitrale,
i
tre
lembi
non
sono
di
eguale
dimensione.
Le
corde
tendinee
sono
più
esili.
La
valvola
aortica
è
interposta
tra
ventricolo
sinistro
e
aorta
ascendente;
è
formata
da
tre
coppe
ancorate
ad
un
anello
fibroso.
Nella
parte
libera
ogni
lembo
presenta
un
margine
ispessito
con
un
nodulo
centrale,
che
consente
una
buona
tenuta
della
struttura.
Al
di
sopra
dell’impianto
della
valvola
dall’arteria
aorta
nascono
le
due
arterie
coronarie,
destra
e
sinistra,
che
si
distribuiscono
a
tutto
il
cuore
per
irrorarlo.
La
valvola
polmonare
è
simile
all’aortica,
manca
però
lo
scheletro
fibroso
di
sostegno,
le
cuspidi
sono
più
sottili.
L’area
degli
osti
valvolari
è
tale
da
consentire
il
flusso
sanguigno
fisiologico
senza
gradiente
pressorio
tra
i
due
compartimenti
che
si
mettono
in
comunicazione
a
4
valvola
aperta.
Quando
essa
si
chiude
i
lembi
valvolari,
accollando
gli
orletti
di
chiusura,
impediscono
il
reflusso
del
sangue.
Esistono
delle
parti
anatomiche
deputate
alla
diffusione
ritmica
e
coordinata
dell’eccitazione
elettrica
del
muscolo
cardiaco.
Queste
strutture
specializzate
nella
conduzione
degli
stimoli
sono:
il
nodo
del
seno
situato
tra
vena
cava
superiore
e
atrio
destro,
è
il
pace‐maker
fisiologico
del
cuore;
il
nodo
atrio‐ventricolare
situato
davanti
allo
sbocco
del
seno
coronarico
ed
in
diretta
continuazione
il
fascio
di
His,
che
si
divide
in
due
branche
i
cui
rami
si
sfioccano
in
un
fascio
periferico
di
fibre
sull’endocardio
dei
due
ventricoli.
Il
passaggio
di
una
onda
di
eccitazione
lungo
le
fibre
miocardiche
si
accompagna
a
variazione
di
potenziale
elettrico
lungo
la
fibre;
tale
variazione
di
potenziale
viene
evidenziata
tramite
l’elettrocardiogramma,
le
cui
onde
rappresentano
la
registrazione
del
passaggio
dell’impulso
e
dell’attivazione
della
muscolatura
delle
diverse
parti
del
cuore2.
Nel
cuore
si
svolgono
fenomeni
elettrici
che
sono
necessari
perché
si
generi
l’attività
meccanica
(contrazione
delle
fibre
muscolari)
ma
indipendenti
da
questa.
L’ECG
non
dà
informazioni
sui
processi
meccanici
(contrazione
e
rilasciamento
del
muscolo)
ma
solo
su
quelli
elettrici.
2
Venne introdotto alla fine dell’800 da Einthoven, che per questo motivo ricevette il premio Nobel, ma conserva ancora oggi intatta
la sua importanza Si ottiene posizionando elettrodi sulla cute, sei sul torace anteriore e quattro sulle estremità degli arti un ECG si
può dividere in cinque parti. Il tracciato elettrocardiografico è costituito da una sequenza di onde che esprimono la
depolarizzazione (attivazione) e la ripolarizzazione (recupero) delle diverse sezioni del cuore. Inizia con un'onda di modeste
dimensioni, l'onda P, provocata dalla contrazione degli atri (sistole atriale), che offre indicazioni del tempo impiegato dall'impulso
per propagarsi a entrambi gli atri (può servire appunto per la diagnosi di patologie atriali come il flutter). Segue un tratto piano
privo di onde, il segmento PQ, che indica il passaggio dell'impulso dagli atri ai ventricoli. Successivamente troviamo il complesso
QRS, formato dall'onda Q, breve e verso il basso, l'alta e stretta onda R e la piccola onda S, anch'essa verso il basso; il complesso
caratterizza la sistole ventricolare con l'arrivo dell'impulso ai ventricoli (onda Q) e l'estensione a tutto il tessuto (onde R e S). Il
complesso QRS dà indicazioni su aritmie, fibrillazioni e può essere utile anche in caso d'infarto. Il lungo intervallo ST che segue
l'onda S e comprende l'onda T può rilevare problemi ischemici, visto che rappresenta il periodo in cui i ventricoli si contraggono e
poi (con l'onda T) ritornano a riposo. L'onda T permette di avere indicazioni sull'ipertrofia cardiaca, l'infarto e l'ischemia. L’onda
U ha significato scarso e incerto. Esistono anche altre grandezze (come l'intervallo QT), significative per patologie particolari. Il
tracciato elettrocardiografico registrato su carta comprende 12 derivazioni, 6 delle quali definite periferiche (I, II, III, aVR, aVL,
aVF) perché ottenute ponendo gli elettrodi alle estremità degli arti, mentre le altre 6, denominate precordiali, perché si registrano
con elettrodi posti sul torace, si distinguono con i simboli V1,V2,V3,V4,V5,V6. Tutte le derivazioni registrano la stessa serie di
fenomeni, cioè la medesima sequenza di onde, anche se la forma e l’ampiezza di queste varia da una derivazione all’altra. In realtà
ciascuna derivazione “vede” il cuore da un punto d’osservazione diverso, per cui tutte insieme offrono un panorama completo
della realtà. Oltre che registrato sulla carta apposita, l’ECG può essere osservato su un monitor. Nelle Unita Coronariche, nelle
Terapie Intensive e nelle Sale Operatorie la monitorizzazione dell’ECG fornisce informazioni di grandissima importanza
sull’attività cardiaca.
5
Il
cuore
è
una
pompa
muscolare
atta
a
generare
un
flusso
continuo
di
sangue
ed
a
mantenere
un
livello
pressorio
nell’albero
circolatorio
In
un
ciclo
cardiaco,
gli
atri
destro
e
sinistro
vengono
riempiti
dal
sangue
che
ritorna
ad
essi,
rispettivamente,
attraverso
le
vene
cave
e
le
vene
polmonari.
Trascorso
il
breve
tempo
necessario
al
riempimento,
essi
si
contraggono
simultaneamente,
spingendo
il
loro
contenuto
rispettivamente
nel
ventricolo
destro
e
sinistro.
Questi
ultimi,
una
volta
riempiti,
si
contraggono
anch’essi
contemporaneamente.
La
forza
della
loro
contrazione
chiude
le
valvole
atrioventricolari
ed
apre
quelle
polmonare
e
aortica,
attraverso
le
quali
il
contenuto
ventricolare
viene
rispettivamente
spinto
nell’arteria
polmonare
e
nell’aorta.
Nello
stesso
tempo
gli
atri
si
riempiono
di
nuovo.
L’efficienza
del
cuore
dipende
in
gran
parte
dal
fatto
che
queste
diverse
fasi
si
susseguono
ordinatamente.
In
certe
condizioni
patologiche
molto
comuni
(aritmie,
fibrillazione),
questa
sequenza
di
eventi
viene
alterata.
Dalla
ritmica
attività
delle
contrazioni
atriale
e
ventricolare
vengono
generati
i
toni
cardiaci
provocati
dalla
rapida
accelerazione
e
decelerazione
che
il
sangue
subisce
durante
il
ciclo
cardiaco.
Il
I
tono
origina
dalla
sistole
ventricolare
segnandone
l’inizio;
è
causato
dall’urto
del
sangue
contro
le
valvole
atrio‐ventricolari
e
all’oscillazione
del
sangue
tra
le
valvole
e
le
pareti
e
dall’oscillazione
del
sangue
che
esce
dalla
dall’aorta
e
dall’arteria
polmonare.
Il
II
tono
origina
dalla
fine
della
sistole
ventricolare;
è
causato
dalla
vibrazione
della
colonna
di
sangue
sui
lembi
chiusi
delle
valvole
aortica
e
polmonare.
6
Il
III
tono
origina
alla
fine
della
fase
diastolica
di
riempimento
rapido;
è
causato
dalla
vibrazione
di
tutto
il
sistema
atrio‐ventricolare.
Il
IV
tono
origina
a
metà
della
sistole
atriale;
è
causato
dalla
stessa
sistole.
Diastole
ventricolare:
comincia
subito
dopo
l’onda
T
dell’ECG
(fase
di
ripolarizzazione)
con
il
rilasciamento
della
muscolatura
ventricolare.
Le
valvole
semilunari
si
chiudono
per
effetto
di
un
regime
pressorio
più
elevato
in
aorta
ed
in
arteria
polmonare
rispetto
alle
cavità
ventricolari;
le
valvole
mitrale
e
tricuspide,
al
contrario,
si
aprono
in
seguito
alla
caduta
delle
pressioni
ventricolari
al
di
sotto
di
quelle
atriali
ed
il
sangue
fluisce
attraverso
di
esse
ad
una
velocità
che
progressivamente
si
riduce,
con
il
riempimento
dei
ventricoli,
al
termine
della
diastole.
Sistole
atriale:
comincia
dopo
l’onda
P
ed
attraverso
la
contrazione
della
muscolatura
atriale
contribuisce
ad
un
20%
del
riempimento
ventricolare.
Sistole
ventricolare:
ha
inizio
dopo
il
complesso
QRS
dell’ECG
(fase
di
depolarizzazione)
con
la
contrazione
del
miocardio
e
la
rapida
chiusura
delle
valvole
atrioventricolari
per
l’improvviso
aumento
di
pressione
all’interno
delle
cavità
ventricolari.
Si
distingue
una
fase
isometrica
della
sistole
durante
la
quale
tutte
le
valvole
cardiache
risultano
chiuse
e
la
tensione
sviluppata
dalle
pareti
muscolari
(lavoro
cardiaco
statico)
si
trasmette
alla
massa
sanguigna
contenuta
nelle
cavità
ventricolari
aumentandone
la
pressione
interna;
quando
quest’ultima
supera
la
pressione
diastolica
in
aorta
(70‐80
mmHg)
ed
in
arteria
polmonare
(10‐
15
mmHg),
con
l’apertura
delle
rispettive
valvole
semilunari,
ha
inizio
la
fase
isotonica
durante
la
quale
la
tensione
di
parete
si
trasmette
alla
massa
sanguigna
espulsa
nei
condotti
arteriosi
ad
un
determinato
regime
pressorio
[valori
medi
normali:
130/80
mmHg]
(lavoro
cardiaco
dinamico).
Le
sezioni
del
cuore
costituiscono
due
sistemi
idraulici
posti
in
serie:
il
circolo
polmonare
(sezione
destra)
a
bassa
pressione
ed
il
circolo
sistemico
(sezione
sinistra)
ad
alta
pressione.
La
quantità
di
sangue
espulsa
dal
ventricolo
sinistro
deve
essere
pari
a
quella
che
giunge
al
ventricolo
destro
nella
medesima
unità
di
tempo.
Il
cuore
è
in
grado
di
adeguare
la
portata
cardiaca
(quantità
di
sangue
che
viene
pompata
dal
cuore
in
un
minuto)
alle
esigenze
metaboliche
dei
tessuti
periferici
attraverso
semplici
variazioni
dei
due
parametri:
frequenza
cardiaca
e
gittata
sistolica.
1. Frequenza
cardiaca
(l´aumento
della
frequenza
cardiaca
non
è
in
grado
di
migliorare
la
portata
cardiaca
in
modo
lineare;
superato
un
certo
limite
la
riduzione
del
riempimento
diastolico
e
della
perfusione
coronarica
determinano
la
diminuzione
della
portata
cardiaca)
7
2. Gittata
sistolica
è
condizionata
da
• precarico
(riempimento
diastolico
ventricolare;
è
influenzato
dalla
volemia,
dal
tono
venoso,
dalla
pressione
intratoracica,
dalla
sistole
atriale
al
riempimento
ventricolare
e
dalla
compliance
delle
pareti
ventricolari)
• postcarico
(tensione
sviluppata
a
livello
della
parete
ventricolare
durante
la
sistole;
è
influenzato
dal
diametro
della
camera
ventricolare
e
dall´impedenza
aortica)
• stato
contrattile
miocardico
(proprietà
contrattile
intrinseca
del
muscolo
cardiaco).
Lo
studio
della
contrattilità
miocardica
(mediante
Ecocardiografia
e
Miocardioscintigrafia)
ha
notevole
valore
prognostico
sul
risultato
chirurgico
immediato
e
a
lungo
termine
Meccanismi
dello
scompenso
cardiaco
sono
la
perdita
di
massa
contrattile
con
sostituzione
fibrotica
per
danno
cellulare
diretto
o
l’aumento
di
massa
muscolare
in
risposta
ad
un
sovraccarico
di
pressione
o
di
volume.
Circolazione
extracorporea
La
circolazione
extracorporea
permette
di
sostituire
temporaneamente
la
funzione
di
pompa
del
cuore
e
di
scambiatore
di
gas
del
polmone.
Essa
è
indispensabile
per
la
chirurgia
cardiaca
e
per
l’assistenza
prolungata
in
pazienti
con
grave
insufficienza
cardiaca
acuta
o
con
insufficienza
respiratoria
acuta.
L’intero
flusso
ematico
venoso
refluo
in
atrio
destro
è
aspirato
e
dirottato
verso
una
macchina
esterna
ove
viene
ossigenato
e
pompato
a
pressione
controllata,
quindi
reintrodotto
nell’albero
arterioso
(aorta
o
arteria
femorale).
Ne
consegue
che
il
sangue
deve
passare
attraverso
condotti
non
endotelizzati
e
gli
organi
ricevono
un
flusso
non
pulsatile
ma
continuo.
Tuttavia
la
specie
umana
tollera
questa
condizione,
che
può
essere
definita
“parafisiologica”.
I
componenti
essenziali
di
un
circuito
extra‐corporeo,
destinati
a
sostituire
il
cuore
e
i
polmoni
per
consentire
una
perfusione
e
un’ossigenazione
dei
tessuti
il
più
vicino
possibile
alle
condizioni
fisiologiche,
sono
la
pompa
e
l’ossigenatore.
A
questi
si
aggiungono
gli
aspiratori,
il
cardiotomo,
i
filtri
e
lo
scambiatore
di
calore.
Questi
vari
componenti
sono
collegati
al
paziente
mediante
tubi
e
cannule
di
materiale
sintetico.
Gli
inconvenienti
legati
al
circuito
sono
di
lieve
entità
quando
viene
usato
per
qualche
ora,
divengono
rilevanti
nell’assistenza
prolungata
cardiaca
o
respiratoria.
Il
sangue,
dopo
eparinizzazione3
del
paziente
viene
raccolto
da
una
cannula
posta
in
atrio
destro
o
da
due
cannule
inserite
nelle
vene
cave
e
raggiunge
l’ossigenatore
da
3
Iniettando 300 UI/kg di eparina. Controlli seriati del tempo di coagulazione consentono di mantenerlo almeno tre volte superiore al
normale per tutto il tempo della circolazione extracorporea. Alla fine del by-pass si neutralizza l’eparina con solfato di protamina
in rapporto di 1:1 con l’eparina somministrata.
8
dove,
depurato
dalla
CO2
e
ossigenato,
quindi
opportunamente
riscaldato
o
raffreddato,
viene
pompato
nell’albero
arterioso
attraverso
una
cannula
inserita
nell’aorta
ascendente
o
nell’arteria
femorale.
In
questo
modo
il
sangue
del
paziente
bypassa
il
cuore
e
i
polmoni
rendendo
possibili
interventi
a
cuore
aperto
con
campo
esangue
e
cuore
fermo.
Circuiti
accessori
permettono
di
aspirare
il
sangue
eparinato
dal
campo
operatorio,
esso
viene
raccolto
e
convogliato
in
un
serbatoio
(cardiotomo),
filtrato
e
fatto
defluire
nell’ossigenatore.
Necessari
sono
i
filtri
per
fermare
microemboli
e
piccole
bolle
d’aria,
uno
scambiatore
di
calore
e
sistemi
di
monitoraggio
della
pressione
e
della
temperatura.4
Il
circuito
extracorporeo
deve
essere
riempito
di
sangue
o
altre
soluzioni
prima
di
essere
collegato
al
paziente
per
evitare
l’immissione
di
aria
in
circolo.
Attualmente
si
adoperano
per
il
priming
soluzioni
idroelettrolitiche
bilanciate
per
ottenere
un
ematocrito
del
20
‐
25%
con
un
minor
uso
di
sangue,
diminuzione
della
viscosità
del
sangue
durante
l’ipotermia,
minore
entità
di
danni
polmonari,
renali
ed
encefalici
postoperatori.
Il
danno
miocardico
conseguente
all’arresto
ischemico
è
la
più
comune
causa
di
mortalità
e
di
morbilità
nella
chirurgia
a
cuore
aperto.
Pertanto
vengono
introdotte
nelle
coronarie,
attraverso
la
radice
aortica,
soluzioni
cardioplegiche
(soluzioni
alcaline
fredde
con
una
concentrazione
di
potassio
di
15
‐
30
mEq/l,
lievemente
ipocalcemiche
e
a
contenuto
in
magnesio
simile
a
quello
intracellulare)
che
riducendo
le
richieste
metaboliche
del
miocardio
stabilizzando
lo
stato
fisico‐
chimico
delle
membrane
cellulari
proteggono
il
cuore
dall’insulto
ischemico.
Rispettando
i
principi
e
le
modalità
di
esecuzione,
che
devono
assicurare
una
distribuzione
uniforme
della
soluzione
cardioplegica
in
tutte
le
regioni
miocardiche,
con
l’ipotermia
profonda
e
la
cardioplegia
si
può
protrarre
anche
per
due
–
tre
ore
il
tempo
di
ischemia.5
4
L’ipotermia (moderata 32° - 25° C, profonda 25° - 18° C) diminuisce il consumo di ossigeno da parte dei tessuti. L’ipotermia
sistemica oltre ad evitare o limitare i danni cardiaci, protegge anche gli altri parenchimi (rene, cervello).
5
La cardioplegia deve pertanto assolvere alle seguenti funzioni: indurre l´arresto diastolico del cuore; indurre l´ipotermia miocardica
- è da considerare "sicura" una temperatura monitorata del setto interventricolare inferiore ai 15 °C; apportare substrati metabolici
(glutammato, aspartato) utilizzando soluzioni iperosmolari (per ridurre l’edema interstiziale). In rapporto alla via di
somministrazione la cardioplegia può essere: anterograda (la soluzione cardioplegica è iniettata nel bulbo aortico ad aorta
clampata), o retrograda (la soluzione cardioplegica è iniettata nel seno coronarico). In rapporto alla modalità di
somministrazione: intermittente (la più diffusa) in cui la soluzione cardioplegica è infusa sistematicamente a dose fissa ogni 20
minuti, o continua in cui la perfusione coronarica cardioplegica è continua per tutto il tempo dell´arresto cardiaco. In rapporto alla
temperatura della soluzione somministrata: ipotermica o normotermica ( alcuni protocolli, non estendibili alla totalità dei
pazienti, possono governare l´arresto cardiaco in normotermia mediante infusione di soluzione ematica iperpotassica ma
espongono gli organi ad uno stress biologico maggiore). Fasi dell´arresto cardioplegico: Induzione: in cui viene indotto l´arresto
cardiaco in diastole. Mantenimento: è la fase più prolungata (varie decine di minuti) in cui il cuore viene mantenuto asistolico. La
durata di questa fase è pari al tempo tecnico della fase centrale dell´intervento cardiochirurgico vero e proprio. In questa fase la
soluzione cardioplegica viene somministrata regolarmente ad intervalli regolari. Riperfusione: si induce la ripresa dell´attività
elettromeccanica del cuore con il ripristino della normotermia e con l´induzione di soluzioni ripolarizzanti. È la fase in cui può
avvenire il danno da riperfusione, causato dall´accumulo di calcio intracellulare e da miocitolisi.
9
La
ridotta
riserva
cardiaca,
l’instabilità
circolatoria,
le
ripercussioni
della
circolazione
extracorporea
sui
polmoni
e
sugli
altri
apparati,
l’elevata
richiesta
metabolica
(per
lo
stato
di
“infiammazione
generalizzata”
e
per
la
necessità
di
riscaldarsi
dall’ipotermia)
impongono
un
trattamento
intensivo
nell’immediato
periodo
postoperatorio.
Il
paziente
ancora
sedato
e
intubato
viene
collegato
ad
un
respiratore
automatico
e
monitorizzato.
Raggiunta
la
stabilità
circolatoria
e
riscaldato
l’operato
viene
lasciato
emergere
dalla
sedazione
e
quindi
estubato.
In
genere,
quando
tutto
procede
bene,
sono
necessarie
8
‐
12
ore
postoperatorie
per
raggiungere
una
situazione
di
equilibrio
stabile
e
24
ore
per
recuperare
il
normale
stato
di
coscienza.
Decorso
postoperatorio
in
terapia
intensiva
garantire
un
risveglio
graduale
dall´anestesia:
si
evitano
così
il
fenomeni
di
ipertensione
e
la
tachicardia
dovuti
all´ansia
e
al
dolore
postoperatorio
normalizzare
la
temperatura
del
paziente,
ricorrendo
sia
a
metodi
di
riscaldamento
attivi
che
a
farmaci
per
prevenire
fenomeni
di
brivido,
causa
di
aumentato
consumo
di
ossigeno
svezzare
gradualmente
il
paziente
dalla
ventilazione
meccanica.
Dopo
la
CEC,
il
parenchima
polmonare
è
edematoso
per
l´aumento
della
permeabilità
capillare
ed
il
sovraccarico
idrico,
la
capacità
vitale
e
la
capacità
funzionale
residua
sono
ridotte,
compaiono
micro‐atelettasie.
Inoltre
la
sonnolenza
dovuta
al
residuo
dell´anestesia,
il
dolore
causato
dalla
ferita
sternale
e
dalla
presenza
di
drenaggi
toracici
e
mediastinici,
la
perdita
di
integrità
delle
pleure
e
la
frequente
presenza
di
versamento
limitano
la
capacità
del
paziente
di
espettorare
e
mantenere
una
ventilazione
adeguata.
Per
questi
motivi
solo
una
piccola
percentuale
di
pazienti
può
essere
risvegliata
ed
estubata
subito
dopo
l´intervento:
la
maggior
parte
necessita
invece
di
un
periodo
di
durata
variabile
di
ventilazione
meccanica
stabilizzare
le
condizioni
emodinamiche:
anche
dopo
interventi
non
complicati,
si
osserva
una
depressione
della
funzionalità
cardiaca
che
raggiunge
l´apice
a
circa
4
ore
dalla
fine
dell´intervento.
Sebbene
si
tratti
di
un
fenomeno
reversibile,
durante
questa
fase
è
indispensabile
intervenire
attivamente
per
mantenere
una
portata
cardiaca
ed
una
pressione
di
perfusione
adeguate,
con
il
controllo
del
sanguinamento
postoperatorio,
il
reintegro
della
volemia,
il
mantenimento
di
un
ritmo
cardiaco
stabile,
l´utilizzo
di
farmaci
inotropi
e
vasoattivi
Per
il
successo
di
un
intervento
chirurgico
assume
particolare
importanza
il
controllo
continuo
di
taluni
parametri,
indici
di
funzionalità
dei
principali
apparati
(cardiocircolatorio,
respiratorio,
renale
e
cerebrale),
della
coagulazione
e
del
metabolismo
generale,
in
modo
da
poterne
controllare
le
variazioni
e
agire
10
tempestivamente
con
manovre
e
accorgimenti
terapeutici
idonei.
Il
monitoraggio
va
attuato
sia
durante
l’intervento6
che
nell’immediato
periodo
post‐operatorio7
in
unità
di
terapia
intensiva.
Arresto
circolatorio
Complicanza
del
decorso
postoperatorio,
soprattutto
delle
prime
24
ore
postoperatorie.
Le
cause
più
frequenti
sono
infarto
postoperatorio,
tamponamento
cardiaco,
ipovolemia
acuta
da
sanguinamento
massivo,
distacco
di
protesi
valvolare,
ipokaliemia
o
iperkaliemia,
pneumotorace
ipertensivo.
Terapia:
massaggio
cardiaco
esterno
(100
compressioni
al
minuto
che
provochino
la
depressione
dello
sterno
di
4‐5
cm);
ventilazione
in
ossigeno
puro
(12
insufflazioni
al
minuto
sincronizzate
con
le
compressioni
toraciche);
defribillazione
elettrica
(scarica
non
sincronizzata
di
corrente
continua
fino
a
360
Joule
di
energia);
farmaci
(adrenalina
in
bolo
di
0,5‐1
mg
o
in
infusione
continua
nella
linea
venosa
centrale
e
cloruro
di
calcio);
massaggio
cardiaco
interno
(dopo
riapertura
d’emergenza
del
torace);
contropulsatore
aortico
(catetere
a
palloncino
posizionato
in
aorta
discendente
collegato
ad
un
apparecchi
esterno
che
gonfia
il
palloncino
in
diastole
e
bruscamente
lo
sgonfia
all’inizio
della
sistole,
in
questo
modi
si
ha
un
rialzo
pressorio
diastolico
con
aumento
della
perfusione
coronaria).
Insufficienza
renale
acuta
postoperatoria
Circa
il
4%
dei
pazienti
operati
in
CEC
sviluppa
insufficienza
renale
oligoanurica,
condizione
che
è
gravata
da
una
mortalità
elevata
(60‐80%).
Fattori
predisponenti
sono
la
creatininemia
preoperatoria
>
1,6
mg/dl;
l’insufficienza
cardiaca
preoperatoria;
l’età
avanzata;
la
durata
della
CEC;
la
bassa
portata
postoperatoria;
la
politrasfusione;
l’uso
di
mezzi
di
assistenza
circolatoria
meccanica.
Una
volta
instaurata,
l’insufficienza
renale
acuta
oligoanurica
insensibile
al
trattamento
con
i
diuretici
deve
essere
trattata
aggressivamente
con
emofiltrazione
o
dialisi
per
evitare
le
conseguenze
dell’uremia,
della
ritenzione
idrica
e
dell’iperpotassiemia.
6
Temperatura, elettrocardiogramma, pressione arteriosa, pressione venosa centrale, diuresi, equilibrio acido-base, bilancio
idroelettrolitico.
7
Temperatura, elettrocardiogramma, pressione arteriosa, pressione venosa centrale, gittata cardiaca, gas ematici, diuresi e parametri
di funzione renale, equilibrio acido-base, bilancio idroelettrolitico, computo delle perdite ematiche dai tubi di drenaggio, assetto
metabolico e coagulativo, esame neurologico ed elettroencefalogramma.
La pressione arteriosa, mediante agocannula in un’arteria periferica, permette di valutare l’efficacia contrattile del miocardio e di
controllare la volemia del paziente. La pressione venosa centrale si ottiene incannulando una vena centrale (succlavia, femorale,
giugulare interna) e serve a valutare sia l’attività cardiaca che l’entità della massa circolante. La misurazione della gittata cardiaca
serve a valutare la funzione di pompa del cuore. La diuresi viene monitorata con un catetere vescicole a palloncino. La funzione
respiratoria viene controllata con l’esame emogasanalitico ripetuto a intervalli regolari. A fine intervento vengono posizionati due
drenaggi in mediastino sia per drenare le perdite ematiche sia per misurare le perdite ed effettuare un adeguato rimpiazzo. Il bilancio
idroelettrolitico si calcola comparando le perdite (diuresi, perdite ematiche, drenaggio dal sondino naso-gastrico, perspiratio
insensibilis) con le entrate (soluzioni somministrate per endovena e per os). Il tempo di risveglio del paziente, il suo orientamento nel
tempo e nello spazio, la capacità di muovere gli arti su richiesta sono i parametri neurologici principali che vanno eventualmente
completati con l’esame neurologico e con l’EEG.
11
Valutazione
del
rischio
chirurgico
European
System
for
Cardiac
Operative
Risk
Evaluation
o
EUROSCORE
rappresenta
uno
dei
più
recenti
strumenti
a
punteggio
per
valutare
il
rischio
chirurgico.
Pubblicato
nel
1999,
è
stato
costruito
su
un
set
di
circa
19.000
pazienti
operati
in
128
centri
di
8
paesi
europei.
L’end
point
analizzato
è
la
mortalità
entro
30
giorni
oppure
nel
corso
del
ricovero,
se
questo
dura
più
di
30
giorni.
La
stima
di
mortalità
nello
studio
originale
è
la
seguente:
da
0
a
2
punti:
0,8%;
da
3
a
5
punti:
3,0%;
oltre
i
5
punti:
11,2%.
12
Cardiopatie
congenite
Nel
feto
solo
una
piccola
quantità
di
sangue
passa
nei
polmoni
non
espansi;
gran
parte
del
sangue
pompato
dal
ventricolo
destro
passa
nell’aorta
discendente
tramite
il
dotto
arterioso.
La
pressione
nell’atrio
destro
si
mantiene
più
alta
che
a
sinistra
e
quindi
parte
del
sangue
può
defluire
attraverso
la
pervietà
del
forame
ovale
nel
ventricolo
sinistro
e
da
qui,
insieme
ad
una
piccola
quota
proveniente
dalle
vene
polmonari,
nell’aorta.
Alla
nascita,
dopo
i
primi
atti
respiratori,
si
ha
una
marcata
vasodilatazione
arteriolare
con
grande
aumento
di
flusso;
nel
contempo
aumentano
le
resistenze
periferiche
per
la
chiusura
dei
vasi
ombelicali.
L’aumentato
ritorno
venoso
polmonare
incrementa
la
pressione
nell’atrio
sinistro
con
chiusura
del
forame
ovale
dapprima
funzionale,
per
apposizione
dei
foglietti
del
setto
interatriale,
in
seguito
anatomica.
Pochi
giorni
dopo
la
nascita
parimenti
avviene
la
chiusura
totale
del
dotto
arterioso
di
Botallo.
La
valutazione
clinica
di
un
neonato
con
cardiopatia
congenita
è
rivolta
al
riconoscimento
della
presenza
di
cianosi8,
di
rumori
cardiaci
aggiunti,
della
difficoltà
nell’alimentazione,
della
mancata
crescita
ponderale,
di
frequenti
infezioni
respiratorie,
della
facile
stancabilità
ed
irritabilità.
La
valutazione
strumentale
comprende
necessariamente
la
radiografia
del
torace
e
l’elettrocardiogramma.
L’esame
ecografico
bidimensionale
e
Doppler
consente
il
riconoscimento
specifico
della
maggior
parte
delle
cardiopatie
congenite.
Nelle
forme
più
complesse
si
aggiunge
il
cateterismo
cardiaco9.
8
Con questo termine s’indica il colorito bluastro che si osserva a carico della cute e delle mucose quando il sangue è particolarmente
povero d’ossigeno. I globuli rossi contengono l’emoglobina, proteina il cui compito è quello di trasportare l’ossigeno; questo si lega
all’emoglobina nei polmoni e viene poi ceduto dall’emoglobina ai tessuti a livello capillare. L’emoglobina si può trovare in due
differenti stati: può contenere l’ossigeno o non contenerlo (in questa seconda situazione prende il nome d’emoglobina ridotta) perché
non è riuscita a captarlo a livello degli alveoli polmonari oppure perché lo ha già ceduto ai tessuti. Il contenuto normale di
emoglobina nel sangue è pari a 16 grammi per 100 millilitri. Quando il sangue capillare contiene più di 5 grammi di emoglobina
ridotta per 100 millilitri, compare la cianosi.
Questo reperto non è specifico delle malattie di cuore ma compare anche in alcune malattie respiratorie.
Cianosi periferica: riflette un’abnorme estrazione di O2 da sangue arterioso con normale saturazione (stagnazione)
Cianosi centrale: risultato di una diminuita saturazione di O2 del sangue arterioso (mixing artero-venoso)
Per accertare la presenza della cianosi è necessario valutare il colorito della cute e delle mucose, osservando particolarmente le
guance, le labbra, le dita delle mani e dei piedi, le unghie, i padiglioni auricolari.
9
È possibile introdurre nel cuore, attraverso vene o arterie periferiche, sottili sonde flessibili (cateteri), sia a scopo diagnostico che
terapeutico. Nel primo caso il catetere, spinto sotto controllo radiologico fin dentro le cavità cardiache, può misurare la pressione
intracavitaria o registrare l’elettrocardiogramma direttamente all’interno del cuore. Si può eseguire, inoltre, attraverso il catetere, un
prelievo di sangue per misurare la saturazione d’ossigeno nelle diverse cavità cardiache (questa tecnica si impiega per misurare la
portata cardiaca o per calcolare l’entità di uno shunt intracardiaco), ed infine si può iniettare mezzo di contrasto per opacizzare le
cavità del cuore o i vasi arteriosi (per esempio, le coronarie) o venosi.
Da un punto di vista terapeutico, il cateterismo cardiaco può consentire di dilatare vasi stenotici (ristretti) od occlusi (tecnica
denominata angioplastica) o valvole stenotiche (valvuloplastica).
Sempre con metodica transcatetere, si possono oggi correggere alcune malformazioni congenite del cuore come il difetto interatriale
o interventricolare e la pervietà del dotto arterioso di Botallo.
Infine, numerose aritmie cardiache possono essere curate con una metodica di stimolazione transcatetere: per esempio nel blocco AV
è possibile introdurre nel cuore un elettrocatetere che, connesso ad uno stimolatore (pacemaker) stimola il cuore evitando che insorga
13
La
chirurgia
delle
cardiopatie
congenite
si
indirizza
sempre
più
verso
la
correzione
completa
in
età
precoce
con
l’obiettivo
di
ristabilire
il
più
rapidamente
possibile
una
normale
funzione
emodinamica.
L’intervento
palliativo
invece
non
raggiunge
questo
obiettivo
e
complica
il
quadro
anatomopatologico,
tuttavia
è
fuori
discussione
il
valore
delle
tecniche
palliative
nelle
malformazioni
complesse,
nelle
procedure
d’urgenza
e
in
particolari
situazioni
anatomiche
perchè
tendono
ad
alleviare
la
sintomatologia
ed
il
compenso
del
piccolo
paziente
senza
modificare
la
lesione
anatomica
responsabile.
Infatti
solo
poche
malformazioni
sono
completamente
risolte
dall’intervento,
più
frequentemente
la
correzione
consente
un
radicale
mutamento
dell’aspettativa
di
vita,
ma
non
esita
in
un
completo
ritorno
alla
normalità.
Difetto
interatriale
È
una
comunicazione
di
varia
dimensione
tra
i
due
atri,
in
genere
si
ha
uno
shunt
sinistro
‐
destro.
Rappresenta
il
7%
delle
cardiopatie
congenite,
più
frequente
nel
sesso
femminile
(2:1).
Abitualmente
il
riscontro
di
difetto
interatriale
è
occasionale,
la
sintomatologia
si
manifesta
nella
IV
‐
V
decade
di
vita
con
aritmie
sopraventricolari,
dispnea10
da
sforzo
e,
nei
casi
gravi,
scompenso
cardiaco;
nei
primi
anni
di
vita
possono
essere
presenti
frequenti
episodi
bronchitici;
all’ascoltazione
soffio
sistolico
polmonare.
Il
cateterismo
cardiaco
non
è
necessario
nei
bambini
e
nei
giovani,
negli
adulti
può
essere
necessario
per
valutare
i
valori
della
pressione
polmonare.
L’intervento
chirurgico
è
indicato
nei
pazienti
con
shunt
superiore
al
50%
della
portata
sistemica
e
consiste
nella
chiusura
del
difetto
mediante
sutura
diretta
o
con
patch
di
materiale
sintetico.
Difetto
interventricolare
É
dovuto
alla
presenza
di
una
comunicazione
tra
i
due
ventricoli.
Le
dimensioni
del
difetto
e
le
resistenze
polmonari
condizionano
il
quadro
fisiopatologico.
Un
ampio
difetto
causa
un
importante
shunt
sinistro
‐
destro
con
grave
iperafflusso
polmonare
e
tendenza
precoce
allo
scompenso
cardiaco.
Se
lo
shunt
è
bidirezionale
compare
cianosi
ma
il
compenso
di
circolo
si
mantiene
più
adeguato.
Difetti
piccoli
presentano
quadri
emodinamici
più
sfumati
e
paucisintomatici.
l’arresto cardiaco dovuto all’asistolia. Somministrando attraverso la punta del catetere, posta a contatto con la superficie interna del
cuore, energia a radiofrequenza, è possibile creare piccole lesioni che provocano a carico del tessuto un danno termico, il quale
evolve poi in fibrosi; si possono così eliminare piccole zone miocardiche dalle quali si origina un’aritmia; questa metodica prende il
nome di ablazione transcatetere.
10
È la sensazione che per respirare si deve fare uno sforzo, come per vincere un ostacolo. Questo sintomo riconosce numerose
cause, ed è comune sia nelle malattie dell’apparato respiratorio che in quelle cardiache.
La dispnea d’origine cardiaca è solitamente sintomo di scompenso cardiaco, esprime cioè quella condizione in cui il cuore non riesce
a fornire una portata circolatoria (cioè una quantità di sangue) sufficiente a soddisfare le richieste dell’organismo. La dispnea
interviene dopo sforzo se la compromissione del cuore è lieve o moderata, mentre quando lo scompenso è d’entità rilevante il
sintomo compare a riposo. Allora il paziente è costretto a dormire con più cuscini o deve addirittura mettersi seduto o in piedi per
respirare. Una dispnea grave e ad insorgenza improvvisa rappresenta un’emergenza, e richiede un trattamento immediato.
14
L’80%
dei
difetti
interventricolari
diagnosticati
ad
un
mese
di
vita
si
chiude
spontaneamente
entro
il
primo
anno.
I
criteri
diagnostici
sono:
soffio
sistolico,
segni
di
scompenso
cardiaco
che
rispondono
bene
alla
terapia
medica;
frequenti
infezioni
broncopolmonari;
scarsa
crescita
corporea.
Un
terzo
dei
pazienti
è
asintomatico.
La
diagnosi,
oltre
ai
reperti
clinici,
è
formulata
sulla
base
dei
dati
ecocardiografici
bidimensionali
e
Doppler.
L’intervento
di
chiusura
con
patch
è
da
fare
in
urgenza
nei
casi
di
difetti
ampi
con
scompenso
conclamato
e
intrattabile.
Può
essere
dilazionato
se
i
sintomi
non
sono
severi.
Persistenza
del
dotto
arterioso
Il
dotto
arterioso
costituisce
una
comunicazione
tra
l’aorta
e
la
parte
distale
del
tronco
dell’arteria
polmonare.
Nei
nati
a
termine
il
dotto
arterioso
si
chiude
nei
primi
giorni
di
vita.
Se
esso
rimane
pervio
si
verifica
iperafflusso
polmonare
con
graduale
tendenza
allo
scompenso
cardiaco.
Il
5%
dei
nati
a
termine
con
persistenza
del
dotto
arterioso
muore
entro
il
primo
anno
di
vita
per
scompenso
cardiaco
e
complicanze
polmonari.
Nella
prima
infanzia
si
osservano
frequenti
infezioni
dell’apparato
broncopolmonare
con
scompenso
cardiaco;
nei
bambini
più
grandi
i
sintomi
sono
sfumati
ma
è
presente
un
soffio
sisto‐diastolico
sul
focolaio
della
polmonare.
Il
trattamento
terapeutico
viene
effettuato
mediante
chiusura
chirurgica
del
dotto.
Tetralogia
di
Fallot
Malformazione
caratterizzata
da
stenosi
infundibolare
e
valvolare
polmonare,
ampio
difetto
del
setto
interventricolare,
cavalcamento
aortico
del
setto
ed
ipertrofia
del
ventricolo
destro.
Costituisce
il
12%
delle
cardiopatie
congenite.
È
dovuta
alla
deviazione
anteriore
del
setto
infundibolare
male
allineato
con
le
restanti
porzioni
del
setto
interventricolare.
Si
realizza
nelle
forme
tipiche
un
quadro
di
shunt
destro
‐
sinistro
con
ridotta
portata
polmonare,
elevata
portata
aortica,
cianosi
marcata,
dispnea
da
sforzo,
ippocratismo
digitale,
squatting,
policitemia.
Se
la
stenosi
polmonare
è
moderata
lo
shunt
sarà
prevalentemente
sinistro
‐
destro
con
cianosi
modesta.
La
gravità
e
l’età
di
comparsa
della
sintomatologia
sono
in
rapporto
al
grado
di
severità
della
stenosi
polmonare.
15
La
tetralogia
di
Fallot
è
spesso
associata
con
difetti
di
crescita,
ma
se
la
malformazione
cardiaca
viene
riparata
precocemente,
può
essere
ottenuta
a
lungo
termine
una
crescita
normale.
L'intervento
precoce,
prima
dei
5
anni
di
età,
determina
un'accelerazione
della
crescita
in
altezza
e
peso,
con
normalizzazione
del
processo
di
crescita
a
lungo
termine
e
raggiungimento
del
potenziale
genetico
individuale.
Trattamento
medico:
prevenzione
delle
crisi
asfittiche.
In
considerazione
della
prognosi
naturale
molto
severa
(la
sopravvivenza
media
spontanea
è
di
12
anni,
con
mortalità
del
50%
nel
primo
anno)
e
degli
ottimi
risultati
tecnici
raggiunti,
la
tetralogia
di
Fallot
rappresenta
una
indicazione
assoluta
all’intervento
chirurgico
correttivo.
Stenosi
polmonare
Rappresenta
circa
il
10%
delle
cardiopatie
congenite.
Causa
un’ostruzione
alla
fuoriuscita
del
sangue
dal
ventricolo
destro
con
conseguente
aumento
della
pressione
intraventricolare.
È
sempre
presente
un
soffio
sul
focolaio
polmonare;
nei
casi
gravi
crisi
ipossiche
e
scarsa
crescita;
dispnea
da
sforzo
e
facile
stancabilità;
possibilità
di
morte
improvvisa.
Il
trattamento
di
scelta
consiste
nella
dilatazione
valvolare
percutanea
con
catetere
a
palloncino
(valvuloplastica).
Forme
associate
con
comunicazione
interatriale
o
con
prevalente
ostruzione
muscolare
infundibolare
richiedono
la
correzione
chirurgica
(commissurotomia
valvolare).
Coartazione
aortica
Restringimento
dell’aorta
a
livello
dell’istmo,
più
frequente
nel
sesso
maschile
(2,5:1).
In
epoca
neonatale
provoca
scompenso
cardiaco
con
mortalità
elevata
(75%
nel
primo
anno
di
vita)
che
impone
il
precoce
intervento
chirurgico
di
resezione
dell’istmo
aortico
stenotico
e
successiva
anastomosi
termino‐terminale
dell’aorta.
La
coartazione
può
rimanere
asintomatica
fino
all’adolescenza
quando
compaiono
i
sintomi:
astenia,
crampi
da
sforzo
agli
arti
inferiori,
cefalea,
epistassi.
Trasposizione
dei
grossi
vasi
La
trasposizione
dei
grossi
vasi
è
una
delle
più
frequenti
cardiopatie
cianogene
del
neonato,
rappresentando
il
30
‐
40%
di
tutti
i
casi.
È
la
risultanza
di
una
anomala
divisione
del
tronco
bulbare
nel
corso
dello
sviluppo
embriologico,
così
che
l’aorta
origina
dal
ventricolo
destro
e
l’arteria
polmonare
dal
ventricolo
sinistro.
L’ossigenazione
ematica
è
possibile
solo
attraverso
un
mescolamento
(mixing)
delle
due
circolazioni
mediante
l’esistenza
di
un
difetto
interatriale
o
interventricolare.
L’assenza
del
mescolamento
è
incompatibile
con
la
vita.
I
sintomi
sono
precoci:
cianosi
di
vario
grado
in
rapporto
al
mescolamento,
scompenso
cardiaco.
La
mortalità
è
molto
alta:
90%
nel
primo
anno
di
vita.
Di
notevole
complessità
è
la
sua
correzione,
che
deve
essere
precoce
e
gravata
di
alta
mortalità.
16
Stenosi
aortica
È
un’ostruzione
all´efflusso
ventricolare
sinistro
(4%).
La
più
frequente
delle
lesioni
anatomiche
è
la
stenosi
valvolare
(50%).
Si
possono
riscontrare
valvole
aortiche
tricuspidi
ma
malformate,
bicuspidi,
monocuspidi
o
a
cupola
con
foro
centrale;
frequenti
sono
le
fusioni
tra
le
commissure
ed
i
processi
degenerativi
dovuti
a
traumi
emodinamici.
La
stenosi
sopravalvolare
è
causata
da
un
restringimento
a
clessidra
subito
sopra
al
piano
valvolare
aortico.
La
stenosi
sottovalvolare
può
essere
determinata
dalla
presenza
di
un
anello
fibromuscolare
sottovalvolare
o
da
una
marcata
ipertrofia
settale
asimmetrica.
In
caso
di
stenosi
valvolare
aortica
una
valvuloplastica
può
ridurre
il
gradiente
e
permettere
di
rinviare
l´intervento
in
attesa
di
un
maggiore
accrescimento
del
piccolo
paziente.
Alternativamente
si
ricorre
ad
interventi
in
circolazione
extracorporea
per
eseguire
commissurotomia
e
rimodellamento
della
valvola
Anomalia
di
Ebstein
Anomalo
sviluppo
della
valvola
tricuspide,
caratterizzato
da
un´inserzione
dei
lembi
settale
e
posteriore,
variamente
dislocati
inferiormente
all´anello
valvolare,
verso
l´apice
ventricolare.
La
riduzione
volumetrica
del
ventricolo
destro
e
l´incontinenza
valvolare
determinano
una
ridotta
capacità
di
riempimento
ventricolare
con
aumento
della
pressione
atriale,
comparsa
di
shunt
destro‐sinistro
e
di
segni
di
insufficienza
ventricolare
destra;
la
cianosi
è
conseguente
allo
shunt
interatriale
invertito
ed
è
di
entità
variabile.
Plicatura
della
parte
atrializzata
del
ventricolo
e
rimodellamento
o
sostituzione
della
valvola
per
ridurne
l´insufficienza.
Le
complicanze
aritmiche
sono
frequenti
e
rendono
pari
al
10%
circa
la
mortalità
perioperatoria
Altre
cardiopatie
congenite
Altre
cardiopatie
congenite
di
minore
frequenza,
spesso
associate,
sono:
•
ritorno
venoso
anomalo
totale
•
atresia
della
tricuspide
•
tronco
arterioso
comune
•
sindrome
del
cuore
sinistro
ipoplasico
•
cor
triatrium
•
ventricolo
unico
•
anomalie
coronariche
•
malposizione
del
cuore
•
arco
aortico
interrotto.
17
Cardiopatie
acquisite
Valvulopatie
La
stenosi
valvolare
si
crea
quando
le
cuspidi
o
foglietti
valvolari
si
inspessiscono
e
si
fondono
tra
loro
negli
angoli
in
cui
si
toccano
(commissure).
Separando
le
due
parti
fuse
tra
di
loro
si
può
ridurre
la
stenosi
e
permettere
ai
foglietti
di
muoversi
più
liberamente.
L’insufficienza
valvolare
può
essere
causata
dall’indebolimento
o
allungamento
dei
foglietti
valvolari
o
delle
corde
tendinee.
Il
bordo
dei
lembi
che
normalmente
devono
combaciare
viene
spostato,
la
valvola
non
chiude
più
correttamente
ed
il
sangue
refluisce
indietro.
Il
rigurgito
stesso
del
sangue
fa
ulteriormente
progredire
la
disfunzione
valvolare
causandone
la
dilatazione;
diventa
quindi
necessario
restaurare
chirurgicamente
i
corretti
rapporti
tra
le
diverse
componenti
della
valvola.
Per
far
questo
può
essere
necessario
asportare
il
tessuto
in
eccesso,
oppure
accorciare
le
corde
tendinee,
oppure
ancora
stringere
l’anello
valvolare
rinforzandolo
con
anelli
di
supporto.
In
alcuni
casi
le
due
alterazioni
sono
presenti
contemporaneamente
nella
stessa
valvola:
"stenoinsufficienza".
Stenosi
aortica
Può
essere
di
origine
congenita
(rara),
degenerativa
ma
più
frequentemente
reumatica
(50%
dei
casi);
il
reperto
anatomopatologico
è
caratterizzato
inizialmente
dall’ispessimento,
la
retrazione
e
la
fusione
delle
cuspidi
valvolari
che
successivamente,
a
causa
della
turbolenza
del
flusso
ematico
a
livello
dell’ostio
valvolare
alterato,
andranno
incontro
a
calcificazione
e/o
fusione
di
una
o
più
commissure.
L’ostacolo
che
la
valvola
aortica
stenotica
oppone
all’uscita
del
sangue
dal
ventricolo
sinistro
determina
un
aumento
del
lavoro
necessario
per
mantenere
adeguata
la
portata
cardiaca.
Pazienti
portatori
di
stenosi
aortica
possono
essere
asintomatici.
I
pazienti
sintomatici
hanno
sincopi,
vertigini,
angina
pectoris
o
dispnea
durante
lo
sforzo
fisico.
Nel
10%
si
verifica
la
morte
improvvisa.
La
sopravvivenza
media
senza
intervento
è
di
2
anni.
Bisogna
intervenire
alla
comparsa
dei
primi
sintomi
o
quando
all’esame
emodinamico
si
riscontri
un
gradiente
pressorio
transvalvolare
superiore
a
75
mmHg.
L’intervento
chirurgico
correttivo
consiste
nella
sostituzione
della
valvola
aortica
con
una
protesi
valvolare11
meccanica
o
biologica.
11
Il disegno, i materiali e le funzioni di tutte le protesi valvolari cardiache sono tesi a soddisfare le caratteristiche di valvola
artificiale ottimale: non essere ostruttiva, non essere incontinente, non provocare emolisi, non essere trombogenica essere
biologicamente inerte, essere facile da inserire, avere lunga durata. Le protesi meccaniche si suddividono in tre gruppi: protesi
18
Insufficienza
aortica
Il
reflusso
di
sangue
dall’aorta
al
ventricolo
sinistro
durante
la
diastole
determina
un
aumento
del
lavoro
del
cuore,
il
ventricolo
sinistro
ad
ogni
sistole
deve
espellere
oltre
alla
gittata
sistolica
anche
il
sangue
refluito
durante
la
diastole
precedente.
L’etiologia
può
essere
secondaria
a
malattia
reumatica,
ad
ectasia
dell’anulus
aortico,
ad
endocardite
infettiva,
secondaria
ad
aneurisma
aterosclerotico
dell’aorta,
essere
complicanza
della
sifilide
o
di
malattie
autoimmuni
che
retraggono
le
cuspidi
valvolari.
Può
essere
un
vizio
valvolare
cronico
ingravescente
che
spesso
gode
di
una
lunga
fase
asintomatica,
o
avere
un
inizio
improvviso
e
acuto.
I
sintomi
dominanti
sono:
dispnea
da
sforzo,
angina
pectoris,
cardiomegalia.
Vi
è
indicazione
all’intervento
chirurgico
di
sostituzione
valvolare
in
tutti
i
pazienti
sintomatici
e
negli
asintomatici
con
cardiomegalia
o
con
tendenza
al
sovraccarico
ventricolare
in
cui
non
raramente
è
necessario
procedere
ad
un
intervento
d’urgenza.
Stenosi
mitralica
La
causa
più
frequente
(99%)
è
la
malattia
reumatica.
Si
manifesta
con
un’incidenza
doppia
nel
sesso
femminile
rispetto
al
maschile.
Il
paziente
lamenta
dispnea
da
sforzo,
ortopnea
e
dispnea
parossistica
notturna.
Complicanze
della
stenosi
mitralica
sono:
la
fibrillazione
atriale
episodica
o
persistente
con
concomitante
embolia
arteriosa
sistemica,
l’edema12
polmonare
acuto,
l’emottisi,
l’ipertensione
polmonare
che
può
determinare
scompenso
ventricolare
destro.
Tre
tipi
di
intervento
chirurgico,
consigliabile
in
tutti
i
pazienti
sintomatici
a
causa
del
basso
rischio
operatorio
e
della
possibilità
di
episodi
embolici
cerebrali,
possono
a palla, a disco oscillante, a due emidischi. Le valvole biologiche sono costituite da valvole aortiche di maiale o costruite con
pericardio di bue. I pazienti in cui sono stati impiantate protesi meccaniche devono seguire una terapia anticoagulante per ridurre il
rischio di formazione di coaguli sanguigni sulle protesi; i pazienti con protesi biologiche non richiedono terapia anticoagulante se
hanno ritmo sinusale; purtroppo il processo di soppressione dell’antigenicità dei tessuti della protesi provoca la distruzione
parziale di alcuni costituenti biologici con progressiva alterazione della struttura (distruzione e calcificazione della valvola) in un
tempo variabile da pochi anni fino a 10 anni. Protesi meccaniche e biologiche vanno considerate valutandone pregi e difetti, quindi
la loro indicazione deve essere di volta in volta adeguata alla storia clinica del paziente.
12
Si definisce edema la condizione in cui liquido fuoriuscito dai capillari si raccoglie nell’interstizio, particolarmente nel
sottocutaneo, nel parenchima di un viscere o in una cavità sierosa (pleura, pericardio, peritoneo). L’edema sottocutaneo si accumula,
a causa della forza gravità, nelle zone declivi. Il gonfiore si rileva esercitando una pressione, con il polpastrello del pollice, sul dorso
del piede, alla caviglia o sulla faccia anteromediale della tibia, là dove l’osso non è ricoperto da muscolo: se è presente edema, la
pressione genera un avvallamento (segno della fovea). Nel caso, invece, in cui il malato decomba da tempo a letto, è poco utile
ricercare la fovea al piede o alla gamba, perché il liquido non si accumula in quelle zone; bisogna invece mettere il paziente a sedere
e comprimere in corrispondenza del sacro, dove, in caso di edema, si apprezzerà il segno della fovea.
La presenza di edema si può riscontrare in diverse condizioni, le più importanti delle quali sono:
• Lo scompenso cardiaco
• Le malattie del fegato o del rene in cui è alterata la composizione delle proteine plasmatiche.
19
essere
praticati:
la
commissurolisi
mitralica
“a
cuore
chiuso”
mediante
un
divulsore
che
forza
sui
lembi
valvolari
in
modo
da
separare
le
commissure
fuse;
la
commissurotomia
in
circolazione
extracorporea;
la
sostituzione
della
valvola
mitralica
con
protesi.
Insufficienza
mitralica
Il
reflusso
di
sangue
dal
ventricolo
sinistro
all’atrio
sinistro
può
essere
ad
etiologia
cronica
dovuto
a
malattia
reumatica,
a
mesenchimopatie,
a
prolasso
della
mitrale,
a
lesioni
valvolari
determinate
da
una
endocardite
infettiva
o
ad
una
malformazione
della
valvola,
o
acuta
per
rottura
dei
muscoli
papillari
da
ischemia
miocardica.
La
forma
cronica
può
restare
asintomatica
per
anni.
Sintomi
caratteristici
sono:
astenia
e
ridotta
tolleranza
allo
sforzo,
dispnea
da
sforzo
e
parossistica
notturna,
ortopnea,
palpitazioni,
cardiopalmo13.
Vanno
trattati
chirurgicamente
pazienti
con
insufficienza
mitralica
sintomatica
refrattaria
al
trattamento
medico
o
pazienti
asintomatici
con
ingrandimento
progressivo
del
ventricolo
sinistro.
L’intervento
chirurgico
consiste
nella
riparazione
della
valvola
o
nella
sua
sostituzione
con
una
protesi.
Insufficienza
tricuspidale
É
il
vizio
più
frequente
a
carico
della
valvola
tricuspide
Determina
un
reflusso
di
sangue
dal
ventricolo
destro
all’atrio
destro
durante
la
sistole.
Riconosce
nella
maggior
parte
dei
casi
una
etiologia
reumatica.
Con
l’eccezione
delle
forme
da
endocardite
settica,
frequenti
nei
tossicodipendenti,
non
si
presenta
in
forme
isolate,
ma
spesso
è
associata
a
valvulopatie
mitraliche.
Il
quadro
clinico
comprende
edemi
declivi,
turgore
giugulare,
epatomegalia,
frequente
la
fibrillazione
atriale.
L’insufficienza
tricuspidale
isolata
lieve
o
moderata
non
ha
indicazione
a
correzione
chirurgica
perché
ben
tollerata,
quella
severa
richiede
il
trattamento
chirurgico
di
riparazione
o
di
sostituzione
quando
determina
una
netta
riduzione
della
capacità
funzionale
del
paziente.
13
Normalmente il battito cardiaco non viene avvertito dall’individuo, se non in particolari condizioni (per esempio, dopo una corsa).
La sensazione che deriva dal sentire il battito del proprio cuore viene definita cardiopalmo. Spesso il cardiopalmo dipende
dall’aumento del numero dei battiti (tachicardia), ma i due fenomeni non sono sempre associati: è possibile, infatti, non accorgersi
del battito cardiaco anche in presenza di una tachicardia ad elevata frequenza, e al contrario si può “sentire” il cuore anche se
questo batte a frequenza normale (fra 60 e 100 battiti al minuto nell’adulto). Davanti ad un paziente che riferisce cardiopalmo, la
prima cosa da fare è palpare il polso. Questa semplice manovra consente di rilevare due dati: la frequenza (numero di battiti al
minuto) e la regolarità o irregolarità del polso. E’ così possibile comprendere se alla base del cardiopalmo vi sia un’alterazione del
ritmo cardiaco (aritmia) o della frequenza, o se invece non sia presente alcun’anomalia che spieghi il sintomo.
20
Stenosi
tricuspidale
Il
quadro
anatomico
è
caratterizzato
dalla
fusione
dei
lembi
valvolari
che
delimitano
una
piccola
apertura
centrale
di
1
‐
1,5
cm
di
diametro,
con
alterazioni
più
o
meno
gravi
delle
corde
tendinee.
Per
la
sua
correzione
si
può
procedere
alla
commissurotomia
o
alla
sostituzione
valvolare,
in
base
alle
alterazioni
anatomiche
dei
lembi
e
delle
corde
tendinee.
Le
alterazioni
a
carico
della
valvola
tricuspide
vengono
generalmente
trattate
chirurgicamente
al
momento
della
correzione
della
concomitante
e
più
importante
patologia
mitralica.
Endocardite
infettiva
È
una
infezione
localizzata
sulle
valvole
cardiache
native
(endocardite
valvolare
da
Streptococco),
sulle
protesi
(endocardite
protesica
da
Stafilococco),
sull’endocardio
parietale.
La
sintomatologia
è
costituita
da:
febbre,
segni
sistemici
di
infezione,
insorgenza
o
aggravamento
di
un
rigurgito
valvolare.
Sono
frequenti
le
complicanze
emboliche
o
microemboliche
a
carico
di
ogni
distretto.
Il
trattamento
medico,
dopo
l’antibiogramma,
deve
essere
attuato
per
via
endovenosa;
quello
chirurgico
deve
essere
sollecito
se
la
sepsi
non
è
controllata
rapidamente
(10
gg)
dall’antibiotico,
se
compare
scompenso
cardiaco,
se
si
verificano
embolie.
Cardiopatia
ischemica
La
cardiopatia
ischemica
rappresenta
la
singola
causa
di
morte
più
importante
nel
mondo
occidentale.
È
determinata
da
uno
squilibrio
fra
fabbisogno
e
apporto
di
Ossigeno
o
per
aumentato
consumo
miocardico
o
per
riduzione
del
flusso
coronario.
La
causa
più
importante
è
la
malattia
aterosclerotica.
La
lesione
fondamentale
è
la
placca
ateromasica14
a
sviluppo
nei
vasi
arteriosi
intraluminale
ed
intraparietale.
Se
la
placca
cresce
lentamente
si
possono
sviluppare
circoli
collaterali
in
grado
di
mantenere
una
buona
riserva
coronarica.
La
placca
può
andare
incontro
a
complicanze
quali
la
calcificazione,
l’ulcerazione,
l’emorragia
e
la
trombosi.
Quest’ultima
non
comporta
necessariamente
una
ostruzione
permanente
poiché
la
retrazione
del
coagulo
o
la
ricanalizzazione
del
trombo
permettono
il
ristabilirsi,
almeno
in
parte,
della
circolazione
sanguigna.
Nella
maggior
parte
dei
casi
nella
genesi
dell’ischemia
miocardica
accanto
al
fattore
organico
partecipa
quello
funzionale:
lo
spasmo
dei
vasi
coronarici.
L’aterosclerosi
coronarica
può
essere
asintomatica
o
può
determinare
vari
gradi
di
angina
per
giungere
fino
all’infarto,
allo
scompenso,
alle
aritmie,
alla
morte
improvvisa.
Lo
spasmo
coronarico
in
assenza
di
placca
aterosclerotica
è
possibile
ma
molto
raro.
Un
tipo
del
tutto
particolare
di
malattia
coronarica
su
base
non
aterosclerotica
si
14
La placca ateromasica è dotata di un centro lipidico di colesterolo e di una sovrastante cappa fibrosa.
21
manifesta
nel
trapianto
cardiaco
(da
denervazione).
Si
va
diffondendo
la
cardiopatia
ischemica
da
cocaina.
Sintomo
principale
è
il
dolore
anginoso15,
improvviso,
intenso,
di
breve
durata
~10
m,
alla
parete
anteriore
del
torace,
che
si
irradia
alla
spalla
e
all’arto
superiore
sinistro
(faccia
ulnare),
o
alla
mandibola.
Talora
presenti:
pallore,
sudorazione,
senso
di
angoscia.
La
diagnosi
si
basa
sull’anamnesi,
sull’esame
obiettivo,
sulle
curve
enzimatiche,
sull’ECG,
sull’ecocardiogramma16
e
sulle
indagini
radioisotopiche
a
riposo,
da
sforzo
e
dopo
somministrazione
di
farmaci
coronaroattivi.
La
coronarografia
è
utile
per
valutare
sede
e
gravità
delle
alterazioni
coronariche
ed
è
il
presupposto
indispensabile
ad
una
procedura
di
rivascolarizzazione
miocardica.
La
ventricolografia
sinistra
permette
di
valutare
l’efficienza
ventricolare
e
la
presenza
di
altre
complicanze
o
di
altre
patologie.
15
Dolore da ischemia cardiaca
Compare nella cardiopatia ischemica e nella pericardite acuta. La prima si deve quasi sempre a stenosi (restringimento) o occlusione
di un’arteria coronaria o di un suo ramo determinandosi l’ischemia, che è alla base del dolore.
Nella pericardite si verifica un’infiammazione del pericardio; il dolore si deve in questo caso proprio al processo infiammatorio che
stimola le terminazioni nervose dolorifiche del pericardio.
Il dolore cardiaco ischemico è molto più comune di quello pericardico, e può essere localizzato ovunque nel torace, ma più spesso è
retrosternale e s’irradia ad entrambe le braccia e al giugulo. Questo dolore può essere di durata variabile: quando dura da qualche
minuto fino a 20-30 m, la malattia sottostante è l’angina pectoris, mentre durate maggiori corrispondono di solito all’infarto
miocardico. È non di rado difficile precisare l’origine (cardiaca o no) di un dolore toracico solo in base alle sue caratteristiche
(sede, irradiazione, intensità, durata), ma è spesso necessario ricorrere a indagini strumentali (elettrocardiogramma,
ecocardiogramma) o di laboratorio per escludere o affermare l’origine cardiaca del dolore di un determinato paziente. Nella
diagnosi differenziale del dolore cardiaco, vanno considerate le seguenti condizioni:
• Nevriti e nevralgie toraciche (p.e. herpes zoster)
• Affezioni gastriche o esofagee (p.e. ernia jatale)
• Affezioni respiratorie (p.e. pneumotorace, pleurite)
• Affezioni cardiovascolari (p.e. aneurisma dissecante dell’aorta)
• Embolia polmonare.
Dolore da ischemia acuta degli arti
Un’arteria periferica può occludersi per la formazione di un trombo o la migrazione di un embolo che, trasportato dal sangue, finisce
per ostruire il vaso; nella maggior parte di occlusione embolica di un’arteria, l’embolo proviene dal cuore sinistro o dall’aorta.
L’occlusione improvvisa di una grossa arteria degli arti si accompagna ad un quadro clinico spesso drammatico. La mancanza di
flusso sanguigno a tutto l’arto o ad una parte di esso provoca l’ischemia della zona non più irrorata, ciò genera immediatamente
dolore acuto e impotenza funzionale.
In casi del genere, è il malato ad attirare l’attenzione del personale sanitario. Le prime semplici manovre da compiere, nel sospetto di
un’occlusione arteriosa acuta sono:
1. L’ispezione della parte colpita, per osservare se il colore della cute è o no uguale a quello osservabile nell’arto
controlaterale (l’arto ischemico si presenta, nella fase acuta, più pallido del controlaterale).
2. La palpazione della parte colpita, per ricercare se la sua temperatura è o no più bassa di quella rilevabile nelle analoghe
zone dell’arto controlaterale (l’arto ischemico è più freddo del controlaterale). Si può ricercare la presenza dei polsi, cioè la
pulsatilità delle grosse arterie, paragonandola sempre con quella rilevabile nell’arto omologo (l’arresto del flusso di sangue
si accompagna ad assenza dei polsi corrispondenti ad arterie che nascono al di sotto dell’ostruzione). Per l’arto superiore
andrà ricercato il polso radiale, mentre per l’arto inferiore bisogna esplorare i polsi femorale, pedidio e tibiale posteriore.
16
L’ecocardiogramma è l’esplorazione del cuore eseguita con ultrasuoni. Gli ultrasuoni (suoni che l’uomo non può sentire perché
hanno frequenza maggiore alla soglia dell’udibile) vengono prodotti da un apposito apparecchio e diretti all’interno del corpo
attraverso un trasduttore (sonda). A seconda degli organi interni che incontrano nel loro tragitto, gli ultrasuoni vengono riflessi e
ritornano alla sonda con caratteristiche che dipendono dalla struttura e dalla composizione dei tessuti che li riflettono. Si formano
così le immagini degli organi. L’ecocardiografia ha rivoluzionato la diagnostica cardiologia perché, in particolare con gli
apparecchi dell’ultima generazione, è possibile ottenere immagini del cuore particolarmente nitide e attendibili.
L’ecocardiogramma può essere eseguito con tecnica monodimensionale, bidimensionale e recentemente anche tridimensionale.
Inoltre la tecnica Doppler e color Doppler consente uno studio adeguato del flusso intracardiaco, rivelando per esempio
insufficienze valvolari o shunt (passaggi innaturali di sangue) intracardiaci.
22
La
terapia
chirurgica
della
cardiopatia
ischemica
ha
il
compito
di
normalizzare
il
flusso
nelle
zone
di
miocardio
nelle
quali
la
malattia
lo
ha
ridotto
e
correggere
eventuali
complicanze
dell’infarto
al
fine
di
alleviare
la
sintomatologia
soggettiva
e
prolungare
la
vita
del
paziente.
La
normalizzazione
del
flusso
coronarico
viene
ottenuta
impiantando
sulla
porzione
sottostenotica
dell’arteria
ammalata
(by‐pass
aorto‐coronarico17)
un
tratto
di
vena
safena
autologa
di
calibro
idoneo
che
all’estremo
craniale
viene
impiantata
sull’aorta
ascendente,
oppure
l’arteria
mammaria
interna
il
cui
estremo
prossimale
viene
lasciato
alla
sua
origine
nell’arteria
succlavia,
oppure,
in
caso
di
estrema
necessità,
delle
protesi
sintetiche
di
dacron
e
teflon18.
I
risultati
dei
by‐pass
sono
condizionati
da
alcuni
fattori
negativi
quali
possibilità
di
obliterazione
della
protesi
(15
‐
20%)
nel
primo
anno
postoperatorio
e
dalla
naturale
tendenza
alla
progressione
della
malattia
aterosclerotica
di
base
con
ostruzione
a
monte
dell’anastomosi.
Altra
moderna
metodica
di
rivascolarizzazione
è
l’angioplastica
coronaria
percutanea
transluminale19
che
consiste
nell’introdurre
nell’arteria
coronarica
un
catetere
con
palloncino
e,
in
corrispondenza
della
stenosi,
risolvere
la
stessa
gonfiando
il
palloncino.
Nei
pazienti
colpiti
da
infarto
miocardico
possono
evidenziarsi
a
breve
o
a
lungo
termine
complicanze
dell’episodio
necrotico
stesso,
quali
la
perforazione
del
setto
interventricolare,
la
rottura
della
parete
libera
del
ventricolo
sinistro,
l’insufficienza
mitralica
acuta
o
cronica,
l’aneurisma
ventricolare
sinistro,
la
cardiomiopatia
ischemica;
queste
lesioni
determinano
solitamente
gravi
alterazioni
dell’emodinamica
cardiaca.
17
Consiste nella sostituzione del tratto di coronaria compromesso con un innesto di un segmento di vaso che aggira l'ostruzione. Per
l'innesto si possono usare sia segmenti di arterie sia segmenti di vene. Quando si sceglie un segmento di arteria, è possibile
suturare le due estremità una alla aorta e l'altra alla coronaria interessata al di sotto dell'ostruzione, oppure si può lasciare
l'estremità più lontana attaccata all'arteria "donatrice" e limitarsi a suturare l'estremo libero alla coronaria (sempre al di sotto
dell'ostruzione). Si preleva l'innesto dall'arteria mammaria interna del torace, dalla vena safena della gamba, dall'arteria radiale del
braccio o anche da altre arterie più o meno periferiche. Il numero di bypass che si possono effettuare dipende dal numero di
coronarie o di rami delle coronarie ostruiti: uno, tre, cinque, teoricamente non c'è limite. Le complicanze incidono per il 5%, la
mortalità per il 2%.
18
I condotti si dividono in:
19
Peduncolati o in situ: sono le arterie delle quali si conserva l´origine anatomica. In pratica ciò è possibile per le
arterie mammarie e l´arteria gastroepiploica destra
Free graft: sono quelli per i quali si rende necessaria un´anastomosi prossimale a un´altra arteria che fornisca il
sangue arterioso; sono free graft tutti i condotti venosi, artificiali e quelle arterie che devono essere escisse
completamente quali la radiale e l´epigastrica inferiore
L'angioplastica a palloncino diminuisce la resistenza al flusso ematico del lume coronarico stirando e lacerando la placca
aterosclerotica e la parete del vaso, e per un grado minore, ridistribuendo la placca lungo il diametro longitudinale del vaso. Il
meccanismo più importante per il miglioramento del flusso sanguigno sembra essere la rottura e la frammentazione della placca
aterosclerotica che determina la formazione di numerose fissurazioni e di canali subito riempiti dal sangue. la frequenza di
successo è del 90%. Complicanza immediata è l'occlusione improvvisa del vaso (4-8%); complicanza a distanza è la ristenosi (3040%). Lo stent è il metodo di scelta per trattare la minaccia di chiusura improvvisa del vaso. In base al loro disegno, rivestimento e
composizione, gli stent differiscono per forze radiali, flessibilità, profilo, rintracciabilità , radio opacità, biocompatibilità,
trombogenicità e rischio di ristenosi intra-stent. La malattia di una singola coronaria è la principale indicazione alla PTCA
23
La
correzione
di
queste
complicanze
prevede
una
serie
di
procedure
chirurgiche
tendenti
a
rimuovere,
riparare,
sostituire
le
strutture
anatomiche
danneggiate
(resezioni
di
aneurismi,
infartectomia
con
resezione
endomiocardica
mirata;
chiusura
delle
brecce
settali;
sostituzione
o
riparazione
valvolari,
trapianto
cardiaco,
ecc.).
Aneurismi
dell´aorta
toracica
L´aneurisma
aortico
è
una
condizione
anatomica
caratterizzata
da
una
dilatazione
del
vaso
in
cui
le
tre
tuniche
parietali
(intima,
media
ed
avventizia)
sono
normalmente
e
contemporaneamente
presenti.
Viene
invece
definito
pseudoaneurisma
una
dilatazione
sacciforme
dell´aorta,
perlopiù
di
origine
traumatica,
il
cui
lume
è
in
diretto
contatto
con
quello
aortico
ma
la
cui
parete
non
è
composta
interamente
dalle
tre
tuniche
aortiche.
Gli
aneurismi
dell´aorta
toracica
rappresentano
il
35%
degli
aneurismi
aortici.
Distinguiamo,
a
seconda
del
tratto
interessato
dalla
lesione,
aneurismi
dell´aorta
ascendente,
dell´arco
aortico,
dell´aorta
discendente.
Gli
aneurismi
dell´aorta
ascendente
sono
i
più
frequenti,
con
una
percentuale
del
45%;
seguono
quelli
dell´aorta
discendente
(35%),
dell´arco
(10%)
e
del
tratto
toraco‐addominale
(10%).
Tra
i
fattori
eziologici
più
comuni
degli
aneurismi
aortici
ricordiamo
la
patologia
aterosclerotica,
le
patologie
degenerative,
le
aortiti
e
le
lesioni
congenite.
Le
lesioni
aterosclerotiche
danneggiano
la
tunica
intimale
riducendo
l´elasticità
della
media.
L´ipertensione,
compagna
costante
della
patologia
aterosclerotica,
trova
nelle
lesioni
aneurismatiche
un
locus
minoris
resistentiae
determinando
un
progressivo
incremento
del
diametro
aortico.
Tra
le
patologie
degenerative
la
medionecrosi
cistica
gioca
il
ruolo
principale.
Le
lesioni
luetiche
sono
invece
tra
le
cause
più
frequenti
di
aortite.
La
presenza
di
coartazione
aortica,
di
una
persistenza
del
dotto
arterioso
pervio
e
di
stenosi
valvolari
aortiche
favorisce
lo
sviluppo
di
dilatazioni
aneurismatiche.
L´evoluzione
naturale
degli
aneurismi
vascolari
è
la
progressiva
dilatazione
sino
alla
rottura
del
vaso.
La
comparsa
di
dolore
indica
una
rapida
espansione
della
massa
aneurismatica.
La
presenza
di
insufficienza
valvolare
aortica
è
attribuibile
alla
dilatazione
della
giunzione
sinotubulare
con
aumento
della
reciproca
distanza
tra
i
rafi
delle
commissure
aortiche
e
conseguente
mancata
coaptazione
delle
cuspidi
valvolari.
La
radiografia
del
torace
documenta
la
dilatazione
dell´aorta
ascendente
ed
il
tracciato
dell´elettrocardiogramma
può
evidenziare
i
segni
di
un´ipertrofia
ventricolare
sinistra
da
ipertensione
arteriosa.
L´indagine
ecocardiografica
confermerà
la
diagnosi
fornendo
dati
sulla
continenza
valvolare.
La
TC
con
mezzo
di
24
contrasto
e
la
RM
sono
indagini
diagnostiche
raffinate
e
consentono
di
definire
i
rapporti
dell´aneurisma
con
le
strutture
circostanti.
Lo
studio
agiografico
è
indispensabile
per
definire
l´anatomia
dell´albero
coronarico.
L´intervento
chirurgico
è
indicato
in
presenza
di
un
aneurisma
di
diametro
superiore
ai
5
cm.
Gli
aneurismi
dell´arco
aortico
sono
attribuibili
perlopiù
a
fattori
degenerativi
della
parete
aortica
e,
in
percentuale
ridotta,
a
processi
infettivi
ed
aterosclerotici.
La
sintomatologia
è
rappresentata
dal
dolore
toracico
e
dai
segni
di
compressione
delle
strutture
circostanti.
La
compressione
della
trachea
può
determinare
dispnea
fino
a
fenomeni
di
fistolizzazione
nelle
vie
aeree
con
conseguente
emottisi.
La
tensione
esercitata
sul
nervo
laringeo
ricorrente
determina
disfonia.
L´indicazione
chirurgica
viene
posta
quando
il
diametro
dell´aneurisma
oltrepassa
i
5‐6
cm.
Le
procedure
diagnostiche
sono
le
medesime
descritte
per
gli
aneurismi
dell´aorta
ascendente.
Dissezione
aortica
La
dissezione
aortica
è
caratterizzata
dalla
presenza
di
una
fissurazione
delle
tuniche
aortiche
con
formazione
di
un
falso
lume
che
decorre
tra
lo
strato
esterno
e
quello
interno
della
media,
separato
dal
vero
lume
aortico
ed
in
comunicazione
con
questo
attraverso
una
o
più
porte
d´ingresso
e
d´uscita.
La
dissezione
aortica
è
un
evento
acuto,
caratterizzato
dalla
comparsa
di
un
violento
e
trafittivo
dolore
toracico
irradiato
al
dorso
ed
alla
base
del
collo.
Se
la
presenza
della
dissezione
coinvolge
importanti
rami
collaterali
dell´aorta
si
possono
avere
manifestazioni
di
mancata
perfusione
dell´organo
interessato
che
vanno
dalla
sincope
alla
lesione
neurologica
per
dissezione
delle
carotidi,
all´anuria
per
ischemia
renale,
alla
ischemia
degli
arti
inferiori
per
interessamento
delle
arterie
iliaco‐
femorali,
alla
comparsa
di
infarto
miocardico
per
dissezione
delle
coronarie.
Se
la
dissezione
interessa
il
bulbo
aortico
si
assiste
alla
comparsa
di
insufficienza
aortica
per
distacco
delle
commissure
delle
cuspidi
valvolari
dalla
parete
del
vaso.
L´ipertensione
arteriosa
è
un
fattore
eziologico
presente
nel
90%
dei
casi
di
dissezione
aortica.
Possiamo
distinguere
una
dissezione
di
tipo
A,
con
interessamento
dell´aorta
ascendente,
ed
una
di
tipo
B,
nella
quale
l´arco
e
l´aorta
ascendente
sono
risparmiati.
Il
paziente
con
dissezione
aortica
appare
solitamente
iperteso.
È
presente
un´asimmetria
dei
polsi
periferici.
L´elettrocardiogramma
può
indicare
i
segni
di
una
ipertrofia
ventricolare
sinistra
da
sovraccarico
cronico
di
pressione
ed
eventuale
ischemia
miocardica
per
dissezione
delle
coronarie.
Il
radiogramma
del
torace
evidenzia
un
marcato
ingrandimento
dell´aorta
con
possibile
versamento
pleurico
sinistro
se
vi
è
rottura
in
cavità
pleurica.
L´ecocardiogramma
transtoracico
è
diagnostico
nei
casi
di
dissezione
di
tipo
A
e
permette
di
valutare
la
concomitante
presenza
di
rigurgito
valvolare
aortico.
L´osservazione
di
un
versamento
pericardico
25
o
di
un
tamponamento
cardiaco
testimonia
la
presenza
di
una
rottura
dell´aorta.
L´ecocardiogramma
transesofageo
conferma
la
diagnosi
e
permette
di
meglio
studiare
l´arco
aortico.
La
TC
è
anch´essa
esame
diagnostico
affidabile.
La
prognosi
di
una
dissezione
di
tipo
A
è
estremamente
infausta.
La
diagnosi
impone
il
trattamento
chirurgico
d´emergenza.
In
caso
di
dissezione
di
tipo
B
il
primo
provvedimento
terapeutico
da
effettuarsi
è
il
controllo
della
pressione
arteriosa
(β‐bloccanti).
L´intervento
d´emergenza
all´esordio
della
patologia
è
indicato
solo
in
caso
di
rottura
dell´aneurisma
in
cavità
toracica
o
per
ischemia
d´organo.
Tumori
del
cuore
Possono
essere
primitivi
o
secondari.
I
primitivi
possono
essere
benigni
(75%)
o
maligni.
L’incidenza
dei
tumori
maligni
primitivi
varia
dal
5
all’11%
di
tutti
i
tumori
maligni
dell’organismo.
Tra
i
tumori
benigni
il
più
frequente
è
il
mixoma
(50%),
che
si
sviluppa
nell’atrio
sinistro,
è
costituito
da
cellule
mucoidi
con
scarso
connettivo
e
si
presenta
generalmente
come
una
formazione
multilobulata
a
consistenza
gelatinosa;
si
manifesta
tra
i
30
e
i
60
anni
con
tre
possibili
quadri:
• stenosi
mitralica
per
ostacolato
passaggio
del
sangue
al
ventricolo
sinistro;
• embolia
arteriosa
per
sfaldamento
del
tumore;
• sincope20
per
completo
ostacolo
al
flusso
sanguigno.
L’intervento
di
asportazione
va
effettuato
appena
il
tumore
viene
scoperto
per
il
rischio
di
embolia
sistemica.
Il
lipoma
(19%)
si
sviluppa
da
cellule
adipose
localizzate
più
frequentemente
nel
subendocardio
dell’atrio
destro
o
del
ventricolo
sinistro.
Il
fibroelastoma
papillare
(17%)
appare
come
una
massa
gelatinosa
che
origina
dal
tessuto
connettivo
delle
valvole
atrioventricolari,
delle
semilunari
aortiche
o
più
raramente
dall’endocardio
ventricolare.
Tali
neoformazioni
sono
spesso
asintomatiche
e
rappresentano
un
20
La sincope viene definita come una transitoria perdita della coscienza e del tono posturale. Essa dipende da un’improvvisa
alterazione del metabolismo delle cellule cerebrali, le quali necessitano, per il loro funzionamento, di un continuo rifornimento di
ossigeno e di glucosio.
Le cause più comuni della sincope sono:
• Le alterazioni vascolari quali l’occlusione di un’arteria succlavia (Sindrome da furto della succlavia), L’improvvisa
caduta della pressione arteriosa, che comunemente consegue a vasodilatazione arteriolare (sincope da vasodepressione). La
perdita del tono delle arteriole è, in genere, di natura riflessa, cioè consegue a un determinato stimolo che eccita (riflesso) il
nervo vago, responsabile della vasodilatazione.
• L’improvvisa mancanza del battito cardiaco. Se il cuore non si contrae per 6 secondi o più l’individuo perde i sensi
perché viene meno il flusso di sangue al cervello.
• L’alterazione cerebrale che consegue all’occlusione di un’arteria che porta il sangue al cervello.
• Malattie cardiache come la stenosi della valvola aortica o il mixoma atriale,l’ipersensibilità del seno carotideo (risposta
riflessa eccessiva alla compressione dell’arteria carotide nel punto in cui si biforca), e altre condizioni di minore rilievo.
26
riscontro
occasionale.
Altre
neoplasie,
molto
più
rare,
hanno
manifestazione
inferiore
al
4%.
Tutti
i
tumori
maligni
sono
sarcomi
(angiosarcoma,
rabdomiosarcoma,
fibrosarcoma),
rari,
invadono
il
pericardio
con
versamento
emorragico.
La
sintomatologia
è
costituita
da
affaticamento,
dispnea,
edemi,
turgore
giugulare,
epatomegalia,
anemia.
L’intervento
non
è
quasi
mai
eseguibile.
I
tumori
secondari
sono
conseguenti
(21%)
a
localizzazioni
metastatiche
di
neoplasie
primitive
del
polmone,
della
mammella,
di
linfomi
o
leucemia,
oppure
a
infiltrazione
miocardica
da
parte
di
tumori
contigui.
L’ecocardiografia
bidimensionale
rimane
l´indagine
diagnostica
di
scelta,
utile
la
TC
o
la
RM.
Pericarditi
Le
affezioni
del
pericardio
di
interesse
chirurgico
si
dividono
in
infiammatorie
e
tumorali.
La
pericardite
essudativa
non
provoca
alterazioni
emodinamiche
fino
a
che
non
si
verifica
un
rapido
accumulo
o
una
notevole
raccolta
di
liquido
pericardico
e
quindi
il
tamponamento
cardiaco.
L’etiologia
può
essere:
batterica
(batteriemie
streptococciche
o
stafilococciche,
empiema
polmonare);
traumatica
(emopericardio);
iatrogena
(sindrome
postpericardiotomica,
sanguinamento
postoperatorio,
trattamento
radiante
di
tumori
mediastinici);
tumorale
(tumori
primitivi
del
pericardio,
metastasi
di
carcinomi
polmonari
o
sarcomi
mediastinici);
rottura
postinfartuale
di
cuore.
La
sintomatologia
è
costituita
da
un
dolore
atipico
non
specifico;
all’esame
obiettivo
rumori
pericardici
e
attenuazione
dei
toni
cardiaci.
Le
forme
acute
di
versamento
pericardico
si
manifestano
clinicamente
con
i
segni
del
tamponamento
cardiaco
caratterizzato
da
ipotensione,
stasi
venosa
con
turgore
giugulare,
epatostasi,
sino
al
quadro
più
conclamato
di
bassa
portata
cardiaca.
Le
forme
croniche
sono
ad
evoluzione
più
lenta
e,
data
l´elasticità
del
pericardio,
si
deve
accumulare
un
cospicuo
di
versamento
(anche
più
di
un
litro)
prima
che
il
quadro
si
manifesti
clinicamente
con
dolore
aspecifico
ed
i
segni
del
tamponamento.
La
terapia
consiste
nell’aspirazione
del
liquido
pericardico
(pericardiocentesi)
o
nella
rimozione
chirurgica
(sternotomia
e
drenaggio).
La
pericardite
costrittiva
è
una
forma
subacuta
o
cronica
di
tamponamento
cardiaco,
causata
da
retrazione
fibrosa
del
pericardio
secondaria
ad
un
processo
infiammatorio.
Può
avere
etiologia
batterica
(generalmente
tubercolare),
attinica
(evoluzione
fibrosa
di
trattamento
radiante
del
mediastino),
tumorale
(mesotelioma).
La
sintomatologia
consiste
in
dispnea,
febbre,
perdita
di
peso,
tosse,
27
dolore
pericardico
e
pleurico
in
fase
acuta,
tachicardia
compensatoria
e
indebolimento
dei
toni
cardiaci;
in
fase
cronica
dispnea
da
sforzo
e
fibrillazione
atriale.
Può
essere
presente
epatomegalia,
ascite
e
turgore
delle
giugulari.
L’indicazione
chirurgica
è
assoluta
nei
casi
con
impegno
emodinamico
e
consiste
nella
rimozione
più
ampia
possibile
del
pericardio
(pericardiectomia).
Trapianto
del
cuore
Nel
1967
Christian
Barnard
eseguì
in
Sudafrica
il
primo
trapianto
cardiaco.
Ora
questo
intervento
è
diventato
talmente
affidabile
da
essere
in
aumento
progressivo
e
costante
in
tutto
il
mondo.
In
Italia
a
partire
dal
luglio
1985
il
Ministero
della
Sanità
ha
autorizzato
8
centri
a
compiere
i
trapianti
di
cuore.
Le
due
patologie
principali
sono:
la
cardiomiopatia
dilatativa
che
a
livello
mondiale
rappresenta
il
47%
dei
casi;
la
cardiomiopatia
ischemica
non
trattabile
in
modo
conservativo,
49%
dei
casi;
le
altre
patologie
rappresentano
il
rimanente
4%
dei
casi.
La
compatibilità
tra
donatore
e
ricevente
viene
stabilita
innanzitutto
sulla
base
del
gruppo
sanguigno,
con
gli
stessi
criteri
utilizzati
per
le
trasfusioni,
AB0
e
HLA.
L’organo
di
una
persona
di
gruppo
0,
per
esempio,
è
compatibile
con
tutti
gli
altri,
però
vista
la
difficoltà
di
trovare
organi,
può
donare
solo
ad
altre
persone
dello
stesso
gruppo,
che
altrimenti
sarebbero
penalizzate.
Il
secondo
criterio
è
rappresentato
dalle
dimensioni
del
cuore
e
dall’età
di
donatore
e
ricevente.
Il
donatore
deve
essere
di
età
inferiore
a
60
anni,
deceduto
per
causa
naturale
o
accidentale,
sieronegativo
per
HBV,
HCV,
HIV.
Per
l’inserimento
in
lista
d’attesa
sono
necessari
una
serie
di
accertamenti
ed
un’attenta
valutazione
clinica.
Successivamente,
se
ritenuto
idoneo,
il
paziente
dovrà
eseguire
controlli
periodici
che
serviranno
a
verificare
lo
stato
di
salute
durante
l’attesa.
Si
possono
così
riassumere
i
criteri
generali
di
selezione:
•
•
•
•
•
•
malattia
cardiaca
terminale
con
prognosi
di
vita
inferiore
ai
6
mesi
età
inferiore
a
65
anni
funzione
renale
ed
epatica
normale
assenza
di
infezioni
negatività
per
diabete
insulino‐dipendente
stabilità
psicosociale
e
ambiente
familiare
cooperante.
Il
trapianto
di
cuore
è
ancora
in
grande
prevalenza
ortotopico,
ossia
avviene
per
sostituzione
del
cuore
del
ricevente
con
quello
del
donatore.
Alla
tecnica
tradizionale,
nota
anche
come
tecnica
biatriale,
si
è
aggiunta
di
recente
la
tecnica
bicavale
che
prevede
la
resezione
della
vena
cava
superiore
e
inferiore,
conservando
l’integrità
dell’atrio
destro.
28
Il
trapianto
eterotopico,
in
paziente
con
alte
resistenze
polmonari
o
in
caso
di
cuore
di
donatore
di
dimensioni
inferiori
rispetto
al
ricevente,
si
realizza
posizionando
l’organo
nell’emitorace
destro.
Appena
viene
segnalata
l’esistenza
del
potenziale
donatore,
il
primo
paziente
compatibile
in
lista
d’attesa
deve
entrare
in
ospedale
e
prepararsi
per
la
possibile
operazione,
mentre
nell’altro
ospedale
l’equipe
incaricata
valuta
le
caratteristiche
dell’organo.
Una
volta
accertata
l’idoneità
del
cuore,
l’equipe
chirurgica
inizia
l’asportazione,
in
stretto
coordinamento
con
i
medici
dell’ospedale
del
ricevente.
Il
cuore
del
donatore
viene
lavato
con
una
soluzione
fisiologica
salina
fredda
(4
gradi),
prelevato
e
immerso
in
un
contenitore
con
la
stessa
soluzione,
in
grado
di
conservarlo
per
4‐5
ore.
Inizia
a
questo
punto
la
corsa
contro
il
tempo
che
prevede
uno
scambio
di
informazioni
costante
tra
le
due
equipe.
L’intervento
dura
poco
più
di
un’ora,
dopodiché
il
paziente
viene
portato
nell’unità
di
terapia
intensiva
per
le
cure
post‐operatorie.
Dopo
il
trapianto
è
necessario
seguire
una
terapia
con
farmaci
che
impediscano
i
fenomeni
di
rigetto21,
cioè
le
reazioni
immunitarie
con
le
quali
l’organismo
tenta
di
liberarsi
dell’organo
“intruso”.
Altre
frequenti
complicanze
sono
le
infezioni,
la
cui
insorgenza
viene
ridotta
da
protocolli
di
farmaci
antibiotici,
antivirali
e
antimicotici,
e
le
coronaropatie.
Nel
reparto
di
degenza
ordinaria
il
paziente
si
ferma
per
un
periodo
di
circa
tre
o
quattro
settimane
durante
le
quali
si
effettuano
prelievi
del
sangue
per
monitorare
il
nuovo
organo.
Quindi
il
paziente
può
tornare
ad
una
normale
attività
e
all’abituale
stile
di
vita22.
Il
paziente
dovrà
continuare
la
terapia
immunosoppressiva
indefinitamente;
dopo
il
primo
anno
non
si
eseguono
più
biopsie
endomiocardiche
di
routine,
inizia
invece
un
programma
di
coronarografie
periodiche,
ogni
3‐6
mesi
deve
essere
eseguito
un
controllo
clinico
con
dosaggio
ematico
degli
immunosoppressori,
ecocardiografia,
radiografia
standard
del
torace.
21
Il rigetto può essere: assente, lieve (caratterizzato da soli infiltrati linfocitari perivasali), moderato (comparsa di edema interstiziale,
infiltrati pericellulari e focolai di miocitolisi), severo (necrosi miocardia diffusa e marcata attivazione dei linfociti; esso è spesso
accompagnato da malessere, febbre, mialgie, linfocitosi; ipotensione arteriosa, segni di alterata funzionalità cardiaca
all’elettrocardiogramma e all’ecocardiogramma). Negli ultimi due casi si impone il trattamento medico (steroidi ad alte dosi) ed in
quello severo il precoce controllo bioptico endomiocardico per via endoscopica.
22
Terapia perioperatoria: inizia con un’induzione preoperatoria/intraoperatoria generalmente a base di steroidi ad alte dosi, terapia
anticorpale per 1 o 2 settimane, somministrazione ad elevate dosi degli immunosoppressori di mantenimento. Terapia di
mantenimento: prosegue indefinitamente. Quella che si è affermata dagli anni Ottanta, portando la trapiantologia ai risultati
attuali, è la "triplice": ciclosporina + azatioprina + steroidi. A partire da metà degli anni Novanta si sono diffusi farmaci alternativi,
tra cui spiccano per importanza: tacrolimus, sirolimus e micofenolato mofetil, in varie combinazioni tra loro e con i farmaci
classici. Attualmente la terapia di mantenimento più utilizzata è ancora triplice: un inibitore della calcineurina (ciclosporina o
tacrolimus), un antimetabolita (micofenolato mofetil) e steroidi. Possono essere usati anticorpi sia come induzione nei primi 7-14
giorni dopo il trapianto, sia come terapia dei rigetti acuti: sieri antitimociti di coniglio e da anticorpi monoclonali contro i recettori
IL-2 e CD-52. Terapia degli episodi di rigetto acuto: sono possibili molti schemi, tra i più sperimentati si contano gli steroidi ad
alte dosi e gli anticorpi; alcuni farmaci di mantenimento come il tacrolimus si prestano a temporanei aumenti di dosaggio, oppure
si può convertire la terapia di mantenimento in altri farmaci. In casi selezionati si è rivelata utile la plasmaferesi. In passato si è
usato talvolta l´irradiamento.
29
I
VAD
(Venticular
Artificial
Device),
sono
pompe
pulsatili
che
vengono
inserite,
in
“parallelo”,
al
cuore,
in
crisi,
del
paziente;
impiantate
all’interno
del
corpo
e
collegate
ad
una
fonte
(pneumatica
od
elettrica)
energetica
esterna.
Anche
questi
“ventricoli
artificiali”,
il
cui
vantaggio
principale
consiste
nel
poter
rendere
svincolabile
il
paziente
dal
letto
di
degenza,
servono
non
solo
come
“ponte”
al
trapianto,
ma
si
sta
facendo
strada
l’ipotesi
di
utilizzarli
per
consentire,
anche
a
pazienti
non
candidabili
al
trapianto,
di
prolungare
la
loro
sopravvivenza
in
condizioni
di
qualità
di
vita
dignitose,
se
non
addirittura
normali.
Prospettive
chirurgiche
future:
Xenotrapianto:
Sono
in
corso
studi
in
tutto
il
mondo
per
rendere
compatibili
con
l´uomo
cuori
di
animali
mediante
tecniche
di
ingegneria
genetica.
L´animale
più
studiato
è
il
maiale.
Oltre
ai
notevoli
problemi
che
la
cosa
riveste
in
sé,
esistono
forti
e
fondati
timori
sul
passaggio
all´uomo
di
virus
e
altri
patogeni
finora
bloccati
dalle
barriere
di
specie.
Chirurgia
conservativa
dello
scompenso
cardiaco:
Sono
stati
ottenuti
importanti
risultati
con
la
correzione
dell´insufficienza
mitralica
ed
il
rimodellamento
ventricolare,
che
consiste
nella
resezione
di
aree
infartuate
acinetiche
o
discinetiche
ricostruendo
una
corretta
geometria
del
ventricolo
sinistro.
Trapianto
di
cellule:
La
possibilità
di
usare
precursori
autologhi
rende
particolarmente
interessante
questa
prospettiva.
Finora
le
applicazioni
cliniche
sono
numericamente
limitate,
sono
dimostrati
alcuni
benefici
sulla
funzione
ventricolare
globale,
ma
non
ancora
la
formazione
di
nuovo
miocardio
che
si
contragga
in
modo
coordinato
ed
efficace.
Cardiomioplastica:
Il
muscolo
gran
dorsale
viene
avvolto
attorno
al
cuore
e
stimolato
ritmicamente
con
uno
speciale
pacemaker.
Tra
i
numerosi
problemi
che
si
sono
manifestati
vi
è
la
degenerazione
nel
tempo
del
muscolo
dorsale.
30
INDICE
ANATOMIA DELLA PARETE TORACICA ................................................................................ 2
ANATOMIA E FISIOLOGIA CARDIACA ................................................................................... 3
CIRCOLAZIONE EXTRACORPOREA....................................................................................... 8
DECORSO POSTOPERATORIO IN TERAPIA INTENSIVA ........................................................ 10
Arresto circolatorio ..................................................................................................................................................11
Insufficienza renale acuta postoperatoria................................................................................................................11
Valutazione del rischio chirurgico ...........................................................................................................................12
CARDIOPATIE CONGENITE ............................................................................................... 13
Difetto interatriale....................................................................................................................................................14
Difetto interventricolare ...........................................................................................................................................14
Persistenza del dotto arterioso .................................................................................................................................15
Tetralogia di Fallot ..................................................................................................................................................15
Stenosi polmonare ....................................................................................................................................................16
Coartazione aortica..................................................................................................................................................16
Trasposizione dei grossi vasi....................................................................................................................................16
Stenosi aortica ..........................................................................................................................................................17
Anomalia di Ebstein..................................................................................................................................................17
CARDIOPATIE ACQUISITE ................................................................................................. 18
Valvulopatie..............................................................................................................................................................18
Stenosi aortica ..........................................................................................................................................................18
Insufficienza aortica .................................................................................................................................................19
Stenosi mitralica .......................................................................................................................................................19
Insufficienza mitralica ..............................................................................................................................................20
Insufficienza tricuspidale..........................................................................................................................................20
Stenosi tricuspidale...................................................................................................................................................21
CARDIOPATIA ISCHEMICA ................................................................................................ 21
ANEURISMI DELL´AORTA TORACICA ................................................................................. 24
DISSEZIONE AORTICA ...................................................................................................... 25
TUMORI DEL CUORE ........................................................................................................ 26
PERICARDITI ................................................................................................................... 27
TRAPIANTO DEL CUORE ................................................................................................... 28
31