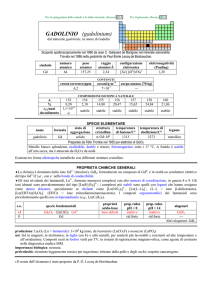
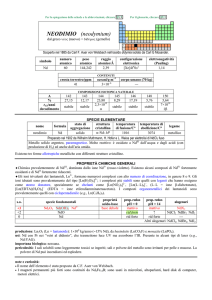
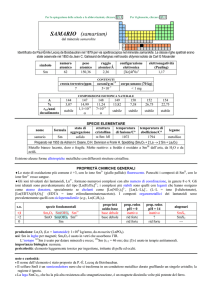
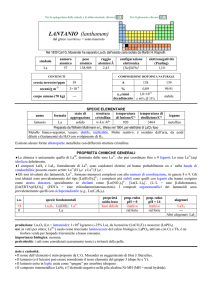
1.2.7 Titolazioni complessometriche
Queste titolazioni si basano sulle reazioni di formazione di ioni complessi aventi elevata
stabilità, utilizzabili ai fini dell’analisi volumetrica.
In esse uno ione metallico M presente in soluzione acquosa come acquocomplesso, reagisce
con dei leganti L (ioni o molecole) sostituendo gradualmente le molecole di acqua di
coordinazione, con molecole di legante:
M +L
ML
ML + L
ML2
ML2 + L
ML3
..........................
Ad ognuno di questi equilibri corrisponde la sostituzione di una molecola di acqua con una
di legante L e quindi una costante di equilibrio K1, K2, K3, ... dove:
[ ML]
= K1
[ M ] ⋅ [ L]
,
[ ML ]
2
[ ML] ⋅ [ L]
= K2
,
......
Le costanti Ki si dicono costanti di formazione o di stabilità del complesso.
La complessazione avviene per stadi successivi e quindi in soluzione coesistono complessi
diversi. Solo se si aggiunge un eccesso di legante L, l’equilibrio si sposta decisamente verso
la formazione di una data specie. Le costanti relative agli equilibri rappresentati dai vari
stadi assumono dei valori non molto diversi tra loro. Ciò implica che riportando su un
grafico i valori di pM (pM= -log [ M ]) in funzione dei volumi di agente complessante
aggiunti, la curva che si ottiene non presenta flessi apprezzabili corrispondenti al
raggiungimento di uno stadio intermedio; essa invece cresce in modo continuo con un
fenomeno analogo a quello già visto per la titolazione di acidi per esempio diprotici, nei casi
in cui Ka1 /Ka2 < 104.
Questo significa che il punto finale di una titolazione non è caratterizzato dalla rapida
diminuzione della concentrazione di [M] nè dalla rapida crescita della concentrazione di
legante libero [ L].
Per questi motivi molte reazioni di complessazione non si possono utilizzare ai fini dei
dosaggi volumetrici. Si è notato però che con la crescita del numero dei “punti
complessanti” posseduti da un legante, aumenta considerevolmente la stabilità del
complesso formato e quindi, durante una titolazione, si ottengono flessi più pronunciati.
In sintesi un complesso formato tra un metallo e un legante con due “punti complessanti” o
legante bidentato (es. lo ione ossalato), risulta molto più stabile di un complesso formato
dallo stesso metallo ma con due molecole di un legante monodentato. Per questo i metodi
quantitativi complessometrici più usati, sono quelli relativi alla formazione di complessi
formati tra ioni metallici e leganti esadentati (per es. EDTA). Questi sono infatti molto
stabili; in questo caso si parla di Chelometria perchè si usano leganti organici polidentati
che bloccano gli ioni metallici come fra le chele dei crostacei.
In questi complessi detti chelati, vi sono coppie di doppietti elettronici non condivisi su
atomi posti a distanza tra loro: coordinandosi con lo ione metallico si formano degli anelli
stabili a 5 o a 6 termini.
1
L’EDTA per esempio è l’acido etilendiamminotetracetico, un acido tetraprotico impiegato
sotto forma di sale bisodico biidrato (schematicamente H2Y2-):
Na+ -OOC-CH2
CH2-COO- Na+
N-CH2-CH2-N
HOOC-CH2
CH2-COOH
Questo legante esadentato, ha la proprietà di formare chelati con cationi aventi numeri di
ossidazione > +1 reagendo sempre nel rapporto 1:1; i cationi complessati entrano a far parte
di cicli a 5 termini che come è noto, sono molto stabili. L’EDTA è un acido tetraprotico con
i seguenti valori di pK:
pK1 = 2.0 ; pK2 = 2.7 ; pK3 = 6.3 ; pK4 = 11.0
Come si vede, solo due protoni sono fortemente acidi mentre gli altri due vengono ceduti a
valori più alti di pH (6.3 e 11.0). Gli equilibri di formazione di un complesso dell’EDTA
con ioni aventi carica diversa, sono:
MeY2- + 2 H+
Me2+ + H2Y2Me3+ + H2Y2MeY2- + 2 H+
Me4+ + H2Y2MeY + 2 H+
Si nota così che qualunque sia la carica dello ione, questi equilibri sono influenzati dal pH.
Partendo dal presupposto che solo la specie completamente dissociata dell’EDTA (Y4-) sia
disponibile ai fini della complessazione, per un metallo del tipo di Ca2+, si dovrebbe avere il
seguente equilibrio di complessazione:
CaY2da cui:
Ca2+ + Y4(1)
[ CaY 2 − ] = K
[ Ca 2 + ] ⋅ [Y 4 − ] formazioneostabilità
K = costante di formazione o di stabilità
del complesso
Ma le condizioni del pH del mezzo fanno sì che nascano degli equilibri collaterali in cui il
protone compete l’agente chelante Y4- con lo ione metallico Men+:
(2)
Men+
+
Y4+
nH+
MeYn-4
E’ necessario pertanto introdurre
un’altra costante detta costante
condizionale o costante di
stabilità effettiva che è legata
naturalmente alla costante di stabilità
n-4
HnY
del complesso ma è anche funzione
del pH.
Quindi nell’equilibrio (1) bisogna sostituire alla concentrazione [Y4-] la somma di tutte le
possibili forme protonate:
[Y4-] = [HY3-] + [H2Y2-] + [H3Y-] + [H4Y]
2
E’ facile dimostrare che:
K condizionale =
K formazione
2
H +] [H +]
[
A = 1+
+
K4
(3)
A
K4 ⋅ K3
+
[H +]3
K 4 ⋅ K 3 ⋅ K2
+
dove:
[H +]4
K4 ⋅ K3 ⋅ K2 ⋅ K1
e dove: K4 , K3 , K2 , K1 sono le quattro costanti di dissociazione dell’EDTA.
Ora, se si fissa un valore di Kcondizionale = 106, valore che ci garantisce una buona riuscita
della titolazione di uno ione metallico la cui concentrazione iniziale sia 0,01M , si può
risalire, applicando l’espressione (3), al valore minimo di pH necessario per la titolazione di
quel particolare metallo. Inoltre, per ogni ione metallico è possibile costruire delle curve in
cui si riportano i valori del
log Kcondizionale in funzione del pH; queste curve presentano
un valore massimo del log Kcondizionale a cui corrisponde il valore ottimale di pH per quel
particolare ione. Esaminando inoltre l’equilibrio (2) si può osservare che l’aggiunta di un
reattivo complessante o precipitante lo ione Men+ sottrae quest’ultimo dall’equilibrio
comportando di conseguenza uno spostamento a sinistra dello stesso.
Questo fenomeno può essere sfruttato per “mascherare” alcuni ioni: si possono così
precipitare o complessare (formazione di complessi altamente stabili) alcuni ioni metallici
permettendo la titolazione selettiva di altri.
Per esempio il Ni, il Cu, il Co, Cd e lo Zn possono essere “mascherati” aggiungendo ioni
CN- che li complessa tutti stabilmente; il Fe, l’Al e il Mn possono essere mascherati con
trietanolammina e il Hg con ioni I-. La selettività può essere inoltre aumentata effettuando
delle precipitazioni o delle ossido-riduzioni preventive di ioni particolari.
1.2.7.1 Tipi di titolazioni complessometriche con EDTA
Si possono avere diverse tecniche di titolazione con EDTA:
• dirette
• di ritorno (o retrotitolazione)
• indirette (per anioni)
Titolazioni dirette: sono quelle normali. Si aggiunge cioè alla soluzione in esame un
tampone, l’indicatore metallocromico e, se necessario, un eventuale complessante ausiliario
come mascherante di altri ioni. Si titola infine con EDTA fino a viraggio.
Titolazioni di ritorno: si aggiunge alla soluzione in esame (neutra o acida) previamente
trattata con precipitanti o complessanti di mascheramento, una quantità nota (in eccesso) di
EDTA. Si alcalinizza la soluzione, si aggiunge l’indicatore metallocromico, quindi si
retrotitola l’eccesso di EDTA con una soluzione a concentrazione nota di un metallo (in
genere Zn2+ o Mg2+ ). Si impiega questa tecnica quando o non si dispone di indicatori utili
per la titolazione diretta o quando la formazione del complesso tra l’analita in esame e
l’EDTA è troppo lenta.
3
Titolazioni indirette (per anioni): si aggiunge alla soluzione in esame un eccesso di una
soluzione a titolo noto di uno ione metallico che formi un composto poco solubile
(precipitato) con l’anione da dosare. Si titola poi l’eccesso dello ione precipitante, con
EDTA. Così per esempio si può dosare lo ione solfato (SO42-) precipitandolo con un eccesso
noto di Ba2+, quindi titolando l’eccesso con EDTA, usando porpora di ftaleina a pH 10-11,5,
come indicatore metallocromico.
1.2.7.2 Indicatori metallocromici
Sono composti organici solubili in acqua, capaci di dare al pH di esercizio, complessi
colorati con un particolare ione presente in soluzione; tale colorazione è molto diversa da
quella dello stesso indicatore libero, allo stesso pH. I requisiti necessari per un indicatore
metallocromico sono:
• sensibilità della colorazione in prossimità del punto di equivalenza
• costante di stabilità (o di formazione) del complesso metallo-indicatore sufficientemente
alta (Kformazione Me-Ind = 104-105) in modo che si abbia una variazione netta di colore.
Tale costante però deve essere decisamente meno alta di quella di formazione del
complesso tra lo stesso metallo e l’EDTA (Kformazione Me - EDTA / Kformazione Me - ind = 104).
Quest’ultimo requisito è necessario a garantire lo spostamento quantitativo del catione
complessato, dall’indicatore all’EDTA. In tal modo si otterrà di nuovo tutto l’indicatore
libero con conseguente variazione netta della colorazione.
• la reazione di formazione del complesso Me-Ind deve essere rapida.
Fra gli indicatori metallocromici più usati si possono segnalare:
• Nero Eriocromo T (NET): è un colorante azoico utilizzabile nell’intervallo di pH 6-12.
Allo stato libero ha una colorazsione blu mentre forma un complesso stabile rosso con
Mg2+ (pK del complesso con Mg2+ = 7,0). Tale complessazione è reversibile per aggiunta
di EDTA. Viene usato normalmente per la determinazione della durezza totale nelle
acque
• Acido Calconcarbonico: è un colorante azoico, indicatore specifico per lo ione Ca2+. E’
attivo a pH molto basici. Allo stato libero ha una colorazione blu. Forma un complesso
selettivo stabile con Ca2+, di colore rosa. Si usa per la determinazione del Ca2+ e quindi
anche per la durezza calcica e magnesiaca nelle acque
• Muresside: a valori di pH > 12 dà un viraggio da rosso a viola nella determinazione del
Ca2+; nell’intervallo di pH tra 7.0 e 11.0, dà un viraggio da arancio a viola nella
determinazione di Co2+, Cu2+, Ni2+
4