Review n. 2 – Italus Hortus 12 (4), 2005: 79 - 92
Trasformazione genetica delle piante da frutto: risultati, applicazioni e
sperimentazione
Bruno Mezzetti1* e Alessandra Gentile2**
1
Dipartimento di Scienze Ambientali e delle Produzioni Vegetali, Università Politecnica delle Marche,
Via Brecce Bianche, 60131 Ancona
2
Dipartimento di OrtoFloroArboricoltura e Tecnologie Agroalimentari, Università di Catania, Via
Valdisavoia 5, 95123 Catania
Ricevuto 29 luglio 2005; accettato 12 agosto 2005
Genetic transformation o f f r u i t
crops: results, applications and
research
Abstract. The recent evolution of molecular biotechnology has promoted the development of new DNA
recombinant technologies with important perspectives
of application on agricultural systems and food industries, but at the same time opening a controversial
discussion on their risks and benefits for the environment and the consumers. These novelties for the agriculture and food industries have induced European
and National institutions to identify specific and
restricted rules. Field trials are a prerequisite for the
assessment of risks and benefits of any new genetically modified plants, and as a consequence, for
market approval. Although the commercial production
of transgenic annual crops is a reality, commercial
genetically-engineered fruit trees are still far from
common. At research level, for several fruit crops
were achieved important results particularly for the
improvement of disease resistance (fungi, bacteria,
virus and insects, plant habitus control, fruit set and
quality). In 10 years of GMOs field trial notification, a
peculiarity of our country was the research activity
carried out on many fruit (cherry, kiwi, strawberry,
raspberry, olive, table grape). The future of genetic
transformation as a tool for the breeding of fruit trees
requires the development of genotype-independent
procedures, based on the transformation of meristematic cells with high regeneration potential and/or the
use of regeneration-promoting genes. Now we have
the important need to implement research trial notifications in the EU countries and to create a National
and European network for the larger and coordinated
activities related to the assessment GM plants risk
and benefits.
Key words: genetically-engineered fruit trees, regeneration and transformation protocols, disease resistance, plant habitus, fruit quality, GMO rules.
Introduzione
Il miglioramento genetico delle piante arboree da
frutto è spesso ostacolato da numerosi aspetti connessi
alle caratteristiche biologiche riscontrabili in molte
specie, tra le quali il lungo ciclo riproduttivo, la prolungata fase giovanile, l’elevata eterozigosi e la complessa biologia fiorale, che rendono particolarmente
lungo e oneroso il perseguimento di obiettivi specifici
attraverso le tecniche convenzionali, quali l’incrocio e
la selezione.
La trasformazione genetica presenta potenzialità
enormi per la realizzazione di specifici programmi di
miglioramento genetico, principalmente perché consente di superare molti dei limiti sopradescritti.
Inoltre, dal momento che le specie arboree da frutto
vengono propagate attraverso metodi di propagazione
agamica, la diffusione di un valido clone transgenico
può avvenire rapidamente dopo la sua costituzione. Le
potenzialità della trasformazione genetica sono anche
legate alla capacità di modificare geneticamente cultivar economicamente valide, spesso frutto di un lungo
lavoro di selezione, ma che risultano non idonee per
specifici caratteri (per esempio, la suscettibilità ad un
patogeno).
Accanto, tuttavia, alle potenzialità offerte, l’applicazione della trasformazione genetica, volta all’ottenimento e all’utilizzazione di organismi “migliorati”
impiegabili in diversi settori produttivi, suscita dubbi
e perplessità, solo raramente supportati da adeguate
conoscenze scientifiche. La diffusione commerciale di
varietà geneticamente modificate (GM) ha finora interessato solo alcune specie erbacee di ampio interesse
agronomico (mais, soia e cotone), mentre per le piante
da frutto l’utilizzo è sporadico. In questi ultimi anni la
superficie mondiale dedicata alla coltivazione di piante GM ha visto un continuo incremento, superando nel
2004 i 70 milioni di ettari (http://www.isaaa.org/kc/).
*[email protected]
**[email protected]
79
Mezzetti e Gentile
Con riferimento alle specie frutticole, la sola pianta da
frutto GM coltivata (ora più del 50% della produzione
mondiale) è la papaia (Carica papaya L.) resistente al
PRSV (Papaya ringspot virus) (Alston, 2004,
www.agibios.com).
Nella consapevolezza che la problematica dell’accettazione delle piante transgeniche deve essere necessariamente legata ad una corretta analisi
beneficio/rischio (Bassi et al., 2005) e che risulta difficile una trattazione onnicomprensiva delle recenti
acquisizioni delle attività di ricerca, obiettivo di questo lavoro è quello di analizzare alcuni risultati sin qui
ottenuti nel settore della trasformazione genetica delle
piante arboree da frutto, sottolineandone anche le problematiche specifiche relative alla loro costituzione.
Verrà inoltre analizzata la situazione relativa alla normativa nazionale secondo l’impostazione definita da
quella comunitaria, per il trasferimento, dal laboratorio al campo, delle ricerche su piante GM.
I risultati della trasformazione genetica nelle specie da frutto
L’applicazione delle tecniche di ingegneria genetica è già stata dimostrata in diverse specie da frutto.
Molti lavori sono stati pubblicati sulla messa a punto
di metodi e sul miglioramento dell’efficienza delle
tecniche di trasformazione, utilizzando solo geni marcatori e riportando solo l’integrazione di geni con un
putativo effetto positivo, ma senza fare una valutazione dell’effetto sulle piante trasformate in ambiente
confinato e in campo. In questa sede si è pensato più
opportuno riportare una descrizione sintetica dei risultati ottenuti da sperimentazioni su piante da frutto che
hanno dimostrato il trasferimento di geni ed anche un
loro effetto di interesse biologico e applicativo. Di
seguito e nella tabella 1 vengono sintetizzati i risultati
ottenuti per i caratteri di attuale maggiore interesse.
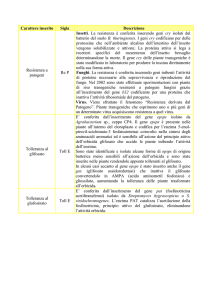
Geni che conferiscono resistenza a stress biotici
L’ottenimento di nuove varietà resistenti alle
malattie, della pianta e del frutto, è il principale obiettivo di molti programmi di ricerca ed è considerata la
strategia più interessante per una frutticoltura sempre
più a basso impatto e con maggiori garanzie di qualità
delle produzioni. A livello sperimentale sono già state
dimostrate applicazioni per patogeni e parassiti che
interessano le maggiori specie frutticole diffuse nelle
nostre coltivazioni.
• Resistenza a funghi. Il risultato più recente e di
maggiore interesse è l’isolamento e il trasferimento in una varietà commerciale di melo
80
(‘Gala’) del gene HcrVf2, per indurre resistenza
alla ticchiolatura, causata da Venturia inaequalis.
Il gene impiegato è omologo ai geni di resistenza
di Clamidosporum fulvum ed è originato dalla
regione del gene Vf derivato dalla specie selvatica di Malus floribunda 821 (Belfanti et al.,
2004). Tale risultato è di grande valenza perché
consentirebbe una più facile accettabilità delle
piante GM da parte dell’opinione pubblica, dal
momento che non sono stati impiegati geni esogeni. Le prime valutazioni in serra hanno dimostrato l’effetto di questo gene nel determinare
una maggiore tolleranza dei cloni GM ad infezioni con V. inaequalis. Sempre per la resistenza
alla ticchiolatura in melo sono in sperimentazione anche linee transgeniche per il gene della
puroindoline B (pinB) da frumento (Faize et al.,
2004) e per i geni delle chitinasi isolati da
Trichoderma spp. (Bolar et al., 2000; Faize et
al., 2003). In quest’ultimo caso l’acquisizione di
una certo livello di resistenza è stata accompagnata da una riduzione dello sviluppo delle piante (Bolar et al., 2000). In arancio dolce è stata
indotta resistenza a Phytophthora citrophthora
utilizzando geni che esprimono proteine antifungine e, precisamente, il gene per la proteina P23
di pomodoro (PR-5) simile all’osmotina. Il livello di resistenza ottenuto è stato assai diverso
nelle linee transgeniche ottenute anche se per
una di esse non sono stati riscontrati sintomi
della malattia anche dopo 6 mesi dall’infezione
(Fagoaga et al., 2001). Recentemente, sono state
costituite linee transgeniche di limone per la resistenza a Phoma tracheiphila, agente del malsecco, utilizzando il gene per la chitinasi isolato da
Trichoderma harzianum. Le linee ottenute hanno
dimostrato un più elevato grado di tolleranza a P.
tracheiphila e a Botrytis cinerea sia in vitro che
in vivo (Gentile et al., 2004) senza manifestare
alterazioni del fenotipo diversamente da quanto
riscontrato in melo trasformato con lo stesso
gene (Bolar et al., 2000). Il gene RCC2 che codifica per chitinasi è stato introdotto nella cv ‘Neo
Muscat’ di vite (Yamamoto et al., 2000) e per lo
stesso obiettivo geni che codificano per altri
enzimi litici sono stati inseriti nella cv
‘Thompson seedless’ (Scorza et al., 1996). Altre
varietà di vite da vino trasformate con geni che
codificano proteine ad attività antimicrobica
sono attualmente in fase di valutazione (Vidal et
al., 2003). L’actinidia è stata trasformata con il
gene della ß-1,3-endoglucanasi cDNA clonato in
Piante da frutto transgeniche
soia (Nakamura et al., 1999) e con un gene della
stilbene sintasi di vite (Kobayashi et al., 2000).
Le piante trasformate con il gene che sintetizza
l’endoglucanasi si sono distinte per una maggiore tolleranza a B. cinerea, mentre le piante trasformate con il gene della vite hanno evidenziato
una produzione di resveratrolo-glucoside di interesse per aumentare la qualità nutrizionale dei
frutti. L’aumento della tolleranza a B. cinerea è
stato ottenuto anche in fragola grazie all’espressione del gene thauI che ha determinato l’accumulo della thaumatin II. Gli stessi cloni thauI si
sono distinti anche per l’aumento del contenuto
in zucchero dei frutti (Schestibratov e Dolgov, in
stampa).
• Resistenza a batteri. Certamente, il batterio più
dannoso e per il quale vengono sviluppati intensi
programmi di miglioramento genetico per la
costituzione di cultivar di melo e pero resistenti è
l’agente causale del colpo di fuoco batterico,
Erwinia amylovora. Meli e peri transgenici in
grado di esprimere il peptide litico dell’attacina
E hanno evidenziato una maggiore tolleranza alla
malattia (Reynoird et al., 1999; Ko et al., 2000).
La sperimentazione in campo per valutare una
possibile resistenza a batteri e funghi è attualmente in atto in Olanda (B/NL/02/03) e
Germania (B/DE/03/140). Sempre per la resistenza a E. amylovora risulta interessante l’approccio che prevede l’utilizzo di un diverso
costrutto con il gene reporter uidA, sotto il controllo di promotori da tabacco che determinano
una più elevata espressione del gene in risposta
all’infezione del batterio (Malnoy et al., 2003).
• Resistenza a virus. In genere, i successi nella trasformazione genetica delle piante per conferire
resistenza ai virus, hanno fatto riferimento
all’applicazione del concetto della resistenza
indotta dal patogeno. Questa strategia si basa sull’introduzione e sull’espressione di sequenze
virali che nella pianta possono interferire con il
ciclo vitale dello stesso virus o di virus strettamente correlati, conferendo resistenza alle infezioni. Per quanto riguarda i virus delle piante da
frutto, le emergenze principali riguardano la resistenza al virus della sharka (plum pox virusPPV) e al virus della tristezza (Citrus Tristeza
Virus- CTV) che rappresentano, rispettivamente,
la virosi più temuta per albicocco, pesco e susino
e quella più pericolosa per gli agrumi. Per la resi-
stenza a sharka, attualmente sono stati isolati
diversi geni di interesse, ma purtroppo per le difficoltà che si hanno nel realizzare procedure
complete di trasformazione e di rigenerazione
delle drupacee, soprattutto del pesco, pochi sono
ancora i dati disponibili che permettono di dimostrare un risultato efficace sull’intera pianta. Il
primo risultato in cui è stato dimostrato un
aumento della resistenza a sharka è stato ottenuto
in piante di albicocco trasformate con il gene
della coat protein (cpPPV) del virus, dove sono
stati usati embrioni immaturi come tessuti per la
rigenerazione delle piante transgeniche (Laimer
da Camara Machado et al., 1992). Solo recentemente sono stati sviluppati per l’albicocco sistemi efficienti di rigenerazione anche da tessuti
somatici, così da permettere anche la trasformazione di varietà commerciali (Petri et al. , 2004).
In susino è in fase avanzata di studio un clone
(C5) nel cui genoma sono integrate diverse copie
del gene cpPPV e che si distingue per una elevata resistenza alla sharka (Ravelonandro et al.,
1997). Questo clone è stato utilizzato anche
come parentale di incroci e nelle progenie è stata
dimostrata una segregazione mendeliana della
resistenza introdotta con la manipolazione genica
(Ravelonandro et al., 2002). Una strategia alternativa per aumentare la resistenza a sharka nelle
drupacee sembra offerta da nuovi strumenti biotecnologici (SiRNAs o Harpin RNAs) che permettono di mediare la degradazione selettiva di
RNA target. Su questo principio è stato preparato
il gene ihprolC-PP197 che ha conferito una resistenza sistemica ad infezioni di PPV in
Nicotiana benthamiana. Questo gene e/o simili
costrutti potrebbero essere in grado di conferire
la resistenza a PPV in piante da frutto
(Pandolfini et al., 2003). Negli agrumi sono stati
ottenuti risultati interessanti per la resistenza al
virus della ‘tristeza’ (CTV) grazie all’utilizzo di
geni derivati dal patogeno (Ghorbel et al., 2000;
Dominguez et al., 2002) anche se il grado di
resistenza ottenuto è stato parziale. Il primo lavoro per la resistenza a virus nella vite riguarda il
trasferimento nella cv. “Thompson seedless” del
gene per la proteina del capside del virus del
mosaico del pomodoro (Scorza et al., 1996).
Diverse varietà di vite sono poi state trasformate
con il gene c p G F L V (grape fanleaf virus)
(Gutoranov et al., 2001), ma ancora non si hanno
risultati certi sul comportamento dei cloni transgenici ottenuti per quanto riguarda la tolleranza
81
Mezzetti e Gentile
acquisita nei confronti di questa malattia, ora
molto diffusa anche in Italia. Embrioni somatici
di V. rupestris sono stati trasformati con il gene
che codifica per la proteina che controlla la
mobilità del virus GVA (grapevine virus A), ma
il fenotipo di queste piante non è ancora stato
valutato (Martinelli et al., 2002). La resistenza al
virus della maculatura anulare della papaia
(PRSV) è stata ottenuta mediante l’introduzione
del gene che codifica per la proteina del capside
del virus (Fitch et al., 1992; Lius et al., 1997), e
due linee GM per questo gene sono già stata
approvate per il consumo umano ed animale e
quindi già ampiamente diffuse a livello commerciale.
• Resistenza a insetti. Tra i geni per la resistenza
insetti, il gene cryIA(c) isolato da Bacillus thu ringensis, è stato inserito in kaki dove ha consen tito di ottenere piante trasformate con una elevata
capacità di controllare l’attacco di due lepidotteri
(Tao et al., 1997). Questa strategia potrebbe essere estesa con successo anche in altre specie.
Recentemente è stato dimostrato che l’integrazione del gene D 5 C 1, un gene artificiale con
un’attività simile all’attacina E, è in grado di
controllare anche l’infezione da Psylla piri, un
insetto dannoso del pero (Puterka et al., 2002).
Geni per il controllo dello sviluppo e della “perfor mance” della pianta
La modificazione del bilancio ormonale delle piante da frutto è stata perseguita utilizzando diverse strategie anche se, certamente, quella che ha fatto registrare i risultati più significativi riguarda l’introduzione di geni del T-DNA di Agrobacterium rhizogenes e,
in particolare, i geni rol A, B, C.
Il gene rolB da A. rhizogenes è stato introdotto nel
portinnesto di melo M26, dove ha determinato una
riduzione degli internodi delle piante ed un miglioramento della radicazione delle talee (Welander et al.,
1998; Zhu et al., 2001); queste piante sono attualmente in sperimentazione in campo in Svezia
(B/SE04/1227). Analogo risultato è stato conseguito
in un portinnesto di pero (Zhu et al., 2003).
In ‘Calypso’, una varietà rifiorente di fragola
(Fragaria x ananassa), è stato inserito il gene rolC da
A. rhizogenes, che, per la sua particolare caratteristica
di aumentare il metabolismo delle citochinine, ha prodotto un maggiore accestimento della pianta, corrispondente ad un aumento della produzione di frutti
82
che, anche se di pezzatura minore, presentano un
aumento del contenuto in zuccheri; gli stessi cloni
transgenici hanno anche manifestato una maggiore
tolleranza a Phytophthora cactorum (Mezzetti et al.,
2004a). Il gene rolC è stato utilizzato anche per ridurre la vigoria in portinnesti di pero (Bell et al., 1999). I
diversi portinnesti di pero con i geni rol sono attualmente in sperimentazione in campo.
L’insieme dei geni rolABC ha indotto un aumento
della capacità di radicazione di piante di kiwi, associata ad un aumento della suscettibilità a
Pseudomonas, probabilmente per l’elevata attività
auxinica (Rugini et al., 1991; Balestra et al., 2001). I
geni di A. rhizogenes sono stati inseriti anche nel portinnesto del ciliegio ‘Colt’ (P. avium x
pseudocerasus) (Guitiérrez-Pesce et al., 1998), inducendo una più elevata capacità di radicazione delle
talee anche in assenza di trattamenti con auxine esogene. Lo stesso risultato è stato ottenuto per altri portinnesti del ciliegio ‘Inmil’ (P.incisa x serrala) e
Damil (P. dawyckensis) (Druart et al., 1998) trasformati con il gene che codifica la phosphinotricina
acetyl transferase e selezionati su un substrato con
l’erbicida ‘Basta’.
Anche in noce, l’introduzione dei geni rol ABC ha
determinato un minore sviluppo delle piante, un maggiore accestimento ed una maggiore capacità di radicazione (Vahadti et al., 2004).
L’inserimento e l’integrazione dei geni rolABC in
portinnesti di agrumi ha determinato la costituzione di
piante con habitus vegetativo compatto (fig. 1), con
una maggiore efficienza fotosintetica, un maggiore
sviluppo dell’apparato radicale e una maggiore capacità antiossidante delle radici (Gentile et al., 2004b).
Inoltre, studi condotti sulla composizione delle popolazioni microbiche dei suoli che ospitavano da un
triennio gli apparati radicali dei cloni transgenici non
hanno fatto registrare modificazioni nella popolazione
dei batteri residenti (La Malfa et al., 2004).
Un’altra strategia utilizzata per modificare lo sviluppo delle piante da frutto è stata l’inserimento dei
geni che codificano per le proteine del fitocromo e, in
particolare, fitocromo A e fitocromo B. Il gene del
fitocromo A (phyA) di riso è stato inserito in ciliegio
Colt (Negri et al., 1998) e i cloni transgenici ottenuti
hanno manifestato una modificazione della estensione
degli internodi, un incremento della ramificazione e
una riduzione della dominanza apicale (Muleo e
Iacona, 1998). Anche in agrumi, l’inserimento del
gene del fitocromo B (phyB) di Arabidopsis thaliana
ha consentito di ottenere piante con una modificazione della crescita (Distefano et al., 2004).
Piante da frutto transgeniche
Pandolfini et al., 2002), è stato introdotto in fragola,
uva da tavola (fig. 2) e lampone (fig. 3), in cui si è
evidenziato un effetto positivo sugli aspetti qualitativi
e produttivi (Mezzetti et al., 2002, 2004b e 2005).
Fig. 1 - Effetto nanizzante dei geni rolABC in piante innestate (a
sinistra) e autoradicate (a destra) di citrange Troyer.
Fig. 1 - Dwarfing effect caused by rolABC gene in grafted trees
(left) and ownrooted (right) citrange Troyer plants.
La lunga fase giovanile che contraddistingue gli
alberi da frutto prolunga drasticamente il tempo
necessario per valutare le caratteristiche dei frutti e
rappresenta, pertanto, uno degli ostacoli maggiori
nella realizzazione dei programmi di miglioramento
genetico. Da Arabidopsis sono stati isolati diversi geni
coinvolti nell’induzione della fioritura e, quando
espressi in piante transgeniche determinano un anticipo della fioritura stessa. I geni LEAFY (LFY) o APE TALA1 (AP1) di Arabidopsis sono stati inseriti ed
espressi in diverse specie anche assai distanti botanicamente, dimostrando la loro efficacia. Semenzali di
agrumi, transgenici per tali geni, hanno evidenziato
una riduzione della giovanilità ed un anticipo della
fioritura (Pena et al., 2001). Le piante transgeniche
hanno prodotto fiori normali e fertili da cui sono derivati frutti con semi. Queste caratteristiche sono risultate trasmissibili alle progenie, consentendo di avere
alberi con un tempo di generazione di un anno da
seme a seme. Le piante con il gene L F Y h a n n o
mostrato un’alterazione nello sviluppo e crescita,
mentre quelle con AP1 nella fase adulta sono risultate
normali.
Geni per il controllo dello sviluppo e qualità frutto
Uno dei principali problemi della biologia fiorale
di alcune specie da frutto è legato alla presenza di fattori di incompatibilità polline-pistillo. Recenti lavori
su melo hanno evidenziato la possibilità di inibire l’espressione di geni del locus S nel pistillo così da superare i problemi di autoincompatibilità (Broothaerts et
al., 2004; B/BE/03/VI).
Il gene DefH9-iaaM che promuove il metabolismo
auxinico nelle cellule placenta-ovulo, noto per essere
in grado di produrre lo sviluppo partenocarpico di
melanzane e pomodori (Rotino et al. , 1997;
Fig. 2 - Grappoli della varietà di vite Silcora dal controllo (sinistra) e dal clone DefH9-iaaM (destra).
Fig. 2 - Bunches of grape variety Silicora from control (left)
plants and from DefH9-iaaM (right) clone.
Fig. 3 - Esempio di fruttificazione di un tralcio del clone DefH9iaaM di Ruby, varietà di lampone rifiorente.
Fig. 3 . Fruiting of the DefH9-iaaM clone of Ruby primo-cane
raspberry variety.
83
Mezzetti e Gentile
Aspetti tecnici della trasformazione genetica
Il trasferimento di geni nelle piante da frutto viene
principalmente effettuato utilizzando una tecnica di
trasformazione mediata da Agrobacterium, anche se,
alcune volte, viene impiegata una tecnica diretta quale
il bombardamento con microproiettili, ad esempio per
la papaya (Fitch et al., 1990).
La modalità di trasferimento del DNA (mediato o
diretto) è certamente molto importante ed è alla base
del successo nell’ottenimento di piante transgeniche.
Oltre ad un efficace metodo di trasformazione, è
necessario disporre di un efficiente protocollo di rigenerazione in vitro a partire dai tessuti utilizzabili per
la trasformazione e di un valido protocollo di selezione in grado di individuare i nuovi rigenerati con eventi di trasformazione stabili e omogenei. Nelle piante
da frutto, in particolare, la frequente presenza di rigenerati chimerici (derivati da un processo di morfogenesi originato da più cellule non tutte geneticamente
modificate) o di ‘escapes’ (rigenerazioni che non
risentono del fattore di selezione), spesso rende il
lavoro di selezione molto lungo e difficile da realizzare.
Per quanto riguarda la tecnica di trasformazione
genica mediata da Agrobacterium, sono già disponibili risultati che dimostrano una diversa virulenza dei
ceppi batterici nei confronti di diverse specie da frutto
(Cervera et al. , 1998a). Tra i vari ceppi di
A g r o b a c t e r i u m solitamente utilizzati per produrre
piante GM, i maggiori successi per le piante da frutto,
anche in specie più difficili quali l’albicocco, il castagno e il mirtillo, sono stati ottenuti utilizzando il
ceppo EHA105 (Petri et al., 2004; Corredoira et al.,
2004; Song e Sink, 2004) e, soprattutto in passato, il
ceppo LBA4401 (James et al., 1990). Nuovi ceppi in
sperimentazione con un aumentato numero di copie
dei geni virG sembrano indurre maggiore virulenza e
quindi migliorare l’efficienza della trasformazione
(Ghorbel et al., 2001).
La virulenza dell’Agrobacterium può inoltre essere
influenzata delle condizioni di incubazione durante
l’infezione e dal periodo di co-coltura con il tessuto
utilizzato per la trasformazione. In particolare, l’espressione dei geni vir può essere alterata dal pH,
dalla temperatura e dalle condizioni osmotiche del
substrato di co-coltura (Alt-Morbe et al., 1989). In
natura, l’Agrobacterium infetta le piante laddove vi è
una ferita da cui sono rilasciati composti fenolici. Per
questo motivo, l’aggiunta nel substrato di co-coltura
di composti fenolici, come l’aceto siringone (3’,5’dimethoxi-4’hydroyaceto-phenone), stimola la trascri84
zione dei geni vir di Agrobacterium (Stachel et al.,
1985) e l’effetto positivo di questo composto è stato
dimostrato per la trasformazione di diverse specie da
frutto (Cervera et al., 1998b; James et al., 1993; Petri
et al., 2004). Sebbene gli eventi di trasformazione
generalmente aumentino all’aumentare del periodo di
co-coltura è opportuno non superare i 3-4 giorni di
contatto del batterio con i tessuti somatici al fine di
evitare problemi nel controllo della contaminazione
d e l l ’A g r o b a c t e r i u m durante la fase di selezione
(Cervera et al., 1998a; Ainsley et al., 2002; Petri et
al., 2004).
Per molte specie arboree da frutto, il genotipo è il
fattore determinante per il successo della trasformazione e il protocollo sviluppato per una cultivar risulta
spesso non appropriato per altre della stessa specie.
Tale concetto è ancora più esasperato se si considera
che, anche nell’ambito dello stesso clone, l’efficienza
del processo di trasformazione si modifica in funzione
del tipo di tessuto impiegato; nelle specie in cui è stata
conseguita la trasformazione genetica, questa ha infatti riguardato pochi genotipi, a volte anche di scarso
interesse commerciale. Le attuali tecnologie sembrano
ancora lontane dall’offrire procedure efficienti di trasformazione indipendenti dal genotipo.
Le caratteristiche del genotipo riguardano sicuramente la specifica suscettibilità al meccanismo di
infezione dell’Agrobacterium, ma ancor più determinante è la disponibilità di efficienti protocolli di rigenerazione da tessuto somatico. I protocolli di trasformazione che hanno portato a risultati di successo si
basano su un’elevata efficienza di rigenerazione, prevalentemente per caulogenesi avventizia, di particolari
tessuti somatici, come ad esempio la lamina fogliare
da germogli in proliferazione in vitro e gli internodi.
L’embriogenesi somatica trova applicazione solo in
protocolli di trasformazione sviluppati per alcune specie, tra cui ad esempio la vite, spesso trasformata a
partire da linee embriogenetiche originate da antere
(Iocco et al., 2001).
Le tecniche di coltivazione in vitro ma soprattutto
il genotipo e il tipo di tessuto sono determinanti per lo
sviluppo di protocolli con le più elevate frequenze di
rigenerazione, indispensabili per la produzione di
nuovi cloni transgenici. Ad esempio, nella fragola è
stato riportato che genotipi con efficienze di rigenerazione da tessuti fogliari superiori al 90% (= % percentuale di foglie con rigenerazione) sono in grado di
garantire risultati di trasformazione ripetibili e con
frequenze anche vicino all’1%. Tale risultato si riduce
per genotipi che si caratterizzano per efficienze di
rigenerazione fino a circa il 60%, mentre si annulla
Piante da frutto transgeniche
completamente per i genotipi con efficienze inferiori
(Landi e Mezzetti, in stampa). Il problema dell’efficienza di rigenerazione e quindi di trasformazione è
ancora un fattore limitante per molte cultivar di diverse specie arboree da frutto, su cui diversi autori hanno
comunque sviluppato esperienze di particolare rilevanza (Dolgov, 1999; Gentile et al., 2003; Petri et al.,
2004; Pratesi et al., 2004). Tra queste, per l’importanza che assumono e per le difficoltà di applicazione del
protocollo che fanno registrare, si devono certamente
annoverare i mandarini e mandarino-simili e il pesco.
Diversi autori hanno tentato la trasformazione di
meristemi apicali da germogli in proliferazione in
vitro (Ye et al., 1994; Druart et al., 1998), una tecnica
considerata utile per risolvere il problema della rigenerazione e per trasformare più direttamente cultivar
di maggiore interesse commerciale. Tuttavia, l’elevata
mortalità e/o le difficoltà di controllo dell’infezione
dell’Agrobacterium hanno limitato l’applicazione di
questa tecnica a tutte le specie da frutto (Scorza et al.,
1995). Recente è, invece, lo sviluppo di una nuova
tecnica di rigenerazione, provata su vite (Mezzetti et
al., 2002) ma utilizzabile anche in altre specie da frutto (Petri e Burgos, 2005), che si basa sull’ottenimento
di tessuti con elevata competenza di rigenerazione
(denominati ‘ammassi meristematici’); è, infatti, proprio l’elevato numero di cellule in divisione e differenziamento che li rende particolarmente idonei per la
trasformazione con Agrobacterium.
Nel complesso, gli esperimenti di trasformazione
genetica delle specie arboree da frutto hanno utilizzato
fondamentalmente tessuti giovanili o, comunque, soggetti a ringiovanimento in seguito alla micropropagazione, richiedendo, pertanto, un numero elevato di
anni per la valutazione delle caratteristiche dei frutti
(Giri et al., 2004). Per gli agrumi, sebbene la maggior
parte dei lavori di trasformazione genetica abbia utilizzato internodi ottenuti da semenzali, la recente tecnica di utilizzo di internodi prelevati da piante già in
fruttificazione e l’adozione del microinnesto delle
gemme transgeniche su portinnesti vigorosi ha consentito di ridurre notevolmente i tempi per l’ottenimento e la valutazione di frutti di agrumi transgenici
(Cervera et al., 1998b).
In definitiva, il successo dell’intero processo di trasformazione genetica dipende, quindi, dalla disponibilità di un metodo di rigenerazione in vitro che consenta di disporre di cellule che siano, da un lato competenti alla trasformazione (cioè in grado di ricevere ed
integrare il transgene), e dall’altro di moltiplicarsi e
rigenerare strutture (embrioni o germogli avventizi) in
grado di evolversi in piante complete.
La selezione dei rigeneranti trasformati è l’ultimo
passaggio critico dei protocolli di trasformazione. Il
gene di interesse agronomico viene solitamente accostato ad un altro gene (marcatore) che serve per identificare, nella fase di rigenerazione, i nuovi individui
che si originano da cellule che hanno subito l’evento
di trasformazione. I geni marcatori più comunemente
utilizzati per le piante da frutto sono il gene per la
neomicina fosfotransferasi (nptII), che conferisce resistenza agli antibiotici aminoglicosidici (kanamicina),
e il gene per la fosfinotricina acetil transferasi, che
conferisce la resistenza all’erbicida fosfinotricina
(Miki e McHugh, 2004).
La preoccupazione che l’utilizzo dei geni marcatori antibiotici potrebbe causare rischi di trasferimento
del carattere di resistenza attraverso gli alimenti, ha
stimolato la realizzazione di diversi studi per sviluppare metodi alternativi di selezione, quali ad esempio,
l’impiego del gene della green fluorescent protein
(GFP), un marcatore vitale che consente di visualizzare nei tessuti sottoposti alla trasformazione e in condizioni di luce ultravioletta, le cellule che hanno subito
l’evento di trasformazione genetica (Zuo et al., 2002).
Recentemente è stata sviluppata una tecnica che permette di eliminare (“gene cleaning”) il gene marcatore
non appena avvenuta la selezione delle piante transgeniche (Sreekala et al., 2005).
Tuttavia, occorre sottolineare che il marcatore antibiotico nptII presenta alcune caratteristiche quali l’elevata efficienza nella fase critica della selezione (fondamentale per le frequenti situazioni chimeriche che
si possono determinare durante il processo di rigenerazione e selezione), la facilità di analisi e l’assenza di
effetti sul fenotipo, che lo rendono attualmente lo
strumento molecolare più valido per il trasferimento
di geni di interesse agronomico nelle piante da frutto
(Zuo et al., 2002)
Quest’affermazione non contrasta con le normative
definite a livello Europeo. Infatti, la direttiva comunitaria 2001/18/CE, che disciplina la sperimentazione e
commercializzazione degli OGM, prevede l’eliminazione dei geni marcatori antibiotici a livello commerciale entro 31 dicembre 2004 ed entro 31 dicembre
2008 per la sperimentazione, ma solo di quelli che
possono avere effetti negativi sulla salute umana e
sull’ambiente. Recentemente l’EFSA (l’organismo
tecnico in materia della commissione Europea) ha poi
fornito una classificazione degli antibiotici in 3 gruppi
di rischio, distinguendoli secondo la loro frequenza di
diffusione nelle popolazioni microbiche e importanza
per l’uso clinico. Nel gruppo 1 sono classificati geni
per la resistenza ad antibiotici che (a) sono già
85
Mezzetti e Gentile
ampiamente diffusi nel suolo e nei batteri enterici e (b)
conferiscono resistenza ad antibiotici che non hanno o
hanno una rilevanza terapeutica minimale nella medicina umana e veterinaria. Il gene nptII e il gene hph che
conferiscono resistenza all’igromicina sono assegnati a
questo gruppo e, pertanto sono considerati marcatori di
selezione che non danno problemi di sicurezza (‘safe
for use as selectable markers’) (http://www.
efsa.eu.int/science/gmo/gmo_opinions/384_en.html), in
quanto la loro presenza nel genoma delle piante geneticamente modificate è giudicata insignificante rispetto
alla loro già ampia diffusione nell’ambiente.
Utilizzando i marcatori selettivi, il lavoro di selezione in vitro si considera terminato solo quando i
putativi nuovi rigenerati GM sono in grado di proliferare e radicare in presenza del fattore di selezione ed
in completa assenza di sintomi. Da questo momento
inizia il lavoro di caratterizzazione molecolare fondamentale per la conferma e l’identificazione degli
eventi di trasformazione. Di solito un’analisi preliminare con la PCR permette di dare una prima conferma
molecolare dell’evento di trasformazione, identificando la presenza o meno del gene di interesse agronomico associato al marcatore. In seguito è fondamentale
completare la caratterizzazione con l’analisi Southern
blot (ibridazione con sonde dell’intero gene) che permette anche di individuare il numero di copie inserite
nel genoma della pianta per entrambi i geni.
Quest’ultima analisi è richiesta, secondo le normative
vigenti, anche per le fasi successive di valutazione
delle notifiche di sperimentazione ed eventuale commercializzazione. Ulteriori analisi vengono poi effettuate per verificare il livello di espressione del gene
(ora prevalentemente per RT-PCR) considerato utile
per meglio caratterizzare gli effetti sul fenotipo. La
ricerca sulla pianta identificata come GM deve estendersi a sperimentazioni in serra, ma possibilmente
anche in campo, utili per una corretta valutazione dei
possibili benefici agronomici e produttivi, come anche
su eventuali rischi per l’uomo e per l’ambiente.
La normativa sulla sperimentazione delle piante
geneticamente modificate
L’attuale situazione regolamentare in materia
d’immissione nell’ambiente (sperimentazione e commercializzazione) di organismi geneticamente modificati si identifica con un complicato quadro giuridico.
Nel 2001, la Commissione Europea, nell’intento di
offrire un approccio affidabile e sicuro sugli OGM, ha
approvato un importante pacchetto legislativo che
traccia un sistema di controlli e regole per la sperimentazione, il commercio e l’etichettatura di tali pro86
dotti allo scopo di regolarne la loro immissione in
ambiente confinato ad uso sperimentale ma anche sul
mercato, attraverso una specifica procedura di autorizzazione (direttiva 2001/18/CE). Nel nostro Paese la
normativa nazionale di riferimento è stata aggiornata
con la pubblicazione nella G.U.R.I. del Decreto
Legislativo nr. 224, 8 luglio 2003, che ha recepito la
dir. 2001/18/CE. Il D.Leg. 224 è stato poi completato
dal recente D.Leg. nr. 5 (28/01/05), predisposto dal
ministero dell’Agricoltura, che tende a garantire una
possibile coesistenza tra coltivazioni GM e i sistemi di
coltivazione tradizionali, rispetto alla quale le singole
Regioni sono tenute, entro giugno 2006, ad aderire
con la presentazione di un loro piano di coesistenza
che deve prevedere, in primo luogo, l’identificazione
di siti pubblici ufficiali dove poter attivare la sperimentazione.
Il provvedimento normativo comunitario ed il corrispondente recepimento nazionale si articola in quattro parti: la parte A contiene le disposizioni principali,
quella B regola l’immissione nell’ambiente - a scopi
sperimentali - di organismi geneticamente modificati,
la successiva parte C disciplina la relativa immissione
in commercio, conseguente ad una decisione comunitaria; infine nella parte D sono contemplate le disposizioni finali, poi integrate con la richiesta per ogni notifica di specifici piani di sicurezza e di monitoraggio.
La normativa nazionale non ha il solo scopo di
proteggere la salute umana e l’ambiente dai potenziali
rischi in caso di emissione sperimentale o immissione
sul mercato di organismi transgenici, ma, quale elemento di novità non direttamente contemplato nella
Direttiva 2001/18/CE, di tutelare l’agrobiodiversità, i
prodotti tipici, biologici e di qualità. Inoltre, rispetto
alla normativa nazionale di attuazione della precedente Direttiva, l’Autorità competente a cui è affidata la
gestione del settore transgenico passa dal Ministero
della Salute (a cui resta la competenza sui microrganismi transgenici) a quello dell’Ambiente e della Tutela
del Territorio, che coordina la Commissione
Interministeriale di Valutazione (CIV) e che si identifica come l’organo tecnico che deve elaborare i pareri
sulle notifiche (tipo B – sperimentazione e tipo C
commercializzazione).
Le notifiche per la sperimentazione di piante GM
devono essere finalizzate ad una completa valutazione
agronomica delle caratteristiche delle piante geneticamente modificate, non solo per i possibili rischi, ma
soprattutto per i possibili benefici che possono derivare dalla coltivazione dei nuovi genotipi modificati per
singoli geni e che possono determinare importanti
miglioramenti quantitativi e qualitativi della produzione.
Piante da frutto transgeniche
Accettabilità e interesse delle piante da frutto GM
per la nostra agricoltura
L’applicazione delle tecnologie di modificazione
genetica delle piante da frutto ha sollevato diverse
preoccupazioni nell’opinione pubblica, tra le quali il
rischio di diffusione di geni di resistenza ad antibiotici
ed erbicidi ad altre specie non target, il rischio della
diffusione a lunga distanza del polline per molti anni,
il rischio di effetti negativi sulla biodiversità; in
aggiunta a ciò, si avverte un generico timore per effetti non attesi. In generale, le problematiche che si
dibattono comunemente sugli OGM riguardano la
sicurezza per la salute dell’uomo, per l’ambiente e
soprattutto per i sistemi agricoli locali. La possibilità
di diffondere geni con il polline delle piante da frutto
è una realtà che può interessare in modo diverso le
varie specie o il tipo di pianta (chiaramente non è un
problema per i portinnesti). Attualmente non ci sono
possibilità concrete di controllare la dispersione di
polline, se non la coltivazione in ambiente protetto. In
definitiva, il rischio ambientale connesso alla diffusione di polline di piante GM dipende dalla diffusione
negli ambienti circostanti di specie autoctone compatibili, cosa non molto frequente per molte specie frutticole; tale rischio deve essere posto al pari di quello
che può derivare dall’introduzione di nuove specie
esotiche (Gartland et al., 2003). Il ciclo poliannuale e
la propagazione clonale, non per seme, già di fatto
riduce comunque rispetto alle piante annuali il rischio
di diffusione in ambiente di piante da frutto GM.
La percezione di rischio che nel nostro paese viene
al momento maggiormente diffusa sulle piante GM
riguarda il danno che esse possono recare all’immagine delle nostre produzioni agricole di qualità e molto
spesso riconosciute con marchi anche importanti.
L’agricoltura del nostro Paese è da molti considerata
incompatibile con la tipologia di agricoltura intensivaestensiva ora associata alla agricoltura OGM.
Attualmente le coltivazioni GM vengono esclusivamente associate al lavoro di multinazionali straniere;
sarebbe invece importante favorire anche nel nostro
Paese lo studio delle biotecnologie vegetali con programmi finalizzati a risolvere problemi specifici della
nostra agricoltura, e quindi per la salvaguardia o l’aumento della competitività dei nostri prodotti (Basso et
al., 2003; Sansavini, 2003). Le piante da frutto in
Italia presentano, ad esempio, delle problematiche
prioritarie (si pensi alla suscettibilità a malattie) difficili da superare con le sole tecniche tradizionali di
incrocio e selezione. Infine, anche per le piante da
frutto, il maggiore problema di accettabilità si identifica con il potenziale conflitto con le coltivazioni biolo-
giche. In questo caso non si tratta di rischi biologici
per l’uomo o per l’ambiente, ma solo di rischi di tipo
commerciale che i prodotti biologici possono avere se
‘contaminati’ dalle vicine coltivazioni GM. In quest’ambito gli studi sulla coesistenza tra questi due
sistemi di produzione sono comunque di fondamentale importanza ed anche per questo le sperimentazioni
di campo sarebbero necessarie per identificare i limiti
di accettabilità e diffusione di questi due sistemi di
coltivazione. Da sperimentazioni effettuate in diversi
paesi europei sono già disponibili dati che hanno
dimostrato la possibilità della coesistenza tra questi
sistemi di coltivazione (http://www.agrsci.dk/gmcc03/gmcc_proceedings.pdf).
Segnaliamo, infine, come di recente, sono state
attivate nuove linee di ricerca che potrebbero, in un
prossimo futuro, sciogliere alcune riserve nei confronti delle piante GM da parte dell’opinione pubblica.
Tra queste si ricordano:
• utilizzo di geni che sono originati da piante, a
volte anche della stessa specie (omologhi), o da
microrganismi (batteri) che hanno da sempre
avuto un’interazione con queste piante (in molti
casi comprendendo anche un naturale scambio di
DNA, come è appunto noto per
l’Agrobacterium);
• rimozione del gene marcatore selezionabile nptII
a posteriori, cioè dopo l’avvenuta rigenerazione
completa della pianta transgenica (g e n e
cleaning);
• utilizzo di promotori tessuto-specifici che possono rendere esprimibile un determinato costrutto
solo in un tessuto;
• integrazione del transgene nel DNA cloroplastico in maniera da prevenire la sua diffusione nell’ambiente attraverso il polline.
Conclusioni
Dal 1998 in Italia come in Europa a causa delle
varie discussioni e decisioni politiche il numero delle
notifiche di sperimentazioni in campo ha subito una
continua riduzione (Masciarelli et al., 2004) fino a
limitarsi attualmente a soli due campi autorizzati,
presso l’Università della Tuscia e presso l’Università
Politecnica delle Marche e all’accettazione della
richiesta di notifica da parte dell’Università di
Catania. In generale, tale situazione è molto significativa del livello di carenza che si è creata nel nostro
Paese sulle conoscenze necessarie per una valutazione
coerente, su base scientifica, dei possibili rischi, benefici o meglio reale utilità delle piante GM per la
87
Mezzetti e Gentile
Tab. 1 - Esempi di applicazione della trasformazione genica in piante da frutto.
Tab. 1 - Applications of gene transfer techniques in fruit plants.
Geni che conferiscono resistenza a stress biotici
Specie
Transgene
Papaya (Caricapapaya)
Lima Messicana (Citrus aurantifolia)
Kiwi (Actinidia deliciosa)
Arancio amaro (Citrus aurantium)
Pompelmo (Citrus paradisi)
Arancio dolce (Citrus sinensis)
Limone (Citrus limon)
Kaki (Dyospiros kaki)
Noce comune (Juglans regia)
Melo (Malus x domestica)
Effetto
Riferimento
Cp-PRSV
Resistenza a PRSV
Cp-CTV
Resistenza a CTV
b-1,3-endoglucanase cDNA Tolleranza a Botrytis cinerea
Cp-CTV
Resistenza a CTV
Cp-CTV, GNA
Resistenza a CTV/Resistenza a insetti
PR-5
Resistenza a Phytophthora citrophthora
Endochitinasi
Incremento attivita antifungina
cryIA(c)
Resistenza a insetti lepidotteri
cryIA(c)
Resistenza a Cydia pomonella
Lius et al., 1997
Dominguez et al., 2002
Rugini et al., 1991
Ghorbel et al., 2000
Yang et al., 2000
Fagoaga et al., 2001
Gentile et al., 1997
Tao et al., 1997
Dandekar et al., 1998
Endochitinase
ech42 and nag70
pinB
HcrVf2
Rs-AFP2 and AMP1
attE
Resistenza alla ticchiolatura
“
“
“
Attività anticrobica e antifungina
Resistenza al colpo di fuoco batterico (fire blight)
Resistenza alla Sharka
Bolar et al., 2000
Faize et al., 2003
Faize et al., 2004
Belfanti et al., 2004
De Bondt et al., 1999
Ko et al., 2000
Resistenza alla Sharka
Resistenza al colpo di fuoco batterico (fire blight)
Resistenza al colpo di fuoco batterico (fire blight)
Resistenza a patogeni fungini
Scorza et al., 1994
Puterka et al., 2002
Albicocco (Prunus armeniaca)
Cp-PPV
Susino europeo (Prunus domestica)
Pyrus communis (Pero)
Cp-PPV
D5C1
Pero (Pyrus communis)
attE
Vite (Vitis vinifera)
RCC 2
Laimer da Camara Machado et
al., 1992
Reynord et al., 1999
Yamamoto et al., 2000
Geni per il controllo dello sviluppo e della “performance” della pianta
Kiwi (Actinidia deliciosa)
Citrange Troyer (Citrus sinensis x
Poncirus trifoliata)
Citrange Troyer (Citrus sinensis x
Poncirus trifoliata)
Vite (Vitis vinifera)
Melo (Malus x domestica)
Portinnesto di melo
rol A, B, C
Rol ABC
Phytochrome B
DefH9-iaaM
S-gene silencing construct
rol A
Portinnesto di melo
Rol B
Portinnesto di pero
Rol B
Miglioramento radicazione
Rugini et al., 1991
Riduzione taglia, aumento radicazione Gentile et al., 2004 a e b; La
Malfa et al., 2004
Modificazione crescita della pianta Distefano et al., 2004
Sviluppo frutto e fertilità pianta
Autofertilità
Riduzione altezza pianta e lunghezza
degli internodi
Maggiore efficienza di radicazione,
maggiore numero di radici, riduzione
numero dei nodi
Maggiore efficienza di radicazione
Mezzetti et al., 2002 & 2004
Broothaerts et al., 2004
Zhu et al., 2001
Welander et al., 1998; Zhu et
al., 2001
Zhu et al., 2003
Geni per il controllo dello sviluppo e qualità frutto
Pompelmo (Citrus paradisi)
Livelli maggiori di b-carotene
Costa et al., 2002
Citrange Carrizo (Citrus sinensis x
Poncirus trifoliata)
Ciliegio (Prunus avium)
Prunus incisa x serrula
Geni coinvolti nella sintesi
di carotene
Leafy and Apetala1
Fase giovanile più breve
Pena et al., 2001
Ri-T-DNA
T-DNA (ipt) bar
Gutiérrez-Pesce at al., 1998
Druart et al., 1998
Pero (Pyrus communis)
Pero (Pyrus communis)
rol B
rol C
Pesco (Prunus persica)
T-DNA (ipt)
Miglioramento radicazione
Miglioramento radicazione Resistenza a ‘Basta’
Miglioramento radicazione
Riduzione lunghezza internodi e
altezza pianta
Maggior vigore, minor radicazione
88
Zhu et al., 2003
Bell et al., 1999
Smigocki e Hammerschlag
Piante da frutto transgeniche
nostra agricoltura. A tale situazione è corrisposto un
indebolimento nel sistema di valutazione e soprattutto
di acquisizione e trasferimento delle competenze
necessarie per l’applicazione corretta, competitiva e
mirata alle esigenze della nostra agricoltura delle tecniche innovative di biologia molecolare e di ingegneria genetica.
In questo scenario preoccupante, si può rilevare di
positivo che, soprattutto a livello nazionale, i gruppi
di lavoro sulla trasformazione hanno concentrato la
loro attenzione su diverse specie di interesse per le
produzioni orto-floro-frutticole (Masciarelli et al.,
2004). I risultati rilevabili per le piante da frutto, in
particolare, possono essere presi ad esempio su come
queste tecniche molecolari rappresentino validi strumenti integrativi al ‘breeding’ tradizionale e su come
deve essere affrontata una ricerca che comprende la
produzione e sperimentazione su piante GM.
L’accettabilità futura di piante e prodotti GM
dipende solamente dalla continuità della ricerca che
deve operare per migliorare le tecniche di trasformazione genetica, per individuare e sperimentare geni di
interesse connessi alla risoluzione di problematiche
specifiche dei nostri sistemi produttivi con la completa assenza di rischi per l’uomo e per l’ambiente. Tale
aspetto è particolarmente importante per le specie
arboree da frutto se si considerano la notevole complessità fisiologica della piante e il lungo ciclo delle
coltivazioni, fattori che rendono più complessi i problemi connessi alla stabilità dell’espressione del transgene.
I ricercatori hanno quindi la responsabilità di continuare le loro ricerche, anche con i pochi mezzi
disponibili, perché solo con risultati scientifici e
dimostrazioni applicative sarà possibile sviluppare un
dibattito più coerente e concreto con l’opinione pubblica.
Riassunto
Sebbene la produzione commerciale di piante transgeniche di specie annuali sia una realtà, per le specie
da frutto la produzione commerciale è invece ancora
una prospettiva abbastanza lontana. La ricerca ha già
però prodotto diversi risultati di interesse per le principali specie da frutto, in particolare per la resistenza a
malattie (funghi, batteri, virus e insetti), la modificazione dell’habitus della piante e il miglioramento
della qualità dei frutti. In 10 anni di sperimentazione
in campo con OGM, il nostro paese si è distinto particolarmente per le ricerche sviluppate soprattutto per le
specie da frutto (ciliegio, kiwi, fragola, lampone,
olivo e uva da tavola). Il futuro della trasformazione
genica per il miglioramento delle specie da frutto
richiede lo sviluppo di protocolli di trasformazione
genotipo indipendente, basati sulla trasformazione di
cellule meristematiche con elevata efficienza rigenerativa. Attualmente vi è l’esigenza di incrementare le
notifiche di sperimentazione in campo nel nostro
paese e in Europa e di creare una rete Nazionale ed
Europea sulla valutazione rischi e benefici delle piante
da frutto GM.
Parole chiave: piante da frutto GM, protocolli di rigenerazione e trasformazione, resistenza a malattie,
habitus della piante, qualità frutto, normative OGM.
Bibliografia
AINSLEY P.J., C OLLINS G.G., S EDGLEY M., 2002. Factors affecting
Agrobacterium-mediated gene transfer and the selection of
transgenic calli in paper shell almond (Prunus dulcis Mill.). J.
Hortic. Sci. Biotech., 76: 522–528.
ALT-MORBE J., K UHLMANN H., S CHRODER J., 1989. Differences in
induction of Ti-plamid virulence genes virG and virD and
continued control of virD expression by four external factors.
Mol. Plant-Microbe Interact., 2: 301–308.
ALSTON J.M., 2004. Horticultural biotechnology faces significant
economic and market barriers . California Agriculture,
58(2):80-88.
BALESTRA G.M., RUGINI E., VARVARO L., 2001. Increased suscep tibility to Pseudomonas syringae p v . syringae a n d
Pseudomonas viridi.ava of kiwi plants having transgenic
rolABC genes and its inheritance in the T1 o.spring . J.
Phytopathol., 149: 189–194.
BASSI D., E DERLE D., V ENTURA V., 2005. Gli OGM in agricoltu ra: tra paure e nuovi orizzonti. Lettura tenuta il 16 dicembre
2004. Annali dell’ Accademia Nazionale di Agricoltura,
Bologna: 663-683.
BASSO B., CASATI D., F RISIO D., G IORNI B., R OSSI L., S ALA F.,
2003. Biotecnologie per la tutela dei prodotti tipici italiani.
21° secolo edizioni.
BELFANTI E., S ILFVERBERG-DILWORTH E., T ARTARINI S., P ATOCCHI
A., B ARBIERI M., Z HU J., VINATZER B.A., G IANFRANCESCHI L.,
GESSLER C. AND SANSAVINI S., 2004. The HcrVf2 gene from a
wild apple confers scab resistance to a transgenic cultivated
variety. P. Natl. Acad. Sci. USA 101: 886–890.
B E L L R.L., S C O R Z A R., S R I N I V A S A N C., W E B B K ., 1999.
Transformation of ‘Beurre Bosc’ pear with the rolC gene. J.
Am. Soc. Hortic. Sci. 124: 570–574.
BOLAR J.P., N ORELLI J.L., W ONG K.W., H AYES C.K., H ARMAN
G.E. AND ALDWINCKLE H.S., 2000. Expression of endochitina se from Trichoderma harzianum in transgenic apple increases
resistance to apple scab and reduces vigor. Phytopathology,
90: 72–77.
B R O O T H A E R T S W., K E U L E M A N S J. A N D VA N NE R U M I ., 2004.
Selffertile apple resulting from S-RNase gene silencing. Plant
Cell Rep., 22: 497–501.
C E R V E R A M., L Ò P E Z M.M., N A V A R R O L., P E N A L ., 1998a.
Virulence and supervirulence of Agrobacterium tumefaciens
in woody fruit plants. Physiol. Molec. Plant Pathol. 52: 67–78.
CERVERA M., JUAREZ J.A., NAVARRO A., P INA J.A., D URA-VILA
N., N AVARRO L., P ENA L., 1998b. Genetic transformation and
regeneration of mature tissues of woody fruit plants bypassing
the juvenile stage. Transgenic Res. 7: 51–59.
89
Mezzetti e Gentile
COSTA M.G.C, O TONI W.C., M OORE G.A., 2002. An evaluation of
factors affecting the efficiency of Agrobacterium-mediated
transformation of Citrus paradisi (Macf.) and production of
transgenic plants containing carotenoid biosynthetic genes.
Plant Cell Rep., 21: 365–373.
CORREDOIRA E., M ONTENEGRO D., S AN-JOSE M.C., V IEITEZ A.M.,
BALLESTER A., 2004. Agrobacterium-mediated transformation
of European chestnut embryogenic cultures. Plant-CellReports.; 23(5): 311-318.
DANDEKAR A.M., M CGRANAHAN G.H., VAIL P.V., URATSU S.L.,
LESLIE C., TEBBETS J.S., 1998. High levels of expression of full
length cryIA(c) gene from Bacillus thuringiensis in transgenic
somatic walnut embryos. Plant Sci., 131: 181–193.
D E B O N D T A., E G G E R M O N T K., P E N N I N C K X I., G O D E R I S I . ,
BROEKAERT W.F., 1996. Agrobacterium-mediated transforma tion of apple (Malus x domestica Borkh): an assessment of
factors affecting regeneration of transgenic plants. Plant Cell
Rep., 15: 549–554.
D E B O N D T A., Z A M A N S., B R O E K A E R T W.F., C A M M U E B . ,
KEULEMANS J., 1999. Genetic transformation of apple (Malus
pumila Mill.) for increased fungal resistance: in vitro antifun gal activity in protein extracts of transgenic apple expressing
RS-AFP2 or ACE-AMP1. Acta Hort., 484: 565–570.
DISTEFANO G., L ATINI P., L A MALFA S., C ONTINELLA A., G ENTILE
A., M U L E O R., T R I B U L A T O E ., 2004. Phytochrome B gene
expressed in transgenic Troyer citrange changes some aspects
of plant growth. Proceedings of 10th ISC Congress. Agadir
(Morocco), 15-20 February 2004. In press.
D O L G O V S . V . (1999) Genetic transformation of sour cherry
(Cerasus vulgaris Mill.). In: Bajaj YPS (ed), Transgenic Trees.
(pp. 29–38) Springer-Verlag, Berlin.
DOMÌNGUEZ A., H ERMOSO DE MENDOZA A., G UERRI J., C AMBRA
M., N AVARRO L., M ORENO P., P ENA L., 2002. Pathogen-deri ved resistance to Citrus tristeza virus (CTV) in transgenic
mexican lime (Citrus aurantifolia (Christ.) Swing.) p l a n t s
expressing its p25 coat protein gene. Mol. Breeding 10: 1–10.
D R U A R T P., D E L P O R T E F., B R A Z D A M., U G A R T E - B A L L O N C . ,
DACAMARA MACHADO A., L AIMER DA CAMARA MACHADO M.,
JACQUEMIN J., W ATILLON B., 1998. Genetic transformation of
cherry trees. Acta Hort 468: 71–76.
FAGOAGA C., R ODRIGO I., CONEJERO V., H INAREJOS C., T USET J.J.,
ARNAU J., PINA J.A., NAVARRO L., PENA L., 2001. Increased
tolerance to Phytophthora citrophthora in transgenic orange
plants constitutively expressing a tomato pathogenesis related
protein PR-5. Mol Breeding 7: 175–185.
F A I Z E M., M A L N O Y M., D U P U I S F., C H E V A L I E R M., P A R I S I L . ,
CHEVREAU E., 2003. Chitinases of Trichoderma atroviride
induce scab resistance and some metabolic changes in two
cultivars of apple. Phytopathology 93: 1496–1504.
F A I Z E M., S O U R I C E S., D U P U I S F., P A R I S I L., G A U T I E R M . F . ,
CHEVREAU E., 2004. Expression of wheat puroindoline-b redu ces scab susceptibility in transgenic apple (Malus domestica
Borkh.). Plant Sci 167: 347–354.
FITCH M.M.M., MANSHARDT R.M., G ONSALVES C., S LIGHTOM J.L.,
SANFORD J.C., 1990. Stable transformation of papaya via
microprojectile bombardment. Plant Cell Rep. 9: 189–194.
FITCH M.M.M., M ANSHARDT R.M., GONSALVES D., SLIGHTOM J.L.,
SANFORD J.C., 1992. Virus resistant papaya plants derived
from tissues bombarded with the coat protein gene of papaya
ringspot virus. Bio-Technol 10: 1466–1472.
GARTLAND K.M.A., CROW R.M., FENNING T.M., G ARTLAND J.S.,
2003. Genetically modified trees: production, properties, and
potential. Journal of Arboriculture 29, 5: 259-266.
GENTILE A., M ONTICELLI S., D AMIANO C., 2003. Adventitious
shoot regeneration for Agrobacterium-mediated transforma tion in Prunus. Acta-Hortic., 616: 331-334
GENTILE A., DENG Z., LA MALFA S., D ISTEFANO G., D OMINA F.,
POLIZZI G., T RIBULATO E., 2004a. Transgenic endochitinase
90
lemon plants show increased tolerance to fungi. Proceedings
of 10th ISC Congress. Agadir (Morocco), 15-20 February
2004. In press.
GENTILE A., D ENG Z.N., L A MALFA S., D OMINA F., G ERMANÀ C.,
T R I B U L A T O E . , 2004b. Morphological and physiological
effects of rolABC genes into citrus genome. Acta Hort. (ISHS)
632:235-242.
GHORBEL R., D OMÌNGUEZ A., N AVARRO L., P ENA L., 2000. High
efficiency genetic transformation of sour orange ( C i t r u s
aurantium) and production of transgenic trees containing the
coat protein gene of citrus tristeza virus. Tree Physiol. 20:
1183–1189.
GHORBEL R., L A MALFA S., L ÒPEZ M.M., P ETIT A., N AVARRO L.,
PENA L., 2001. Additional copies of virG from pTiBo542 pro vide a super-transformation ability to Agrobacterium tumefaciens in citrus. Physiol. Molec. Plant Pathol. 58: 103–110.
GIRI C.C., SHYAMKUNAR B., ANJANEYULU C., 2004. Progress in
tissue culture, genetic transformation and applications of bio technology to trees: an overview. Trees 18: 115-135
G U T O R A N O V G.P., T S V E T K O V I.J., C O L O V A - T S O L O V A V . M .
ATANASSOV A.I., 2001. Genetically engineered grapevines
carrying GFLV coat protein and antifreeze genes. Agric
Conspec. Sci., 66: 71–76.
GUTIÉRREZ-PESCE P., T AYLOR K., M ULEO R., R UGINI E., 1998.
Somatic embryogenesis and shoot regeneration from transge nic roots of the cherry rootstock Colt (Prunus avium P. pseudocerasus) mediated by pRi 1855 T-DNA of Agrobacterium
rhizogenes. Plant Cell Rep. 17: 574–580.
JAMES D.J., P ASSEY A.J., BARBARA D.J., 1990. Agrobacterium mediated transformation of the cultivated strawberry
(Fragaria x ananassa Duch.) using disarmed binary vectors.
Plant Sci., 69:79-94.
JAMES D.J., U RATSU S.L., C HENG J., NEGRI P., V ISS P., D ANDEKAR
A.M., 1993. Acetosyringone and osmoprotectans like betaine
or proline synergistically enhance Agrobacterium-mediated
transformation of apple. Plant Cell Rep. 12: 559–563.
KO K., N ORELLI J.L., R EYNOIRD J.P., B ORESJZA-W YSOCKA E.,
BROWN S.K., A LDWINCKLE H.S., 2000. Effect of untranslated
leader sequence of AMV RNA 4 and signal peptide of patho genesis- related protein 1b on attacin gene expression, and
resistance to fire blight in transgenic apple. Biotechnol. Lett.
22: 373–381.
KOBAYASHI S., 2000. Advances of resveratrol research: resvera trol, a phytoalexin in grape, having cancer- and arteriosclero sis-preventive activities. Bulletin of the National Institute of
FruitTree-Science, 34: 1-15.
IOCCO P., FRANKS T., THOMAS M.R., 2001. Genetic transformation
of major wine grape cultivars of Vitis vinifera L. Transgenic.
Research. 10(2):105-112.
LAIMER DA CÀMARA MACHADO M., DA CÀMARA MACHADO A.,
H A N Z E R V., W E I S S H., R E G N E R F., S T E I N K E L I N E R H . ,
M A T T A N O V I C H D., P L A I L R., K N A P P E., K A L T H O F F B . ,
KATINGER H.W.D., 1992. Regeneration of transgenic plants of
Prunus armeniaca containing the coat protein gene of Plum
Pox Virus. Plant Cell Rep.11: 25–29.
LANDI L., M EZZETTI B., 2005. TDZ, auxin and genotype effects on
leaf organogenesis in Fragaria. Plant Cell Rep., in stampa.
LA MALFA S., C IRVILLERI G., RIZZITANO A., S PINA S., D OMINA F.,
ABBATE C., DENG Z., G ENTILE A., 2004. Evaluation of tran sgenic rolABC citrange Troyer for growth habit and rootassociated bacteria. Proceedings of 10th ISC Congress.
Agadir (Morocco), 15-20 february. In press.
LI U S S., M A N S H A R D T R.M., F I T C H M.M.M., S L I G H T O M J . L . ,
SANFORD J.C., GONSALVES D., 1997. Pathogen-derived resi stance provides papaya with effective protection against
papaya ringspot virus. Mol. Breeding, 3: 161–168.
MALNOY M., VENISSE J.S., REYNOIRD J.P., CHEVREAU E., 2003.
Activation of three pathogen inducible promoters of tobacco
Piante da frutto transgeniche
in transgneic pear (Pyrus communis L.) after abiotic and bio tic elicitation. Planta 216: 802814.
MASCIARELLI E., M EZZETTI B., C IALDEA L., M ANZO A., 2004.
Attività di sperimentazione in Italia su piante geneticamente
modificate. L’Informatore Agrario, 28: 39-42
MARTINELLI L., C ANDIOLI E., COSTA D., M INAFRA A., 2002. Stable
insertion and expression of the movement protein gene of
Grapevine Virus A (GVA) in grape (Vitis rupestris S.).Vitis,
41: 189–193.
ME Z Z E T T I B., P A N D O L F I N I T., N A V A C C H I O., L A N D I L ., 2002.
Genetic transformation of Vitis vinifera via organogenesis.
BMC Biotechnology, 2: 18
M E Z Z E T T I B., C O S T A N T I N I E., C H I O N C H E T T I F., L A N D I L . ,
PANDOLFINI T., S PENA A., 2004a. Genetic transformation in
strawberry and raspberry for improving plant productivity
and fruit quality. Euroberry Symposium, Acta Hort. (ISHS)
649: 107-110.
MEZZETTI B., L ANDI L., P ANDOLFINI T., S PENA A., 2004b. The
DefH9-iaaM auxin-synthesizing gene increases plant fecun dity and fruit production in strawberry and raspberry. BMC
Biotechnology, 4: 4.
MEZZETTI B., S ILVESTRONI O., C OSTANTINI E., P ANDOLFINI T.,
SPENA A., 2005. Genetic transformation of Table Grape via
organogenesis and field evaluation of DefH9iaaM transgenic
p l a n t s. ISHS International Symposium on Grapevine
Physiology & Biotechnology UC – Davis, June 21-25.
ActaHortic. In stampa.
MIKI B., MCHUGH S., 2004. Selectable marker genes in transgenic
plants: applications, alternatives and biosafety. J. Biotechnol.,
107: 193–232.
N A K A M U R A Y., S A W A D A H., K O B A Y A S H I S., N A K A J I M A I . ,
YOSHIKAWA M., 1999. Expression of soybean b-1,3-endoglu canase cDNA and effect on disease tolerance in kiwifruit
plants. Plant Cell Rep., 18: 527–532.
NEGRI P., M AGNANIMI E., C ANTONI L., B ERARDI G., S ANSAVINI S.,
1998. Piante arboree transgeniche: prime esperienze sul tra sferimento di geni per il controllo dell’habitus vegetativo.
Rivista-di-Frutticoltura-e-di-Ortofloricoltura 60(5): 91-97
MULEO R., I CONA C., 1998. Architecture regulation by phytochro me, phenotypic evidences in cherry plants transformed with
phytocrome A of rice. Proc. AGROBIOFRUIT, Cesena, Italy,
pp.14-15.
PANDOLFINI T., ROTINO G.L., CAMERINI S., DEFEZ R., SPENA A.,
2002. Optimization of transgene action at the post-transcrip tional level:high quality parthenocarpic fruits in industrial
tomatoes. BMC Biotechnology, 2: 1.
PANDOLFINI T., MOLESINI B., AVESANI L., SPENA A., POLVERARI A.,
2003. Expression of self-complementary hairpin RNA under
the control of the rolC promoter confers systemic disease resi stance to plum pox virus without preventing local infection.
BMC Biotechnology, 3: 7.
PRATESI D., P ARIS R., N EGRI P., S COTTI A., 2004. Agrobacteriummediated genetic transformation competence of different
Prunus explants, as revealed by gus expression. Acta-Hortic.,
663 (Vol. 1): 495-498.
PEÑA L., M ARTYN-TRILLO M., JUAREZ J.A., PINA J.A., NAVARRO
L., MARTYNEZ-ZAPATER J.M., 2001. Constitutive expression of
Arabidopsis LEAFY or APETALA1 genes in citrus reduces
their generation time. Nat. Biotechnol 19: 263–267.
PE T R I C., A L B U R Q U E R Q U E N., G A R C Y A- C A S T I L L O S., E G E A J . ,
BURGOS L., 2004. Factors affecting gene transfer efficiency to
apricot leaves during early Agrobacterium-mediated transfor mation steps. J. Hortic. Sci. Biotech., 79: 704–712.
PETRI C., B URGOS L., 2005. Transformation of fruit trees.Useful
breeding tool or continued future prospect? T r a n s g e n i c
Research 14:15 –26,2005.
PUTERKA G.J., B OCCHETTI C., D ANG P., B ELL R.L., S CORZA R.,
2002. Pear transformed with a lytic petide gene for disease
control affects nontarget organism, Pear Psylla (Homoptera:
Psyllidae). J. Econ. Entomol. 95: 797–802.
RAVELONANDRO M., S CORZA R., B ACHELIER J.C., L ABONNE G.,
LEVY L., D AMSTEEGT V.D., C ALLAHAN A.M., D UNEZ J., 1997.
Resistance of transgenic Prunus domestica to plum pox virus
infection. Plant Dis 81: 1231–1235.
RAVELONANDRO M., BRIARD P., MONSION M., SCORZA R., RENAUD R.,
2002. Stable transfer of the plum pox virus (PPV) capsid tran sgene to seedlings of two French cultivars ‘Prunier d’Ente
303’ and ‘Quetsche 2906’, and preliminary results of PPV
challenge assays. Acta Hort 577: 91–96.
REYNOIRD J.P., MOURGUES F., NORELLI. J.L., A LDWINCKLE H.S.,
BRISSET M.N., C HEVREAU E., 1999. First evidence for impro ved resistance to fire blight in transgenic pear expressing the
attacin E gene from Hyalophora cecropia. Plant Sci. 149:
23–31.
ROTINO G.L., P ERRI E., Z OTTINI M., S OMMER H., S PENA A., 1997.
Genetic engineering of parhenocarpic plants.Nat Biotechnol
15:1398-20.
RUGINI E., P ELLEGRINESCHI A., M ENCUCCINI M., M ARIOTTI D.,
1991. Increase of rooting ability in the woody species kiwi
(Actinidia deliciosa A. C h e v.) by transformation with
Agrobacterium rhizogenes rol genes. Plant Cell Rep. 10:
291–295.
SANSAVINI S., 2003. I traguardi, le priorità e le prospettive della
ricerca italiana in frutticoltura. Italus Hortus, Speciale: 19532003: Cinquant’anni di Frutticoltura Italiana.
SCHESTIBRATOV K.A., DOLGOV S.V., 2005. Genetic Engineering of
Strawberry cv. Firework and cv. Selekta for Taste
Improvement and Enhanced Disease Resistance by
Introduction of thauII Gene. ISHS Int. Strawberry Symposium
Australia. Acta Hortic. in stampa.
SCORZA R., RAVELONANDRO M., CALLAHAN A.M., CORDTS J.M.,
FUCHS M., D UNEZ J., G ONSALVES D., 1994. Transgenic plums
(Prunus domestica L.) express the plum pox virus coat protein
gene. Plant Cell Rep., 14: 18–22.
SCORZA R., LEVY L., D AMSTEEGT V.D., YEPES L.M., C ORDTS J.M.,
HADIDI A., SLIGHTOM J., GONSALVES D., 1995. Transformation
of plum with the papaya ringspot virus coat protein gene and
reaction of transgenic plants to plum pox virus. J Am. Soc.
Hortic. Sci. 120: 943–952.
SCORZA R., CORDTS J.M., GRAY D.J., GONSALVES D., EMERSHAD
R.L., R A M M I N G D . W ., 1996. Producing transgenic
’Thompsom Seedless’ grape (Vitis vinifera L.) plants. J. Am.
Soc. Hortic. Sci., 121: 616–619.
SONG G.Q., S INK K.C., 2004. Agrobacterium tumefaciens-media ted transformation of blueberry (Vaccinium corymbosum L.).
Plant-Cell-Rep., 23 (7): 475-484
SM I G O C K I A.C., H A M M E R S C H L A G F . A ., 1991. Regeneration of
plants from peach embryo cells infected with a shooty mutant
strain of Agrobacterium. J. Am. Soc. Hortic. Sci., 116:
1092–1097.
SREEKALA C., WU L., GU K., WANG D., T IAN D., YIN Z., 2005.
Excision of a selectable marker in transgenic rice (Oryza sativa L.) using a chemically regulated Cre/loxP system. Plant
Cell Rep., 24(2):86-94.
STACHEL S.E., M ESSENS E., V AN MONTAGU M., Z AMBRYSKI P.,
1985. Identification of the signal molecules produced by
wounded plant cells that activate T-DNA transfer in
Agrobacterium tumefaciens. Nature, 318: 624–629.
TAO R., D ANDEKAR A.M., U RATSU S.L., V AIL P.V., T EBBETS J.S.,
1997. Engineering genetic resistance against insects in
Japanese persimmon using the cryIA(c) gene of Bacillus thuringiensis. J. Am. Soc. Hortic. Sci., 122: 764–771.
VAHDATI K., M C KENNA J.R., D ANDEKAR A.M., U RATSU S.L.,
HACKETT W.P., N EGRI P., M CGRANAHAN G.H., 2004. Rooting
and other characteristics of a transgenic waknut hybrid
(Juglans hindsii x J. regia) rootstock expressing rolABC.
91
Mezzetti e Gentile
Journal of the American Society Science, 127, 5: 724-728.
VIDAL J.R., K IKKERT J.R., W ALLACE P.G., R EISCH B.I., 2003.
High-efficiency biolistic co-transformation and regeneration
of ‘Chardonnay’ (Vitis vinifera L.) containing npt-II and anti microbial peptide genes. Plant Cell Rep., 22(4):252-60.
WELANDER M., P AWLICKI N., H OLEFORS A., W ILSON F., 1998.
Genetic transformation of the apple rootstock M26 with the
RolB gene and its influence on rooting. J. Plant Physiol., 153:
371–380.
YAMAMOTO T., I KETANI H., I EKI H., N ISHIZAWA Y., N OTSUKA K.,
HIBI T., H AYASHI T., M ATSUTA N., 2000. Transgenic grapevi ne plants expressing a rice chitinase with enhanced resistance
to fungal pathogens. Plant Cell Rep., 19: 639–646.
YANG Z.N., I NGELBRECHT I.L., L OUZADA E., S KARIA M., M IRKOV
T.E., 2000. Agrobacterium-mediated transformation of the
commercially important grapefruit cultivar Rio Red (Citrus
paradisi Macf.) Plant Cell Rep., 19: 1203–1211.
YE X.J., B ROWN S.K., S CORZA R., CORDTS J.M., SANFORD J.C.,
1994. Genetic transformation of peach tissues by particle
bombardment. J. Am. Soc. Hortic. Sci., 119: 367–373.
ZHU L.H., HOLEFORS A., AHLMAN A., X UE Z.T., WELANDER M.,
2001. Transformation of the apple rootstock M.9/29 with the
rolB gene and its influence on rooting and growth. Plant Sci.
160: 433–439.
ZHU L.H., LI X.Y., AHLMAN A., WELANDER M., 2003. The rooting
ability of the dwarfing pear rootstock BP10030 (Pyrus communis) was significantly increased by introduction of the rolB
gene. Plant Sci 165: 829–835.
92
ZUO J., NIU Q.W., I KEDA Y., C HUA N.H., 2002. Marker-free tran sformation: increasing transformation frequency by the use of
regeneration-promoting genes. Curr. Opin. Biotechnol. 13:
173–180.
Siti di interesse:
http://www.efsa.eu.int/science/gmo/gmo_opinions/384_en.html
http://www.minambiente.it/Sito/settori_azione/scn/ogm/anc_ogm.
asp
http://www.bioinformatica.unito.it/bioinformatics/Spena/index.ht
ml
http://www.biocommedia.it/index2.php?Direct=new&ID=906
http://www.isaaa.org/kc/
http://www.geo-pie.cornell.edu/educators/who.html
http://bch.biodiv.org/
http://www.foodpolicyinstitute.org/
http://www.nuffieldbioethics.org/home/
http://www.pgeconomics.co.uk/co_exist_in_%20the%20EU.htm
http://www.bio.org/er/timeline2.asp
http://www.galileo2001.it/materiali/documenti/ogm/rischi_piante_gm.php
http://www.kataweb.it/speciali/ogm/glossario.html
http://www.whybiotech.com/index.asp?id=2157
Reports and proceedings:
http://www.jbc.org/cgi/content/full/276/24/21578
http://www.jac.oupjournals.org/cgi/content/abstract/53/3/418
http://californiaagriculture.ucop.edu/0402AMJ/pdfs/barriers.pdf
http://www.agrsci.dk/gmcc-03/gmcc_proceedings.pdf
http://www.whybiotech.com/html/pdf/GoodIdeas-96dpi.pdf