ANESTETICI GENERALI
Gli anestetici generali sono farmaci deprimenti dell’eccitabilità dei neuroni; applicati per
ridurre la sensibilità al dolore in modo parziale o totale fino a perdita della coscienza. Lo
scopo è di ottenere uno stato di incoscienza e di rilassamento muscolare adatti per un
intervento chirurgico. Una tipica successione di eventi in funzione del dosaggio utilizzato è il
seguente:
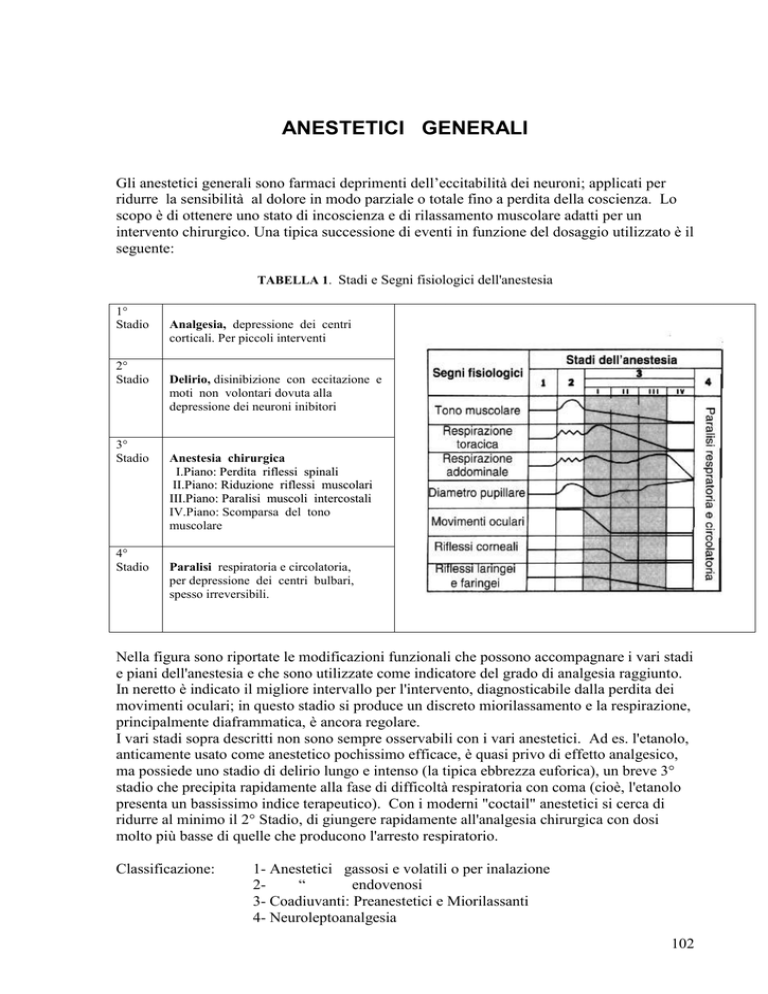
TABELLA 1. Stadi e Segni fisiologici dell'anestesia
1°
Stadio
2°
Stadio
3°
Stadio
4°
Stadio
Analgesia, depressione dei centri
corticali. Per piccoli interventi
Delirio, disinibizione con eccitazione e
moti non volontari dovuta alla
depressione dei neuroni inibitori
Anestesia chirurgica
I.Piano: Perdita riflessi spinali
II.Piano: Riduzione riflessi muscolari
III.Piano: Paralisi muscoli intercostali
IV.Piano: Scomparsa del tono
muscolare
Paralisi respiratoria e circolatoria,
per depressione dei centri bulbari,
spesso irreversibili.
Nella figura sono riportate le modificazioni funzionali che possono accompagnare i vari stadi
e piani dell'anestesia e che sono utilizzate come indicatore del grado di analgesia raggiunto.
In neretto è indicato il migliore intervallo per l'intervento, diagnosticabile dalla perdita dei
movimenti oculari; in questo stadio si produce un discreto miorilassamento e la respirazione,
principalmente diaframmatica, è ancora regolare.
I vari stadi sopra descritti non sono sempre osservabili con i vari anestetici. Ad es. l'etanolo,
anticamente usato come anestetico pochissimo efficace, è quasi privo di effetto analgesico,
ma possiede uno stadio di delirio lungo e intenso (la tipica ebbrezza euforica), un breve 3°
stadio che precipita rapidamente alla fase di difficoltà respiratoria con coma (cioè, l'etanolo
presenta un bassissimo indice terapeutico). Con i moderni "coctail" anestetici si cerca di
ridurre al minimo il 2° Stadio, di giungere rapidamente all'analgesia chirurgica con dosi
molto più basse di quelle che producono l'arresto respiratorio.
Classificazione:
1- Anestetici gassosi e volatili o per inalazione
2“
endovenosi
3- Coadiuvanti: Preanestetici e Miorilassanti
4- Neuroleptoanalgesia
102
Anestetici Gassosi e Volatili
Vengono mescolati e vaporizzati nell'aria respiratoria (aria, ossigeno e anidride carbonica in
opportune proporzioni) e quindi somministrati per via polmonare mediante sistemi a circuito
chiuso. La concentrazione di anestetico in fase gassosa e nel sangue viene valutata ed
espressa in pressione parziale. L' attività viene espressa in MAC ( minima concentrazione
alveolare per indurre insensibilità ad un certo stimolo dolorifico nel 50% dei soggetti).
Inoltre un buon anestetico deve dare: a) rapida induzione di anestesia; b) rapido risveglio;
c) eliminato rapidamente ed il più possibile attraverso il polmone in forma inalterata. A
intervento concluso, la permanenza prolungata nel sangue e, in maggior misura, il deposito
nei tessuti adiposi (cerebrale, epatico e sottocutaneo) aumentano gli effetti tossici e la
estensione del metabolismo che spesso produce derivati molto tossici.
Caratteristiche chimico fisiche di un anestetico polmonare sono quindi:
a- Elevata lipofilia, per attraversare efficacemente le membrane biologiche. Elevata
lipofilia e bassa tensione di vapore (bassa volatilità) per raggiungere elevate
concentrazioni nel tessuto nervoso. Questi fattori aumentano la potenza.
b- Gassoso o elevata tensione di vapore (basso punto di ebollizione o alta volatilità) se
liquido così da raggiungere elevate concentrazioni alveolari, da diffondere rapidamente
nel sangue e, soprattutto, di essere eliminato rapidamente per via polmonare a fine
anestesia. Questi fattori determinano rapidità dell'anestesia e del risveglio.
c- Basso rischio di tossicità: acuta per il paziente e cronica per il personale medico.
d- Non infiammabile.
GASSOSI
Protossido o sottossido di azoto, chiamato dai primi scopritori gas esilarante per l'euforia
indotta durante il 2° Stadio. Scoperto verso il 1850. La struttura elettronica è simile a quella
dell'azoto molecolare che, con un doppietto elettronico libero, dà legame dativo con un
atomo di ossigeno. La molecole è isoelettronica o isostera con quella del biossido di
carbonio e ha quindi in comune le proprietà deprimenti dell'eccitabilità neuronica (vedi
inibitori dell'anidrasi carbonica come anticonvulsivanti, Cap. 14):
..
N N
N N
O
N N O
..
oppure:
..
N N O
..
..
O
.. C O
Si prepara per ebollizione in acqua di nitrato di ammonio. L'azoto 3- dell'ammonio
si ossida a 0 e quello 5+ del nitrato si riduce a 2+, scambiandosi tre elettroni:
3-
5+
NH4NO3
D
0
2+
N N
O
+
H2O
3e
L' N2O per il fatto di essere gassoso e di essere dotato di una discreta polarità è poco potente
e produce scarso miorilassamento, ma dà rapidi induzione e risveglio ed è sicuro perché non
infiammabile e poco tossico, viene quasi completamente eliminato inalterato per via
polmonare. Attualmente è usato in associazione con gli anestetici fluorurati e/o endovenosi.
Ciclopropano: più efficace del protossido d'azoto per la più alta lipofilia e, quindi, più alto
coefficiente di ripartizione Olio/Acqua, atossico, ma è infiammabile e forma miscele
esplosive con l'aria. In passato usato per un lungo periodo ora abbandonato. Analoga
103
efficacia è posseduta da altri idrocarburi gassosi o a basso punto di ebollizione in particolare
il propilene e l'etilene.
LIQUIDI (volatili)
Come si può osservare dalla Tabella 1 il coefficiente di partizione olio/acqua è fortemente
influenzato dalla volatilità (o temperatura di ebollizione o tensione di vapore): per composti
poco polari minore è la volatilità, più elevato è il peso molecolare e quindi le forze di
London fra olio e composto, più elevato il coefficiente di partizione e la potenza anestetica.
Etere etilico. CH3CH2-O-CH2CH3. Ha avuto molto successo ed è stato lungamente usato. Più
potente degli anestetici gassosi per la minor volatilità. Liquido con punto di ebollizione di
37°C, più facile da manipolare e da dosare dei gas e di pronta evaporazione, relativamente
poco tossico. Abbandonato per la lenta induzione e ancor più lento e fastidioso risveglio, ma
soprattutto perché incendia e esplode in miscela con aria.
N.B. Formazione di perossidi esplosivi .......................
Cloroformio: CHCl3 , triclorometano, usato nello stesso periodo ed in alternativa all'etere
etilico nei paesi tropicali per il più elevato punto di eboll. (62°C). Un altro vantaggio è di
essere difficilmente infiammabile. Ma per il resto è notevolmente svantaggioso, soprattutto
per la tossicità epatica e cardiaca. Già per esposizione alla luce solare genera un pericoloso
veleno il fosgene o dicloruro dell'acido carbonico, un potente agente acilante. Questa
decomposizione si rallenta fortemente conservando il liquido in bottiglie scure e per
aggiunta di una piccola percentuale di etanolo (EtOH) che blocca il fosgene per dare
carbonato dietilico e parzialmente blocca anche l' HCl per dare cloruro di etile; purtroppo
non si può porre riparo alla tossicità del fosgene e HCl prodotti per via metabolica (vedi
dealogenazione metabolica Cap. 8):
Cl
Cl
C
Cl
Cl
h oppure
Cl
H
CYP450
Cl
radicale
EtOH
C
Cl
C
H2O
H
Cl
C
Cl
OH
gem-aloidrina
Cl
H
O
+
Cl
EtO
Cl
+
Cl
Cl
cloroformio
EtOH
OH oppure
C
O
fosgene
O + 2HCl
EtOH + HCl
EtCl + H2O
EtO
Nel caso precedente in vitro da dove vengono gli OH rad e dove vanno gli H rad ???.
oppure attraverso perossidi:
104
O2
O2
Cl
H2O
Cl
h
h
Cl
C
Cl
C
Cl
Cl
O
Cl
C
O
+
H Cl
Cl
H
Cl
H
Cl
C
Cl
OH
Cl
OH.
Cl
Cl
O
Cl
Cl
OH
Cl
Cl
C
C
Cl
Cl
Cl
Cl
Cl
In ogni caso la notevole attività del cloroformio ha stimolato la ricerca nel campo degli
alogenoderivati. La presenza di atomi di alogeno legati covalentemente al carbonio aumenta
fortemente la lipofilia. Il cumulo di atomi di alogeno sullo stesso carbonio o su carboni
adiacenti riduce drasticamente la reattività verso i nucleofili: aumenta la stabilità all'idrolisi e
le proprietà alchilanti, riducendone la tossicità. Difatti nelle SN1 la stabilità del carbocatione
diminusce con l'aumento di atomi di alogeno secondo l'ordine:
CH3+ > XCH2+ > X2CH+ > X3C+ >> CX3-CX2+
Mentre la reattività nelle SN2 viene ridotta dall'impedimento sterico essendo l'alogeno molto
più voluminoso dell'idrogeno. Infine, sfruttando la maggior energia del legame fluorocarbonio 1, sono stati scoperti composti polifluorurati molto efficaci e relativamente sicuri
come anestetici. Tuttavia, il cumulo di atomi di alogeno non diminuisce la reattività nelle
reazioni radicaliche, come, appunto, l'ossidazione da parte del Citocromo P450. In ogni caso
la quantità biotrasformata in metaboliti tossici è trascurabile nei termini più volatili (basso
p.e.) ma aumenta considerevolmente con l'aumentare del punto di ebollizione e con la
stabilità dei radicali intermedi (vedi Tabella 1).
Alotano. E' un alo etano: CF3-CHBrCl, non è infiammabile. E' dotato di buona attività
(MAC 0,77) ma la presenza di Br lo rende sensibile ai nucleofili: attacca le apparecchiature
ed è epatotossico. Il Br- è un ottimo gruppo uscente sia per il legame più debole di Cl e F
con il carbonio sia perché più polarizzabile di Cl- e di F- per le più grandi dimensioni. Ora è
stato sostituito dai aloderivati eterei che vedremo. Viene metabolizzato per ca. il 20%
secondo il seguente schema (vedi anche Cap. 8):
Cl
catal.
F3C C H
Br
Cl
F3C C
radicalica
Br
H2O
Cl
F3C C O
Br
H
- Br- H+
Cl
F3C C O
OH
+ H2O
- HCl
F3 C C O
Il cloruro dell'acido trifluoroacetico è un potentissimo agente acilante e, in alternativa
all'idrolisi, potrebbe reagire con gruppi amminici di proteine, enzimi e DNA innescando
reazioni allergiche, tossicità epatica, cardiaca … mutagenesi e carcinogenesi.
1
L'energia del legame diminuisce nell'ordine: C-F >> C-Cl > C-Br > C-I. Il motivo è che gli elettroni 2p del
carbonio danno la maggior sovrapposizione con gli elettroni di valenza 2p del F, avendo analoga dimensione.
L'entità della sovrapposizione diminuisce con i 3p del Br e ancor più con i 4p dello I.
105
Metossifluorano. Cl2CH- CF2-O-CH3 . E' notevole la sua attività: MAC 0,16 ma è troppo
esteso il suo metabolismo e quindi la sua potenziale tossicità. Attualmente non viene usato
in anestesia. Ciò può essere attribuito alla sua scarsa volatilità (p.e. 105°C), quindi accumulo
nei tessuti e più lenta eliminazione per via polmonare, e alla presenza del gruppo
metossilico, dove il CH3 rende stabile per iperpolarizzazione il radicale catione all' ossigeno:
H
Cl2CH-CF2
catal.
O C H
+
Cl2CH-CF2
radicalica
H
H
- H
O C H
Cl2CH-CF2
+
O C H
H
H
H
+
Cl2CH-CF2
O C H
Cl2CH-CF2
+
O C H
H
H
+ H2O
radicale catione
stabilizzato per
iperconiugazione
+
- H+
H
OH
O C H
Cl2CH-CF2
Cl2CH-CF2
H
H
semiacetale
......
- O=CH2
F
fluoruro acilico
tossico
O C H
- HF
Cl2HC C O
F
Cl2HC C O
H
F
Defluorano. F3-CH(F)-O-CHF2 E' il meno tossico, ma anche il meno attivo dei fluorurati
per la sua più elevata volatilità. Viene eliminato quasi completamente inalterato per via
polmomare. Si noti la bassa percentuale di metabolismo (0,02 %). L'assenza di di alogeni
diversi dal fluoro rende il peso molecolare contenuto e maggiore stabilità alla molecola.
Enflurano:
Cl(F)HC-CF2-O-CHF2
Isofluorano: F3C- CH(Cl)-O-CHF2
Sevofluorano: (CF3)2CH-O-CH2F . Questi ultimi tre hanno caratteristiche intermedie fra i
due precedenti e sono i più usati come anestetici per inalazione associati o in alternanza con
il protossido di azoto. Metabolismo: v. Foye
Tabella 1. Partizione MAC Metabolismo e alcune proprietà fisiche
Anestetico
Metossifluorano
Alotano
Enflurano
Isofluorano
Sevofluorano
Desfluorano
Ossido Nitroso
p.e.
°C
105
50
56
48
58
23
-88
Partizione
olio/gas
970
224
98
91
53
19
1
Partizione
sang./gas
12.0
2.3
1.2
1.4
0.6
0.4
0.5
MAC
0.16
0.77
1.70
1.15
1.71
6.00
104.00
MAC + N2O
(60-70%)
0.07
0.29
0.60
0.50
0.66
2.83
----
% metab.
50.0
20.0
2.4
0.2
4-6
0.02
0.004
NOTA. A questo punto ci si chiede, se il punto debole nell'ossidazione radicalica è il legame
C-H , perché non si usano perfluoro idrocarburi o perfluoro eteri ? Analogamente, perché
sono stati usati gas reattivi come il ciclopropano, etilene o propilene, mentre hanno avuto
poco successo etano, propano o butano ? Si potrebbe pensare che la grande stabilità di questi
composti porta ad un accumulo della frazione non espirata, perché molto stabile verso la
degradazione metabolica ?
106
MECCANISMO D'AZIONE DEGLI ANESTETICI POLMONARI.
Il meccanismo d'azione degli anestetici gassosi non è ancora conosciuto con chiarezza. Di
sicuro si conosce che inibiscono la conduzione dell’ impulso nervoso soprattutto fra neurone
e neurone e quindi a livello delle sinapsi. Sono state ipotizzate varie teorie:
Perturbazione aspecifica della organizzazione del doppio strato fosfolipido delle
membrane cellulari prodotta da sostanze altamente lipofile. A sostegno di questa teoria sta
il fatto che l'anestesia è prodotta da composti con caratteristiche fisico-chimiche molto
differente con in comune principalmente un elevato coefficiente si ripartizione olio/acqua.
In alcune classi di composti l'attività anestetica (MAC) aumenta con l'aumentare della
lipofilia. Così, proprietà anestetiche più o meno rilevanti sono possedute da molti gas
apolari compreso i gas nobili e la CO2, solventi apolari e olii esenziali. La
disorganizzazione del bilayer potrebbe essere parzialmente responsabile di alterazioni di
permeabilità dei vari canali ionici: voltaggio dipendenti o operati da neurotrasmettitore.
Interazione con tasche idrofobiche presenti in determinate proteine di membrana con
conseguente alterazione dell'attività di proteine recettoriale o canale associate alla
membrana stessa. In particolare potrebbero essere inibiti i recettori ionotropi del
glutamato. Essendo il glutammato il principale neurotrasmettitore eccitatorio, il blocco
della sua attività produce una forte depressione psicomotoria. Più complesso potrebbe
essere l'azione degli anestetici gassosi sulle teminazioni sinaptiche inibitorie, come quelle
GABAergiche (v. Cap. 13): queste in un primo momento, alle basse concentrazioni di
anestetico, vengono inibite, producendo i fenomeni eccitatori che caratterizzano il 2°
Stadio dell'analgesia; concentrazioni più elevati di analgesico sembrano stimolare i
recettori del GABA. Così, la stimolazione di un recettore inibitorio produce depressione
dell'eccitabilità, che si va a sommare a quella prodotta dalla depressione dei recettori del
glutamato.
PREANESTETICI.
Ansiolitici (miorilassanti). Tipici composti provvisti di azione ansiolitica e debolmente
miorilassante sono le benzodiazepine (v. Cap. 13). Fra queste più usate sono:
Diazepam. Per via orale, essendo insolubile in acqua e non salificabile. Poichè non è
somministrabile per via parenterale, non può raggiungere concentrazioni ematiche
elevate.
Lorazepam, orale e parenterale.
Midazolam cloridrato, solubilissimo in acqua quindi facilmente somministrabile per
iniezione. N.B. Il flumazenil, antagonista delle benzodiazepine, viene talvolta utilizzato
per interrompere la eccessiva sedazione postoperatoria indotta da benzodiazepine.
Antistaminici, tipo difenidramina (v. Cap. 21) e Neurolettici fenotiazinici (v. Cap. 15)
possono essere sfruttati per la loro azione collaterarale comune: la sedazione. I primi
riducono anche evetuali reazioni allergiche prodotte dagli anestetici.
Butirrofenoni (potenti neurolettici non sedativi; v. Cap. 15) e/o Analgesici (v. Cap. 12)
fra loro sinergici ai fini di ridurre la sensibilità dolorifica, riducono notevolmente il
dosaggio di altri anestici generali (v. più avanti: neuroleptoanalgesia)
Miorilassanti. per indurre uno stato di rilassamento muscolare richiesto in molti
interventi chirurgici. Si usano miorilassanti periferici o curari trattati nel Cap. 20.
Antiemetici …
107
ANESTETICI GENERALI ENDOVENOSI
Hanno azione più rapida e gradevole rispetto ai polmonari. Si possono usare in associazione
a protossido d'azoto e con i preanestetici sopra elencati.
Barbiturici (v. Cap. 13). Qui di fianco è riportato il più utilizzato: tiopentale sodico o
tipentone sodico. Per possedere le caratteristiche richieste per l'anestesia devono avere:
solubilità in acqua, per essere somministrati per via
endovenosa;. quindi sono usati sotto forma di sali di
sodio.
rapida induzione, cioè altamente lipofili. Un
incremento di lipofilia rispetto ai normali barbiturici
per uso sedativo è raggiunta:
1. sostituendo l'ossigeno sul C2 con lo solfo. Il
legame C=S è molto meno polare del C=O e lo S ha un peso atomico doppio
dell’ossigeno
2. inserendo un metile su uno dei due atomi di azoto. Ciò produce forte riduzione di
acidità (vedi Cap. 13a) e la perdita del gruppo idrofilo N-H ammidico.
durata d'azione ultrabreve. Raggiunta inserendo in C5 un radicale ramificato o insaturo,
perché questi vengono facilmente ossidrilati dal CYP450 e quindi rapidamente eleiminati
come glucoronidi o solfati.
Antagonisti del glutamato: Ketamina. Logicamente la ketamina si trova in forma di
cloridrato, così da potersi sciogliere in acqua ed
essere iniettata per una pronta risposta. Si noti la
somiglianza della molecole con quella della
Cl
O
fenciclidina, un potente analgesico oppiaceo. E’
H
N
N
presente un carbonio chinale e l'isomero S(+) è
CH3
da tre a cinque volte più potente del R(-). Viene
usata in associazione con una benzodiazepina.
Fenciclidina
Ketamina
Per il meccanismo d'azione si veda il paragrafo
"Recettori del Glutammato". Principalmente indicata su bambini. Metabolismo: Ndemetilazione e ossidrilazione dell’anello cicloesanico
Propofololo: Degno da ricordare è il meccanismo
d'azione: produce anestesia per potenziamento
dell'attività del GABA, il neurotrasmettitore inibitorio
più diffuso nel SNC. Si deve somministrare in
soluzione oleosa perché insolubile in acqua e non
salificabile.
OH
(CH3)2CH
CH(CH3)2
Neuroleptoanalgesia. Si utilizza l'associazione di un potente neurolettico (droperidolo
cloridrato) con un potente analgesico (fentanil citrato); questa provoca uno stato di
tranquillità con ridotta attività motoria, ridotta ansietà e indifferenza all'ambiente esterno.
Non si perde necessariamente lo stato di coscienza, perciò il paziente è in grado di
collaborare. E' particolarmente indicata su soggetti cardiopatici o anziani.
108
HOOC
H
N
CH2
HOOC C OH
H3C
O
N
HOOC
O
CH2
O
Cl
N
N
N
H
F
Fentanil citrato
Droperidolo cloridrato
109
RECETTORE DEL GLUTAMMATO
Sinapsi eccitatorie
Il glutammato è il neurotrasmettitore eccitatorio più diffuso nel SNC. Analoghe proprietà
possiede l'aspartato, ma è molto meno diffuso e conosciuto (altri AA bicarbossilici più rari
sono l'omocisteato e il chinurenato). In generale si può affermare che aminoacidi
bicarbossilici generano risposte recettoriali eccitatorie e, al contrario, AA monocarbossilici
come il GABA, la glicina e la taurina generano risposte recettoriali inibitorie.
La scoperta del ruolo neurotrasmettitore degli AA è relativamente recente per le difficoltà
implicite nel dimostrare questa loro attività, perché gli AA sono normali costituenti cellulari
coinvolti nella sintesi e nel catabolismo delle proteine. Tuttavia una elevata concentrazione
di AA e del sistema enzimatico richiesto per la loro biosintesi in cellule neuronali e la
scoperta di antagonisti (e agonisti) permettono di ottenere prove validanti di queste
particolari proprietà.
Caratteristiche di un neurotrasmettitore:
1. Biosintesi nel soma del neurone
2. Trasporto e Accumulo nelle vescicole presinaptiche
3. Liberazione atraverso stimolo elettrico (chimico o meccanico)
4. Legame con i recettori sinaptici
5. Rapida terminazione degli effetti a livello recettoriale.
Biosintesi del glutamato:
L’acido glutammico è un AA non essenziale, quindi sprovvisto di un carrier specifico per
poter attraversare le membrane. Quello dietetico non oltrepassa la BEE e deve essere
biosintetizzato in tutte le cellule. Le vie biosintetiche principali sono le seguenti:
1. da ac. chetoglutarico per intervento di transaminasi e piridossal fosfato
2. da glutamina per idrolisi
3. da ornitina H2N-CH2-CH2-CH2-CH(NH2)-COOH alfa deamminazione ciclizzazione - isomerizzazione - idrolisi - deidrogenazione
Ciclo di Krebs
H2NOC.CH2.CH2.CH(NH2).COOH
glutaminasi
(via princip.)
R CH2 NH2
Ammina o
aminoacido
CH2COOH
+
CH2
C COOH
O
Transaminasi
CH COOH
CH2CHO
Transaminasi
4.
+
R CH=O
NH2
Aldeideossidasi
CH2
CH COOH
NH2
Ornitina
CH2COOH
CH2
CH COOH
catabolismo
CH2CH2.NH2
CH2
NH3
NH3
NH2
Semialdeide
glutammica
Accumulo vescicolare: ATP dipendente
110
ridotto in ipossia, ipoglicemia, ictus ↓
aumento glutamato extracellulare → morte neuronica
eccitotossicità 2
Terminazione del segnale: riassorbimento (proteine trasportatrici)
Ruolo COENZIMATICO della B6
Un AA cede NH3 alla B6 e si trasforma in a-chetoacido
(reazione verso destra)
R C COOH
H
--
O PO3
HO
N
NH2
H3C
N
+
H
NH
H2O
CH
CH
CH
HO
O
R C COOH
R C COOH
R CH COOH
CHO
O
-PO3
HO
O
-PO3
--
O PO3
HO
N
+
H3C
Vit B 6 + Aminoacido
N
H3C
H
H
Base di Shiff
N
Struttura chinonica
H3C
N
Chetoacido + Immina di
Vit B 6
Un Chetoacido riceve NH3 alla B6 e si trasforma in AA
(reazione verso sinistra)
RECETTORI per il GLUTAMATO
Localizzati su tutte le regioni del SNC
A canale ionico: ionotropi
influsso Ca2+ ( sottotipo NMDA)
influsso Na+ (sottotipi : AMPA e Kainato)
potenti effetti eccitatori rapidi o classici
eccitotossicità morte neuronale
Associati a proteina G: metabotropi
2
risposte lente di modulazione dell’ attività ionotropa
neuroprotezione
Concentrazioni di glutamato:Elevate nei neuroni glutaminergici : 10 mM
Elevatissime nelle vescicole presinaptiche : 100 mM
Bassissime in liquidi extra e cefalo_rach : 1-5 M
111
integrazione stimoli sensitivi, visivi, pressori, dolorosi
Oss. Nitrico Sintasi
NO : importante mediatore dello
stato di coscienza:
a) Attiva la guanilciclasi
cGMP che induce:
fosforilazione di proteine
fosfodiesterasi
apertura di canali ionici
b) diffonde nei neuroni
circostanti all’ erta
c) diffonde nella rete
capillare
vasodilatazione
Inibitore della NOS : L-nitroarginina
metilestere
112
Recettori per il glu (Poletti pg. 268)
Recettori ionotropi:
risposta a breve termine;
aprono canali ionici
AMPA:
acido
-amino- -(3-idrossi-4,5-diidro-5metil.imidazol-4-il)-propionico
aumento permeabilità Na+
H3C
O
N
OH
H2N
COOH
NMDA: N-metil-D-aspartato
aumento permeabilità del Ca2+
O
OH
H2N
COOH
Recettori Metabotropi:
Associati a proteine G
Risposta a lungo termine
Attivazioni (I) / inibizionio (II-III) metaboliche 2° messaggero:
fosfolipasi C IP3
fosfolipasi B ac. arachidonico
adenilato ciclasi
Tossicità:
Epatotossicità: es. alotano
casi 1 /10.000-30.000 proporzionale a entità metabolismo
Trifluroacetilazione di proteine: antigene - anticorpo
Sensibilità crociata
Nefrotossicità: collegata alla liberazione di ioni fluoruro
(metossifluorano)
Ipertermia maligna:
Contrazioni muscolari incontrollate con produzione di calore
1:14.000 Fatale se non trattata immediatamente
113












