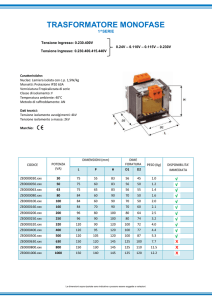
Atomica - Ottobre 2015 - Appello Straordinario
• Per un atomo con due elettroni ottici nella shell d (nd2 ), calcolare (e riportare i calcoli !) i
possibile termini in rappresentazione L-S (2S+1 L) e per ciascuno di essi determinare il numero
di stati.
• Per lo stesso atomo (due elettroni ottici nella shell d (nd2 )), ordinare i termini trovati precedentemente secondo energie crescenti, includendo i termini di correlazione e spin-orbita
• Per un atomo con tre eletroni ottici p (np3 ) trovare SOLO lo stato fondamentale in rappresentazione L-S (riportare la derivazioni e/o le considerazioni fatte)
Risoluzione
• Nel caso di due elettroni ottici equivalenti (nella stessa shell) occorre scrivere la tabella dei
possibili valori di ML , MS e progressivamente eliminare gli stati a partire dai massimi valori
di ML ed MS .
Nel caso specifico la tabella e’
-2,1/2
-1,1/2
0,1/2
1,1/2
2,1/2
-2, -1/2
-1,-1/2
0,-1/2
1,-1/2
2,-1/2
-2,1/2
XXX
-3,1
-2,1
-1 1
01
-4,0
-3,0
-2,0
-1,0
0,0
-1,1/2
0,1/2
Table 1: default
1,1/2 2,1/2 -2,-1/2
XXX
-1,1
0,1
1,1
-3 0
-2,0
-1 0
0,0
1,0
XXX
1,1
2,1
-2,0
-1,0
0,0
1,0
2,0
XXX
3,1
-1,0
0,0
1,0
2,0
3,0
XXX
0,0
1,0
2,0
3,0
4,0
-1,-1/2
0,-1/2
1,-1/2
2,-1/2
XXX
-1,-1
0,-1
1,-1
XXX
1,-1
2,-1
XXX
3,-1
XXX
XXX
-3,-1
-2,-1
-1,-1
0,-1
Identificando i valori massimi di ML e MS progressivamente, si trovano i termini 1 G (9 stati),
3 F (21 stati), 1 D (5 stati), 3 P (9 stati), 1 S (1 stato).
• Ordinando gli stati in energia, seguendo le regole di Hund (massimo S, massimo L, minimo
J) si ha (elencando solo lo stato di piu’ bassa energia per termine)
3
F2 ,3 P0 ,1 G3 ,1 D2 ,1 S0
• La regola di Hund suggerisce che il termine di piu’ bassa energia ha massimo spin. Dunque
avremo uno stato con tutti i 3 spin up, che danno MS = 3/2. Dunque S = 3/2. Ma se tutti
i 3 spin sono up, i possibili valori di ML devono essere distinti, per Pauli. Quindi potranno
solo essere −1, 0, 1 che contribuiscono con un ML = 0. Valori di ML piu’ grandi di zero non
si possono realizzare. Per cui L = 0. Lo stato fondamentale e’ dunque 4 S3/2
1
Molecolare
Un potenziale spesso usato per descrivere la dipendenza della distanza dell’ energia dello stato
fondamentali negli alogenuri alcalini e’ (in unita’ atomiche)
V (R) = E∞ −
1
+ Ae−cR
R
dove E∞ , A e c sono delle costanti. In particolare, questo potenziale puo’ essere usato per descrivere
il cloruro di sodio N aCl. Questa molecola biatomica ha una distanza di equilibrio di R0 = 4.38
unita’ atomiche ed una energia di dissociazione elettronica pari a 5.364 eV . Trovare l’ energia di
dissociazione chimica (in eV) ed il valore di A e c (in unita’ atomiche).
Risoluzione
L’equazione che definisce la posizione del minimo e’ dV (r)/dR = 0. Dunque
1
− cAe−cR0 = 0
R02
Ae−cR0 =
1
cR02
Il valore del potenziale nel minimo e’
V (R0 ) = E∞ −
1
+ Ae−cR0
R0
e dunque l’ energia di dissociazione elettronica ∆e ≡ V (∞) − V (R0 ) e’
∆e =
1
1
1
− Ae−cR0 =
−
R0
R0 cR02
che consente di calcolare c
1
R2
= 0 − ∆e R02
c
R0
Trasformando 5.364 eV in u.a. troviamo ∆e = 5.364/27.2114 = 0.197123 u.a.
1
= 4.38 − 0.197123 ∗ 4.38 ∗ 4.38 = 0.5983
c
o c = 1.67136. Tornando alla espressione Ae−cR0 = cR1 2 possiamo trovare A
0
A=
1
1
= 47.1267
2
−cR
0
cR0 e
Per trovare l’ energia di dissociazione chimica occorre trovare la frequenza vibrazionale. Infatti
Dc = De −
~ω
2
Per trovare ω occorre trovare il valore della derivata seconda del potenziale nel minimo, cioe’
k≡
d2 V
2
1
2
|R0 = − 3 + c2 Ae−cR0 = − 3 + c2 2 = 0.0633u.a.
2
dR
R0
R0
cR0
2
Possiamo trovare la frequenza da
s
ω=
k
µ
La massa ridotta della molecola e’ (sapendo mN a = 22 e mCl = 34 (in unita’ della massa del
protone mp )
mN a mCl
µ=
= 13.3571mp
mN a + mCl
Per non confonderci con le unita’, scriviamo (e convertiamo tutto in MKSA (µ = 2.2341351E − 026
Kg), k = 117.110 J/m2 , ~ = 1.05457E − 34 J/s )
s
ω=
k
6.6440 1013
= 6.6440 1013 Rad/s =
Hz =
µ
2π
che possiamo trasformare in cm−1 dividendo per la velocit’ della luce (3E10) o in eV
~ω = 352.40cm−1 = 352.40 ∗ 1.2398 10−4 eV = 0.0437eV
La costante di dissociazione chimica e’ dunque
Dc = De − 0.0437/2 = 5.364 − 0.0218 = 5.342eV
3