Acidi carbossilici
Composti in cui è combinata la funzione alcolica con quella
carbossilica.
Danno luogo alla formazione di legami idrogeno e sono quindi
caratterizzati da p.f. e p.e. elevati (formano per lo più dimeri).
Sono parzialmente, o solo in alcuni casi totalmente, miscibili in
H2O.
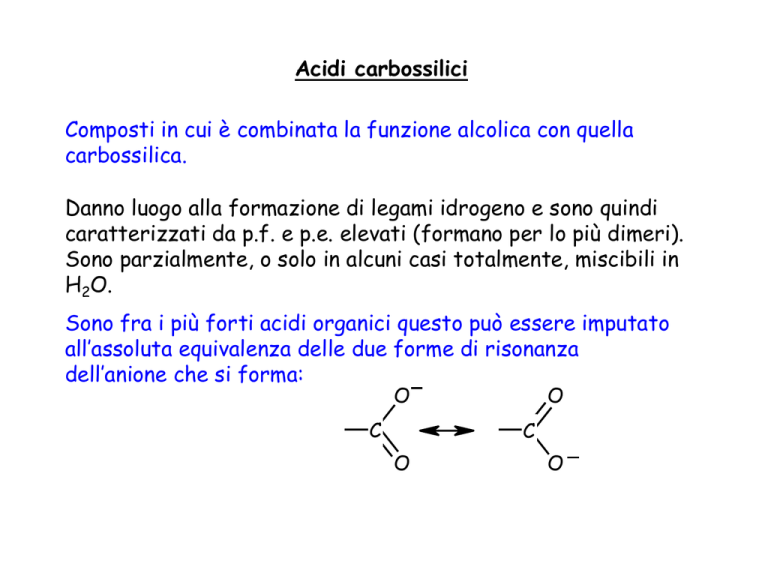
Sono fra i più forti acidi organici questo può essere imputato
all’assoluta equivalenza delle due forme di risonanza
dell’anione che si forma:
O
C
O
C
O
O
Nomenclatura
O
O
Acido
formico
HCOH
Acido
valerianico
CH3CH2CH2CH2COH
O
O
Acido
acetico
CH3COH
O
CH3CH2COH
Acido
propionico
O
CH3CH2CH2COH
Acido
butirrico
CH3CH2CH2CH2CH2COH
Acido
capronico
O
CH3(CH2)14COH
Acido palmitico
(esadecanoico)
O
CH3(CH2)16COH
Acido stearico
(octadecanoico)
O
O
O
OH
H3C
OH
CH3
2-carbossicicloesanone
CH3
acido 2-4 dimetilesanoico
O
O
OH
OH
Acido benzoico
Acido 2-butenoico
O
O
OH
Acido acrilico
H3C
O
OH
OH
Acido lattico
HO
OH
Acido glicolico
Esteri
gruppo idrossi (O-H)
sostituito dall'alcossi O-R
Ammidi
gruppo idrossi (O-H)
sostituito da un'ammina
Anidridi
Formate dalla condensazione
di 2 molecole di acido
Nitrili
R-CN
Alogenuri acilici
gruppo idrossi (O-H)
sostituito da un alogeno
Per attribuire i nomi viene
mantenuta la radice dell'acido
il suffisso varia per i diversi
composti:
ico dell'acido
Esteri :
O
O
O
HCOH
CH3
O
CH3CH2CH2COH
CH3COH
O
H
diventa ato:
CH
CH3
Formiato di isopropile
dall'ac. formico
O
O
CH3CO
CH2CH3
acetato di etile
dall'ac. acetico
CH3CH2CH2CO
CH3
butirrato di metile
dall'ac. butirrico
Sono composti con odori che contraddistinguono in natura i fiori, la
frutta,etc., nell’industria vengono utilizzati come agenti aromatizzanti.
Sono generalmente insolubili in H2O, hanno p.e. poco superiori agli
idrocarburi con equivalente peso molecolare.
L’acetato di etile e di butile sono ottimi solvente per lacche, parzialmente
solubili in H2O.
O
H
Formiato di etile
O
O
O
Rum
Acetato di isopentile
Banana
Acetato di ottile
Arancia
O
O
O
O
Butanoato di metile
Mela
Butanoato di etile
Ananas
O
O
O
O
NH2
Ammino benzoato di metile
Uva
ico dell'acido
Ammidi :
2,2-dimetil
propionammide
Propionammide
O
CH3CH2
sostituito da ammide
NH2
H3C
H3C
O
CH3
N-metilbutirrammide
O
NH2
CH2
H3C
CH2
NH
CH3
Le ammidi primarie (-NH2), che possono dare legami H, presentano p.e.
elevati, le ammidi primarie sono solide
Sono solubili in solventi organici, alcune ammidi anche in acqua.
O
H2N
NH2
Vale la pena di ricordare la struttura
dell’urea, un’ammide importante nella
fisiologia umana.
Alogenuri :
Cloruro di propionile
diventa ile
bromuro di benzoile
O
O
CH3CH2
ico dell'acido
Cl
Br
cloruro di 4-metilvaleroile
H3C
O
CHCH2CH2CCl
CH3
Sono molto reattivi con l’acqua, sono fortemente tossici e lacrimogeni
(gas lacrimogeni).
Il fosgene COCl2 è stato la causa principale dei caduti per gas nella
prima guerra mondiale.
Generano associazioni dipolari e quindi i loro p.e. sono più alti dei
corrispondenti alcani.
Anidridi:
prendono il nome dall'acido preceduto da "anidride"
Possono derivare da due molecole dello stesso acido o da acidi diversi.
O
H3C
CH3CH2CH2
O
O
CH3
O
CH2CH2CH3
Anidride acetica
O
H3C
O
O
O
anidride butirrica
O
H
anidride acetico-formica
Le proprietà fisiche (p.e.) di questi composti sono simili ai corrispondenti
alcani. Sono in genere liquidi fino a 9 atomi di C.
Nomenclatura ACIDI BICARBOSSILICI
O
O
O
OH
Acido
ossalico
OH
O
OH
HO
O
HOC(CH2)3COH
O
O
O
HOC(CH2)2COH
Acido
malonico
Acido
succinico
O
O
HOC(CH2)4COH
O
Acido
glutarico
Acido
adipico
O
HOC(CH2)5COH
Acido
pimelico












