CORSO DI LAUREA in
Scienze e tecniche psicologiche
Corso di
Neurofisiologia Clinica
Guido Rodriguez
Andrea Brugnolo
Nicola Girtler
Neurofisiologia Clinica (DiNOG)
Università di Genova
NEUROCHIMICA
DEL
COMPORTAMENTO
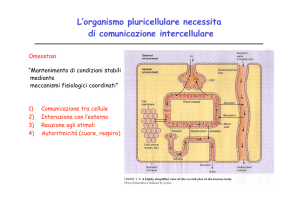
MODALITA’ DI COMUNICAZIONE INTERCELLULARE
SINAPTICHE
Tipiche del SN
ANCESTRALI
Autocrina (es. interleuchina-1)
Paracrina (es. fattori di crescita)
Endocrina (es. insulina)
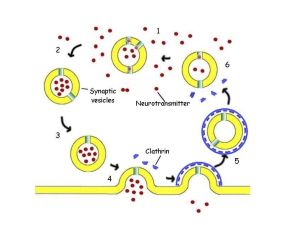
Sinapsi chimiche
CLASSIFICAZIONE DEI MEDIATORI SINAPTICI
NEUROTRASMETTITORI
MESSAGGERI
Aminoacidi
Glutamato
Aspartato
GABA
Glicina
NEUROMODULATORI
RETROGRADI
Ormoni
es. ADH
Neuropeptidi
es. Oppioidi
Acetilcolina (Ach)
Amine biogene
Catecolamine (A, NA, DA)
Serotonina
Istamina
Derivati Purinergici (Adenosina, ATP)
NO
CO
Derivati dell’
acido arachidonico
La scoperta dei neurotrasmettitori
1920 Otto Loewi utilizza 2 cuori di rana
messi in due contenitori comunicanti pieni
di fisiologica (un cuore è connesso al vago
l’altro no). La stimolazione elettrica del
vago s causa un rallentamento delle
pulsazioni del cuore 1 e quindi dopo poco
anche il secodo rallenta; Loewi ipotizza
che la stimolazione del vago comporti il
rilascio nel primo vaso di una sostanza
chimica "Vagusstoff“, la quale passa poi al
secondo . Oggi sappiamo che la sostanza è
l’acetilcolina.
Recettori sinaptici
J. Langley nel 1907
introdusse il concetto di
molecole recettrici.
I recettori sono proteine
che legano i
neurotrasmettitori e
permettono la modificazione
dei canali ionici nel versante
postsinaptico
Recettori sinaptici
Recettori
IONOTROPI
e
METABOTROPI
Potenziali
postsinpatici
eccitatori
e
inibitori
LE CATECOLAMINE
LE CATECOLAMINE
• Le catecolamine che agiscono come
neurotrasmettitori sono la noradrenalina e la
dopamina (l’adrenalina è secreta dal surrene e non è
presente nel SNC).
• La via di sintesi è comune ed il fattore limitante è la
tirosina idrossilasi. Non conosciamo ancora sostanze
che interagiscano con questo enzima.
• Alcune sostanze possono competere con la formazione
di dopamina e quindi dare origine a falsi
neurotrasmettitori come l’octopamina
nell’encefalopatia epatica o come altri prodotti
durante la terapia con inibitori delle MAO
(spiegherebbe l’effetto sulla pressione).
LE CATECOLAMINE
• LE VIE NORADRENERGICHE
Varie teorie sul ruolo del locus
ceruleus nella memoria,
nell’acquisire conoscenza,
nell’ansia e nelle psicosi. Un più
generale e più comprensibile
ruolo può essere descritto come
un sistema in grado di orientare
il cervello verso gli stimoli
derivanti dall’ambiente e dai
visceri. Questo sistema è
attivato da un gran numero di
stimoli in relazione alla vigilanza,
necessaria per esplorare
l’ambiente.
LE CATECOLAMINE
•
•
Il sistema LC è una parte necessaria del controllo centrale del sistema
nervoso autonomo e della regolazione del ritmo veglia-sonno, ed è
coinvolto nel meccanismo della ricompensa e del rinforzo.
Si può ritenere che il sistema del LC è centrale nei disturbi affettivi,
nei disordini d’ansia, nella dipendenza da sostanze psicoattive e nella
sindrome d’astinenza.
FUNZIONI DELLA NORADRENALINA
Tono simpatico
Tono timico (umore) > teoria monoaminergica del disturbo bipolare
Veglia e Attenzione
Comportamento alimentare
Memoria
Dolore
Motilità
Recettori adrenergici
Sono tutti METABOTROPI.
•
Alfa-1. Legano solo NA e sono eccitatori. Vasi, canale digerente, sistema
genitourinario, occhio, cute, SNC.
•
Alfa-2. Autorecettori inibitori, regolano il rilascio delle catecolamine.
Presenti anche nel SNC.
•
•
Beta-1. Legano NA >> A e sono eccitatori. Regolano i parametri cardiaci.
Beta-2. Legano soprattutto A e sono eccitatori. Estesa distribuzione
periferica.
Beta-3. Poco conosciuti, presenti nel tessuto adiposo.
•
LE CATECOLAMINE
• LE VIE DOPAMINERGICHE
4 sistemi di proiezione, di questi: il
mesocorticale, il mesolimbico, il nigro
striatale hanno similarità
farmacologiche. In generale il
nigrostriatale (dalla nigra al caudatoputamen) influisce sull’inizio e
mantenimeto dell’attività motoria. Il
mesolimbico (all’amigdala, ippocampo, n.
accumbens e area del setto) ed il
mesocorticale (alle regioni frontali)
nascono dal tegmento ventrale. Ci sono
modalità di interscambio tra i due
sistemi.
Il tratto tuberoinfundibulare regola
alcuni peptidi ipotalamici ed ipofisari (la
prolattina aumenta se la dopamina è
inibita = galattorrea per l’uso dei
neurolettici = predizione dell’effetto).
LE CATECOLAMINE
•
•
Il sistema tuberoinfundibulare (che non ha autorecettori sul terminale
presinaptico) è inibito nello stress acuto (al contrario del sistema
mesocorticale e mesolimbico) e la prolattina è uno dei cosidetti ormoni
dello stress.
I sistemi mesolimbico e mesocorticale sembrano importanti per l’inizio ed il
mantenimento di comportamenti diretti al raggiungimento dello scopo ed
all’ottenimento della ricompensa. Un’alterazione di questo sistema modifica
il normale processo associativo e porta ad un malfunzionamento delle
modalilità percettive delle aree eteromodali del lobo frontale. Da ciò
incapacità a valutare stimoli non importanti forse alla base della perdita
delle associazioni, percezioni deliranti e fuga delle idee: la dopamina sembra
essere coinvolta anche nella regolazione dell’espressione dell’affettività.
Una classica malattia di aumentato tono del sistema dopaminergico è la
malattia di Huntington mentre il Parkinson è un classico esempio di
diminizione del tono dopaminergico.
FUNZIONI DELLA DOPAMINA
Tono vasomotorio, Trasmissione gangliare autonoma (cellule SIF)
Tono timico > gratificazione, euforia, aggressività
Ideazione, pensiero creativo > teoria dopaminergica della schizofrenia (↓via
mesocorticale, ↑via mesolimbica)
Termoregolazione
Sessualità (neurolettici > anedonia)
Comportamento alimentare
Recettori dopaminergici
Due famiglie di recettori esclusivamente METABOTROPI:
D1-like family.
Sono eccitatori. Comprende:
D1. striato (soprattutto neuroni nigrostriatali a sostanza
P/dinorfina), tubercolo olfattivo, isole di Calleja (cellule a granuli),
nucleo endopeduncolare, neocorteccia, ippocampo, amigdala, retina
D5. ippocampo, nucleo talamico parafascicolare, nucleo mammilare
laterale
Recettori dopaminergici
D2-like family.
Sono inibitori. Comprende:
D2. striato, tubercolo olfattivo, setto, ipotalamo, ippocampo,
corteccia cerebrale, sostanza nera e area tegmentale ventrale
(autorecettore), cellule melanotrofe e mammotrofe
dell’adenoipofisi
D3. isole di Calleja, guscio (shell) del nucleo accumbens,
archicerebello, zone ventricolare subependimale, sostanza nera e
area tegmentale ventrale
D4. corteccia frontale, temporale, cingolata ed entorinale, nucleo
settale laterale, nucleo preottico mediale, ippocampo, cellule a
granuli cerebellari, ipofisi, retina, cuore
ALTRE AMINE BIOGENE
Serotonina
La via di sintesi è analoga a quella delle catecolamine, ma l’elemento limitante è
l’assunzione di triptofano nei neuroni.
Il triptofano attraversa la barriera ematoencefalica grazie ad un meccanismo
di trasporto attivo per il quale compete con altri aminoacidi neutri, quali
leucina, lisina e metionina. L’attivita’ di questo meccanismo di trasporto e’
favorita dalla presenza di insulina e di glucosio. Altro aspetto interessante di
questo sistema e’ il fatto che il triptofano e’ uno dei pochi aminoacidi che si
trovi in forma legata in quantita’ significativa a livello plasmatico. L’effettivo
sito di legame e’ rappresentato dal recettore per gli acidi grassi dell’albumina.
Questa modalita’, in ultimo, determina il fatto che la sintesi di serotonina sia
sotto il controllo di una serie di fattori limitanti. Ad esempio, tutto cio’ che
provoca un aumento di acidi grassi liberi determina lo spiazzamento del
triptofano dal sito di legame, aumentandone quindi la quantita’ libera in grado
di oltrepassare la BEE. Alcuni esempi: ogni evento stressante che aumenta la
risposta dei glucocorticoidi, l’esercizio fisico, l’intossicazione acuta da alcol.
Il metabolismo della serotonina e’ essenzialmente dovuto alle MAO; il
metabolita principale e’ rappresentato dal 5HIAA.
ALTRE AMINE BIOGENE
• LE VIE SEROTONINERGICHE
Nascono dal nucleo del rafe dorsale e dal rafe
magnus che agiscono come facilitatori del
processo di informazione tramite gli input
ascendenti. Un esempio è il sonno ad onda lenta.
Altre implicazioni dovute agli input sensori
verso questi nuclei sono rappresentate dal
sensory gating e dall’attenzione diretta. Il
Locus Ceruleus è importante nel risveglio e
nella vigilanza. La Vigilanza è uno stato di
aumentato risveglio ed e’ necessaria per
focalizzare e dirigere l’attenzione, ma non e’
sufficiente. La focalizzazione dell’attenzione
richiede che le informazioni entranti dal
sensorio ricevano una priorita’ a seconda
dell’importanza. Se gli stimoli non vengono
rinforzati, si ha un processo di abituazione. Una
carenza nell’attenzione diretta puo’ apparire
come una mancanza di concentrazione.
ALTRE AMINE BIOGENE
• LE VIE SEROTONINERGICHE
FUNZIONI DELLA SEROTONINA
Motilità digerente, Tono vasomotorio, Emostasi
Tono timico (umore) > teoria monoaminergica del disturbo bipolare
Motilità
Dolore
Comportamento alimentare > farmaci anoressizzanti
Sessualità > controbilancia la DA
Controllo neuroendocrino
Termoregolazione > controbilancia la DA
Socievolezza > paroxetina un tempo pubblicizzata come “farmaco per la
timidezza patologica”
Percezione > allucinogeni, entattogeni e psicodislettici
Recettori serotoninergici
Complessa famiglia recettoriale (5HT1, 5HT2, 5HT3, 5HT4, 5HT5, 5HT6,
5HT7), con numerose isoforme. Sono tutti METABOTROPI tranne 5HT3.
5HT1 sono stati suddivisi in quattro sottotipi principali, il più importante dei
quali è il 5HT-1a, localizzato nel rafe e nell’ippocampo. Questo recettore
agisce quale autorecettore nel modulare il rilascio di 5HT dai neuroni
presinaptici. Inoltre, I recettori 5HT-1a sono legati alla proteina G e sono
stati messi in relazione con i processi di termoregolazione, di risposta
arteriolare vasomotoria, con l’ipotensione, con il comportamento sessuale e
forse anche con il sonno.
5HT-2 sono localizzati nella corteccia e sono stati messi in relazione con
l’aggregazione piastrinica, con la vasocostrizione, con movimenti improvvisi
del capo e forse con il sonno. Dal punto di vista farmacologico, questi
recettori sono importanti e possono essere interessati da un’ampia varietà di
agenti farmacologici, compresi i butirrofenoni e le fenotiazine.
5HT-3 è presente nell’area postrema che stimola il vomito.
ALTRE AMINE BIOGENE
Istamina
L’istamina viene sinentizzata per decarbossilazione dell’istidina, mentre il
catabolismo è ad opera di istaminasi, MAO, aldeide idrogenasi. E’ prodotta
soprattutto a livello locale, mentre nel SNC è molto concentrata a livello
ipotalamico (nuclei tubero-mammillari).
• LE VIE ISTAMINERGICHE
FUNZIONI DELL’ISTAMINA
Flogosi, Tono Vasomotorio,
Immunosensibilità, Secrezione
ossintica gastrica, Motilità
uterina
Veglia > gli antiistaminici hanno
effetti ipnotici
Termoregolazione
Secrezione neuroendocrina
Recettori istaminergici
H1. Molto rappresenato nel SNC, ma anche miocardio, tratto genitourinario,
coclea, mastociti, arterie craniche.
H2. Soprattutto a livello periferico (mucosa gastrica, utero, neutrofili, vasi),
ma anche corteccia, cervelletto, gangli della base, ippocampo.
H3. Autorecettore inibitorio presente soprattutto nel SNC e possibile
bersaglio farmacologico per i disturbi del sonno. Modula un gran numero di
vie neurochimiche centrali (tra cui nigro-striatale e colinergica).
H4. Per lo più diffuso tra le cellule infiammatorie (eosinofili e mastociti).
Sono tutti METABOTROPI.
ACETILCOLINA
Viene sintetizzata a partire da colina (dieta, metabolismo lipidico) e
acetilCoA. L’enzima colinacetiltransferasi (CAT) è contenuto solo nelle
cellule che sintetizzano l’acetilcolina e quindi ne è un marker. Il catabolismo,
molto rapido, è dovuto all’acetilcolinesterasi (vera o falsa), enzima
particolarmente importante dal punto di vista farmacologico (AD, gas nervivi
ecc). Dopo il rilascio nella sinapsi, l’acetilcolina viene idrolizzata a colina ed
acetato; la colina viene recuperata nel neurone presinaptico (grazie alle
proteine HACU) e quindi utilizzata per una nuova sintesi di acetilcolina o per
sintetizzare fosfolipidi che possono servire come deposito di colina.
E’ un classico neurotrasmettitore eccitatorio
FUNZIONI PERIFERICHE
Contrazione muscolare scheletrica
Trasmissione gangliare
Trasmissione postgangliare parasimpatica
Secrezione catecolamine surrenaliche
ACETILCOLINA
• LE VIE COLINERGICHE
Il terzo gruppo di neuroni
colinergici si trova nei gangli della
base e sembra che abbiano un
ruolo nelle alterazioni
del movimento.
La via basalo-corticale proietta dal nucleo
basale del Meynert alla corteccia e risulta
compromessa nella demenza di Alzheimer. Il
nucleo sembra coinvolto nei processi di
apprendimento e di memoria e nei processi
di integrazione cognitiva delle informazioni
vegetative e di rilevanza motivazionale.
Il secondo sistema nasce dal tronco e
manda fibre nel mesencefalo e nel talamo:
sembra collegato al ritmo sonno veglia ed
alla insorgenza del sonno REM. Si ritiene che
i neuroni di questi nuclei funzionino come dei
filtri sensoriali e alcuni studi hanno
riportato in alcuni malati schizofrenici una
minore disponibilità di CAT nei nuclei
pontini colinergici. Il significato di questa
condizione è incerto, anche se è noto che gli
agenti anticolinergici ad alte dosi mimano
condizioni di psicosi.
Recettori colinergici
•
•
•
•
Esistono due tipi principali di recettori colinergici, basati su di un
legame differenziale: il recettore muscarinico ed il recettore
nicotinico.
Le tecniche di medicina nucleare sono in grado di legare preferibilmente
i recettori muscarinici con agenti quali la dexitimide o il QNB. Sono in
corso studi per valutare la sensibilità di questi agenti nella valutazione
della malattia di Alzheimer.
Analisi genetiche hanno dimostrato l’esistenza di cinque sottotipi di
recettori muscarinici, tutti legati alla proteina G. (metabotropici)
Questi sottotipi sembrano inoltre essere diversamente distribuiti nel
cervello dei Mammiferi.
Il recettore nicotinico è un recettore ionotropico composto di cinque
subunità. E’ interessante notare che l’iniezione nel coniglio di una delle
subunità più lipofile dà luogo ad una sindrome indistinguibile dalla
miastenia grave. Ciò sembra confermare il sospetto che la MG sia una
malattia autoimmune. Il recettore nicotinico è un sistema canale-ligando
composto di cinque subunità. E’ il principale responsabile degli effetti
periferici dell’acetilcolina a livello dei gangli periferici e della giunzione
neuromuscolare. Ci potrebbero essere alcuni recettori nicotinici
centrali, ma il loro contributo è incerto.
GLUTAMMATO
•Il Glutammato e’ considerato il principale aminoacido eccitatorio del SNC e il suo
ruolo nel metabolismo cellulare e’ ben conosciuto.
•E’ largamente distribuito lungo tutto l’asse neurale. Le regioni in cui esso sembra
assumere particolare importanza sono le cellule granulari del cervelletto, le cellule
piramidali dell’ippocampo,le cellule di Betz della motor strip e le proiezioni dei lobi
frontali sui gangli basali.
•E’ stato difficile riconoscere al glutammato il suo ruolo di neurotrasmettitore, in
quanto e’ presente solo in piccola percentuale nelle vescicole sinaptiche: la
stragrande maggioranza e’ infatti presente come intermedio metabolico. La
possibilità di definire il ruolo del glutammato e’ risultata dalla scoperta dei
recettori specifici per questa molecola e dalla loro definizione tramite marcatura
con diversi analoghi.
FUNZIONI ED EFFETTI DEL GLUTAMMATO
Motilità
Memoria
Epilettogenesi
Allucinazioni > sostanze dissociative (es. PCD) > possibile ruolo nella schizofrenia???
Neurotossicità > XTC, squilibri metabolici
Recettori glutammatergici
Esistono quattro tipi di recettori per il glutammato con una certa
importanza. Certamente col tempo ne saranno scoperti molti altri e la
nomenclatura potrebbe subire numerose variazioni nei prossimi anni. I 4
sottotipi sono:
•Il
•Il
•Il
•Il
recettore NMDA
recettore quisqualte (AMPA)
recettore cainato
recettore metabotropico
Caratteristica comune di questi recettori e’ la depolarizzazione del
potenziale di membrana, con in più alcune peculiarità che rendono questo
sistema particolarmente interessante. Intanto, l’insieme dei recettori
sembra possedere un certo grado di cooperatività’, cioè funzionano
sostanzialmente in contemporanea (vedi sotto)
Recettori glutammatergici
Va notato che il recettore NMDA è inattivo in presenza di ioni Mg++ che
bloccano il canale del calcio. Affinché esso ridiventi attivo, è necessario che il
magnesio liberi il sito occupato nel canale. Ciò viene determinato dalla
depolarizzazione di membrana indotta dagli altri recettori per il glutammato.
Una volta che questo evento si sia verificato e il recettore sia di nuovo attivo,
avviene un processo chiamato eccitotossicità, dovuto all’apertura dei canali
del calcio e che risulta in un aumento del calcio libero. L’entità del danno
sembra essere per lo più limitata da un meccanismo energia-dipendente che
lega il calcio. In situazioni di ischemia o di ipoglicemia questo sistema non
funziona e si ha una eccitotossicità elevata.
Si è ripetutamente cercato di individuare specifici recettori NMDA che
proteggano dal danno di tipo ischemico. Alcuni dei composti scoperti fino ad
oggi sono i benzomorfani, il MK801, e la fenciclidina, molecole che possiedono
attività psicotomimetica, e che pertanto sono di utilità limitata. Pertanto
l’attenzione viene ora focalizzata sul canale del calcio stesso. Un altro sito
potenziale è quello della glicina, che agisce come facilitatore allosterico. Il
legame della glicina accresce la capacità del glutammato di attivare
apparentemente il canale; non è chiaro se si tratti anche dello stesso sito su
cui agisce l’acido nitrico.
GABA
(Acido gamma-amino-butirrico)
• L’acido gamma amino butirrico GABA è stato identificato nel
cervello dei mammiferi negli anni ’50 ed è ritenuto essere il
maggiore neurotrasmettitore di tipo inibitorio. E’ sintetizzato
dall’enzima Glutamico acido decarbossilasi (GAD), enzima
fattore-dipendente. E’ noto che una deficienza congenita di
vitamina B6 predispone a convulsioni che rispondono alla terapia
con vitamina B6.
• Dopo il rilascio, il GABA puo’ essere recuperato dai neuroni o
dagli astrociti. Sembra inoltre che il rilascio del GABA sia anche
sotto il controllo di un autorecettore. Il GABA viene
metabolizzato dall’enzima GABA transaminasi (GABA-T) per
formare la semialdeide dell’acido succinico. Questa viene
ulteriormente metabolizzata ad acido succinico, che e’ un
intermedio del ciclo di Krebs. L’enzima GABA-T e’ inibito
dall’acido valproico, il che suggerisce che l’acido valproico sia una
molecola GABAergica. Per il metabolismo GABAergico esistono
anche percorsi alternativi.
GABA
(Acido gamma-amino-butirrico)
• Neuroni GABAergici sono presenti in: corteccia, cervelletto,
ippocampo, talamo, gangli della base, retina, midollo spinale.
FUNZIONE DEL GABA
Regolazione dell’eccitabilità neuronale
Quando c’è un deficit di funzione GABAergica:
• Epilettogenesi
• Depressione
• Ansia
Quando c’è un eccesso di funzione GABAergica:
• Soppressione dell’attività del SNC (es. intossicazione etilica, BDZ)
Recettori GABAergici
Ce ne sono due fondamentali sottotipi, GABA-A (IONOTROPO) e GABA-B
(METABOTROPO).
GABA-A è quello prevalente nel cervello dei Mammiferi. E’ simile al recettore
per l’acetilcolina in quanto correlato con un canale ionico, in questo caso quello
per il cloruro. Il legame del GABA a questo recettore comporta un aumento di
permeabilità allo ione cloruro e conseguentemente iperpolarizzazione o
inibizione del neurone. Il recettore GABA-a è costituito da quattro subunità
fondamentali, i peptidi 2-alfa e 2-beta che circondano il canale del cloro. In
questo complesso sono presenti tre fondamentali siti di legame:Il primo è il
sito del GABA, il secondo quello delle benzodiazepine, il terzo è interno al
canale ed è sostanzialmente un sito per i barbiturici.
Il legame al sito delle benzodiazepine può avere tre tipi di effetto: agonismo,
agonismo inverso, antagonismo. I tipici farmaci ansiolitici o sedativi ipnotici,
come il diazepam e il lorazepam, agiscono come agonisti di questi recettori. Il
loro legame aumenta l’affinità del recettore per il GABA: ciò dà luogo ad un
aumento dell’entrata degli ioni cloruro. L’effetto di agonismo inverso avviene
invece con le beta-carboline. Questi agenti riducono l’intake del cloruro al di
sotto del livello basale: clinicamente, questa situazione è accompagnata da uno
stato ansioso. Le molecole antagoniste come il flumazenil agiscono invece
spiazzando gli agonisti e gli agonisti inversi, senza un’azione diretta sui canali
del cloro.
Recettori GABAergici
•GABA-B è collegato alla proteina G ed è distinto dai siti per il GABA-A. La
maggiore concentrazione di recettori GABA-B si trova nei nuclei
interpeduncolari e nel cervelletto. Sembra che uno dei suoi effetti principali
sia l’aumento dell’efflusso di potassio dalla cellula. Ciò si tradurrebbe in
un’iperpolarizzazione. Dal punto di vista farmacologico, il baclofen è
considerato un agonista GABA-b, il cui effetto fondamentale è il
miorilassamento.
•Esiste una relazione significativa tra la dopamina e il GABA. In generale il
GABA agisce riducendo l’attivazione dei neuroni dopaminergici nel tegmento e
nella substantia nigra. Questo è alla base dell’uso delle benzodiazepine come
strategia di rinforzo nel trattamento delle psicosi. Inoltre, le benzodiazepine
possono essere utili nel caso di un’iperattività della dopamina nello striato
motorio, come nella corea di Huntington o Discinesia tardiva. Si pensa che
esse agiscano aumentando l’inibizione da feedback da parte dei neuroni
GABAergici del globo pallido e del putamen verso i neuroni dopaminergici della
substantia nigra, costituendo un importante meccanismo di regolazione
dell’attività di questi ultimi.
NEUROPEPTIDI E NEURO-ORMONI
Sono numerosissimi, diffusamente distribuiti in varie sedi del SNC e hanno
effetti per lo più modulatori.
SOMATOSTATINA > regola motilità, stato di arousal corticale (sedazione),
secrezione neuro-endocrina.
Ippocampo, talamo, gangli vertebrali, neocorteccia, amigdala.
SECRETINE > come il VIP, coliberato con l’Ach in ipotalamo e striato.
ORMONI STEROIDI > Ho tiroidei importanti per la loro azione neurotropa e
neurotrofica (si pensi al cretinismo).
Ho sessuali (soprattutto testosterone, in entrambi i sessi) regolano le
funzioni limbiche e influenzano il dimorfismo sessuale delle funzioni
cognitive.
Cortisolo ha importanti funzioni modulatorie nella memoria e nello stress;
quello esogeno può produrre effetti psicotomimetici.
TACHININE > come la sostanza P (ponte, rafe midollare) che modula la
percezione dolorifica, il vomito e l’ansia.
VARI NEUROPEPTIDI > come neuropeptide Y e colecistochinina che regolano
il comportamento alimentare.
NEUROPEPTIDI E NEURO-ORMONI
ORMONI IPOTALAMO-IPOFISARI
ADH e Ossitocina (OT) sono prodotti dai nuclei sopraottico e
paraventricolare dell’ipotalamo endocrino, immaganizzati nella neuroipofisi e
secreti in risposta a stimoli opportuni e con significato molto diverso.
Hanno recettori variamente distribuiti in talamo, ippocampo, sistema
limbico, sostanza nera, midollo spinale; utero, mammella e nefroni.
Sono coinvolte in:
Assunzione di liquidi
Memoria
Attenzione
Comportamento materno
Comportamento sessuale (OT release time-locked to orgasm phase)
Negli ultimi anni, sono stati effetuati alcuni studi che vertono
sull’endocrinologia del comportamento e, in particolare, della vita
sentimentale.
L’OT è un ormone che si libera durante il rapporto sessuale e nell’ambito di
contesti comportamentali che riferiscono ad atteggiamenti di intimità e di
affetto, come l’abbraccio (“hug hormone”), il bacio o l’accarezzamneto.
Pertanto, alcuni autori hanno ipotizzato un ruolo significativo dell’OT nella
vita sentimentale e affettiva dell’individuo, alcuni addirittura propongono
che potrebbe infuenzare la plasticità corticale in modo che si rinforzino
circuiti neuronali alla base di relazioni affettive stabili e durature >
BONDING HORMONE.
NEUROPEPTIDI E NEURO-ORMONI
PEPTIDI OPPIOIDI
Per agente ANALGESICO si intende una sostanza farmacologicamente
capace di sopprimere la percezione dolorifica (un agente ANESTETICO,
invece, sopprime due o più modalità sensoriali; l’analgesia rientra tre le prime
fasi dell’anestesia).
OPPIACEI > analgesici esogeni, come morfina, codeina, eroina, metadone.
Derivano dall’oppio (nepente), la resina che si estrae dal lattice delle spore
immature del papavero sonnifero. L’uso dell’oppio a scopi medici e rituali è
conosciuto fin dall’antichità (i Sumeri ne parlavano già al 4000 aC,
riferendosi al Papaver Somniferum come la “pianta della felicità”).
Era molto diffuso nel XIX dC, usato anche
dagli artisti a scopo ricreativo e perché si
credeva aumentasse la creatività (Samuel T.
Coleridge, “Kubla Khan”).
Successivamente, nel 1913 la Harrison
Narcotic Act ha
vietato l’uso non medico degli oppiacei (si
erano già fatti vedere gli effetti
dell’eroina...).
NEUROPEPTIDI E NEURO-ORMONI
PEPTIDI OPPIOIDI
OPPIOIDI > analgesici endogeni, prodotti dal nostro organismo; sono
praticamente ubiquitari nel SNC. Già negli anni ’30 si notava che la
stimolazione elettrica di certe aree cerebrali, come il PAG o la porzione
rostrale del bulbo, poteva produrre effetti analgesici.
Verso la metà degli anni ’70 si venne poi a sapere che tale effetto è dovuto alla
produzione endogena di peptidi che mimano l’azione della morfina (analgesico a
titolo di prototipo) > ENCEFALINE ENDORFINE DINORFINE
Recettori per gli oppioidi
Delta. Encefalinergico specifico. Corteccia, bulbo olfattivo, tubercolo
olfattivo, caudato, putamen, nucleo accumbens, amigdala, midollo spinale;
utero, cellule immuni, cute.
Mu. Endorfinergico specifico, lega anche encefaline e morfina. E’ diffusissimo.
Kappa. Dinorfinergico specifico. Distribuzione simile a delta.
NOP. Lega la NOCICETTINA (orfanina FQ), un oppioide dinorfino-simile
scoperto più recentemente.
Sigma. Lega l’allucinogeno fenciclidina (PCD), un vecchio anestetico
dissociativo; è discussa la sua appartenenza ai recettori oppioidi (perché
insensibile al naloxone).
NEUROPEPTIDI E NEURO-ORMONI
PEPTIDI OPPIOIDI
ENCEFALINE > storicamente furono scoperte per prime, ma sono le meno
potenti. Derivano dalla pre-encefalina e sono le protagoniste dell’analgesia
spinale endogena.
Altri effetti: analgesia centrale (stress), sedazione, tono timico.
ENDORFINE > “morfine endogene”, potenza media tra encefaline e dinorfine.
Derivano dalla POMC per spicing alternativo. Sono principalmente coinvolte
nell’analgesia centrale da stress (liberate insieme all’ACTH).
Altri effetti: catatonia, euforia, analgesia spinale (stimoli termo-nocicettivi).
DINORFINE > sono le più potenti. Hanno effetti a breve termine e se ne
studia l’uso come farmaco per l’assuefazione alla cocaina e come antidepressivo
(un’antagonista).
Effetti: analgesia spinale (stimoli meccano-nocicettivi) e centrale, disforia,
appetito.
FUNZIONI PERIFERICHE
prurito (liberazione HA mastocitica), immunosoppressione, inibizione motilità
uterina-urinaria-intestinale, vasodilatazione, soppressione della tosse.
NEUROPEPTIDI E NEURO-ORMONI
PEPTIDI OPPIOIDI
FUNZIONI CENTRALI
Analgesia
Tono timico
Vigilanza
Memoria > la dinorfina ha effetti amnesizzanti, mentre l’encefalina potenzia a
livello ippocampale il consolidamento degli engrammi. Il recettore NMDA
facilita l’attività dell’ultima e inibisce quella della dinorfina.
Piacere conscio (gratificazione) > modulazione via dopaminergica a livello
dell’accumbens
Piacere inconscio (liking) > agiscono direttamente su recettori oppioidi a livello
dell’accumbens > blocco interneuroni GABAergici
Comportamento alimentare (assunzione di zuccheri)
Comportamento sessuale (endorfine = “ormoni del piacere”)
Vomito
Secrezione neuroendocrina (PRL)
Miosi
Depressione respiratoria
DISTURBI MEDICI DI PROBABILE
EZIOLOGIA NEUROCHIMICA
•
•
•
•
•
•
•
•
•
M. DI PARKINSON: ↓ via nigrostriatale e altri nuclei pigmentati (rafe, locus ceruleus,
nuclei colinergici); ↑ interneuroni colinergici intrastriatali
M. DI HUNTINGTON: ↑ via nigrostriatale
M. DI ALZHEIMER: degenerazione vie colinergiche; neurotossicità glutamatergica
EPILESSIE: ↑ attività glutamatergica, ↓ attività GABAergica
CEFALEA: i farmaci antiemicranici funzionerebbero attivando il rilascio di 5HT
DISTURBI DEL SONNO: complesse interazioni tra catecolamine, Ach, 5HT, HA
TICS: possibile coinvolgimento 5HT?
ENCEFALOPATIA EPATICA: sintesi di falsi o deboli neurotrasmettitori
SINDROME SEROTONINERGICA DA CARCINOIDE: tossicità multi-organo
5HTergica
In molte malattie neuro-comportamentali si osserva disregolazione degli assi neuroendocrini.
DISTURBI MEDICI DI PROBABILE
EZIOLOGIA NEUROCHIMICA
• SCHIZOFRENIA: ↓ via mesocorticale e ↑ via mesolimbica; disfunzione
glutamatergica; complesse interazioni anche con 5HT, GABA, Ach,
endorfine
• DISTURBO BIPOLARE: ↓ NA e 5HT (depressione), ↑ NA e ↓ 5HT
(mania); ipoattività GABAergica (in entrambe); possibile coinvolgimento
Ach e glutamato
• DISTURBI D’ANSIA: ↓ NA, 5HT, GABA; possibile coinvolgimento
neuropeptidi (ADH)
• DISTURBI DEL COMPORTAMENTO ALIMENTARE: disfunzioni
neurochimiche/endocrine, soprattutto nella bulimia
NEUROCHIMICA DELLA DIPENDENZA
DA SOSTANZE D’ABUSO
Le dipendenze possono essere innate (es. acqua, cibo) o acquisite. Tra le
seconde troviamo dipendenze fisiologiche o patologiche e le dipendenze
terapeutiche (es. insulina nel DM1).
Alla neurobiologia della dipendenza interessano soprattutto le dipendenze
patologiche da sostanze psicoattive, che possono essere fisiche e/o
psichiche.
Due dei principali criteri per parlare di “dipendenza da sostanze” sono:
•TOLLERANZA > necessità di aumentare la quantità di sostanza assunta per
raggiungere l’effetto desiderato e/o calo dell’effetto desiderato per l’uso
continuato del medesimo dosaggio
•ASTINENZA > sviluppo di una sindrome caratteristica per ogni sostanza, a
seguito di marcata sospensione o riduzione della stessa
Queste caratteristiche denunciano una dipendenza FISICA e possono essere
attese nel caso delle dipendenze terapeutiche (es. beta-bloccanti); non sono
obbligatoriamente presenti in tutte le tossicodipendenze.
Si parla di ABUSO DI SOSTANZE quando vi sia presente un uso ripetitivo
delle stesse che può condurre a problemi di salute e psicosociali, con o senza
la presenza di astinenza o di assuefazione.
L’ASSUEFAZIONE (addiction) (tossicofilia) è una malattia bio-psico-sociale
caratterizzata dall’uso continuato di sostanze psicoattive, senza tener conto
dei possibili danni biologici, psicologici e sociali che ne derivano, e da
alterazioni neurochimiche documentate.
Denuncia la presenza di una dipendenza assolutamente patologica,
caratterizzata da comportamenti ripetitivi e compulsivi verso l’assunzione di
una determinata sostanza.
Due ne sono i punti cardine, che la differenziano dalle dipendenze
terapeutiche:
• Craving > desiderio incotrollabile per l’assunzione della sostanza; vi è
una base neurobiologica
• Drug-seeking behavior > i comportamenti intrappresi per la ricerca
della sostanza
Esempio: un paziente che assume morfina o metadone può aumentare la dose
per ottenere l’effetto desiderato, ma non si crea un bisogno psicopatologico
di dipendenza, anche perché non li usa a scopo ricreativo; l’eroinomane,
invece, presenta il craving.
CLASSIFICAZIONE DELLE
SOSTANZE D’ABUSO PSICOATTIVE
Non tutte le sostanze psicoattive si identificano nelle sostanze d’abuso, ad
esempio è difficile che ciò succeda con i neurolettici.
Non tutte le sostanze d’abuso sono psicoattive, com’ è il caso di parecchie
sostanze usate nel doping (es. steroidi sessuali, emopoietina).
Approccio Classificativo
•
DEPRESSORI DEL SNC
Esempi: Alcol, eroina, barbiturici, solventi (es. etere, cloroformio), BDZ
•
STIMOLANTI DEL SNC
Esempi: Cocaina, anfetamine dopaminomimetiche, nicotina, caffeina ed altre
xantine, sostanze inalanti (es. nitriti)
•
ALLUCINOGENI
Innumerevoli, tra cui: LSD, XTC, sostanze naturali (es. mescalina), dissociativi
(es. ketamina, PCD, destrometorfano), cannabis
Da notare che alcune classificazioni sono convenzionali, per comodità descrittiva
(es. XTC > “entattogeno” e sostanza con effetti overlap tra allucinogeno e
psicostimolante)
Caffeina + Nicotina + Alcol = “domestic drugs”
BASI NEUROBIOLOGICHE DELL’ASSUEFAZIONE
Il Circuito della Ricompensa
HT laterale + nuclei settali + amigdala + nucleo accumbens + corteccia limbica
frontale (ACC, OFC), uniti dal fascicolo proencefalico mediale che trasporta la
maggior parte delle vie monoaminergiche del tronco encefalico
• Come si sviluppano alcuni
comportamenti? Il ruolo
dei meccanismi della
“ricompensa”.
Per “ricompensa” si intende la
capacità del nostro cervello di
comprende che un’azione è
“positiva” perchè risponde a quanto
previsto o desiderato dall’individuo;
i collegamenti che servono a
“sintetizzare” questa azione
saranno resi più stabili insieme ad
una ricompensa di “piacere”.
Il contrario per azioni che non
rispondono al goal.
Quando la corteccia riceve ed elabora uno stimolo
sensoriale che potrebbe indicare una possibile
“ricompensa” manda un segnale ad un’area del mesencefalo
–area del tegmento ventrale- la cui attività aumenta.
L’area del tegmento
rilascia dopamina in varie
regioni cerebrali quali il
nucleo accumbens, il
nucleo del setto, l’amigdala
e la corteccia prefrontale.
Non tutte le “ricompense”
sono uguali
Lo zucchero cala nel sangue
Fame
Aumento lo zucchero nel sangue
a) Con una flebo di glucosata
b) Con un piatto i ravioli
La ricompensa dei ravioli non è quella della flebo
A volte la “ricompensa” è
difficile da intuire
Faccio un’azione come quella di “leggere”
L’azione è finalizzata ad imparare
Perché leggo ed imparo?
Perché mi piacerebbe vincere il premio Nobel l
Perché mi piace leggere Topolino e non siamo tutti
uguali
Quando il cervello ottiene una
ricompensa anche se non “attesa”
aumenta la scarica nella corteccia
prefrontale
Braver & Cohen 2000
La ricompensa
So di aver vinto
Ricevo la vincita
Quando si verifica una
discrepanza tra la
ricompensa che si
ottiene e quella che
avremmo atteso?
C’è l’errore!
Come si riconosce?
Quando avviene il riconoscimento dell’errore si
attivano moltissime aree cerebrali.
Potrebbe essere il funzionamento tipico se dobbiamo
apprendere dagli errori.
Il sistema ricompensariconoscimento dell’errore
si evolve.
Esagerata attivazione del nucleo accumbens negli
adolescenti. In contrasto l’estensione dell’attivazione
della corteccia frontale degli adolescenti sembra più
quella dei bambini che quella degli adulti.
BASI NEUROBIOLOGICHE DELL’ASSUEFAZIONE
Il nucleo accumbens (NAc) fa parte, insieme alle relative porzioni ventrali del
caudato e del putamen, dello STRIATO VENTRALE o LIMBICO.
Riceve la via dopaminergica mesolimbica e può essere funzionalmente
suddiviso in due parti:
•
•
Core: importante per funzioni somatomotorie
Shell: importante nell’acquisizione di comportamenti associati a stimoli
motivazionali rilevanti
Entrambi giocano un proprio ruolo nei comportamenti appresi e nel
condizionamento pavloviano.
Recentemente è stato scoperto che, mentre il NAc è importante negli stadi
iniziali di induzione della dipendenza, caudato e putamen sembrano
contribuire alla formazione dell’abitudine di assumere la sostanza > casual
versus habitual drug-use shift.
Tale processo è presumibilmente dovuto a fenomeni di plasticità a lungo
termine sequenziali e reciprochi.
BASI NEUROBIOLOGICHE DELL’ASSUEFAZIONE
Il potenziale di dipendenza/assuefazione di una sostanza d’abuso sembra
essere dovuto soprattutto, ma non esclusivamente, alla sua capacità di
modulare la trasmissione dopaminergica a livello del nucleo accumbens.
Infatti, alcune di queste sostanze non hanno un effetto diretto su tale
modulazione, ma possono interferire tramite altre vie neurochimiche, come il
GABA e la 5HT; di conseguenza, l’attivazione della via dopaminergica
mesolimbica rappresenta la via finale comune dell’assuefazione e non
necessariamente ne è l’evento iniziale.
Il circuito mesolimbico e le modificazioni neurochimiche che vi avvengono
ci spiega il correlato neurobiologico delle caratteristiche dell’assuefazione
(craving, drug-seeking behavior) ma NON gli effetti comportamentali
“tipici” di una determinata sostanza.
Esempio:
l’eroina blocca i neuroni GABAergici che proiettano al NAc, liberandone
l’attività > assuefazione
attiva i recettori oppioidi > effetti comportamentali: sedazione,
euforia (se si lega ai recettori mu), rash, prurito ecc
BASI NEUROBIOLOGICHE DELL’ASSUEFAZIONE
Corteccia insulare ed assuefazione alla nicotina
Damage to the Insula Disrupts Addiction to Cigarette Smoking
Nasir H. Naqvi et al, Science 26, January 2007
The results of this study suggest that the insula is a critical
neural substrate for the urge to smoke, although they do not
in themselves indicate why the insula, a region known to play a
role in the representation of the bodily states), would play
such an important role in urge. A clue may be provided by the
account of one patient in our sample who quit smoking
immediately after he suffered a stroke that damaged his left
insula. He stated that he quit because his "body forgot the
urge to smoke" . His experience suggests that the insula plays
a role in the feeling that smoking is a bodily need. Indeed,
much of the pleasure and satiety that is obtained from
smoking is derived from its bodily effects, in particular its
impact on the airway. In addition, nicotine withdrawal is
associated with changes in autonomic and endocrine function,
which may contribute to its unpleasantness. Current evidence
suggests that the insula plays a role in conscious feelings
by anticipating the bodily effects of emotional events. The
insula may therefore function in the conscious urge to
smoke by anticipating pleasure from the airway effects of
smoking and/or relief from the aversive autonomic effects
of nicotine withdrawal. Thus, damage to the insula could
lead a smoker to feel that his or her body has "forgotten"
the urge to smoke.
FUNZIONI DELLA NICOTINA NEL SNC
(Benowitz, 1996):
•
•
•
•
Migliora le prestazioni cognitive
Innalza il tono timico
Induce uno stato di benessere soggettivo
Riduce lo stress emotivo
T U T T A V I A
è la sostanza con il massimo potenziale di
assuefazione ↑ tasso di morbidità e di
mortalità per altre sostanze presenti nel
tabacco
Links: http://www.iuphar-db.org/GPCR/ReceptorFamiliesForward (tutto quello che volete sapere sui recettori)
http://www.tvo.org/TVOsites/WebObjects/TvoMicrosite.woa?bestlecturer (video-lezione sulle sostanze d’abuso)