MODULI
I concetti da trattare non sono solo quelli che si possono desumere dalle competenze, ma ce ne sono
molti funzionali al raggiungimento o alla messa in atto di tali competenze. Per es. i concetti di
elettronegatività e ottetto. Nelle programmazioni individuali tali concetti dovranno essere esplicitati.
Analogamente vi sono alcune competenze (soprattutto di “numeracy”) prerequisite, che dovranno
essere controllate e riesercitate frequentemente.
I moduli sono calibrati per una classe reale, come la terza dello scorso anno. Sfogliando i testi in
adozione si nota un gap notevole, specialmente nel livello di approfondimento teorico. I contenuti
del programma ufficiale sono molto più vicini a questa programmazione poiché in essi il livello di
approfondimento teorico (teorie quantistica, cinetica ecc.) è specificato solo in grandi linee. Questa
constatazione ci incoraggia a focalizzarci sulle competenze. In fase di programmazione didattica
dettagliata occorrerà tenere conto di questa divergenza nella scelta dei materiali di studio sui testi in
adozione.
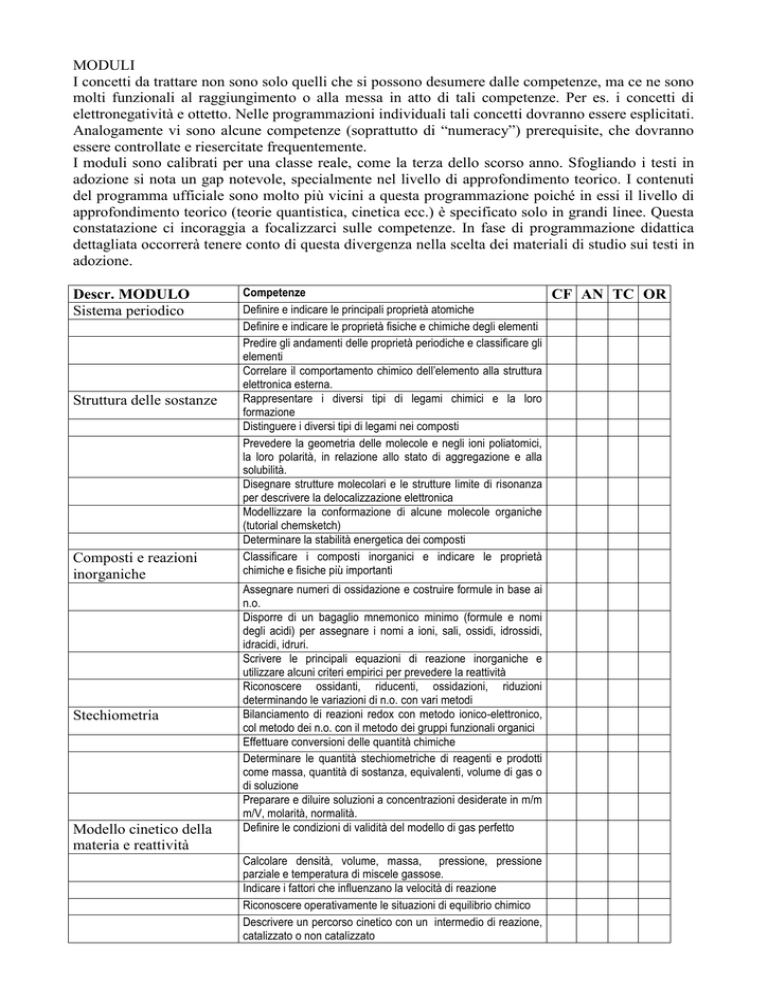
Descr. MODULO
Sistema periodico
Struttura delle sostanze
Composti e reazioni
inorganiche
Stechiometria
Modello cinetico della
materia e reattività
Competenze
Definire e indicare le principali proprietà atomiche
Definire e indicare le proprietà fisiche e chimiche degli elementi
Predire gli andamenti delle proprietà periodiche e classificare gli
elementi
Correlare il comportamento chimico dell’elemento alla struttura
elettronica esterna.
Rappresentare i diversi tipi di legami chimici e la loro
formazione
Distinguere i diversi tipi di legami nei composti
Prevedere la geometria delle molecole e negli ioni poliatomici,
la loro polarità, in relazione allo stato di aggregazione e alla
solubilità.
Disegnare strutture molecolari e le strutture limite di risonanza
per descrivere la delocalizzazione elettronica
Modellizzare la conformazione di alcune molecole organiche
(tutorial chemsketch)
Determinare la stabilità energetica dei composti
Classificare i composti inorganici e indicare le proprietà
chimiche e fisiche più importanti
Assegnare numeri di ossidazione e costruire formule in base ai
n.o.
Disporre di un bagaglio mnemonico minimo (formule e nomi
degli acidi) per assegnare i nomi a ioni, sali, ossidi, idrossidi,
idracidi, idruri.
Scrivere le principali equazioni di reazione inorganiche e
utilizzare alcuni criteri empirici per prevedere la reattività
Riconoscere ossidanti, riducenti, ossidazioni, riduzioni
determinando le variazioni di n.o. con vari metodi
Bilanciamento di reazioni redox con metodo ionico-elettronico,
col metodo dei n.o. con il metodo dei gruppi funzionali organici
Effettuare conversioni delle quantità chimiche
Determinare le quantità stechiometriche di reagenti e prodotti
come massa, quantità di sostanza, equivalenti, volume di gas o
di soluzione
Preparare e diluire soluzioni a concentrazioni desiderate in m/m
m/V, molarità, normalità.
Definire le condizioni di validità del modello di gas perfetto
Calcolare densità, volume, massa, pressione, pressione
parziale e temperatura di miscele gassose.
Indicare i fattori che influenzano la velocità di reazione
Riconoscere operativamente le situazioni di equilibrio chimico
Descrivere un percorso cinetico con un intermedio di reazione,
catalizzato o non catalizzato
CF AN TC OR
Equilibri acido-base e
analisi quantitativa
Equilibri di
complessazione e analisi
qualitativa
Descrivere matematicamente le situazioni di equilibrio chimico
e i fattori che ne influenzano la posizione
Determinare le condizioni di precipitazione/dissoluzione dei
composti ionici poco solubili
Scrivere le equazioni di ionizzazione all’equilibrio in acqua degli
elettroliti forti e deboli
Determinare la concentrazione dello ione idronio e il pH di
soluzioni di elettroliti
Stabilire se una determinata reazione è utilizzabile per
un’analisi quantitativa
Determinare gli equivalenti, il volume e le normalità delle
soluzioni impegnate nelle titolazioni volumetriche
Scegliere gli idonei indicatori per le titolazioni acido-base
Standardizzare soluzioni da usare per volumetriche in lab.
Utilizzare leganti per formare complessi colorati e per
mascherare ioni.
Utilizzare alcuni reattivi noti e non tossici (complessati,
precipitanti, ossidanti o riducenti, acidi e basi) per individuare
procedure atte a identificare qualitativamente alcuni anioni e
cationi.
Tecniche di base per
l’utilizzo della
strumentazione e
materiale del lab di
analisi
Grandezze e misure
Foglio elettronico
Elaboratore di testi
Inglese chimico e ricerca
di informazioni in
internet, banche dati
chimica
Utilizzo dell’ambiente
collaborativo per
produzioni,
cooperazione,
tutoraggio allo studio
Distinguere e indicare le grandezze e le unità di misura S.I. e
derivate rilevanti per la chimica
Convertire in multipli e sottomultipli, con prefissi e in notazione
esponenziale
Leggere e utilizzare strumenti di misura del alb di chimica
Esprimere le misure ed esprimere il risultato di calcoli con il
corretto numero di cifre significative, anche in notazione
esponenziale.
Indicare i parametri statistici fondamentali di una serie di misure
(monovariata)












