Chimica Biologica
A.A. 2010-2011
Destino anaerobico del
piruvato: fermentazione
Marco Nardini
Dipartimento di Scienze Biomolecolari e Biotecnologie
Università di Milano
Macromolecole Biologiche
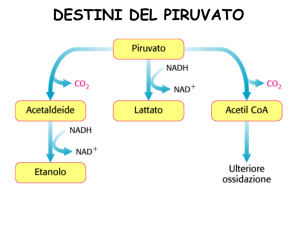
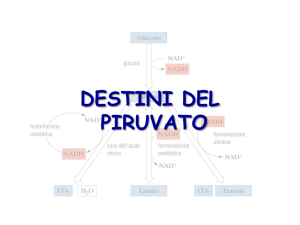
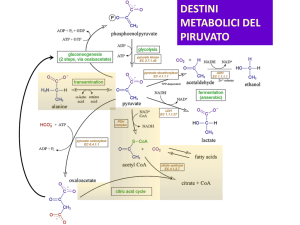
Destino anaerobico del piruvato
Destino anaerobico del piruvato
- il piruvato deve essere convertito in un prodotto finale ridotto per
riossidare il NADH prodotto da GAPDH
1) nel muscolo e nei batteri lattici:
fermentazione omolattica
⇒ piruvato ridotto a lattato
con rigenerazione di NAD+
2) nel lievito:
fermentazione alcolica
⇒ piruvato decarbossilato a CO2
ed acetaldeide, ridotta ad etanolo
con rigenerazione di NAD+
Macromolecole Biologiche
Destino anaerobico del piruvato
Fermentazione omolattica
- nei batteri lattici e nel muscolo dei vertebrati
esiste l’enzima lattato deidrogenasi
- la reazione catalizzata avviene in condizioni
vicine all’equilibrio
- la reazione catalizzata dall’enzima consiste
nel trasferimento di uno ione idruro (H:-) dal
NADH al C2 (carbonile) del piruvato
- NAD e NADP scambiano sempre coppie di
e- associate a un protone nella forma di ione
idruro (H:-)
Macromolecole Biologiche
Destino anaerobico del piruvato
Lattato deidrogenasi (LDH)
meccanismo:
- trasferimento stereospecifico di uno
ione idruro dal C4 del NADH al C2
del piruvato
- concomitante trasferimento di un
protone dall’imidazolo di His195
- His195 e Arg171 orientano il substrato
(piruvato o lattato nella reaz. inversa)
elettrostaticamente
- il lattato può essere riconvertito in piruvato
o esportato fuori dalla cellula
(trasportato dal sangue nel fegato ed utilizzato per la sintesi del glucosio
⇒ via metabolica della gluconeogenesi)
Destino anaerobico del piruvato
Macromolecole Biologiche
Fermentazione omolattica
- nel muscolo, durante una intensa attività fisica, quando la domanda di
ATP è elevata ed il rifornimento di O2 è scarso, l’ATP è largamente
sintetizzato attraverso la glicolisi anaerobica che genera ATP più
rapidamente rispetto alla fosforilazione ossidativa, che è più lenta e
richiede O2
- glicolisi:
glucosio + 2 NAD+ + 2 ADP + 2 Pi → 2 piruvato + 2 NADH + 2 ATP + 2 H2O + 2 H+
- fermentazione omolattica:
piruvato + NADH + H+ → lattato + NAD+
glucosio + 2 ADP + 2 Pi → 2 lattato + 2 ATP + 2 H2O
Macromolecole Biologiche
Destino anaerobico del piruvato
Fermentazione alcolica
reazione (nel lievito): conversione del piruvato in etanolo e CO2
1) piruvato decarbossilasi: decarbossilazione del piruvato a formare
acetaldeide e CO2
(enzima non presente negli animali)
2) alcol deidrogenasi: riduzione dell’acetaldeide in etanolo con
ossidazione del NADH a NAD+ (necessaria per la
reazione glicolitica della GAPDH)
Destino anaerobico del piruvato
Macromolecole Biologiche
1) piruvato decarbossilasi
⇒ decarbossilazione del piruvato a formare acetaldeide e CO2
- l’enzima contiene il coenzima tiamina pirifosfato (TPP) legato in modo
non covalente
- TPP agisce come “trappola di elettroni” che stabilizza (delocalizzandolo)
l’accumulo di carica negativa che si genera sul carbonio carbonilico dello
stato di transizione durante la decarbossilazione di un α-chetoacido
(piruvato)
- decarbossilazione di un α-chetoacido:
lo stato di transizione è molto instabile
perché si ha accumulo di carica negativa
sul carbonio carbonilico
stabilizzazione mediante
delocalizzazione della carica negativa
(“trappola per gli elettroni”)
stato di transizione
instabile
Macromolecole Biologiche
Destino anaerobico del piruvato
1) piruvato decarbossilasi
TPP
- atomo di H del C2 è acido per la vicinanza di N quaternario (+) che
stabilizza elettrostaticamente il carbanione formato dalla dissociazione
di H
ylid: carbanione dipolare (forma attiva di TPP)
Macromolecole Biologiche
Destino anaerobico del piruvato
1) piruvato decarbossilasi
TPP
- la tiamina si addiziona ai gruppi carbonilici e, fungendo da serbatoio
per gli elettroni, favorisce la decarbossilazione degli α-chetoacidi
- la tiamina è un coenzima che mette in atto meccanismi di catalisi
covalente su substrati carbonilici
- la tiamina è il coenzima più utilizzato nelle reazioni di decarbossilazione
degli α-chetoacidi
Destino anaerobico del piruvato
Macromolecole Biologiche
1) piruvato decarbossilasi
- rilascio dell’acetaldeide
- eliminazione di TPP ylid
- rigenerazione enzima attivo
attacco nucleofilico di
ylid al C carbonilico del
piruvato
rilascio di CO2 per dare
un carbanione stabilizzato
per risonanza
protonazione
del carbanione
anello tiazolico come trappola di elettroni
Destino anaerobico del piruvato
Macromolecole Biologiche
1) piruvato decarbossilasi
beriberi: (debolezza in cingalese)
- condizione letale dovuta a deficienza di tiamina (vitamina B1)
- disturbi neurologici, dolori, paralisi ed atrofia delle gambe, danni
cardiaci, formazione di edemi (accumulo di fluidi nei tessuti)
- la tiamina non viene né sintetizzata né accumulata nei tessuti dei
vertebrati, ma introdotta con la dieta
- diffuso in Asia (in passato in zone dove si puliva il riso rimuovendo lo
strato esterno più duro ma ad alto contenuto di tiamina)
Macromolecole Biologiche
Destino anaerobico del piruvato
2) alcol deidrogenasi di lievito (YADH)
⇒ conversione di acetaldeide in etanolo
- YADH è un tetramero: ogni subunità
lega uno ione Zn2+
- trasferimento stereospecifico di un atomo di H
dal NADH all’acetaldeide (trasferisce solo Hpro-R)
- Zn2+ polarizza il gruppo carbonilico dell’acetaldeide
e stabilizza la carica negativa dello stato di
transizione
Macromolecole Biologiche
Destino anaerobico del piruvato
2) alcol deidrogenasi del fegato (LADH)
- anche il fegato dei mammiferi contiene una alcol deidrogenasi
- LADH (liver alcohol deidrogenasi) da mammifero è un dimero e contiene
un secondo ione zinco con probabile ruolo strutturale
- LADH e YADH hanno una significante similarità in sequenza
- LADH metabolizza anaerobicamente gli alcoli prodotti per
fermentazione dalla flora intestinale e quelli assunti con le bevande
alcooliche
- la direzione della reazione dipende dalle concentrazioni di etanolo e
gliceraldeide
Destino anaerobico del piruvato
Macromolecole Biologiche
Energetica della Fermentazione
1) fermentazione omolattica
piruvato ridotto a lattato con rigenerazione di NAD+
glucosio → 2 lattato
ΔG°’= -196 kJ/mole
2) fermentazione alcolica
piruvato decarbossilato a CO2 ed acetaldeide, ridotta ad etanolo
con rigenerazione di NAD+
glucosio + 2 H+ → 2 etanolo + 2 CO2
ΔG°’= -235 kJ/mole
- le reazioni sono accoppiate alla sintesi di 2 ATP
ΔG°’= 2 x (+30.5 kJ/mole) = +61 kJ/mole
efficienza: (1) 61/196 = 31%
(2) 61/235 = 26%
il resto dell’energia libera viene dissipata
in calore rendendo il processo irreversibile
Macromolecole Biologiche
Destino anaerobico del piruvato
Efficienza della Fermentazione omolattica (alcolica)
- il 31% (26%) dell’energia libera rilasciata in condizioni biochimiche
standard durante il processo viene recuperata sotto forma di ATP
- in condizioni fisiologiche ([reagenti] e [prodotti] ≠ condiz. standard)
efficienza >50%
- la fermentazione anaerobica utilizza il glucosio in modo inefficiente (2
ATP per glucosio) se paragonata alla fosforilazione ossidativa (fino a
32 ATP per glucosio)
- la velocità di produzione di ATP in condizioni anaerobiche è fino a
100 volte maggiore rispetto quella della fosforilazione ossidativa
- tessuti come il muscolo (in condizioni di rapido consumo di ATP) lo
rigenerano quasi totalmente mediante la glicolisi anaerobica (nella
fermentazione omolattica il lattosio viene riconvertito in glucosio nel
fegato)
Macromolecole Biologiche
Destino anaerobico del piruvato
Produzione glicolitica di ATP nel muscolo
- fibre a contrazione lenta (fibre “rosse”, eme citocromo dei mitocondri)
ricche di mitocondri ⇒ ATP quasi tutto da fosforilazione ossidativa
- fibre a contrazione veloce (fibre “bianche”)
quasi prive di mitocondri, dove avviene la fosforilazione ossidativa
⇒ ATP quasi tutto da glicolisi anaerobica
Esempio:
uccelli migratori ⇒ petto fibre rosse a contrazione lenta
uccelli da cortile ⇒ petto fibre bianche a contrazione veloce