PROGETTO HUMUS
L’INQUINAMENTO RADIOATTIVO–STRUTTURA DELLA MATERIA
3. LA STRUTTURA DELLA MATERIA
La struttura dell'atomo
L'atomo è la più piccola parte della materia che conserva le proprietà
chimiche di un elemento; è composto da un nucleo centrale, circondato
da elettroni che orbitano attorno ad esso.
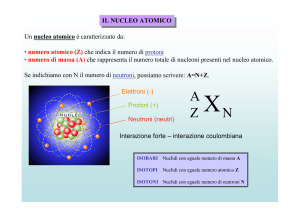
Il nucleo
Elettricamente positivo, presenta densità molto elevata infatti, pur
occupando solo la centomillesima parte circa del volume dell'atomo, ne
costituisce la quasi totalità della massa.
Il nucleo è composto da particelle, chiamate nucleoni, che si
suddividono in protoni e neutroni.
Il protone (p + ) possiede una massa circa 1836 volte maggiore di quella
dell'elettrone e carica elettrica positiva unitaria, uguale a quella di un
elettrone ma di segno opposto.
Il neutrone (n°) possiede massa circa 1838 volte maggiore di quella
dell'elettrone e non possiede carica elettrica.
Il numero di nucleoni definisce il numero di massa (A), che è la somma
del numero dei neutroni (N) e del numero di protoni (Z), detto anche
numero atomico. Vale quindi la relazione:
A = Z + N
Il neutrino e l'antineutrino sono due particelle di massa prossima allo
zero e carica elettrica neutra. Non possono essere considerati dei
costituenti del nucleo ma vengono emessi da questo in corso di vari
processi radioattivi.
I numeri quantici
I nucleoni si caratterizzano dal punto di vista energetico mediante
quattro numeri quantici:
n
numero quantico principale che determina l'energia del
nucleone nell'orbita
l
numero quantico azimutale che caratterizza la forma
dell'orbita
j
numero quantico che esprima la direzione di rotazione del
nucleone sul suo asse (spin)
m
numero quantico magnetico in relazione con l'orientazione
dell'orbita nello spazio
Pagina 1 di 8
PROGETTO HUMUS
L’INQUINAMENTO RADIOATTIVO–STRUTTURA DELLA MATERIA
Per il principio di esclusione di Pauli su ogni orbita nucleare permessa non possono
muoversi insieme più di un protone e di un neutrone.
Il legame nucleare
La forza che mantiene unite le particelle nucleari è la forza nucleare.
Essa, agendo entro distanze paragonabili alla dimensione del nucleo,
prevale sulla forza elettrica che provocherebbe la repulsione tra i
protoni, elettricamente positivi.
Al crescere della massa atomica aumentano le distanze tra i protoni che
iniziano a sentire l'effetto della repulsione elettrostatica. Pertanto, per la
stabilità nucleare è necessaria una prevalenza di neutroni rispetto ai
protoni.
L'energia di legame necessaria alla coesione dei nucleoni proviene dalla
trasformazione di parte della massa di questi ultimi e corrisponde alla
differenza fra la massa che hanno quando sono legati tra loro e la somma
delle masse che avrebbero se non fossero legati. Tale massa mancante è
trasformata in energia di legame secondo la relazione di equivalenza
massa-energia, scoperta da Einstein
E=mc 2
dalla quale deriva che una unità di massa atomica (amu), pari ad un
dodicesimo della massa arbitraria assegnata al 1 2 C, corrisponde a 931
MeV di energia.
Nuclidi
In generale, mentre per la distinzione di una specie chimica da un'altra
si è soliti usare una simbologia che si riferisce solamente all'elemento
chimico X, per individuare una specie fisica (nucleare), ossia un nuclide,
si usa la notazione:
dove in alto a sinistra dell'elemento chimico X compare il numero di
massa A e in basso il numero atomico Z. Ad esempio:
è un nuclide dell'ossigeno (O indica il simbolo dell' elemento chimico
considerato).
Isotopi, isobari, isotoni e isomeri
In base ad A, Z e N i nuclidi possono classificarsi in isotopi, isobari,
Pagina 2 di 8
PROGETTO HUMUS
L’INQUINAMENTO RADIOATTIVO–STRUTTURA DELLA MATERIA
isotoni e isomeri:
Differenze tra isotopi, isobari, isotoni e isomeri
Numero atomico Numero di massa Numero di neutroni Proprietà chimiche
Isotopi
Uguale
Diverso
Diverso
Uguale
Isobari
Diverso
Uguale
Diverso
Diverso
Isotoni
Diverso
Diverso
Uguale
Diverso
Isomeri
Uguale
Uguale
Uguale
Uguale
Isotopi
Sono isotopi due o più forme di uno stesso elemento, che presentano
quindi lo stesso numero atomico Z, con diverso numero di massa A; in
altre parole, hanno lo stesso numero di protoni, ma diverso numero di
neutroni. Tra loro gli isotopi presentano le stesse caratteristiche
chimiche, e possono essere fisicamente stabili (ossia non radioattivi) o
instabili (radioattivi).
Ad esempio, gli isotopi dell'idrogeno sono:
l'idrogeno comune (
abbondante in natura;
) che ha solo un protone (A=Z=1) ed è il più
il deuterio (
) che ha un protone (Z=1) ed 1 neutrone (A=2) ed è
presente in natura anche se raro (lo 0.8% dell'idrogeno naturale);
) che ha un protone (Z=1) e 2 neutroni (A=3), esiste
il trizio (
solo perché prodotto artificialmente ed è fisicamente instabile.
La Medicina Nucleare sfrutta le proprietà dei radioisotopi, a scopo
diagnostico, terapeutico e di ricerca.
Isobari
Sono isobari elementi differenti (diverso Z) che presentano lo stesso
peso atomico (uguale A). In altre parole presentano lo stesso numero di
nucleoni, ma diverso numero di protoni e diverse caratteristiche
chimiche. Non trovano impiego in Medicina Nucleare.
Isotoni
Sono isotoni elementi differenti (diverso Z) che presentano lo stesso
numero di neutroni (diverso A). Differiscono dunque anche per le
caratteristiche chimiche. Non trovano impiego in Medicina Nucleare.
Pagina 3 di 8
PROGETTO HUMUS
L’INQUINAMENTO RADIOATTIVO–STRUTTURA DELLA MATERIA
Isomeri
Sono forme di uno stesso elemento, identiche nella composizione
nucleare (Z e A uguali), che si differenziano per lo stato di eccitazione
del nucleo. Alcuni elementi, infatti, rimangono in stato eccitato per un
tempo misurabile (da 1E-12 secondi fino ad alcune ore) prima di
decadere ad un livello energetico inferiore attraverso un'emissione di
fotoni gamma per transizione isomerica. Tale condizione è detta "stato
metastabile".
Normalmente, infatti, un nucleo che si trova ad un livello energetico
superiore (in stato eccitato) libera l'energia in eccesso, sotto forma di
radiazione gamma, riportandosi al livello energetico più basso in un
tempo inferiore a 1E-13 secondi.
Esempio di isomero è il Tecnezio 99 metastabile ( 9 9 m Tc), di fondamentale
importanza in medicina nucleare.
Gli elettroni
Sono particelle extranucleari che orbitano ad alta velocità attorno al
nucleo.
Possiedono massa costante di 0.000549 amu e carica elettrica negativa
unitaria.
Gli elettroni si caratterizzano dal punto di vista energetico mediante
quattro numeri quantici:
n
numero quantico principale che determina l'energia
dell'elettrone nell'orbita
L
numero quantico azimutale che caratterizza la forma
dell'orbita
M
numero quantico magnetico che caratterizza l'orientazione
dell'orbita nello spazio
S
numero quantico che esprime la direzione di rotazione
dell'elettrone sul suo asse (spin)
Per il principio di esclusone di Pauli non possono esistere nello stesso
atomo due o più elettroni con gli stessi numeri quantici, ossia nello
stesso stato energetico. Da ciò deriva che ogni orbitale può essere
occupato al massimo da due elettroni con spin opposto.
Pagina 4 di 8
PROGETTO HUMUS
L’INQUINAMENTO RADIOATTIVO–STRUTTURA DELLA MATERIA
Il legame elettronico
Nella configurazione energetica più stabile gli elettroni orbitano attorno
al nucleo occupando le orbite più interne che sono a più basso contenuto
di energia.
L'energia che lega gli elettroni al nucleo è maggiore per quelli che
occupano le orbite più vicine rispetto a quelli più periferici; inoltre, a
parità di orbita, è maggiore per gli elementi con alto Z che hanno una
carica nucleare positiva maggiore. Tale energia di legame è uguale
all'energia necessaria per rimuovere completamente l'elettrone
dall'atomo.
Gli elettroni possono spostarsi verso orbite più periferiche o addirittura
abbandonare l'atomo se viene loro ceduta energia. Quando ciò accade
l'equilibrio energetico perturbato viene ripristinato per mezzo dello
spostamento degli elettroni da orbite a più alto contenuto di energia
verso le orbite a più basso contenuto di energia e la liberazione
dell'energia in eccesso sotto forma di radiazione elettromagnetica
denominata raggi X.
Tabella riassuntiva delle caratteristiche delle
particelle fondamentali
Massa
relativa
Kg
amu
Elettrone -1
1
9.1*
10 - 3 1
0.000549
Protone
1836
1.673*
10 - 2 7
1.007277
1838
1.675*
10 - 2 7
1.008665
Particella
Carica
+1
Neutrone 0
Il decadimento radioattivo
In natura esistono circa 1300 nuclidi diversi a fronte di circa un centinaio
di elementi chimici. Tali nuclidi si possono ottenere combinando i
possibili valori di Z (da 1 a 102) con i possibili valori di A (da 1 a 260).
L’80% di questi nuclidi ha una composizione nucleare che li rende
energeticamente
instabili.
Tali
specie
nucleari
sono
chiamati
radionuclidi e si portano in condizione di stabilità energetica attraverso
l'emissione di radiazione corpuscolare o elettromagnetica.
Il decadimento radioattivo o disintegrazione è quindi il processo di
trasformazione, con liberazione di energia nucleare, di un radionuclide
padre, in un nuclide figlio, il quale può essere a sua volta stabile o
instabile. Se il figlio è stabile, il processo di decadimento è terminato.
Se anche il figlio è instabile, inizia un nuovo processo di decadimento
che può essere differente rispetto a quello del suo predecessore.
Pagina 5 di 8
PROGETTO HUMUS
L’INQUINAMENTO RADIOATTIVO–STRUTTURA DELLA MATERIA
Emivita fisica (T 1 / 2 )
Il tempo che trascorre affinché un nucleo instabile decada è soggetto ad
una legge probabilistica e caratteristico per ogni radionuclide. Si
definisce emivita o tempo di dimezzamento il tempo che deve
trascorrere affinchè la metà dei nuclei di un dato radionuclide vada
incontro a decadimento. Tale tempo può variare tra le frazioni di
secondo a milioni di anni.
Il decadimento di un radionuclide può essere espresso dalla funzione:
N(t)=N 0 e - λ t dove:
N(t) = numero degli atomi al tempo t
N 0 =numero degli atomi al tempo zero
λ=costante di decadimento che equivale circa al 70% dell’emivita
I decadimenti α, β e γ
Decadimento alfa
La particella alfa è un nucleo di elio (costituito da 2 protoni e da 2
neutroni) e presenta doppia carica elettrica positiva. Origina dal
decadimento di atomi pesanti che si trasformano in elementi più leggeri
attraverso la perdita di 4 nucleoni (e due cariche positive). Il radio
(Ra), ad esempio, si trasforma in radon (Rn):
226
8 8 Ra
⇒
222
8 6 Rn
+ α
Il percorso di una particella alfa, a parità di energia cinetica, è molto
più breve di quello di radiazioni con massa minore. La radiazione alfa
presenta quindi basso range di azione ma alta densità di
ionizzazione. In aria il range medio di una particella alfa non supera i
4-5 cm, riducendosi drasticamente con l'aumentare della densità del
mezzo, tanto che la radiazione alfa non riesce ad attraversare una
barriera come la pelle.
Decadimento beta
Una particella beta è un elettrone ad alta velocità che fuoriesce da un
nucleo in disintegrazione.
Quando il nucleo è instabile per eccesso di neutroni, un neutrone in
eccesso si trasforma in protone secodo la formula:
n = p + + e - (+ antineutrino)
Essendo molto più piccole e elettricamente meno cariche delle particelle
alfa, le particelle beta hanno una più bassa densità di ionizzazione e
Pagina 6 di 8
PROGETTO HUMUS
L’INQUINAMENTO RADIOATTIVO–STRUTTURA DELLA MATERIA
potere penetrante circa 1000 volte quello di una particella alfa di
pari energia. Il range medio di una particella beta può arrivare fino ad
alcuni metri in aria e fino ad alcuni millimetri nei tessuti molli.
Fotoni X e Gamma
Derivano dalla diseccitazione energetica di nuclei instabili che liberano
l'energia in eccesso sotto forma di radiazioni gamma.
I fotoni gamma
(come i fotoni X) sono radiazioni elettromagnetiche: non hanno massa
né carica e viaggiano alla velocità della luce (300000 km/sec). L'unica
differenza tra i fotoni gamma e i fotoni X è la loro origine: i gamma
sono prodotti a seguito di riequilibri energetici del nucleo, mentre gli X
originano da riequilibri energetici del mantello elettronico dell'atomo.
I fotoni viaggiano nello spazio (anche vuoto) sotto forma di onde
elettromagnetiche che sono la propagazione sinusoidale delle intensità
dei campi elettrico e magnetico e che possiedono tre caratteristiche:
lunghezza d'onda λ, frequenza ν (cicli/sec o Hertz) e velocità c (la
velocità della luce nel vuoto è pari a 300000 km/sec ). Lunghezza
d'onda e frequenza sono tra loro inversamente proporzionali, secondo la
formula: ν=c/λ.
L'energia E dei fotoni è direttamente proporzionale alla loro
frequenza, secondo la formula: E=h ν, dove h è la costante di Plank pari
a 6.6 x 10 - 3 4 J*s.
I fotoni X e gamma trasferiscono la loro energia alla materia che
attraversano, per mezzo di complesse interazioni con i nuclei e gli
elettroni atomici. Alcune di queste interazioni provocano la fuoriuscita di
un elettrone orbitale da un atomo, con conseguente ionizzazione, o la
creazione di una coppia elettrone-positrone. A loro volta, questi
elettroni producono ionizzazione del mezzo. Il fenomeno della
ionizzazione è alla base del meccanismo per il quale le radiazioni
ionizzanti producono effetti biologici.
Serie radioattive
Quando l'uranio 238 decade emettendo una particella alfa, si forma il torio 234 che a
sua volta decade con emissione di una particella beta, e forma protattinio 234. Il
protattinio 234 emette una particella beta e si trasforma in un nuovo isotopo
dell'uranio, con numero di massa 234. Quest'ultimo decade per emissione alfa e forma
il torio 230, che a sua volta decade per emissione alfa formando il radio 226.
Come mostrato in figura, questa serie radioattiva, chiamata serie dell'uranio,
prosegue in modo analogo e attraverso ulteriori cinque emissioni alfa e quattro
emissioni beta arriva al prodotto finale, un isotopo non radioattivo (stabile) del
piombo con numero atomico 82 e numero di massa 206. Ogni elemento della tavola
periodica tra l'uranio e il piombo è rappresentato in questa serie e ogni nuclide è
distinguibile per il suo caratteristico periodo di dimezzamento. I membri della serie
hanno tutti una caratteristica comune: i loro numeri di massa possono essere espressi
dalla semplice formula 4n + 2, dove n è un numero intero.
Pagina 7 di 8
PROGETTO HUMUS
L’INQUINAMENTO RADIOATTIVO–STRUTTURA DELLA MATERIA
.
Un'altra serie naturale è quella del torio, detta serie 4n perché i numeri di massa di
tutti i suoi membri sono esattamente divisibili per 4; vi è poi quella dell'attinio, o
serie 4n + 3. Il capostipite della serie del torio è l'isotopo torio 232 e il suo elemento
finale è l'isotopo stabile piombo 208. La serie dell'attinio comincia invece con l'uranio
235 (chiamato attinuranio dai primi ricercatori) e si conclude col piombo 207.
Una quarta serie, la serie 4n+ 1, nella quale tutti i membri sono radioisotopi
artificiali, è stata scoperta in anni recenti; il termine iniziale è l'isotopo curio 241 e
l'elemento finale è il bismuto 209.
Pagina 8 di 8