ANNO ACCADEMICO 2008-2009
Facoltà di Scienze Matematiche, Fisiche e Naturali
Corso di Laurea in Fisica
Tesi di Laurea
Dinamica di reti neuronali
Candidato:
Simona Olmi
Relatore:
Correlatore:
prof. Roberto Livi
dott. Alessandro Torcini
28 luglio 2009
Indice
1 Elementi di neurofisiologia
1
1.1 I neuroni . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
1
1.2 I segnali neuronali ed il potenziale di azione . . . . . . . . . . . . . .
3
1.3 Le sinapsi . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . .
4
1.4 Introduzione alla dinamica neuronale . . . . . . . . . . . . . . . . . .
5
1.5 La membrana cellulare del neurone . . . . . . . . . . . . . . . . . . .
7
1.6 Canali ionici e correnti ioniche . . . . . . . . . . . . . . . . . . . . . .
9
1.7 Origine del potenziale di riposo . . . . . . . . . . . . . . . . . . . . . 11
1.7.1
Un modello cellulare semplificato . . . . . . . . . . . . . . . . 11
1.7.2
L’equazione di Nerst . . . . . . . . . . . . . . . . . . . . . . . 12
1.7.3
Effetto del sodio e pompe ioniche . . . . . . . . . . . . . . . . 13
1.7.4
Effetto della permeabilità ionica e dei meccanismi di trasporto 14
1.8 Proprietà elettriche passive della membrana . . . . . . . . . . . . . . 16
2 Modelli semplificati di neuroni e reti neurali
19
2.1 Dal modello di Hodgkin-Huxley al modello leaky integrate and fire . . 20
2.2 Neuroni leaky integrate-and-fire . . . . . . . . . . . . . . . . . . . . . 25
2.2.1
Correnti sinaptiche . . . . . . . . . . . . . . . . . . . . . . . . 28
2.2.2
Adattamento del tasso di sparo e refrattarietà . . . . . . . . . 30
I
2.3 Reti neurali . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 32
2.3.1
Rete di neuroni LIF globalmente accoppiati: il modello . . . . 34
2.3.2
Mappa guidata dall’evento . . . . . . . . . . . . . . . . . . . . 37
2.3.3
Stabilità lineare . . . . . . . . . . . . . . . . . . . . . . . . . . 39
2.4 Impulso di durata finita . . . . . . . . . . . . . . . . . . . . . . . . . 41
2.4.1
Lunghezze d’onda grandi . . . . . . . . . . . . . . . . . . . . . 43
2.4.2
Lunghezze d’onda piccole . . . . . . . . . . . . . . . . . . . . . 44
2.4.3
Diagramma di fase e correzioni di taglia finita . . . . . . . . . 44
2.4.4
Altri stati collettivi della rete . . . . . . . . . . . . . . . . . . 47
2.5 Desincronizzazione in reti neurali diluite . . . . . . . . . . . . . . . . 50
Capitolo 1
Elementi di neurofisiologia
In questo capitolo introdurremo alcuni concetti basilari relativi alla neurofisiologia
del neurone. In particolare, dopo una breve descrizione della morfologia del neurone e delle sinapsi, analizzeremo quei particolari segnali elettrici emessi durante la
dinamica neuronale chiamati potenziali di azione i quali rappresentano l’unità elementare di informazione scambiabile fra i neuroni. Inoltre descriveremo in dettaglio
le caratteristiche della membrana cellulare, sia a riposo che eccitata, con particolare
attenzione alle sue proprietà elettriche.
1.1
I neuroni
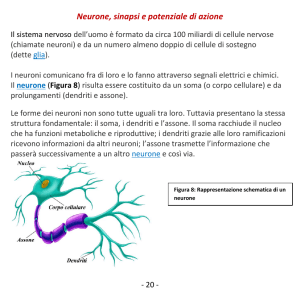
I neuroni sono cellule del sistema nervoso altamente specializzate e dedicate al
trasferimento, immagazzinamento ed elaborazione delle informazioni. Tale elaborazione avviene attraverso segnali elettrici dovuti a differenze di potenziale associate
a correnti elettriche di natura ionica (essenzialmente sono rilevanti solo gli ioni sodio, potassio, calcio e cloro) che attraversano la membrana cellulare del neurone.
I neuroni sono in numero molto elevato e sono connessi fra di loro in modo molto
intricato (vedi fig.1.1): ad esempio nella corteccia cerebrale si ha una densità superiore a 104 neuroni/mm3 . Tipicamente, pur nella varietà di tipi di cellule neuronali
(neuroni della corteccia cerebrale, motoneuroni del midollo spinale, ecc.), possiamo
riconoscere tre parti morfologicamente e funzionalmente distinte: il corpo cellulare
o soma; i dendriti e gli assoni. Il soma ha una struttura compatta che risulta approssimativamente sferica (di circa 70 µm di diametro) ed è sostanzialmente l’unità
deputata all’elaborazione dell’informazione. I dendriti sono estensioni del soma con
una struttura molto ramificata che si estendono per distanze che possono raggiungere il millimetro ed hanno la funzione di raccogliere i segnali provenienti dagli altri
neuroni e trasmetterli al soma. Gli assoni sono lunghe protuberanze (anche oltre
un metro nei neuroni motori degli organismi animali superiori) che si proiettano dal
soma e la loro funzione consiste nella trasmissione del segnale generato dal soma
verso i dendriti di un’altro neurone. Usando la terminologia dei circuiti elettronici si
può quindi dire che i dendriti rappresentano il dispositivo di ingresso (”input”), gli
assoni il dispositivo di uscita (”output”) e il soma l’unità di elaborazione delle informazioni. La morfologia di un particolare tipo di neurone nonché la sua posizione
nella rete neuronale forniscono indizi sulla funzione espletata: ad esempio il livello
di arborizzazione fornisce un’idea del numero di connessioni che può ricevere e verso
quante altre cellule neuronali invii i propri segnali (vedi fig.1.2).
Figura 1.1. Neuroni della corteccia dei mammiferi osservati al microscopio. Possiamo distinguere neuroni con corpi cellulari triangolari e circolari: la cellula b è
un classico esempio di cellula piramidale con corpo triangolare [10].
Figura 1.2.
Forme e dimensioni dei neuroni [11].
1.2
I segnali neuronali ed il potenziale di azione
Si definisce potenziale di membrana la differenza di potenziale misurata ai capi di
due elettrodi, uno posto all’interno della cellula neuronale ed uno posto nel liquido
extracellulare circostante. Quando si parla di segnale neuronale ci si riferisce alla
variazione temporale e spaziale del potenziale di membrana. Quando il neurone è
a riposo, ossia non è in qualche modo eccitato dall’esterno (e chiariremo nel seguito
cosa si intende), il potenziale di membrana assume un valore caratteristico denominato potenziale di riposo, tipicamente dell’ordine di -65mV, ossia l’interno della
cellula si trova ad un potenziale inferiore rispetto all’esterno.
I potenziali di azione sono impulsi di tensione tipici generati durante la dinamica
neuronale; essi hanno una forma pressoché stereotipata e non sono soggetti ad attenuazione o distorsione durante la propagazione lungo l’assone. In fig.2.3 è riportata
la forma tipica di un potenziale di azione. Si notino le seguenti caratteristiche:
• l’impulso di tensione ha una durata di circa 1-2 ms ed una ampiezza misurata
fra il minimo ed il massimo di circa 100-120 mV;
• nella prima fase dell’impulso si assiste ad una crescita veolce del potenziale di
membrana fino ad arrivare ad una fase denominata di depolarizzazione dove
il potenziale di membrana diventa positivo, cioè l’interno della cellula si trova
ad un potenziale superiore rispetto all’esterno;
• nella fase di discesa l’impulso prima di ritornare al valore di riposo passa
attraverso una fase denominata di iperpolarizzazione, tipicamente della durata
di circa 10 ms (e quindi molto piú lenta della depolarizzazione), in cui la cellula
presenta un potenziale di membrana inferiore rispetto a quello di riposo.
Il potenziale di azione, che una volta generato nella cellula neuronale, viaggia lungo
l’assone ed è trasmesso agli altri neuroni, costituisce l’unità elementare associata
alla trasmissione dei segnali neuronali. Tipicamente quindi quando ci si riferisce al
segnale emesso da un neurone si intende la sequenza temporale di questi potenziali
di azione, detta anche treno di impulsi (in inglese spike train).
Figura 1.3.
1.3
Forma tipica di un potenziale di azione (o impulso) [9].
Le sinapsi
La sinapsi costituisce essenzialmente la giunzione tra due neuroni ossia la struttura
attraverso la quale le informazioni sono trasferite da una cellula nervosa all’altra.
In tale contesto si definisce neurone presinaptico il neurone ”trasmettente” i potenziali di azione, a monte della sinapsi, e neurone postsinaptico il neurone ”ricevente”
i potenziali di azione, a valle della sinapsi. Con questa terminologia la sinapsi è
quindi la regione in cui l’assone del neurone presinaptico ”interagisce” con il dendrite del neurone postsinaptico. Si definisce inoltre potenziale postsinaptico (che ha
come acronimo PPS ) la risposta in tensione del neurone postsinaptico conseguente
all’arrivo del potenziale di azione proveniente dal neurone presinaptico.
Si distinguono essenzialmente due tipi di sinapsi: la sinapsi chimica e la sinapsi elettrica (altrimenti detta gap-junction). La sinapsi chimica, della quale è riportato lo schema in fig.1.4, risulta la più comune nel cervello dei vertebrati e si
basa sul meccanismo che andiamo a descrivere. Il potenziale di azione generato
dal neurone presinaptico, giunto all’estremità dell’assone depolarizza localmente la
membrana cellulare causando il rilascio all’interno della fessura sinaptica (ossia il
piccolo spazio tra le due membrane cellulari presinaptiche e postsinaptiche), da
parte di strutture poste sull’assone denominate vescicole sinaptiche, di particolari
sostanze chimiche denominate neurotrasmettitori. Il neurotrasmettitore, non appena raggiunto il versante postsinaptico della sinapsi, è rivelato da speciali molecole
(chemorecettori ) poste sulla membrana postsinaptica che provocano l’apertura (o
direttamente o tramite una catena di segnali biochimici) di specifici canali attraverso i quali una corrente ionica fluisce dal liquido extracellulare alla cellula. L’ingresso
di questi ioni porta a sua volta ad una variazione del valore del potenziale di membrana postsinaptico. Dunque in una sinapsi chimica si ha prima la trasformazione
di un segnale elettrico in un segnale chimico sulla membrana presinaptica e poi la
successiva trasformazione sulla membrana postsinaptica di un segnale chimico in un
segnale elettrico. La sinapsi elettrica realizza invece un accoppiamento elettrico tra
due neuroni attraverso canali ionici altamente specializzati (detti gap-junctions) che
collegano la membrana presinaptica e postsinaptica. La sinapsi elettrica permette
perciò un flusso di corrente diretto tra neuroni adiacenti.
Figura 1.4. Esempio di sinapsi chimica: la terminazione presinaptica libera una
sostanza chimica, il neurotrasmettitore, in risposta ad una depolarizzazione [11].
1.4
Introduzione alla dinamica neuronale
Abbiamo già accennato che l’arrivo di un potenziale di azione dal neurone presinaptico provoca una risposta in tensione (il potenziale postsinaptico) nel potenziale di
membrana del neurone ricevente. A tal proposito si distingue tra potenziale postsinaptico eccitatorio (che ha come acronimo PPSE ) e potenziale postsinaptico inibitorio (che ha come acronimo PPSI ) a seconda che l’effetto sia quello di aumentare
ovvero di diminuire il valore del potenziale di membrana. Analogo significato ha
la distinzione tra sinapsi eccitatoria e sinapsi inibitoria ovvero tra stimolo depolarizzante e stimolo iperpolarizzante. Il numero di contatti sinaptici dipende dal
tipo di neurone: ad esempio i neuroni della corteccia cerebrale (neuroni corticali )
possiedono migliaia di contatti sinaptici (da 3 · 103 a 104 ) con gli altri neuroni della
corteccia dei quali circa l’85% sono eccitatori ed il resto inibitori. In realtà solo una
frazione dell’ordine del 5-10% risultano sinapsi realmente attive [1, 13]. Per avere
un’idea dell’ampiezza di un PPSE si veda la fig.1.5 in cui sono riportati i PPSE
registrati su una cellula neuronale ed il relativo istogramma delle altezze di picco:
come si vede il valor medio è dell’ordine di 0.5 mV. In fig.1.6 è riportata una rappre-
Figura 1.5. Registrazione di 479 PPSE sul soma di cellule piramidali della corteccia visuale del ratto, in presenza di attività neuronale spontanea (fig.A). Istogramma delle altezze di picco dei PPSE (fig.B) [14].
sentazione schematica della dinamica neuronale che si instaura in risposta all’arrivo
di impulsi da neuroni presinaptici:
fig.A: un neurone postsinaptico i riceve impulsi da due neuroni presinaptici j = 1,2;
ui (t) e urest rappresentano rispettivamente il potenziale di membrana e il valore
(f )
del potenziale di riposo del neurone i; la quantità ǫi1 (t − t1 ) rappresenta il
(f )
potenziale postsinaptico generato dall’arrivo all’istante t1
di un impulso dal
neurone j = 1;
(f )
fig.B: un impulso che arriva dall’altro neurone presinaptico j = 2 ad un istante t2 ,
entro un intervallo di tempo sufficientemente breve, causa un secondo potenziale postsinaptico che si somma al precedente; in questo regime la risposta
del neurone postsinaptico risulta approssimativamente lineare nel senso che la
risposta è circa proporzionale agli input che riceve;
fig.C: quando ui (t) raggiunge un valore tipico, θ, denominato soglia di attivazione,
il comportamento del neurone diviene altamente non lineare: è generato un
potenziale di azione (il picco dell’impulso rappresentato da una freccia è fuori
dalla scala della figura) che ha una forma stereotipata e quindi senza legame
con gli stimoli che lo hanno prodotto; inoltre il neurone, per tutta la durata
del potenziale di azione, diviene per cosı̀ dire ”insensibile”, ovvero refrattario,
agli stimoli che gli arrivano dagli altri neuroni.
La refrattarietà neuronale si distingue in genere in refrattarietà assoluta e refrattarietà relativa. La refrattarietà assoluta è quell’arco temporale (di circa 2ms) corrispondente alla durata del potenziale di azione in cui è impossibile che venga generato
un altro potenziale di azione. La refrattarietà relativa, che segue temporalmente la
refrattarietà assoluta, coincide con la fase di iperpolarizzazione del neurone in cui è
”difficile” ma non impossibile che il neurone venga eccitato fino ad emettere un altro
potenziale di azione. Conseguentemente il periodo di refrattarietà fornisce un limite
inferiore al minimo intervallo temporale tra due potenziali di azione consecutivi.
Figura 1.6.
1.5
Rappresentazione della dinamica neuronale [9].
La membrana cellulare del neurone
La membrana cellulare del neurone (vedi fig.1.7) è composta da molecole di lipidi e
proteine. Le molecole lipidiche sono disposte in un doppio strato con uno spessore
di circa 6nm. In questa matrice lipidica si trovano alcune molecole proteiche che
attraversano tutto lo spessore della membrana cellulare entrando quindi in contatto
sia con l’interno della cellula che con il liquido extracellulare. Tali particolari proteine prendono il nome di canali proteici, ovvero canali di membrana, canali acquosi
o canali ionici (la ragione di tali denominazioni sarà chiara a breve). La membrana
cellulare può essere attraversata dalle sostanze dall’esterno all’interno o viceversa
attraverso vari meccanismi. Vi sono ad esempio alcuni tipi di molecole (alcoli o
glicerolo) che attraversano la membrana sciogliendosi nel doppio strato lipidico e
riemergendo dall’altro lato; in tal caso la facilità di penetrazione dipende dal grado
di solubilità nei lipidi. Gli ioni inorganici (sodio, potassio, calcio e cloro) che, come
abbiamo già detto, costituiscono le correnti ioniche alla base dell’attività elettrica
neuronale, si muovono attraverso la membrana o legandosi a particolare molecole
dette molecole di trasporto, che li veicolano, ovvero attraverso i canali proteici sopra citati. Si noti comunque che il meccanismo di trasporto adottato durante la
generazione di un potenziale di azione risulta quello dei canali proteici, in quanto i
flussi di ioni coinvolti (dell’ordine di 106 ioni/s) risultano ben oltre le possibilità di
azione delle molecole di trasporto. Nella struttura dei canali proteici (vedi fig.1.7)
si possono riconoscere i seguenti elementi:
• un poro centrale pieno d’acqua;
• una regione del poro che agisce da filtro di selettività regolando il transito degli
ioni in base alle dimensioni ed alle caratteristiche chimico-fisiche;
• un sistema di porte (in inglese gates) che si aprono e si chiudono in modo
stocastico facendo oscillare il canale tra uno stato di apertura ed uno stato
di chiusura; di norma lo stato di chiusura predomina quando il potenziale di
membrana si trova al valore di riposo. 1 .
1
Esiste peraltro l’eccezione costituita da alcuni canali per i quali lo stato di apertura è predominante nella membrana a riposo: si tratta per lo più, come vedremo nel seguito, di quei canali del
cloro e del potassio che risultano responsabili proprio del valore del potenziale di riposo.
Figura 1.7.
1.6
a) Struttura della membrana cellulare del neurone; b) struttura di un
canale ionico [11].
Canali ionici e correnti ioniche
Quando il canale ionico si trova in uno stato di apertura il canale è detto attivato,
altrimenti quando si trova in uno stato di chiusura è detto inattivato. È opportuno sottolineare che essendo l’apertura e chiusura dei canali un processo di natura
stocastica l’attivazione o disattivazione di un canale sta a significare solo un aumentata o diminuita probabilità di apertura del canale e non uno stato di apertura
o chiusura continua (vedi fig.1.8). Esistono varie modalità di attivazione, ossia di
apertura, di un canale. In particolare se l’apertura del canale può essere regolata
dal valore del potenziale di membrana i canali si dicono voltaggio-attivati. A titolo
di esempio citiamo in questa categoria di canali il canale voltaggio-dipendente del
sodio che, come vedremo in seguito (??), è quello responsabile della depolarizzazione
della membrana che provoca la fase di salita del potenziale di azione. Riguardo alla
selettività alla specificità ionica i canali si possono distinguere in cationici e anionici
a seconda che risultino rispettivamente permeabili agli ioni positivi o negativi. La
permeabilità di una membrana ad una specie ionica, indicata con p, è una proprietà
intrinseca della membrana che misura la ”facilità” con cui gli ioni attraversano la
membrana stessa; essa è definita in modo empirico dalla relazione [1, 17]:
J = −p∆[C]
(1.1)
dove J è il flusso molare (misurato in mol/(cm2 ·s)) e ∆[C] rappresenta la differenza
di concentrazione ionica ai due lati della membrana (misurata in mol/cm3 ). P ha
le dimensioni di una velocità ed è solitamente misurata in cm/s. La permeabilità
dipende solo dal tipo e dal numero di canali ionici presenti sulla membrana. In
particolare i canali cationici possono essere specifici o non specifici qualora risultino
o meno specializzati per una particolare specie ionica (ad esempio si hanno canali
specifici del Na+ , K+ , Ca2+ ). I canali anionici risultano essenzialmente costituiti
dai canali del cloro (Cl− ), che è di gran lunga il maggior permeante anionico nelle
soluzioni biologiche.
Figura 1.8. Esempio di corrente di canale. Come si vede tale corrente risulta di
impulsi di forma quasi rettangolare che possono essere posti in relazione con lo
stato di apertura e chiusura dei canali stessi [15].
La conduttanza è invece una misura dell’abilità della membrana di trasportare corrente elettrica ed è misurata soltitamente in Siemens, con simbolo S, dove 1S =
1Ω −1 . Poichè la corrente è trasportata dagli ioni, la conduttanza di una membrana non dipenderà solo dalle proprietà della membrana (cioè dalla permeabilità)
ma anche dalla concentrazione ionica all’interno ed all’esterno della cellula (ovvero il
numero dei portatori liberi di carica). Non è tuttavia possibile ricavare una relazione
matematica generale tra permeabilità e conduttanza perchè tale relazione dipende
strettamente dalle modalità con cui gli ioni attraversano il canale (semplice diffusione attraverso i pori pieni d’acqua ovvero modelli più complicati che analizzano
l’interazione canale-ione permeante). In generale quindi la corrente che attraversa
un canale ionico dipenderà [11, 16, 17]):
• dalla conduttanza del canale;
• dal gradiente di concentrazione tra l’interno e l’esterno della cellula che tende
a produrre un flusso dalla zona a maggior concentrazione a quella a minor
concentrazione secondo la legge empirica enunciata da Fick [17]:
Jdif f = −D
d[C]
dx
(1.2)
dove Jdif f rappresenta il flusso dovuto alla diffusione (misurato in numero di
ioni/(cm2 ·s)), D è il coefficiente di diffusione (misurato in cm2 /s) e [C] è la
concentrazione ionica (qui espressa in numero di ioni/cm3 );
• dalla differenza di potenziale applicata alla membrana.
1.7
1.7.1
Origine del potenziale di riposo
Un modello cellulare semplificato
In fig.1.9 è presentato un modello cellulare semplificato [11] ma che coglie l’essenza
dell’origine del potenziale di riposo della cellula neuronale. La cellula contiene ioni
potassio (K + ), sodio (Na+ ), cloro (Cl− ) ed altri anioni (A− ) di grandi dimensioni ed
è a sua volta immersa in una soluzione di sodio, potassio e cloro. Le concentrazioni
ioniche mostrate in figura sono espresse in millimoli per litro (che ha per simbolo
mM dove 1mM = 10−3 mol/l). Nelle cellule neuronali sono presenti altri ioni, come
il calcio e il magnesio, ma il loro contributo al potenziale di riposo è trascurabile.
In questo modello la membrana cellulare è completamente impermeabile al sodio
ed all’anione interno (A− ) e risulta invece permeabile al potassio ed al cloro. Il
potassio risulta più concentrato dentro la cellula che fuori e tende quindi a muoversi
verso l’esterno secondo il proprio gradiente di concentrazione. D’altro canto, come
abbiamo precedentemente illustrato, la superficie interna della membrana è negativa
rispetto a quella esterna, e quindi il gradiente di potenziale tende ad attrarre il
potassio dentro la cellula. In una cellula a riposo il gradiente di concentrazione ed
il gradiente elettrico sono in equilibrio. Si definisce potenziale di equilibrio di una
specie ionica il valore del potenziale di membrana al quale non si ha alcun flusso
netto di quella specie ionica. Per il cloro il gradiente di concentrazione ed il gradiente
elettrico hanno direzione opposta rispetto al potassio.
Figura 1.9. Un modello semplificato per le distribuzioni ioniche all’interno ed
all’esterno della cellula. Le frecce rappresentano le direzioni dei gradienti di concentrazione ed elettrici per il potassio (K + ) e per il cloro (Cl− ). Le concentrazioni
sono espresse in millimoli per litro [11].
1.7.2
L’equazione di Nerst
Il potenziale di equilibrio di ogni specie ionica è legato alle concentrazioni intracellulari ed extracellulari attraverso la cosiddetta equazione di Nerst:
Eione =
kT [n]e
ln
q
[n]i
(1.3)
dove: Eione è il potenziale di equilibrio dello ione; [n]e , [n]i sono rispettivamente
le concentrazioni extracellulari ed intracellulari; k ≃ 1.38 · 10−23 J/K è la costante
di Boltzmann; T è la temperatura assoluta in Kelvin; q è la carica elettrica (in
Coulomb) della specie ionica. È possibile capire l’origine dell’equazione di Nerst
attraverso il seguente ragionamento (vedi anche fig.1.10). Dalla meccanica statistica
′
di Boltzmann per sistemi in equilibrio termico si ha che la probabilità p(U < U <
′
′
′
U + dU) che una molecola si trovi in uno stato di energia U < U < U + dU
′
′
risulta: p(U < U < U + dU) ∝ exp(−U/kT ) [18]. Consideriamo adesso degli
ioni con carica positiva q in un campo elettrico statico. La loro energia nel punto
x risulta U(x) = qV (x) dove V (x) è il potenziale nel punto x. La probabilità
di trovare uno ione in una regione nell’intorno del punto x è perciò proporzionale
alla quantità exp(−qV (x)/kT ). Reinterpretando la densità di probabilità come una
quantità proporzionale ad una densità ionica [n(x)], ovvero ad una concentrazione,
si ha:
[n(x1 )]
p(U(x1 ))
=
= exp(−q(V (x1 ) − V (x2 ))/kT )
p(U(x2 ))
[n(x2 )]
(1.4)
e dunque all’equilibrio termodinamico si ha che un gradiente di potenziale elettrostatico ∆V = (V (x1 ) − V (x2 )) genera un gradiente di densità ionica . Ma poichè
questo è un assunto su uno stato di equilibrio la relazione deve valere anche nell’altro senso: ossia un gradiente di concentrazione genera un gradiente di potenziale
elettrostatico. Risolvendo la (1.4) rispetto al gradiente di potenziale si ha che all’equilibrio termodinamico vale ∆V =
Figura 1.10.
kT
q
2
ln [n]
che è appunto l’equazione di Nerst.
[n]1
Origine del potenziale di Nerst [9].
La quantità kT /q ha le dimensioni di una differenza di potenziale elettrico e per
una specie ionica monovalente (per la quale q = e, dove e ≃ 1.6 · 10−19 C è il valore
assoluto della carica dell’elettrone) è uguale a circa 25mV a temperatura ambiente
(T ≃ 300K). Per il modello cellulare mostrato in fig.1.9 nel quale il rapporto delle
concentrazioni del cloro e del potassio è uguale e pari a 1:30 si avrà a T ≃ 300K:
Ek ≃ −85mV , ECl ≃ −85mV . Nel modello cellulare semplificato, essendo gli ioni
potassio e cloro gli unici in grado di muoversi attraverso la membrana ed essendo
entrambi in equilibrio a -85mV, la cellula non manifesta alcun guadagno o perdita
netta di ioni: il potenziale di riposo della cellula semplificata coincide quindi con il
potenziale di equilibrio del potassio e del cloro.
1.7.3
Effetto del sodio e pompe ioniche
Lo ione sodio (Na+ ) è molto più concentrato all’esterno che all’interno della cellula (vedi fig.1.9), dunque per opporsi all’ingresso del sodio dovuto al gradiente di
concentrazione la membrana deve avere una differenza di potenziale tra l’interno e
l’esterno positiva: infatti usando le concentrazioni di fig.1.9 si ha che a T ≃ 300K
il potenziale di equilibrio del sodio risulta EN a ≃ +34mV . Dunque in una cellula
neuronale, dove il potenziale di riposo della membrana è negativo, sia il gradiente
di concentrazione sia il potenziale di membrana favoriscono l’ingresso del sodio. La
membrana cellulare è scarsamente permeabile al sodio ma il sia pur limitato ingresso di questo ione depolarrizza leggermente la membrana rispetto al potenziale
di equilibrio del potassio con la conseguenza che il potassio, fuori dall’equilibrio,
fluisce verso l’esterno. Per mantenere lo stato di equilibrio (ovvero le concentrazioni
ioniche costanti) a fronte di queste perdite continue esistono delle cosiddette pompe
ioniche che trasportano il sodio fuori dalla cellula ed il potassio dentro la cellula
in modo da mantenere uno stato stazionario, ovvero una sistuazione di equilibrio
dinamico. Il più importante sistema di trasporto è costituito dalla pompa Na-K che
trasporta tre ioni sodio fuori dalla cellula per ogni due ioni potassio portati invece
all’interno: in tal caso si dice che il rapporto di accoppiamento Na:K della pompa è
di 3:2. Tale situazione è rappresentata in fig.1.11 dove le frecce tratteggiate indicano
i movimenti ionici passivi (ovvero guidati solo dal bilancio tra i gradienti elettrici e
di concentrazione) mentre le frecce continue e i circoli indicano le pompe ioniche. La
lunghezza delle frecce indica l’entità dei movimenti netti ionici: per ciascuno ione il
flusso totale è nullo all’equilibrio.
Figura 1.11.
1.7.4
Flussi ionici passivi e pompe ioniche in una cellula in stato
stazionario [11].
Effetto della permeabilità ionica e dei meccanismi di
trasporto
Abbiamo visto nel paragrafo 1.7.2 che il potenziale di riposo della membrana è
determinato principalmente dal rapporto delle concentrazioni transmembranali del
potassio. Esiste tuttavia una dipendenza non solo dalle concentrazioni ioniche ma
anche dalla permeabilità alle specie ioniche. L’equazione di campo costante, detta
anche equazione GHK dagli autori D.E. Goldman [19], A.L. Hodgkin e B. Katz [20],
esprime tale dipendenza:
Vm =
kT pk [K + ]e + pN a [Na+ ]e + pCl [Cl− ]i
;
ln
e
pk [K + ]i + pN a [Na+ ]i + pCl [Cl− ]e
(1.5)
dove Vm è il potenziale di riposo della membrana; e (valore assoluto della carica dell‘elettrone) indica la carica degli ioni monovalenti; il simbolo [I]j , dove I =
K + ,Na+ ,Cl− e j = i,e, indica la concentrazione interna ed esterna delle specie
ioniche; pk , pN a , pCl rappresentano le permeabilità ioniche di ogni ione.
Tale
equazione è basata sul presupposto che, a potenziale costante, non deve cambiare
la carica sulla membrana anche se gli ioni la attraversano in piccole quantità . Di
conseguenza le correnti trasportate dalle perdite di sodio verso l’interno, di potasso
verso l’esterno e dalle altre perdite del cloro devono dare come somma zero. Altrimenti si detetrminerebbe un accumulo, o una perdita, costante di carica e quindi una
deriva costante del potenziale di membrana. Il nome equazione di campo costante
è legato al fatto che una delle ipotesi alla base di essa è che il campo elettrico all’interno della membrana sia uniforme. Come si vede l’equazione ricorda quella di
Nerst ma considera tutte le specie ioniche presenti ”pesate” con la loro permeabilità
e corrisponde pertanto a quello che intuitivamente era possibile aspettarsi: ovvero
che il potenziale di membrana tende tanto più al valore del potenziale di equilibrio
di una specie ionica quanto più la sua permeabilità è maggiore di quella delle altre
specie ioniche. È possibile dimostrare [11] che non vi è una grossa dipendenza del
potenziale di riposo dal cloro e pertanto il suo contributo è spesso trascurato; in tal
caso l’equazione di campo costante viene cosı̀ riscritta:
Vm=
kT [K + ]e + b[Na+ ]e
;
ln
e
[K + ]i + b[Na+ ]i
(1.6)
dove b = pN a /pk . Una descrizione ancora più accurata è fornita dall’equazione di
stato stazionario [21] che considera anche gli effetti dei processi di trasporto attivo
della pompa ionica Na − K:
Vm=
kT r[K + ]e + b[Na+ ]e
ln
;
e
r[K + ]i + b[Na+ ]i
(1.7)
dove r è il rapporto di accoppiamento del sistema di trasporto (nel caso della pompa
Na − K si ha r = 3/2). Si capisce facilmente come gli effetti della pompa si
ripercuotano sul potenziale di membrana: infatti il diverso flusso di ioni Na+ e K +
(tre ioni sodio fuori dalla cellula per ogni due ioni potassio portati invece all’interno)
causato dalla pompa genera una corrente ionica netta verso l’esterno; questo flusso
di cariche positive verso l’esterno tende a iperpolarizzare la membrana ad un valore
leggermente più negativo (ossia avvicina il potenziale di membrana un po’ di più al
potenziale di equilibrio del potassio) di quello che ci si aspetterebbe solo in base a
meccanismi passivi. Per avere un’idea dell’entità del contrbuto delle pompe ioniche si
confronti il valore del potenziale di riposo predetto dall’equazione di campo costante
e dall’equazione di stato stazionario relativamente ad assoni di calamaro in acqua
di mare alla temperatura di T ≃ 300K: usando l’equazione di campo costante
si trova Vm ≃ −67mV , mentre usando l’equazione di stato stazionario si trova
Vm ≃ −73mV (abbiamo usato i seguenti valori realistici: [K + ]i = 400mM, [K + ]e =
10mM, [Na+ ]i = 50mM, [Na+ ]e = 460mM, b = pN a /pk = 0.04, r = 1.5).
1.8
Proprietà elettriche passive della membrana
Da un punto di vista elettrico la più semplice schematizzazione di una porzione di
membrana cellulare a riposo fa ricorso a tre elementi circuitali: una resistenza (R),
una capacità (C), ed un generatore di tensione V uguale al potenziale di riposo (vedi
fig.1.12 e fig.1.13). La presenza della resistenza si spiega con l’esistenza dei canali
Figura 1.12.
Schematizzazione elettrica di una porzione di membrana cellulare
del neurone. Vrest indica il potenziale di riposo [1].
Figura 1.13. Equivalente circuitale dell’intera membrana cellulare. I simboli R e
C in questo caso rappresentano il paralllelo rispettivamente di tutte le resistenze e
le capacità delle singole porzioni di membrana; Vrest indica il potenziale di riposo;
Iinj rappresenta una corrente iniettata dentro la cellula [1].
ionici che realizzano un contatto tra l’interno e l’esterno della cellula. La resistena
di membrana è di solito riportata come una resistenza di membrana specifica, Rm ,
definita come una resistenza per unità di superficie (in unità Ω · cm2 ). R è quindi
ottenuta dividendo Rm per l’area della membrana considerata. Rm è determinata
principalmente dalle permeabilità a riposo del potassio e del cloro. Valori tipici di
Rm variano da circa 103 Ω · cm2 per membrane con molti canali ionici a circa 5 x 104
Ω · cm2 per membrane con pochi canali ionici. Ma oltre a permettere il passaggio
di correnti ioniche, la membrana accumula cariche sulla superfici interna ed esterna,
ed è proprio questa separazione che detemina il potenziale di membrana. La realizzazione di questa separazione di cariche conferisce alla membrana le proprietà di un
condensatore. La capacità di membrana è di solito specificata in termini di una capacità di membrana specifica, Cm , definita come una capacità per unità di superficie
(in unità F/cm2 ). C è quindi ottenuta moltiplicando Cm per l’area della membrana considerata. Cm è tipicamente dell’ordine di 1µF/cm2 . Tramite la relazione
Qm = Cm V , dove Qm è la quantità di carica per unità di superficie, ed assumendo
V ≃ -65mV si ha che Qm ≃ (1µ F/cm2 ) x (65mV) ≃ 6.5 x 10−8 C/cm2 che equivale, dividendo per il valore assoluto della carica dell’elettrone, a circa 4 x 1011 ioni
monovalenti per cm2 . Ci preme sottolineare che tale schematizzazione descrive solo
il comportamento passivo della membrana e non prende in considerazione eventuali
componenti non lineari o attivi come ad esempio conduttanze voltaggio-dipendenti
(vedi ??).
Capitolo 2
Modelli semplificati di neuroni e
reti neurali
In questo capitolo uniamo tutti gli elementi costitutivi di un neurone (dendriti,
sinapsi, conduttanze dipendenti dal potenziale, assoni) al fine di ottenere un modello
funzionale della singola cellula; con questo modello a nostra disposizione possiamo
chiederci quali operazioni può effettuare o quanto sia efficace nel codificare informazione. Iniziamo questa operazione trascurando l’albero dei dendriti e rimpiazzando la descrizione dei processi di sparo fondata sulle conduttanze (ovvero la descrizione fornita dalle equazioni realistiche di Hodgkin-Huxley per le correnti di membrana), con una descrizione basata sull’utilizzo di modelli formali, come il modello
leaky integrate and fire, che tratteremo. Questo modello descrive in modo estremamente semplificato la dinamica sottosoglia, cioè la dinamica prima dell’insorgenza
del potenziale di azione, mentre il potenziale di azione è descritto sinteticamente
come evento impulsivo, assumendo implicitamente di aver a che fare con un impulso stereotipato. In questo modo possiamo ridurre incredibilmente la complessità
del problema e caratterizzare il comportamento elettrico dei neuroni attraverso una
singola equazione differenziale ordinaria piuttosto che tramite equazioni accoppiate,
non lineari e alle derivate parziali. Tali semplificazioni ci permettono di trattare reti
formate da un gran numero di neuroni interconnessi, di simularne la dinamica e di
analizzare le soluzioni collettive, non banali, e verificarne la stabilità. La comprensione di un qualsiasi sistema complesso passa dunque per la scelta di un livello di
descrizione che afferra le proprietà fondamentali del sistema e trascura quelle non
essenziali per lo scopo proposto.
2.1
Dal modello di Hodgkin-Huxley al modello
leaky integrate and fire
Il modello di Hodgkin-Huxley è un modello realistico a quattro dimensioni (in cui
cioè la dinamica del neurone è descritta da quattro variabili), pensato per riprodurre i dati sperimentali relativi ad una particolare fibra nervosa, l’assone gigante
del calamaro [5]. Questo modello è costituito da un sistema di quattro equazioni
differenziali del primo ordine che descrivono la dinamica del potenziale di membrana
e delle tre correnti ioniche fondamentali: la corrente di sodio (IN a ), la corrente del
potassio (IK ) e la corrente di perdita, o di dispersione, (IL dall’inglese leakage current), dovuta principalmente al cloro (Cl− ), ma che riassume anche l’effetto di altre
specie ioniche presenti, ma non descritte esplicitamente. Il meccanismo alla base di
queste correnti ioniche risiede nel fatto che le conduttanze della membrana cellulare
per il sodio (gN a ) e per il potassio (gK ) sono dipendenti dalla differenza di potenziale applicata alla membrana, dunque la probabilità che i canali si aprano aumenta
con la depolarizzazione della membrana. L’apertura dei canali avviene tuttavia con
tempi e modalità diverse: la depolarizzazione della membrana attiva inizialmente un
aumento della conduttanza del sodio (seguita da una successiva inattivazione) e solo
Figura 2.1.
Fase di salita del potenziale di azione.
con un certo ritardo temporale quella del potassio. Inoltre l’effetto sul potenziale di
membrana dell’aumento della conduttanza è diverso per il sodio e per il potassio:
• per quanto riguarda il sodio si ha un processo di retroazione positiva; infatti
una piccola depolarizzazione aumenta il numero di canali aperti e questo, a
sua volta, dà luogo ad un ulteriore ingresso del sodio secondo il gradiente
elettrochimico e ad una depolarizzazione ancor più grande;
• per quanto riguarda il potassio, si ha invece che il flusso in uscita secondo
il gradiente elettrochimico, dovuto alla depolarizzazione, porta alla ripolarizzazione della membrana e quindi alla conseguente riduzione della conduttanza
per il potassio fino al valore di riposo (retroazione negativa).
Il profilo tipico di un potenziale di azione è quindi spiegabile, per quanto riguarda
la fase di salita, con un improvviso grande aumento della permeabilità di membrana
al sodio (vedi figura 2.1); la conseguente corrente del sodio porta rapidamente il
potenziale di membrana a spostarsi verso il potenziale di equilibrio del sodio stesso
(EN a ). La fase di caduta del potenziale di azione, ovvero la ripolarizzazione della
membrana, è dovuta ad un successivo aumento della permeabilità al potassio (vedi
figura 2.2): a causa della corrente del potassio, il potenziale di membrana si sposta
Figura 2.2.
Fase di caduta del potenziale di azione.
questa volta, verso il potenziale di equilibrio del potassio (Ek ).
Figura 2.3.
Ricostruzione teorica dell’andamento del potenziale d’azione e relative
variazioni di conduttanza del sodio e del potassio [11].
Il modello di Hodgkin-Huxley spiega inoltre l’esistenza di un livello di soglia del
potenziale di membrana al di sopra del quale nasce l’impulso; tale fenomeno può
essere compreso immaginando di far passare una corrente attraverso la membrana
depolarizzandola solo sino alla soglia e poi di interrompere la corrente. Essendo il
potenziale di membrana lontano dal potenziale di equilibrio del potassio, vi sarà un
aumento della corrente di potassio in uscita, ma verranno attivati anche alcuni canali
di sodio, aumentando la corrente di sodio in ingresso. Alla soglia questi aumenti di
corrente sono esattamente uguali e opposti (equilibrio dinamico), e la membrana è in
una condizione simile a quella di riposo, a parte il fatto che la conduttanza del sodio
ora è instabile. La depolarizzazione oltre la soglia determina cosı̀ un aumento di
gN a sufficiente a superare immediatamente il valore della conduttanza del potassio a
riposo, ma, non appena uno ione in più di potassio lascia la cellula, rispetto al valore
di soglia, la depolarizzazione diminuisce e la prevalenza della corrente di potassio
determina la ripolarizzazione.
Un ultimo aspetto capace di essere spiegato con questo modello è il tempo di
refrattarietà; dopo l’emissione di un potenziale di azione abbiamo a che fare con due
periodi diversi di retrattarietà: il periodo di refrattarietà assoluto e quello relativo.
Il periodo assoluto è l’intervallo durante il quale non può essere assolutamente emesso un potenziale di azione, anche se il neurone è soggetto ad uno stimolo qualsivoglia
grande; il periodo relativo è l’intervallo temporale immediatamente successivo durante il quale la generazione di un nuovo potenziale di azione è inibita, ma non
impossibile. Il periodo refrattario assoluto coincide essenzialmente con l’intera durata del potenziale di azione ed è causato dall’inattivazione dei canali Na+ che in
precedenza si erano aperti per depolarizzare la membrana; questi canali rimangono
inattivi finché la membrana non si ripolarizza, dopodiché si chiudono, si riattivano e
riacquistano la loro capacità di aprirsi in risposta ad uno stimolo. Il periodo refrattario relativo segue temporalmente quello assoluto; i canali potassio si aprono per
terminare il potenziale di azione ripolarizzando la membrana, dunque la conduttanza di membrana del potassio cresce drasticamente. Gli ioni K + che fluiscono in gran
numero fuori dalla cellula fanno sı̀ che il potenziale di membrana si avvicini molto al
potenziale di equilibrio del potassio; questo determina una breve iperpolarizzazione
della membrana, cosiché il potenziale di membrana diventa più negativo dell’usuale
potenziale di riposo. Finché la conduttanza del potassio non raggiunge il suo valore
di riposo, è necessario uno stimolo maggiore per raggiungere il valore di soglia e dar
vita ad una seconda depolarizzazione. Il raggiungimento del potenziale di equilibrio
di riposo determina la fine del periodo di refrattarietà relativo.
Un neurone dunque genererà un potenziale di azione quando il suo potenziale di
membrana raggiungerà un valore di soglia compreso tra −55 e −50 mV . Durante lo
sparo del potenziale di azione, il potenziale di membrana descresce rapidamente e
assume un valore che è iperpolarizzato rispetto al potenziale di soglia. Il meccanismo
per cui le conduttanze dipendenti dal potenziale K + e Na+ producono dei potenziali
di azione è ben compreso e modellizzabile accuratamente; d’altra parte i modelli dei
neuroni possono essere semplificati se non sono esplicitamente inclusi i meccanismi
biofisici responsabili dei potenziali di azione. I modelli integrate-and-fire effettuano
questa semplificazione supponendo che il potenziale di azione sia generato ogni volta
che il potenziale di membrana del neurone modello raggiunge un valore di soglia Θ;
dopo l’emissione del potenziale di azione, al potenziale viene riassegnato un valore R
inferiore al potenziale di soglia, R < Θ. Tali modelli formali partono dal presupposto
che un potenziale di azione costituisca un evento stereotipato, per cui viene descritta
solo la dinamica sottosoglia di un’unica variabile (modello unidimensionale); inoltre
non riproducono in modo dettagliato i potenziali di azione né includono l’effetto di
adattamento o il tempo di refrattarietà. L’insorgenza del potenziale di azione è cosı̀
caratterizzata solo dal tempo di sparo (o in inglese firing time).
2.2
Neuroni leaky integrate-and-fire
Il modello integrate-and-fire è stato proposto da Lapicque nel 1907, molto prima che
fosse compreso il meccanismo di generazione dei potenziali di azione; nonostante la
sua età e la sua semplicità, questo modello rappresenta ancora una descrizione estremamente utile dell’attività neuronale. Trascurando una descrizione biofisica del
potenziale di azione, a questi modelli rimane il compito, più semplice, di modellizzare la dinamica del potenziale di membrana sotto soglia. Questo compito può
esser svolto con vari livelli di rigore; nella versione più semplice, sono ignorate tutte
le conduttanze di membrana attive, compresi gli input sinaptici, e l’intera conduttanza di membrana è schematizzata con un singolo termine di perdita, passivo,
im = ḡL (V − EL ), con im corrente di membrana, V potenziale di membrana, EL
potenziale di riposo di un singolo ione e ḡL parametro da aggiustare per ottenere la
conduttanza di membrana a riposo per uno ione. Questa versione è denominata passiva o modello leaky integrate-and-fire (al quale ci riferiremo anche come LIF). Le
conduttanze neuronali sono approssimativamente costanti per piccole fluttuazioni
attorno al potenziale di membrana di riposo; il modello LIF assume che questa
costanza si mantenga nell’intero range di variazione del potenziale sotto soglia. Per
alcuni neuroni, questa si rivela un’approssimazione ragionevole, mentre per altri non
lo è; con queste approssimazioni il neurone si comporta come un circuito elettrico
costituito da una resistenza ed una capacità in parallelo (figura 2.4) ed il potenziale
di membrana si determina cosı̀ attraverso l’equazione
cm
dV
Ie
= −im +
dt
A
(2.1)
dove cm è la capacità per unità di superficie della membrana, A è la superficie della
membrana, im è la corrente di membrana per unità di superficie ed Ie è la corrente
di elettrodo, che usualmente non è espressa come corrente per unità di superficie;
con im = ḡL (V − EL ) si ha
cm
dV
Ie
= −ḡL (V − EL ) + .
dt
A
(2.2)
È conveniente moltiplicare l’equazione (2.2) per la resistenza specifica di membrana
Figura 2.4. Circuito equivalente per il modello di neurone. Il neurone è rappresentato a sinistra, da un singolo insieme di superficie A con una sinapsi ed un
s indica
elettrodo che inietta corrente. Nel circuito equivalente a destra, il cerchio una conduttanza sinaptica che dipende dall’attività di un neurone presinaptico.
Viene indicata inoltre una singola conduttanza gs , anche se, in genere, ce ne posv indica una conduttanza che dipende dal
sono essere di tipi diversi. Il cerchio potenziale, mentre Ie è la corrente che passa attraverso l’elettrodo. [12].
rm , data in questo caso da rm = 1/ḡL ; questo cancella il fattore ḡL nel membro a
destra dell’equazione e lascia un fattore cm rm = τm nel membro di sinistra, dove τm
è la costante di tempo di membrana del neurone. L’ultimo termine del membro di
destra varia in accordo al fatto che rm /A = Rm , dove Rm è la resistenza di membrana
totale. Si arriva cosı̀ all’equazione fondamentale per i modelli leaky integrate-andfire:
τm
dV
= EL − V + Rm Ie .
dt
(2.3)
Per generare i potenziali di azione in questo modello occorre aggiungere una regola:
assegnare al potenziale il valore R ogniqualvolta il potenziale V raggiunga il valore di
soglia e venga sparato un potenziale di azione. L’equazione (2.3) indica che, quando
Ie = 0, il potenziale di membrana si rilassa esponenzialmente con una costante di
tempo τm a V = EL ; EL è dunque il potenziale di riposo della cellula modello.
Il potenziale di membrana per il modello passivo integrate-and-fire è determinato
integrando l’equazione (2.3) e applicando la regola di soglia e di riassegnazione del
valore del potenziale per la generazione del potenziale di azione. In figura (2.5) è
mostrata la risposta di un neurone LIF ad una corrente di elettrodo che varia nel
tempo.
Figura 2.5. Modello leaky integrate and fire guidato da una corrente di elettrodo
che varia temporalmente. Il grafico superiore indica il potenziale di membrana,
mentre quello inferiore la corrente guida. I potenziali d’azione sono semplicemente
sovrapposti alla traiettoria del potenziale di membrana ogniqualvolta il potenziale
raggiunga il valore di soglia. [12].
Il tasso di sparo di un modello LIF in risposta ad una corrente iniettata costante
può essere calcolato analiticamente. Quando Ie è indipendente dal tempo, il potenziale sotto soglia V (t) può essere facilmente calcolato risolvendo l’equazione (2.3):
V (t) = EL + Rm Ie + (V (0) − EL − Rm Ie )exp(−t/τm ),
(2.4)
dove V (0) è il valore di V al tempo t = 0. Questa equazione è valida per il modello
integrate-and-fire solo finché V rimane sotto soglia. Supponiamo che a t = 0 il
neurone abbia appena sparato un potenziale di azione e si abbia V (0) = R; il
potenziale di azione successivo si avrà quando il potenziale di membrana raggiunge
il valore di soglia, cioè, ad un tempo t = tisi dove
V (tisi ) = Θ = EL + Rm Ie + (R − EL − Rm Ie )exp(−tisi /τm ).
(2.5)
Risolvendo per tisi , ovvero per il tempo a cui si ha il potenziale di azione successivo,
possiamo determinare l’intervallo tra uno sparo e l’altro (in inglese interspike interval
o ISI) per una corrente Ie costante, o, equivalentemente, il suo inverso, che possiamo
chiamare il tasso di sparo del neurone,
risi =
1
Rm Ie + El − R
= τm ln(
)
tisi
Rm Ie + EL − Θ
−1
.
(2.6)
Questa espressione è valida se Rm Ie > Θ − EL , altrimenti risi = 0. Per valori
sufficientemente grandi di Ie , possiamo approssimare linearmente il logaritmo ln(1 +
z) ≈ z per piccoli z in modo da avere
risi
"
Rm Ie + El − Θ
≈
τm (Θ − R)
#
,
(2.7)
+
che mostra che il tasso di sparo cresce linearmente con Ie per grandi Ie .
La figura (2.6A) mostra risi in funzione di Ie ; il tasso di sparo, determinato come
l’inverso dell’intervallo temporale tra i primi due impulsi sparati da un neurone
corticale in vivo in risposta ad una corrente iniettata (cerchi pieni), è in accordo con i
risultati ricavati dal modello LIF, anche se il neurone reale esibisce una caratteristica
di adattamento del tasso di sparo prima di raggiungere uno stato stazionario (figura
2.6B), che il modello LIF può riprodurre solo usando parametri diversi da quelli che
venivano usati per riprodurre gli impulsi iniziali.
2.2.1
Correnti sinaptiche
Nel caso in cui il neurone riceva degli impulsi da altri neuroni, la cosa si può modelizzare nell’ambito dei modelli LIF sostituendo alla corrente esterna Ie che compare
nell’equazione (2.3) la corrente sinaptica Isin . In particolare l’effetto prodotto da un
solo impulso ricevuto dal neurone al tempo t corrisponde ad una corrente
Isin = −Gm [V + W ]τm δ(t)
(2.8)
per una sinapsi che risponda in modo infinitamente rapido [29]. Dove Gm = 1/Rm è
la conduttanza di membrana, W è il potenziale di inversione della sinapsi il cui segno
Figura 2.6. (A)Comparazione dei tassi di sparo in funzione della corrente iniettata, calcolati l’uno con il modello integrate and fire, l’altro attraverso le misure
su un neurone corticale in vivo. I dati puntiformi derivano da una cellula piramidale nella corteccia visiva primaria di un gatto. I cerchi pieni mostrano l’inverso
dell’ISI per i primi due impulsi sparati, mentre i cerchi vuoti mostrano il tasso
di sparo nello stato quasi stazionario, dopo l’adattamento del tasso di sparo. (B)
Registrazione dello sparo di un neurone corticale, soggetto ad una corrente iniettata costante, in cui è visibile l’adattamento. (C) Traiettoria del potenziale di
membrana e potenziali di azione per un modello integrate and fire con una corrente
aggiuntiva. [12].
determina se l’effetto dell’impulso è eccitatorio o inibitorio. Dato che il potenziale
di membrana V ha segno negativo, la sinapsi è detta eccitatoria (rispettivamente
inibitoria) se W < 0 (W > 0); il segno di V è all’origine anche del segno negativo
nell’equazione (2.8). Nel caso in cui il neurone sia connesso ad altri N neuroni
pre-sinaptici il modello LIF si può riscrivere come
τm V̇ = EL − V − τm (V + W )
(m)
dove il tempo tj
N X
X
j=1 m
(m)
δ(t − tj ) ,
(2.9)
rappresenta l’istante di ricezione dell’impulso m-esimo emesso dal
j-esimo neurone pre-sinaptico.
Un modello ancora più semplificato, ma largamente usato in letteratura e che
mette in connessione la dinamica LIF con quella di oscillatori è il seguente
v̇ = c − v −
N X
X
j=1 m
(m)
δ(t − tj ) ,
(2.10)
dove si è assunto che EL = 0, che il tempo unitario sia τm , che il potenziale di
membrana sia stato riscalato come v = (V − R)/(Θ − R), in modo che v ∈ [0,1].
Nell’equazione 2.10 il termine c rappresenta una corrente esterna adimensionale. In
assenza di stimoli esterni, la soluzione dell’equazione 2.10 è semplicemente v(t) =
-50
Θ
-52
-54
v
-56
-58
R
-60
150
175
tempo
200
Figura 2.7. Andamento temporale del potenziale di membrana per un neurone
LIF soprasoglia in assenza di stimoli presinaptici. Le frecce indicano l’istante in
cui avviene l’emissione di un potenziale di azione.
c(1 − exp(−t)), quindi se c < 1 il suo valore asintotico resta sempre sotto soglia,
altrimenti se c > 1 il potenziale di membrana raggiunge soglia e viene riazzerato in
modo ripetitivo con periodo tisi = ln[(c − 1)/c]. In questo caso il neurone è detto
soprasoglia e la sua dinamica ricorda quella di un semplice oscillatore armonico
sovrasmorzato ed è riportata in figura 2.7
2.2.2
Adattamento del tasso di sparo e refrattarietà
L’adattamento del tasso di sparo è una caratteristica comune dei neuroni piramidali
corticali e consiste nell’allungamento degli ISI col passare del tempo in presenza
di una corrente costante iniettata nella cellula, prima di raggiungere un valore di
stato stazionario. La considerazione di questo fenomeno ci permette di mostrare
come un modello LIF possa essere modificato per incorporare una dinamica più
complessa. Il modello LIF che abbiamo descritto nel paragrafo precedente è basato
su due approssimazioni separate: una descrizione altamente semplificata del potenziale di azione e una approssimazione lineare per la corrente di membrana totale.
I dettagli del processo di generazione del potenziale di azione non sono importanti
per l’obiettivo proposto dalla nostra modellizzazione, inoltre la corrente di membrana è modellizzata con dettagli sufficienti. Illustriamo il processo di adattamento
del tasso di sparo usando un modello di conduttanza che ha caratteristiche simili
a quelle delle conduttanze neuronali misurate che giocano un ruolo importante nel
produrre questo effetto. Modellizziamo l’adattamento del tasso di sparo includendo
nell’equazione fondamentale un’ulteriore corrente,
τm
dV
= EL − V − rm gsra (V − EK ) + Rm Ie .
dt
(2.11)
La conduttanza di adattamento del tasso di sparo gsra è stata schematizzata come
una conduttanza K + , cosiché, quando viene attivata, iperpolarizza il neurone, rallentando qualsiasi impulso che può sopraggiungere. EK è il potenziale di inversione
del potassio. Assumiamo che questa conduttanza si rilassi esponenzialmente a 0 con
una costante temporale τsra soddisfacendo l’equazione
τsra
dgsra
= −gsra .
dt
(2.12)
Ogniqualvolta un neurone genera un impulso, gsra è accresciuto di un fattore ∆gsra ,
cioè gsra → gsra + ∆gsra ; durante una sequenza di sparo ripetuta, la corrente si
costruisce attraverso una sequenza di passi causando l’adattamento del tasso di
sparo.
La probabilità che un neurone spari è significativamente ridotta nel breve lasso
temporale successivo alla generazione di un potenziale di azione; tale effetto refrattario non è incluso nel modello base integrate-and-fire. Il modo più semplice per
introdurre nel modello un periodo di refrattarietà assoluto è quello di aggiungere una
condizione alla regola base di superamento della soglia tale che proibisca lo sparo
per un periodo di tempo immediatamente successivo all’emissione dell’impulso. La
refrattarietà può essere incorporata in un modo più realistico aggiungendo una conduttanza simile a quella introdotta per l’adattamento del tasso di sparo; stavolta
la conduttanza dovrà avere un tempo di recupero più veloce ed un incremento più
grande in seguito ad un potenziale di azione. Grazie ad un consistente incremento, il
potenziale del neurone si avvicina, in valore, al potenziale di equilibrio del potassio
EK in seguito ad un potenziale di azione, prevenendo in maniera temporanea un
ulteriore sparo e producendo un periodo di refrattarietà assoluto. Nel momento in
cui questa conduttanza approssima il valore 0, lo sparo sarà possibile anche se inizialmente poco probabile, producendo un periodo di refrattarietà relativo. Quando
il recupero è completato, si ristabilisce la periodicità di sparo usuale.
2.3
Reti neurali
Una rete neurale è, formalmente, un grafo i cui nodi sono costituiti dai neuroni e
le cui connessioni sono costituite dalle sinapsi; ciascuna connessione è pesata con
la corrispondente efficienza sinaptica. Le sinapsi costituiscono cosı̀ un grafo con
connessioni specifiche e direzionate. Ciascun nodo è caratterizzato da un’equazione
di evoluzione in cui lo stato del neurone dipende dai neuroni spazialmente connessi,
ovvero dai neuroni presinaptici; i pesi sinaptici possono essere fissati ma possono
anche evolvere nel tempo (plasticità sinaptica), in accordo con la storia dei due
nodi connessi dalla sinapsi. Se consideriamo le reti neurali come sistemi dinamici,
possiamo dare una formulazione canonica della dinamica neuronale; ciascun neurone
i è caratterizzato dal suo stato, Xi , che appartiene ad un certo insieme compatto I ∈
RM . M è il numero di variabili che caratterizzano lo stato di un neurone; assumiamo
inoltre che tutti i neuroni siano descritti dallo stesso numero di variabili. Il LIF
corrisponde al caso in cui M = 1, Xi = Vi è il potenziale di membrana del neuroni
i e I = [Vmin ,Vmax ]. L’evoluzione di N neuroni è data cosı̀ da un sistema dinamico
deterministico del tipo:
dX
= Fγ (X,t),
dt
tempo continuo,
(2.13)
o,
X(t + 1) = Fγ [X(t),t],
tempo discreto.
(2.14)
La variabile X = {Xi }N
i=1 rappresenta lo stato dinamico di una rete con N neuroni
al tempo t; tipicamente X ∈ M = IN , dove M è lo spazio delle fasi dell’equazione
(2.14) ed Fγ (M) ⊂ M. La mappa Fγ : M → M dipende da un set di parametri
γ ∈ RP ; il caso tipicamente considerato in seguito sarà γ = (W,I(ext) ), dove W è
la matrice dei pesi sinaptici, mentre I(ext) rappresenta una corrente o uno stimolo
esterno. Cosı̀ γ è un punto nello spazio dei parametri di controllo P = N 2 + N
dimensionale.
Un neurone i emette un potenziale d’azione ogni qual volta il suo stato Xi appartiene ad una certa regione connessa P1 del suo spazio delle fasi, altrimenti è quiescente se X ∈ P0 = I\P1 . Per N neuroni identici questo porta ad una “partizione
naturale” P dello spazio delle fasi M. Chiamiamo Λ = {0,1}N , ω= [ωi ]N
i=1 ∈ Λ,
allora P = {Pω }ω∈Λ , dove Pω = Pω1 ×Pω2 × · · · × PωN . Equivalentemente, se X
∈ Pω , si ha che tutti i neuroni con ωi = 1 stanno sparando, mentre quelli con ωk = 0
sono quiescenti.
A ciascuna condizione iniziale X ∈ M possiamo associare un “raster plot” ω̃ = {ω
(t)}+∞
t=0 tale che X (t) ∈ Pω(t) , ∀t ≥ 0; cosı̀ ω̃ è la sequenza di configurazioni di sparo
mostrata dalla rete neurale quando viene preparata nella condizione iniziale X (vedi
figura 2.8). Conoscere il raster plot è dunque equivalente a conoscere la lista dei
tempi di sparo di tutti i neuroni. Ad esempio, se abbiamo a che fare con una rete
omogenea di N neuroni, dove la dinamica di ciascun neurone è periodica, possiamo
dedurre, dall’osservazione del raster plot, che la dinamica della rete è asincrona;
100
0.8
80
Indice di Neurone
1
0.6
vk
0.4
0.2
0
60
40
20
226
226.2
226.4
226.6
Tempo
226.8
227
227.2
0
1750
1800
1850
1900
1950
Tempo
Figura 2.8. (a) La figura mostra l’andamento del potenziale di membrana del kesimo neurone in funzione del tempo, in una rete omogenea di N neuroni. (b) Nella
seconda figura è riportato l’indice del neurone che spara in funzione del tempo.[26]
dunque, se indichiamo con T l’ISI di ciascun neurone, il tasso di sparo della rete è
costante e pari a T /N.
2.3.1
Rete di neuroni LIF globalmente accoppiati: il modello
La comprensione del meccanismo di elaborazione dell’informazione nel cervello può
essere perseguita analizzando le proprietà dinamiche dei modelli di reti neurali; pensare di avvicinarsi a questo problema nella sua assoluta generalità è un obiettivo
incredibilmente ambizioso, dal momento che occorre tenere in conto (i) del ruolo
della topologia delle connessioni, (ii) della dinamica delle stesse connessioni, al fine
di rappresentare la plasticità sinaptica, (iii) della dinamica interna a ciascun modello di neurone, che può dipendere dal numero di canali ionici ma anche da altre
variabili e parametri, (iv) dalla diversità tra i neuroni e le loro connessioni e, infine,
(v) dall’inevitabile presenza di rumore. Ad ogni modo possiamo congetturare che
almeno alcuni meccanismi di base siano robusti e possano dipendere solo da pochi
ingredienti; infatti anche i modelli semplici composti da unità identiche globalmente
accoppiate esibiscono proprietà dinamiche interessanti e, indubbiamente, non ovvie
e non totalmente comprese. Consideriamo ad esempio il cosidetto ”splay state”, che
costituisce un modo collettivo che emerge in reti di oscillatori non lineari completamente accoppiati (vedi figura 2.8); questo stato è caratterizzato dal fatto che tutte
le oscillazioni abbiano la stessa forma d’onda X e che le fasi di tali oscillatori si
dispongano sul cerchio unitario in modo equispaziato. Inoltre lo stato del singolo
oscillatore xk può essere descritto al tempo t da
xk (t) = X(t + kT /N) = A cos(ωt + 2πk/N);
ω = 2π/T ;
k = 1, · · · ,N
(2.15)
dove N è il numero di oscillatori del sistema, T il periodo dell’oscillazione collettiva,
X la forma d’onda comune ed A l’ampiezza dell’oscillazione. La stabilità degli
stati stazionari di questi sistemi è ancora un problema dibattuto. In particolare,
nel contesto delle reti neurali, ove lo “splay state” è caratterizzato da un tasso
di sparo costante dei neuroni, si possono trovare sia dimostrazioni del fatto che
lo “splay state” sia stabile solo in presenza di accoppiamenti eccitatori [28], sia
dimostrazioni del fatto che sia possibile trovare tale stato stabile in presenza di reti
con accoppiamento completamente inibitorio [25].
Il metodo usato di solito per determinare le proprietà di stabilità di tali semplici modelli è basato sull’approssimazione di campo medio; questo ci permette di
ottenere lo spettro degli autovalori associati alla matrice di stabilità nel limite termodinamico N → ∞, dove N denota il numero di neuroni. La stima della stabilità
lineare dello splay state costituisce il passo preliminare verso una completa comprensione delle proprietà dinamiche della rete neurale; per effettuare tale stima si
può introdurre la sezione di Poincaré, vedi (??), che trasforma il sistema dinamico
originale in una mappa che connette le configurazioni dinamiche della rete neurale
corrispondenti a momenti in cui si ha l’emissione di impulsi neurali consecutivi. La
mappa viene costruita tra gli impulsi consecutivi emessi da qualsivoglia neurone e
viene combinata con un opportuno riscalamento degli indici dei neuroni in modo da
ridurre la complessità computazionale del calcolo e da ottenere espressioni analitiche
per valori grandi ma finiti di N.
Consideriamo dunque una rete di N identici neuroni LIF; la dinamica dell’iesimo neurone è descritta da una singola variabile, il potenziale di membrana vi (t),
che obbedisce all’equazione differenziale
v̇i = a − vi + gE(t)
(2.16)
dove tutte le variabili e i parametri sono espressi in unità adimensionali opportunamente riscalate. In accordo con la precedente equazione, il potenziale di membrana
rilassa al valore a + gE(t), ma, non appena raggiunge il valore di soglia vi = 1,
viene riscalato a vi = 0 e viene inviato, simultaneamente, un impulso a tutti gli
altri neuroni (questa procedura di riassegnazione del valore del potenziale è un modo approssimato per descrivere il meccanismo di scarica presente nei neuroni reali).
Il parametro a > 1 corrisponde alla corrente di input soprasoglia, mentre g limita
la forza del campo E(t) agendo come accoppiamento efficace. Il campo E(t) è la
sovrapposizione lineare degli impulsi emessi ogniqualvolta il potenziale di membrana
di ciascun singolo neurone raggiunge il valore di soglia. Assumiamo che la forma di
un impulso emesso a t = 0 sia data da Es (t) =
α2 t −αt
e
N
, dove 1/α è l’ampiezza del-
l’impulso. Questo è equivalente ad affermare che il campo totale evolva in accordo
all’equazione
Ë(t) + 2αĖ(t) + α2 E(t) =
α2 X
δ(t − tn ) ,
N n|tn <t
(2.17)
dove la sommatoria nel membro a destra rappresenta il termine di sorgente dovuto
agli impulsi emessi a tempi tn < t. Quindi la dinamica della rete è data da N
equazioni (2.16) più la (2.17) che descrive l’evoluzione del campo.
2.3.2
Mappa guidata dall’evento
È conveniente trasformare le equazioni differenziali in una mappa a tempo discreto;
per fare questo occorre integrare l’equazione (2.17) tra il tempo tn e il tempo tn+1 ,
dove tn è il tempo immediatamente successivo all’emissione dell’n-simo impulso. La
mappa risultante è
E(n + 1) = E(n)e−ατ (n) + NQ(n)τ (n)e−ατ (n)
Q(n + 1) = Q(n)e−ατ (n) +
α2
,
N2
(2.18)
(2.19)
dove τ (n) = tn+1 − tn è l’intervallo temporale tra un impulso e il successivo e dove
abbiamo introdotto la nuova variabile Q := (αE + Ė)/N. L’ equazione (2.16) può
essere integrata anche esplicitando la dipendenza temporale nota del campo E
vi (n + 1) = vi (n)e−τ (n) + a 1 − e−τ (n) + gF (n)
i = 1, . . . ,N .
(2.20)
dove F è
NQ(n)
τ (n)e−ατ (n)
e−τ (n) − e−ατ (n)
E(n) +
−
NQ(n) .
F (n) =
α−1
α−1
(α − 1)
!
(2.21)
L’intervallo temporale tra un impulso e l’altro τ è ottenuto imponendo la condizione
vm (n + 1) = 1,
"
vm (n) − a
τ (n) = ln
1 − gF (n) − a
#
.
(2.22)
dove l’indice m identifica il neurone più vicino a soglia. Le equazioni (??, 2.19)
e (2.21) possono essere scritte in una forma più compatta esprimendo F (n) come
funzione di τ (n) per mezzo dell’equazione (2.22),
vi (n + 1) = vi (n)e−τ (n) + 1 − vm (n)e−τ (n)
j = 1, . . . ,N − 1 .
(2.23)
Dal momento che in una rete di neuroni indistinguibili viene preservato l’ordine dei
potenziali vi , è conveniente per prima cosa ordinarli e poi introdurre il sistema di
riferimento comovente, ovvero xj (n) = vj−n (n). In questo sistema di riferimento
l’indice del neurone più vicino a soglia è costante e può essere scelto sempre uguale
a 1, senza perdere di generalità; l’equazione di aggiornamento può dunque essere
scritta come
xj−1 (n + 1) = xj (n)e−τ (n) + 1 − x1 (n)e−τ (n)
j = 1, . . . ,N − 1 ,
(2.24)
con la condizione al contorno xN = 0 e dove,
"
x1 (n) − a
τ (n) = ln
1 − gF (n) − a
#
.
(2.25)
L’insieme di equazioni (2.18, 2.19, 2.24, 2.25, 2.21) definisce una mappa a tempo
discreto che è completamente equivalente all’insieme di equazioni differenziali di
partenza. Si ottiene cosı̀, che una rete di N neuroni identici può essere descritta per
mezzo di N + 1 equazioni, due delle quali tengono conto della dinamica di E(n),
mentre le rimanenti N − 1 equazioni descrivono l’evoluzione dei neuroni (un grado
di libertà è stato perso perso andiamo da uno sparo all’altro, ovvero xN non è più
una variabile dal momento che è stata posta, per definizione, sempre uguale a 0). Il
modello ha una dimensione finita, inoltre, in questo sistema di riferimento, lo splay
state periodico si riduce ad un punto fisso che soddisfa le seguenti condizioni:
τ (n) ≡
T
,
N
E(n) ≡ Ẽ ,
(2.26)
Q(n) ≡ Q̃ ,
x̃j−1 = x̃j e−T /N + 1 − x̃1 e−T /N ,
(2.27)
(2.28)
dove T è il tempo che intercorre tra due emissioni di impulso consecutive dello stesso
neurone. Attraverso un semplice calcolo si ottiene
−1
−1
α2 Q̃ = 2 1 − e−αT /N
, Ẽ = T Q̃ eαT /N − 1
.
N
La soluzione dell’equazione (2.28) coinvolge una serie geometrica, la quale, insieme
alla condizione di bordo x̃N = 0, porta ad un’equazione trascendentale per il periodo
T ; senza dar luogo a sorprese, il risultato è indipendente dall’ampiezza dell’impulso
α. Per semplicità riportiamo solo i termini all’ordine O(1/N) nel limite N ≫ 1,
aT + g 1 − e−j T /N ,
"T
#
aT + g
T = ln
.
(a − 1)T + g
x̃N −j =
(2.29)
(2.30)
Se supponiamo di aver a che fare con neuroni disaccoppiati in regime di sparo ripetitivo, cioè se prendiamo a > 1, il periodo T è ben definito nel caso eccitatorio (g > 0)
solo per g < 1 (T → 0 quando g si avvicina ad 1), mentre nel caso inibitorio (g < 0),
esiste una soluzione significativa per qualsiasi valore dell’accoppiamento (T → ∞
per g → −∞).
2.3.3
Stabilità lineare
Al fine di effettuare l’analisi di stabilità dello splay state, è necessario linearizzare le
equazioni (2.18, 2.19, 2.24) attorno al punto fisso (2.26, 2.27, 2.28),
δE(n + 1) = e−αT /N δE(n) + T e−αT /N δQ(n)
−
αẼ − N Q̃e−αT /N δτ (n) ,
δQ(n + 1) = e−αT /N δQ(n) − αQ̃e−αT /N δτ (n) ,
δxj−1 (n + 1) = e−T /N [δxj (n) − δx1 (n)] + e−T /N (x̃1 − x̃j )δτ (n) ,
(2.31)
(2.32)
(2.33)
dove abbiamo introdotto δτ (n), la cui espressione può essere ottenuta linearizzando
le equazioni (2.25,2.21)
δτ (n) = τx δx1 (n) + τE δE(n) + τQ δQ(n) ;
(2.34)
dove τx := ∂τ /∂x1 e dove sono state adottate definizioni analoghe per τE e τQ .
La condizione al contorno xN ≡ 0 imposta dal sistema di riferimento comovente
dà δxN = 0. In pratica, il problema di stabilità è risolto calcolando lo spettro di
1.0
Im{µk}
0.5
0.0
-0.5
-1.0
-1.0
-0.5
0.0
Re{µκ}
0.5
1.0
Figura 2.9. Cerchio unitario e moltiplicatori esatti dello spettro di Floquet per la
mappa completa per N = 20 (cerchi rossi) e N = 10 (cerchi blue) per accoppiamento eccitatorio. I parametri sono a = 3.0, g = 0.4, e α = 30.0.[26]
Floquet dei moltiplicatori {µk }, k = 1, · · · ,N + 1, associati con il problema agli autovalori dell’insieme di equazioni lineari (2.31,2.32,2.33); tale calcolo deve essere, in
generale, effettuato, numericamente. Discutiamo innanzitutto il caso banale g = 0;
in questo caso si trova che µk = exp(iϕk ), dove ϕk =
2πk
,
N
k = 1, · · · ,N − 1, e
µN = µN +1 = exp(−αT /N). Gli ultimi due esponenti interessano la dinamica del
campo di accoppiamento E(t), il cui decadimento è regolato dalla scala temporale α−1 . Non appena l’accoppiamento è acceso, piccole fluttuazioni di ampiezza
∼ O(g/N) influenzano la dinamica dei neuroni e i moltiplicatori dello spettro di
Floquet assumono la forma
µk = eiϕk eT (λk +iωk )/N , ϕk =
2πk
, k = 1, . . . ,N − 1 ,
N
(2.35)
µN = eT (λN +iωN )/N , µN +1 = eT (λN+1 +iωN+1 )/N ,
dove λk e ωk sono la parte reale e immaginaria degli esponenti di Floquet.
In figura (2.9) mostriamo i moltiplicatori dello spettro di Floquet dello splay
state nel caso di accoppiamento eccitatorio e valori di N finiti. I moltiplicatori con
k = 1, · · · ,N − 1 sono molto vicini al cerchio unitario, mentre i due moltiplicatori
isolati µN e µN +1 giacciono molto vicini all’asse reale all’interno del cerchio unitario.
Dal momento che, già per g/N ≈ O(10−2 ), i moltiplicatori del caso accoppiato
possono essere visti come una “perturbazione” piccola del caso non accoppiato (cioè
con g = 0), possiamo cercare di dar vita ad un approccio perturbativo. Prima
di effettuare questo tipo di analisi occorre sottolineare che la variabile ϕk gioca lo
stesso ruolo giocato dal numero d’onda nell’analisi di stabilità lineare di sistemi
spazialmente estesi, cosı̀ che possiamo dire che λk caratterizza la stabilità del kesimo modo. Nell’analisi che segue è conveniente distinguere tra i modi caratterizzati
da ϕk ≈ 0, mod(2π) +O(1/N) e tutti gli altri modi. Si identificano dunque due
componenti spettrali che richiedono di essere trattate in modo matematicamente
diverso: la prima componente corrisponde alla condizione kµk − 1k ∼ N −1 ed è
identificata con la dicitura “lunghezze d’onda grandi” (in inglese long wavelenghts
o LWs); la seconda componente corrisponde a kµk − 1k ∼ O(1) ed è identificata con
“lunghezze d’onda brevi” (in inglese short wavelenghts o SWs).
2.4
Impulso di durata finita
Analizziamo adesso il problema di stabilità dello splay state per reti soggette ad
impulsi con α finito (cioè indipendente dalla dimensione del sistema) per grandi
valori di N. Considerando i termini all’ordine 1/N, la mappa ad evento guidato
(vedi equazioni (2.18, 2.19, 2.24) ) si semplifica nel seguente insieme di N + 1
equazioni:
E(n + 1) = (1 − ατ )E(n) + NQ(n)τ ,
Q(n + 1) = (1 − ατ )Q(n) +
α2
,
N2
xj−1 (n + 1) = (1 − τ )xj (n) + 1 − x1 (n) + τ ,
(2.36)
(2.37)
(2.38)
dove j = 1, . . . ,N −1 mentre τ x1 è stato approssimato con τ poiché 1−x1 ≈ O(1/N).
L’espressione per l’intervallo di intersparo (2.25) si semplifica cosı̀ in
τ (n) =
1 − x1 (n)
.
a − 1 + gE(n)
(2.39)
La soluzione periodica per il campo che tiene conto di tutti gli impulsi diventa
Ẽ = T −1 e Q̃ = α/NT , mentre x̃j e il periodo T sono ancora dati dall’equazioni
(2.29, 2.30). Lo spettro degli autovalori di Floquet µk , k = 1, · · · ,N + 1 può essere
ottenuto linearizzando le equazioni (2.36, 2.37, 2.38) nell’intorno di questa soluzione
periodica e assumendo che ciascuna perturbazione cresca come µnk
µk δE = (1 − αT /N)δE + T δQ ,
µk δQ = (1 − αT /N)δQ −
(2.40)
α2
δτ ,
NT
(2.41)
µk δxj−1 = (1 − T /N)δxj − δx1 + (1 − x̃j )δτ ,
(2.42)
Un’espressione esplicita per δτ si può ottenere valutando la derivata dell’equazione
(2.39)
δτ = −
T2
T
δE − δx1 .
N
g
Sostituendo quanto trovato nelle equazioni (2.40,2.41,2.42), vediamo che il problema
agli autovalori consiste nel trovare le N + 1 radici µk del polinomio associato; una
semplificazione parziale del problema può essere ottenuta estraendo dalle equazioni
(2.41) e (2.42) la dipendenza di δτ dalla perturbazione del potenziale del neurone
più vicino a soglia δx1
δτ = Kδx1
(2.43)
dove
α2 gT
K = −(a − 1 + g/T ) + 2
N (µk − 1 + αT /N)2
"
#−1
.
(2.44)
Infine, sostituendo questa espressione nell’equazione (2.40), otteniamo un insieme
chiuso di equazioni per le perturbazioni del potenziale di membrana,
µk δxj−1 = (1 − T /N)δxj + (K − 1)δx1 − K x̃j δx1 .
(2.45)
Dopo aver imposto la condizione di bordo δxN = 0, l’equazione (2.45) si riduce alla
seguente equazione agli autovalori:
µkN −1 eT
1 − µkN −1
1 − µkN −1 eT
= K(a + g/T )
− [K(a − 1 + g/T ) + 1]
,
1 − µk
1 − µk eT /N
(2.46)
dove K è una funzione di µk . Al fine di risolvere questa equazione analiticamente è
necessario effettuare la distinzione tra lunghezze d’onda grandi e piccole.
2.4.1
Lunghezze d’onda grandi
Consideriamo i modi per cui kµk −1k ∼ N −1 (o, equivalentemente, ϕk ≈ 0, mod(2π)
+O(1/N)). Al fine di semplificare la notazione definiamo
Λk :=
N
ln µk .
T
All’ordine principale, K vale
α2 g
K = −(a − 1 + g/T ) +
T (Λk + α)2
"
#−1
.
Sostituendo questa espressione nell’equazione agli autovalori (2.46) e rimuovendo i
termini in 1/N, si ottiene
aT + g 2
T
−Λk T
−Λk T
, ||Λk || =
6 0.
(Λ
+
α)
(Λ
+
1)
=
Λ
e
−
e
1
−
e
k
k
k
α2 g
(2.47)
Questa equazione coincide con quella derivata attraverso l’analisi di campo medio
[28], eccetto per il fattore ||Λk || = 0, che corrisponde all’esponente di Floquet zero
dell’evoluzione temporale continua (2.16) e scompare nella dinamica a tempo discreto. Occorre sottolineare ancora che, nonostante l’equazione (2.47) abbia N +1 radici,
questa dà un’opportuna approssimazione solo per quelli autovalori che soddisfano la
relazione ||µk − 1|| ∼ N −1 .
2.4.2
Lunghezze d’onda piccole
La seconda componente dello spettro (2.35) è ottenuta per ||µk − 1|| ∼ O(1). In
questo caso K ha la semplice forma
K = −(a − 1 + g/T )−1 .
Introducendo nell’equazione (2.46) la forma esplicita della soluzione periodica (2.30),
si ottiene una notevole semplificazione per lo spettro, ovvero
−T
µN
k = e
a + g/T
=1,
a − 1 + g/T
(2.48)
i.e., questo coincide con uno spettro di Floquet completamente degenere,
ω k ≡ 0 , λk ≡ 0
(2.49)
Notiamo che questa approssimazione vale solo per quelli autovalori per cui ||µk −1|| ∼
O(1), ovvero vale per la maggior parte dello spettro, eccetto quelli autovalori che
giacciono vicino al punto (1,0), dove il cerchio unitario intercetta l’asse reale (vedi
fig. 2.9).
Per quanto riguarda gli autovalori isolati µN e µN +1 , si può facilmente intuire
che questi possano essere sempre contenuti all’interno del cerchio unitario, vicino
all’asse reale, per N finiti e ampiezze dell’impulso finite, e che si avvicinino al punto
(1,0) da sinistra nel limite N → ∞; dunque questi possono al più contribuire alla
stabilità marginale della dinamica.
2.4.3
Diagramma di fase e correzioni di taglia finita
In accordo con i precedenti risultati possiamo dire che, nel limite N → ∞, il manifestarsi dell’instabilità è determinato dagli esponenti di Floquet associati con le LW;
inoltre si ottiene che lo splay state è sempre instabile per accoppiamento inibitorio
α
200
150
INSTABILE
100
50
STABILE
0
0
0.2
0.4
g
0.6
0.8
1
Figura 2.10. Diagramma di fase per la stabilità dello splay state in una rete
neurale con accoppiamento eccitatorio che agisce attraverso un impulso di durata
finita. La linea continua che separa la regione stabile da quella instabile nel piano
(g,α) è stata ricavata dalla formula analitica dello spettro di Floquet (2.47) con
a = 1.3 . Occorre sottolineare che, in questo contesto, stabile si riferisce ad N finiti,
dal momento che per sistemi infiniti la stabilità diventerà marginale.[26]
(g < 0). Nel caso di accoppiamento eccitatorio l’analisi di campo medio predice
stabilità per lo splay state per α ≤ αc (g,a), dove αc (g,a) è la linea critica che separa
la regione stabile da quella instabile (vedi figura 2.10). Questa linea corrisponde
ad una biforcazione di Hopf che dà vita ad un nuovo comportamento periodico collettivo chiamato sincronizzazione parziale . Inoltre si ha che αc diverge a +∞ per
g → 1 ( per g > 1 non può essere sostenuto un regime stazionario dal momento che
l’evoluzione accelera in maniera uniforme ). Nel limite opposto di accoppiamento
che si annulla (g → 0), la biforcazione sopravvive; dall’equazione (2.47) si può vedere
inoltre che la frequenza ωc della soluzione di biforcazione converge a ωc = 2π/T e
αc = −1 +
q
1 + ωc2.
Includendo il ruolo delle SW possiamo concludere che, nel limite N → ∞, lo
stato stazionario può essere al più marginalmente stabile per α ≤ αc (g,a). La degenerazione perfetta dell’esponente zero di Floquet associata con le lunghezze d’onda
brevi toglie i dubbi sulle proprietà di stabilità efficaci di reti grandi ma finite, dal momento che tali modi sono marginalmente stabili. Risolvendo inoltre numericamente
le equazioni agli autovalori (2.31,2.32,2.33) al variare delle dimensioni del sistema
10
-2
|λk|
10
λk
(a)
0
(b)
-0.001
-3
-0.002
10
10
-4
-0.003
-0.004
-5
-0.005
10
-6
10
0
10
1
10
2
k
10
3
-600 -400 -200
0
ϕkN
200
400
600
Figura 2.11. (a) Grafico log-log dei valori assoluti degli esponenti di Floquet λk ,
ordinati dal più grande al più piccolo come funzione dell’indice k = 1,...,N per
N = 100,200,400. La linea tratteggiata ha una pendenza di -2. (b) Esponente
di Floquet come funzione della fase riscalata ϕN , per N = 100 (cerchi neri) and
N = 200 (cerchi rossi). In entrambe le figure i valori dei parametri sono a = 3.0,
g = 0.4, e α = 30.0.[26]
e al variare di g e α si ottiene che lo splay state è strettamente stabile in reticoli
finiti e che l’esponente di Floquet massimo tende a zero da sotto con un andamento
del tipo 1/N 2 (vedi figura 2.11). Questo implica che una teoria delle perturbazioni
fatta fino all’ordine 1/N non può tener conto delle instabilità del modello originale.
Questo è confermato dalla figura 2.12 dove gli spettri di Floquet ottenuti da approssimazioni al primo e al secondo ordine danno luogo ad uno splay state instabile,
anche se la soluzione numerica del problema di stabilità indica che il modello ad N
finito è stabile.
Riassumendo, la stabilità dello splay state può essere indagata riducendo un
modello di equazioni differenziali globalmente accoppiate a delle opportune mappe
guidate dall’evento, che mettono in relazione le configurazioni interne della rete corrispondenti a due emissioni consecutive del potenziale di azione. L’analisi analitica
dello Jacobiano nel limite di grandi N rivela che lo spettro degli autovalori è costituito da due componenti: (i) modi propri di grandi lunghezze d’onda; (ii) modi propri
di brevi lunghezze d’onda. Un approccio di campo medio è capace di riprodurre la
parte dello spettro associata ai modi di grandi lunghezze d’onda col rischio di non
catturare l’instabilità che si manifesta a lunghezze d’onda piccole.
8×10
-4
λk
4×10
-4
0
-4×10
-4
-4
-8×10 -π
-π/2
0
π/2
ϕk
π
Figura 2.12. Esponenti di Floquet λk (ϕ) come funzione della fase ϕk per impulsi
di durata finita α = 30.0 e numero di neuroni finito N = 500 nel caso di accoppiamento eccitatorio g = 0.4. Le cerchi pieni rappresentano il risultato esatto per
N finito, mentre i quadrati rossi quadrati e i triangoli blue vuoti si riferiscono a
risultati approssimati corretti rispettivamente fino al primo e al secondo ordine in
1/N . Il parametro qui è a = 3.[26]
2.4.4
Altri stati collettivi della rete
Discutiamo brevemente adesso della soluzione collettiva che nasce al di sopra della
linea αc (g,a) (vedi figura 2.10), detta sincronizzazione parziale. In questo regime il
campo medio esibisce una dinamica periodica che si manifesta in assenza di qualsiasi
sincronizzazione tra i singoli neuroni, i quali si comportano in modo quasi periodico.
La sincronizzazione parziale deriva dalla destabilizzazione del regime splay state,
che è invece caratterizzato da un campo medio costante e da un comportamento
periodico dei singoli neuroni, le cui fasi sono equispaziate.
In una rete di neuroni LIF, in cui l’accoppiamento è modellizzato da una funzione
α, come in (2.17), troviamo che, per accoppiamento eccitatorio, le reti evolvono verso uno stato asincrono (splay state) se le costanti di accoppiamento temporale sono
sufficientemente basse (piccoli α). Quando α aumenta, la rete inizia a sincronizzarsi; per costanti di tempo finite la rete non raggiunge sincronia completa anche
se è costituita da oscillatori identici e il sistema è completamente privo di rumore.
Solo nel limite di α → ∞ e di durata dell’impulso che tende a zero, lo stato diventa
completamente sincronizzato. Dunque se attraversiamo il diagramma di fase nel
piano (g,α) mantenendo g = costante, passiamo, al crescere di α dallo splay state
alla sincronizzazione parziale e solo nel limite α → ∞ otteniamo una sicronizzazione
completa. Se la rete è composta da più di due unità, i neuroni sparano quasi periodicamente nello stato parzialmente sincronizzato; in sistemi di grandi dimensioni
il tasso di sparo medio della rete in questo stato parzialmente sincronizzato varia
periodicamente, anche se le singole unità sono quasiperiodiche.
Con accoppiamento inibitorio la rete sincronizza completamente per α piccoli;
per α grandi la rete si rompe in due o più cluster completamente sincronizzati. Il numero medio di cluster che si forma cresce al crescere di α, sebbene il numero esatto di
cluster formati dipenda dalle condizioni iniziali. Per una rete con un numero grande
ma finito di oscillatori il numero di cluster formati tenderà ad essere pari al numero
di neuroni, dunque, lo stato finale sarà indistinguibile dallo splay state. Cosı̀ con
accoppiamento inibitorio, il sistema passa da uno stato completamente sincronizzato per piccoli α, ad uno stato sostanzialmente asincrono per grandi α, attraverso
la formazione di un numero crescente di cluster completamente sincronizzati; nel
limite α → ∞ si ritrova lo splay state. La transizione da un sistema sincrono ad
uno asincrono è accompagnata dall’allargamento di un cluster piuttosto che dalla
rottura in più cluster.
In figura (2.13) mostriamo alcuni risultati di simulazioni numeriche effettuate
nel regime di sincronizzazione parziale. Analizziamo in particolare la figura (b).
Se indichiamo con tn [i] il tempo a cui l’i-esimo neurone emette un impulso, e con
T (tn [i]) l’ultimo ISI dello stesso neurone, possiamo ricostriure tutti i tempi di sparo
passati iterando semplicemente la formula ricorsiva
tn−1 [i] = tn [i] − T (tn [i]).
(2.50)
Geometricamente, implementare questa formula corrisponde ad eseguire la seguente
procedura (fig. 2.13(b)): dato il punto (tn ,T (tn )) ci muoviamo verso il basso lungo
la retta di pendenza 1 fino a raggiungere l’asse t al tempo tn−1 ; a questo punto ci
spostiamo verticalmente, verso l’alto, fino ad incontrare la curva T . Considerando
che T (t) è una funzione periodica definita positiva, l’equazione (2.50) non è nient’altro che l’equazione di evoluzione di un oscillatore periodico forzato; ci aspettiamo
dunque l’insorgere di fenomeni di bloccaggio ( in inglese locking ). D’altra parte le
simulazioni numeriche non presentano alcun fenomeno di bloccaggio, anche quando
il rapporto tra le frequenze caratteristiche del termine forzante e del campo forzato
è razionale. Questa caratteristica rimane inspiegata.
In figura (2.13(c)) è riportato l’andamento del “flusso istantaneo” in funzione del
tempo; tale flusso è definito da
π(t) =
1/N
,
tm+1 − tm
(2.51)
dove (tm+1 −tm ) ≈ (1/N) è l’intervallo tra due spari consecutivi della rete; il membro
a sinistra di questa equazione non presenta il pedice m, perché nel limite N → ∞
la variabile temporale diventa nuovamente continua.
Un’altra peculiarità dello stato di sincronizzazione parziale è il fatto che gli ISI
dei singoli neuroni differiscano dal periodo della dinamica macroscopica; in altre
parole i tempi tra un’emissione e la successiva di un impulso, da parte del singolo
neurone, sono sempre più piccoli del periodo di oscillazione del campo forzante.
Possiamo spiegare il fenomeno, in maniera qualitativa, osservando che, da un lato,
i neuroni tendono a raggrupparsi, dall’altro, i neuroni che si trovano sul fronte del
raggruppamento tendono a scappare, mentre quelli che raggiungono il gruppo dalle
retrovie vi si uniscono. Questo giustifica anche il nome di “sincronizzazione parziale”
attribuito a questo fenomeno.
Infine, dalle analisi numeriche svolte sul modello originale soggetto a rumore
additivo, uniformemente distribuito e a media nulla, vediamo (figura 2.13(a)) che il
comportamento collettivo persiste, nonostante sia depresso dall’azione del rumore.
Il campo E ha un’ampiezza più piccola in presenza del rumore, mentre la larghezza
della curva sembra descrescere all’aumentare del numero di oscillatori presenti nella
√
rete con un andamento del tipo 1/ N .
Figura 2.13. (a) Rappresentazione nel piano delle fasi (E,Ė); i punti corrispondono a simulazioni effettuate in presenza di rumore additivo uniformemente distribuito. (b) Evoluzione, in funzione del tempo, dell’intervallo temporale tra uno
sparo e l’altro del singolo neurone (T ). In figura è rappresentato anche un metodo
per ricostruire il tempo di sparo del singolo neurone. (c) Evoluzione temporale del
flusso istantaneo π.[22]
2.5
Desincronizzazione in reti neurali diluite
In questa sezione vogliamo analizzare l’effetto della diluizione delle connessioni fra i
neuroni sulla dinamica di una rete neurale con accoppiamenti solo inibitori. Per rete
diluita si intende una rete neurale in cui siano stati recisi dei legami fra neuroni anche
in modo asimmetrico. Per comprendere il ruolo della diluizione, ricordiamo innanzitutto i risultati noti per reti di neuroni LIF globalmente accoppiati. In quest’ambito
sono di notevole importanza i risultati rigorosi pubblicati da Jin in Ref. [30] per una
rete non omogenea di neuroni LIF globalmente accoppiati, le cui connessioni sono
3
2.5
2
E 1.5
1
0.5
0
Figura 2.14.
354
356
358
Tempo
360
362
364
Andamento del campo E in funzione del tempo nel regime di sincronizzazione parziale e in assenza di rumore additivo.
dominate da inibizione globale. In questo caso sia il numero dei neuroni, sia la distribuzione delle correnti esterne che le ampiezze delle connettività sono arbitrarie;
ogni neurone inoltre può avere una diversa soglia di sparo, un diverso potenziale
di riposo della membrana e un diverso valore a cui riassegnare il potenziale dopo
l’emissione di un impulso. Ciononostante Jin ha dimostrato che, in questo sistema,
la sequenza di impulsi converge a configurazioni periodiche stabili da quasi tutti gli
stati iniziali. Ha dimostrato inoltre che il tempo necessario a tale convergenza (detto
transiente) è finito ed al massimo diverge come una potenza del numero di neuroni
nella rete; il transiente si abbrevia al crescere dell’inibizione globale. Si potrebbe
osservare una divergenza del transiente solo nell’eventualità che due neuroni raggiungessero contemporaneamente la soglia, ma tale situazione si ottiene solo in un
insieme ristretto di stati iniziali dei neuroni che si restringe sempre di più al crescere
del livello di inibizione.
A partire dal modello di rete neurale con accoppiamento inibitorio, descritto in
[30], introduciamo la diluizione e mostriamo che nella versione diluita di tale modello
sono osservati tipicamente dei transienti esponenzialmente lunghi, in presenza di un
accoppiamento sufficientemente grande, anche se l’esponente di Lyapunov1 massimo
1
La caratterizzazione della dinamica in termini di esponenti di Lyapunov verraà discussa in
del sistema rimane negativo. In altri termini, per piccoli valori della costante di
accoppiamento la dinamica converge, dopo un breve transiente, verso lo splay state
e l’unico effetto dovuto alla soppressione di una piccola percentuale di legami tra
i neuroni è la presenza di inomogeneità nelle mutue interazioni che porta a piccole
difformità negli intervalli tra un’emissione e l’altra dell’impulso. D’altra parte, per
valori dell’accoppiamento sufficientemente grandi, sono osservati dei transienti di
tipo stocastico, la cui durata è esponenzialmente lunga con la dimensione della
rete. Dal momento che vari indicatori mostrano che questo regime è stazionario,
è logico aspettarsi che, nel limite di reti infinitamente grandi, questo transiente
rappresenti una fase termodinamica perfettamente legittima. Dal momento che il
comportamento pseudocaotico è sostenuto dalle discontinuità nella regola con cui
viene effettuata una mappatura [27], è naturale aspettarsi che questo valga anche
nel caso presente; osserviamo infatti che in presenza di disordine, dove i neuroni
non sono più l’uno equivalente all’altro, si verificano cambiamenti nell’ordine di
sparo che accompagnano le discontinuità nella regola di evoluzione della mappa. La
transizione si manifesta dunque come un fenomeno di desincronizzazione collettivo;
tale fenomeno è analizzabile solo attraverso simulazioni numeriche, dal momento che
l’analisi di stabilità lineare non permette di identificare la soglia oltre la quale si ha
la transizione poiché tutte le traiettorie sono asintoticamente stabili in entrambi i
regimi. Riportiamo di seguito i principali risultati conseguiti da Zillmer et al. [25]
grazie all’analisi numerica.
In una rete di N neuroni LIF, lo stato dell’i-esimo neurone è completamente
determinato dal potenziale di membrana Vi (t̃) ed obbedisce all’equazione
τ V̇i = C − Vi − τ (Vi + W )
N X
X
j=1 m
(m)
gij δ(t̃ − t̃j ) ,
(2.52)
dove τ è la costante di tempo di membrana, C è la corrente in ingresso sopra soglia
dettaglio nel capitolo successivo.
(che si riferisce ad una resistenza di membrana unitaria) e W è il potenziale di
inversione. Ogniqualvolta il potenziale Vj (t̃) raggiunge il valore di soglia Θ, viene
riassegnato al valore R < Θ e viene emesso un impulso; tale impulso è ricevuto
(m)
istantaneamente da tutti i neuroni connessi a quello che ha sparato, al tempo t̃j
(m identifica l’evento di sparo del j-esimo neurone). La ricezione dell’impulso da
parte dell’i-esimo neurone provoca un abbassamento del potenziale di membrana di
tale neurone, in accordo con la trasformazione
Vi′ + W = (Vi + W ) exp(−gij ).
(2.53)
L’ultimo ingrediente che definisce la dinamica del sistema è la matrice di connettività
gij . La forza di accoppiamento è riscalata con la connettività del neurone che riceve
l’impulso, per cui
gij =
G/ℓi , se i e j sono connessi,
0,
(2.54)
altrimenti,
dove G è la costante di accoppiamento e li il numero di connessioni in ingresso al
neurone i. In altre parole, consideriamo il tipo più semplice di disordine, determinato dalla presenza, o dall’assenza, dei legami tra i neuroni (le autointerazioni sono
escluse). La frazione rm di legami mancanti è determinata fissando deterministicamente il numero totale Nm di legami recisi [Nm = rm N(N −1)]; scegliendo di tagliare
il 5% dei legami si ha rm = 0.05 (caso di debole disordine). A differenza del modello
analizzato in Ref. [30], dove sono distribuite in maniera casuale sia le costanti di
accoppiamento gij , che le correnti di soglia Cij , qui l’unica sorgente di disordine è la
presenza (assenza) di connessioni inibitorie. L’altra importante differenza riguarda
la costante di accoppiamento: mentre in [30] non è ipotizzata nessuna dipendenza
dalla dimensione del sistema, in questo caso è assunta una dipendenza inversamente
proporzionale dal numero di connessioni entranti.
-3.8
N=100
N=200
N=300
Λ
-4
-4.2
-4.4
0
0.1
0.05
rc
0.15
0.2
Figura 2.15. Esponente di Lyapunov massimo in funzione della frazione di legami
recisi e per tre valori diversi della dimensione della rete.[25]
10
5
10
10
10
<Tr>i,d , <Tp>i,d
<Tr>i,d
N=100
N=200
4
10
3
10
1
g
1.5
Transiente
Periodo
Transiente
Periodo
6
10
g=2.5
5
4
10
10
0.5
7
g=1.8
3
2
40
60
80
100
120
140
N
Figura 2.16. (a) Lunghezza media del transiente < ttr > in funzione della costante
di accoppiamento G per due dimensioni diverse della rete. (b) Lunghezza media del
transiente < ttr > (linea continua) e corrispondente periodo < T > dell’attrattore
periodico (linea tratteggiata) in funzione della dimensione della rete. In ascissa la
scala usata è logaritmica. [25]
Ci aspettiamo che il debole disordine introdotto dalla diluizione riduca la forza
della costante di accoppiamento tra i neuroni e faccia aumentare il valore dell’esponente di Lyapunov massimo Λ, rispetto al caso di neuroni completamente accoppiati. Analizzando la figura (2.15) vediamo che l’esponente di Lyapunov massimo
cresce al crescere della frazione di legami tagliati, ma rimane negativo almeno fino
a rm = 0.2. Inoltre le simulazioni numeriche indicano che Λ rimane finito nel limite
termodinamico N → ∞.
Dunque, prima o poi, la dinamica deve convergere verso un’orbita periodica
stabile.
La durata del transiente ttr è definita come il tempo più piccolo necessario affinché
la presente configurazione del potenziale di membrana sia ε vicina ad uno stato
precedente,
ttr =
min t max |vi (t + T ) − vi (t)|
i
<ε ,
dove vi = (Vi − R)/(Θ − R), 1 ≤ i ≤ N e 1 ≤ T ≤ t − 1. Con questa procedura
determiniamo non solo la lunghezza del transiente, ma anche la periodicità T della
soluzione asintotica. Calcoliamo a questo punto la lunghezza media del transiente
< ttr >: la media è effettuata sia su differenti realizzazioni della rete sia su differenti condizioni iniziali dei potenziali di membrana. In figura (2.16a) è riportato
l’andamento della lunghezza media del transiente in funzione di G, per due reti di
dimensione diversa (N = 100,200). Per G ≤ 1, < ttr > decresce leggermente all’aumentare della forza di accoppiamento; aumentando la forza di accoppiamento si
verifica un’improvvisa crescita di < ttr >. Inoltre il tasso di crescita è significativamente più rilevante quando la dimensione della rete viene raddoppiata. Questi dati
suggeriscono dunque l’esistenza di due fasi distinte, che corrispondono approssimativamente a G minore o maggiore di 1. Vediamo adesso come la lunghezza media del
transiente < ttr > e il periodo medio dello stato finale < T > scalano con N (figura
2.16b): per G = 0.5 la lunghezza del transiente cresce linearmente con N, mentre
il periodo medio dell’attrattore asintotico rimane pressoché costante; per G = 1.8
e per G = 2.5 il transiente cresce in modo esponenzialmente veloce. Inoltre per
G = 2.5 anche il periodo cresce esponenzialmente e ciò può essere considerato come
un’indicazione preliminare del fatto che ci possa essere un’ulteriore transizione per
valori della forza di accoppiamento maggiori. Ad ogni modo, focalizziamo la nostra attenzione sui cambiamenti qualitativi che avvengono a G ≈ 1 dove comincia a
crescere esponenzialmente solo il transiente.
50
Indice di Neurone
40
30
20
10
0
10250
10300
10350
10400
10450
Tempo
250
50
200
40
Indice di Neurone
Indice di Neurone
Figura 2.17. Configurazione di sparo (indice del neurone che spara vs tempo) di
un tipico attrattore periodico per G = 2, N = 50 nella LP.[25]
150
30
100
20
50
0
10
140
150
Tempo
160
170
0
17350
17400
17450
17500
17550
17600
Tempo
Figura 2.18. (a) Configurazione di sparo per G = 2, N = 50 nella UP. (b) Configurazione di sparo associata ad un attrattore periodico nella UP per G = 20,
N = 50. Il periodo è indicato dalle linee verticali.[25]
Per G <≃ 1, l’evoluzione dinamica del sistema è simile a quella del caso completamente accoppiato. Dopo un transiente di breve durata, il sistema converge ad
uno stato caratterizzato da una sequenza di N spari ( emessi da N neuroni ), che
si ripetono periodicamente (vedi figura 2.17). Tutti i neuroni sparano con lo stesso
ritmo, ma le loro fasi sono equispaziate; in altri termini la soluzione asintotica è
uno stato sincronizzato (in inglese locked phase o LP). La differenza sostanziale con
il caso completamente accoppiato sta nel fatto che le sequenze di impulsi differenti
non sono equivalenti l’una all’altra. Nel limite di neuroni identicamente accoppiati
la dinamica è invariante sotto qualsiasi permutazione, cosa che non è più vera nel
momento in cui si introducono delle eterogeneità nella connettività della rete. Ne
deriva cosı̀ che, per rm >≃ 0 esiste un numero esponenzialmente grande di attrattori periodici. Più precisamente, il numero totale di attrattori è dell’ordine di
N!/(
QM
d=1
Nd !), dove Nd è il numero di neuroni connessi agli stessi neuroni (sia in
entrata che in uscita) nella rete ed M è il numero di queste classi di equivalenza
presenti in una data realizzazione della rete.
Per valori della costante di accoppiamento più grandi, si manifesta un regime
dinamico irregolare (detto unlocked phase o UP), dove il mutuo ordinamento cambia
durante l’intero transiente, come si può vedere in figura 2.18, dove compare un lento
ma sistematico aggiustamento delle configurazioni.
Riassumendo, la dinamica di transiente ossevata per G ≈> 1: (i) è caratterizzata
da un esponente di Lyapunov negativo; (ii) è effettivamente stazionaria; (iii) ha
durate temporali esponenzialmente lunghe. Queste sono le caratteristiche distintive
del ”caos stabile”, associato alla presenza di discontinuità nello spazio delle fasi.
Nel presente caso la discontinuità è dovuta alla presenza di legami unidirezionali tra
neuroni: nel caso in cui uno dei due legami sia tagliato, uno solo dei due inibisce
l’altro e non si ha più una mutua inibizione. La presenza di discontinuità nello
spazio delle fasi è una condizione per l’instaurarsi di dinamica caotica stabile, ma
il fatto che non si manifestino transienti anomali per piccoli valori della forza di
accoppiamento indica che la condizione è necessaria ma non sufficiente.
Bibliografia
[1] C. Koch, Biophysics of computation, Oxford University Press, New York
(1999).
[2] H.C Tuckwell, Introduction to theoretical neurobiology - Vol. n. 2, Cambridge University Press, New York (1988).
[3] F. Rieke, D. Warland, Rob de Ruyter van Steveninck e W. Bialek, Spikes: exploring the neural code, Massachusetts Institute of Technology: Cambridge,
Massachusetts (1996).
[4] A.L. Hodgkin, A.F. Huxley e B. Katz, Measurement of current-voltage
relations in the membrane of the giant axon of Loligo, J. Physiol. 116,
424-448 (1952).
[5] A.L. Hodgkin e A.F. Huxley, Currents carried by sodium and potassium
ion throught the membrane of the giant axon of Loligo, J. Physiol. 116,
449-472 (1952).
[6] A.L. Hodgkin e A.F. Huxley, A quantitative description of membrane
current and its application to conduction and excitation in nerve, J.
Physiol. 117, 500-544 (1952).
[7] S.H. Strogatz, Exploring Complex Networks, Nature 410, 268-276 (2001).
[8] J.D. Murray, Mathematical Biology, Springer-Verlag, Berlino (1989).
[9] W. Gerstner e W. Kistler, Spiking Neuron Models, Cambridge University
Press, Cambridge (2002).
[10] S. Ramón y Cayal, Histologie du Système Nerveux de l’Homme et des
Vertébré, A. Maloine, Parigi (1909).
[11] J.G. Nicholss, R.A. Martin e B.G. Wallace, Dai Neuroni al cervello,
Zanichelli, Bologna (1997).
58
[12] P. Dayan e L.F. Abbott, Theoretical Neuroscience: Computational and
Mathematical Modeling of Neural Systems, The MIT Press, Cambridge
(2001).
[13] M.N. Shadlen e W.T. Newsome, The variable discharge of cortical neurons: implications for connectivity, computation, and information
coding, J. Neurosci. 18, 3870-3896 (1998).
[14] D.K.S. Smetters, Electrotonic structure and synaptic integration in cortical neurons, Massachusetts Institute of Technology: Cambridge, Massachusetts(1995).
[15] S.G. Cull-Candy, R. Miledi e I. Parker, Single glutamate-activated channels recorded from locust muscle fibres with perfused patch-clamp
electrodes, J. Physiol. 321, 195-210 (1980).
[16] E.R. Kandel, J.H.Schwartz e T.M. Jessell, Principles of neural science,
McGraw-Hill (2000).
[17] D. Johnston e S. Miao-Sin Wu, Foundations of Cellular Neurophysiology,
Massachusetts Institute of Technology: Cambridge, Massachusetts (1995).
[18] K. Huang, Statistical mechanics, John Wiley & Sons, New York (1987).
[19] D.E. Goldman, Potential, impedance and rectification in membranes,
J. Gen. Physiol. 342, 37-60 (1943).
[20] A.L. Hodgkin e B. Katz, The efffect of sodium ions on the electrical
activity of the giant axon of the squid, J. Physiol. 108, 37-77 (1949).
[21] L.J. Mullins e K. Noda, The influence of sodium-free solutions on membrane potential of frog muscle fibers, J. Gen. Physiol. 47, 117-132 (1963).
[22] P.K. Mohanty e A. Politi, A new approach to partial synchronization in
globally coupled rotators, J. Phys. A: Math. Gen. 39, L415-L421 (2006).
[23] A. Beuter, L. Glass, M.C. Mackey, M.S. Titcombe, Nonlinear dynamics in
physiology and medicine, Springer-Verlag, New York (2003).
[24] S.G Lee, A. Neiman e S. Kim, Coherence resonance in a Hodgkin-Huxley
neuron, Phys. Rev. E 57, 3292-3297 (1998).
[25] R. Zillmer, R. Livi, A. Politi e A. Torcini, Desynchronization in diluted
neural networks, Phys. Rev. E 74, 036203 (2006).
[26] R. Zillmer, R. Livi, A. Politi e A. Torcini, Stability of splay state in pulsecoupled networks, Phys. Rev. E 76, 046102 (2007).
[27] F. Ginelli, R. Livi, A. Politi e A. Torcini, Relationship between directed
percolation and the synchronization transition in spatially extended
systems, Phys. Rev. E 67, 046217 (2003).
[28] L.F. Abbott e C. van Vreeswijk, Asynchronous states in networks of
pulse-coupled oscillators, Phys. Rev. E 48, 1483 (1993).
[29] Referenza da trovare
[30] D.Z. Jin, Fast convergence of spike sequences to periodic patterns in
recurrents networks, Phys. Rev. Lett. 89, 208102 (2002).
[31] Y. Yu, W. Wang, J. Wang e F. Liu, Resonance-enhanced signal detection
and transduction in the Hodgkin-Huxley neuronal systems, Phys. Rev.
E 63, 21907 (2001).
[32] R.B. Stein, The frequency of nerve action potentials gerated by applied
currents, Proc. Roy. Soc. Lond. B 167, 64-86 (1967).
[33] J. Guckenheimer e R.A. Oliva, Chaos in the Hodgkin-Huxley model, SIAM
J. Applied Dynamical Systems Vol.1, N.1, 105-114 (2002).
[34] J. Rinzel, On repetitive activity in nerve, Fed. Proc. 37, 2793-802 (1978).
[35] J. Rinzel e R. Miller, Numerical calculations of stable and unstable periodic solutions to the Hodgkin-Huxley equations, Math. Biosci. 49, 27-59
(1980).
[36] T.B. Kepler, L.F. Abbott e E. Marder, Reduction of conductance-based
neuron models, Biol. Cybern. 66, 381-387 (1992).
[37] B. van der Pol, On relaxation oscillations, Phil. Mag. 2, 978-992 (1926).
[38] J. Cronin, Mathematical Aspects of Hodgkin-Huxley Neural Theory,
Cambridge University Press: Cambridge, Regno Unito (1987).
[39] C.E. Shannon, A mathematical theory of communication, The Bell System Technical J. 27, 623 (1948); 27, 379 (1948).
[40] G. Boffetta, M. Cencini, M. Falcioni e A. Vulpiani, Predictability: a way to
characterize complexity, Physics Reports 356, 367-474 (2002).
[41] D.M. MacKay e W.S. McCulloch, The limiting information capacity of a
neuronal link, Bull. math. Biophysics 14, 127 (1952)
[42] J.D. Farmer, Information Dimension and the Probabilistic Structure
of Chaos, Z. Naturforsch. 37 a, 1304-1325 (1982).
[43] F. Moss, A. Bulsara e M.F. Shlesinger, Proceedings of the NATO Advanced Research Workshop on Stochastic Resonance in Physics and
Biology, J. Stat. Phys. 70 (1993).
[44] R. Mannella e P.V.E. McClintock, Proceedings of the International Workshop on Fluctuations in Physics and Biology: Stochastic Resonance,
Signal Processing and Related Phenomena, Nuovo Cimento Soc. Ital.
Fis. 17 (1995).
[45] L. Gammaitoni, P. Hänggi, P. Jung e F. Marchesoni, Stochastic resonance,
Reviews of Modern Physics 70, 223-287 (1998)
[46] H.E. Plesser e W. Gerstner, Noise in integrate and fire neurons: from
stochastic input to escape rates, Neural Comput. 12, 367-384 (2000).
[47] A. Neiman, B. Shulgin, V. Anishchenko, W. Ebeling, L. Schimansky-Geier e J.
Freund, Dynamical Entropies applied to Stochastic Resonance, Phys.
Rev. Lett. 76, 4299-4302 (1996).
[48] E. Salinas e T.J. Sejnowski, Impact of correlated synaptic input on output firing rate and variability in simple neuronal models, J. Neurosci.
20, 6193-6209 (2000).
[49] D.R. Cox, Renewal Theory, Methuen, Londra (1962).
[50] D.R. Cox e H.D. Miller, The Theory of Stochastic Processes, Wiley, New
York (1965).
[51] D. Brown, J. Feng e S. Feerick, Variability of firing of Hodgkin-Huxley
and FitzHugh-Nagumo neurons with stochastic synaptic input, Phys.
Rev. Lett. 82, 4731-4734 (1999).
[52] J. Feng, Behavior of integrate-and-fire and Hodgkin-Huxley models
with correlated inputs, Phys. Rev. E. 63, 51902 (2001).
[53] A.S. Pikovsky e J. Kurths, Coherence Resonance in a Noise-Driven Excitable System, Phys. Rev. Lett. 78, 775-778 (1997).
[54] N.G. van Kampen, Stochastic processes in physics and chemistry, NorthHolland personal library, Amsterdam (1997).
[55] H.A. Kramers, Brownian motion in a field of force and the diffusion
model of chemical reaction, Physica 7, 284 (1940).
[56] B. Lindner, J. Garcı̀a Ojalvo, A. Neiman e L. Schimansky-Geier, Effects of
noise in excitable systems, Physics Reports 392, 321-424 (2004).
[57] W.J. Wilbur e J. Rinzel, A Theoretical Basis for Large Coefficient of
Variation and Bimodality in Neuronal Interspike Interval Distributions, J. theor. Biol. 105, 345-368 (1983).
[58] L. Sacerdote e R. Sirovich, Multimodality of the interspike interval distribution in a simple jump-diffusion model, Scientiae Mathematicae Japonicae Online 8, 359-374 (2003).
[59] G. Giacomelli, M. Giudici, S. Balle e J.R. Tredicce, Experimental evidence
of coherence resonance in an optical system, Phys. Rev. Lett. 84, 3298
(2000).
[60] S. Zhong e H. Xin, Noise-induced oscillations and internal stochastic
resonance in a model of excitable biomembrane, Chem. Phys. Lett. 321,
309 (2000).
[61] A. Ganopolski e S. Rahmstorf, Abrupt glacial climate changes due to
stochastic resonance, Phys. Rev. Lett. 88, 38501 (2002).
[62] A. M. Lacasta, F. Saguès e J.M. Sancho, Coherence and anticoherence
tuned by noise, Phys. Rev. E 66, 45105 (2002).
[63] E. Salinas e T.J. Sejnowski, Correlated neuronal activity and the flow of
neuronal information, Nature Reviews in Neuroscience 2, 539 (2001).
[64] P. Bergé, Y. Pomeau e C. Vidal, Order within chaos, Herman e John Wiley
& Sons, Parigi (1984).
[65] J. Clinton Sprott, Chaos and Time-Series Analysis, Oxford University
Press, New York (2003).
[66] W.H. Press, S.A. Teukolsky, W.T. Vetterling e B. P. Flannery, Numerical
recipes in fortran, Cambridge University Press (1992).
[67] Th. Kreuz, comunicazione privata (2005).