Gennaio-Marzo 2016 • Vol. 46 • N. 181 • Pp. 77-85
Prospettive in Pediatria
Frontiere
Paola Carrera1, 2
Chiara Di Resta3
Maurizio Ferrari1-3
Sindrome adrenogenitale:
più comune di quanto
si pensi
Laboratorio Biologia Molecolare
Clinica, IRCCS Ospedale San
Raffaele, Milano; 2 Unità di
Genomica per la Diagnosi
delle Patologie Umane, IRCCS
Ospedale San Raffaele, Milano;
3
Università Vita-Salute San
Raffaele, Milano
1 La sindrome adrenogenitale (SAG) comprende un gruppo di patologie ereditarie che causano una serie di deficit enzimatici della steroidogenesi del surrene. Tra questi, il deficit di
21-idrossilasi è il più frequente (circa 90% dei casi). Le caratteristiche più distintive della
patologia sono: i) la virilizzazione dei genitali esterni nelle femmine con la forma severa
classica; ii) l’incapacità di mantenere l’equilibrio salino a causa dell’inadeguata sintesi di
aldosterone nei pazienti con la forma classica con perdita di sali; condizione potenzialmente fatale in assenza di terapia. La malattia è ereditata come carattere recessivo; è
causata da varianti del gene CYP21A2 che codifica per l’enzima 21-idrossilasi. Le varianti
patogenetiche più frequentemente osservate sono la conseguenza di eventi di crossing
over ineguale durante la meiosi o di eventi di conversione genica tra il gene CYP21A2 e
lo pseudogene CYP21A1P, duplicato in tandem e altamente omologo al gene funzionale.
La presenza dello pseudogene complica l’analisi molecolare, richiedendo speciali accorgimenti per la selezione del gene.
Grazie a numerosi studi, si è visto che per le varianti patogenetiche, il grado di inattivazione enzimatica correla con la severità della malattia.
Durante gli ultimi venti anni molti progressi sono stati fatti nella conoscenza e nella cura del
deficit di 21-idrossilasi, nella possibilità di contenere la virilizzazione nelle femmine affette e
nell’identificazione precoce dei neonati affetti. La gestione di questa malattia rappresenta,
a nostro parere, uno degli esempi più evoluti di interazione multidisciplinare in medicina.
Riassunto
Congenital adrenal hyperplasia (CAH) refers to a group of inherited disorders causing
enzyme deficiencies that impair steroid synthesis in the adrenal cortex. More than 90%
of cases of CAH are caused by 21-hydroxylase deficiency. Hallmarks of the disease are:
i) virilisation of external genitalia in females in the severe, classic form; ii) inability to maintain sodium balance because of insufficient aldosterone synthesis in patients with the
severe, salt wasting form, which is a potentially fatal condition if not treated. The disease
is recessively inherited and is caused by variants in the CYP21A2 gene encoding the
21-hydroxylase enzyme. The most frequently observed pathogenic variants are due to
unequal crossing over during meiosis or to gene conversions between CYP21A2 and
the highly homologous in tandem duplicated pseudogene CYP21A1P. The presence of
the CYP21A1P pseudogene complicates molecular analysis, requiring special attention
in gene selection. Based on several studies, the degree to which pathogenic variants
compromise enzymatic activity correlates to clinical severity of the disease. Over the last
two decades, many improvements have been made in knowledge and treatment of 21-hydroxylase deficiency, in minimising virilisation in affected females and in early identification of affected newborns. In our opinion, management of the disease is one of the most
evolved examples of multidisciplinary interaction in medicine.
Summary
77
P. Carrera et al.
La sindrome adrenogenitale
La sindrome adrenogenitale (SAG) è una malattia a
trasmissione autosomica recessiva, dovuta all’alterazione della sintesi di alcuni enzimi coinvolti nella
steroidogenesi, nella corteccia del surrene. Sono noti
alcuni deficit enzimatici a carico di questa via metabolica, tutti a carattere autosomico recessivo. La forma più frequente è il deficit di 21-idrossilasi (OMIM201910), che causa oltre il 90% dei casi di SAG. In
questa rassegna ci concentreremo quindi sulla SAG
causata dal deficit di 21-idrossilasi.
Il deficit di 21-idrossilasi si presenta in varie forme
cliniche. Il fenotipo clinico e biochimico dipende dal
grado di compromissione dell’attività enzimatica, a
sua volta correlato alla combinazione genotipica delle varianti geniche, dall’instaurarsi di meccanismi di
compenso extra-surrenalici non ancora chiaramente
definiti e da differenze individuali in risposta alle alterazioni metaboliche. I diversi quadri si riassumono in
due forme cliniche: la forma classica e la forma nonclassica.
La forma classica, è la più severa. Studi epidemiologici hanno indicato che l’incidenza nel mondo della
forma classica del deficit di 21-idrossilasi è variabile
in diverse popolazioni, come illustrato nella tabella I
(White e Speiser, 2000; Balsamo et al., 1996). I pazienti affetti mostrano sintomi severi di iper-androgenismo. In epoca pre-natale e durante le fasi del differenziamento sessuale, l’esposizione a potenti androgeni (testosterone, alpha4-androstenedione), provoca
la virilizzazione dei genitali esterni nelle femmine,
con casi di ambiguità genitale alla nascita. La forma
classica è suddivisa nelle forme virilizzante semplice (simple-virilizing – SV) e con perdita di sali (saltwasting – SW).
Nella forma con perdita di sali (SW), oltre al deficit
di cortisolo e all’aumento di androgeni, si osserva
un’inadeguata produzione di aldosterone (Fig. 1), che
causa insufficiente riassorbimento di sodio a livello
del tubulo renale distale. Nei casi con virilizzazione
semplice (SV) invece, il livello dell’aldosterone è adeguato. Nei neonati con la forma SW si osserva perdita
di peso, ritardo della crescita, vomito, disidratazione,
pressione bassa, bassi livelli di sodio e acidosi metabolica dovuta ad alti livelli di potassio, situazione che
può portare a crisi surrenalica acuta tra la prima-seconda e la quarta settimana di vita. Queste crisi surrenaliche possono essere fatali se non trattate adeguatamente (White e Speiser, 2000).
I pazienti con SW rappresentano circa il 75% dei casi
con forma classica, mentre il rimanente 25% dei pazienti presenta la forma SV (New, 1998).
La forma non-classica, (non-classic – NC), è una tra
le più frequenti patologie a trasmissione autosomica
recessiva. L’incidenza della forma non-classica è di
circa 1:1000, con una frequenza di 1:27 tra gli ebrei
Ashkenazi (Speiser et al., 1985). Gli individui con la
forma NC del deficit di 21-idrossilasi hanno solo un
deficit enzimatico parziale. La forma non-classica si
può presentare a qualsiasi età, con una vasta rosa
di sintomi dell’iperandrogenismo, tranne l’ambiguità
genitale. Perciò le femmine con la forma NC non presentano virilizzazione alla nascita. Nei maschi, poiché la distinzione clinica tra forma SV e forma NC
non è sempre facile, sono utili alla diagnosi l’analisi
genetica e il test dopo stimolazione con ACTH (ormone adrenocorticotropo) (New, 1998; White e Speiser,
2000).
Una parte dei soggetti con la forma NC è completamente asintomatica (criptica).
In Tabella II riportiamo le caratteristiche cliniche distintive per le forme classica e non-classica.
La relativa alta frequenza dello stato di portatore in
una malattia, che se non trattata può avere esiti anche molto gravi, ha portato alcuni studiosi a proporre l’ipotesi del vantaggio dell’eterozigote, secondo la
quale l’elevata e veloce risposta al cortisolo, osservata nei portatori, potrebbe garantire una rapida ri-
Tabella I. Frequenza del deficit di 21-idrossilasi, forma classica in alcune popolazioni (dati ottenuti da screening neonatali).
Regione
Alaska, Esquimesi
Incidenza
Riferimenti bibliografici
1:280
Pang, 1982
Isola La Reunion
1:2100
Pang, 1988
Svezia
1:9800
Thil’en, 1998
Stati Uniti (Wisconsin)
1:11000
Allen, 1997
Francia
1:13000
Cartigny, 1999
Giappone
1:18000
Tajima, 1997
Stati Uniti (Texas)
1:16000
Therrel, 1998
Scozia
1:17000
Pang, 1988
Italia
1:18000
Balsamo A, 1996
Nuova Zelanda
1:23000
Cutfield, 1995
78
Sindrome adrenogenitale: più comune di quanto si pensi
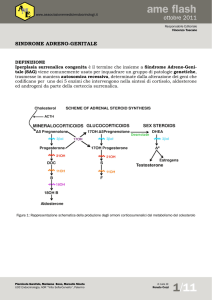
Figura 1. Schema della steroidogenesi nel deficit di 21-idrossilasi.
Tabella II. Caratteristiche cliniche dei soggetti con il deficit di 21-idrossilasi, forma classica e non-classica.
Caratteristiche
Forma classica
Forma non-classica
Virilizzazione prenatale
Nelle femmine
Assente
Virilizzazione postnatale
Nei maschi e nelle femmine
Variabile
~ 75% dei casi
Assente
~ 100%
Raro
Perdita di sali
Deficit di cortisolo
sposta a stress infiammatori, infettivi o ambientali in
genere, offrendo un vantaggio selettivo nel prevenire
risposte immunitarie eccessive o inappropriate, come
avviene nelle malattie autoimmunitarie.
Steroidogenesi e fisiopatologia
del deficit di 21-idrossilasi
La 21-idrossilasi è uno degli enzimi coinvolti nella
steroidogenesi surrenalica, che comprende tre vie
principali: mineralocorticoidi, glucocorticoidi e ormoni sessuali (Fig. 1). Il pregnenolone è il principale substrato nella steroidogenesi e la sua produzione è regolata dall’ACTH, prodotto e regolato dal
sistema nervoso centrale, nell’asse ipotalamo-ipofisi-surrene. Il cortisolo, uno dei prodotti finali della
steroidogenesi, regola a sua volta la secrezione di
ACTH attraverso un meccanismo di feedback negativo. Quindi, la diminuita secrezione di cortisolo
nei soggetti con deficit di 21-idrossilasi, porta all’au-
mentata produzione di ACTH (noi diremmo: “la mancanza del feedback negativo”) e, di conseguenza,
stimola la sintesi eccessiva di prodotti surrenalici (o
del surrene) e porta all’accumulo di precursori nelle
vie bloccate dal deficit enzimatico, principalmente
di 17-idrossiprogesterone. Il 17-idrossiprogesterone
viene poi trasferito alla via degli androgeni, dove
viene normalmente convertito in testosterone, provocandone l’accumulo.
Poiché la via dei mineralocorticoidi richiede una minima attività da parte dell’enzima 21-idrossilasi, la
perdita di sali è una caratteristica associata solo alle
mutazioni che aboliscono completamente l’attività
dell’enzima (alleli nulli) (New, 1998; White e Speiser,
2000).
Aspetti clinici
I feti femmina affetti dalla forma classica sono esposti
ad alti livelli sistemici di androgeni; in particolare, il
periodo di differenziamento dei genitali esterni è circa
79
P. Carrera et al.
dalla 9 alla 15 settimana di gestazione. Ciò determina
uno sviluppo dei genitali esterni con fenotipo maschile a vari livelli di gravità, dalla semplice clitoridomegalia alla scrotalizzazione delle strutture labiali e a seni
urogenitali, che possono portare a errori nell’identificazione del sesso. Il grado di virilizzazione genitale è
classificato in cinque stadi, secondo la scala di Prader
(Prader e Gurtner, 1955). I genitali femminili interni
(utero, tube di Falloppio e ovaie) sono normali. L’alta
frequenza di queste forme porta a riconoscere il deficit di 21-idrossilasi come la causa singola più comune
di pseudo-ermafroditismo femminile. I neonati maschi
non mostrano anormalità alla nascita; si evidenzia
una virilizzazione precoce attorno al 18°-24° mese.
Nei pazienti con la forma classica trattati adeguatamente, la pubertà si presenta come atteso (Ghali et
al., 1977), o con un po’ di anticipo rispetto alla popolazione generale, sia nelle femmine che nei maschi
(Trinh et al., 2006). Se non trattato rapidamente, in
entrambi i sessi, l’eccesso di androgeni può portare a
pubarca precoce e a un anticipato sviluppo nell’accrescimento. I soggetti affetti mostreranno una precoce
comparsa dei peli del pube e delle ascelle, saranno
ad alta statura durante l’infanzia ma rimarranno bassi,
come risultato della prematura chiusura dei centri di
crescita epifisari delle ossa, circa 1,1-1,5 deviazioni
standard sotto la media dell’altezza dei genitori (Brunelli et al., 2003). Nelle femmine, i segni dell’iperandrogenismo possono includere anche alopecia, acne,
irsutismo, infertilità, amenorrea o disfunzione del ciclo
mestruale. Inoltre è stata descritta l’associazione tra
SAG e sindrome dell’ovaio policistico (Barnes et al.,
1994).
Identità di genere
I maschi, al contrario delle femmine, non mostrano
alterazioni del comportamento per quanto riguarda
l’identità di genere, l’orientamento sessuale e il gioco nell’infanzia (Hines et al., 2004). Nelle femmine,
è stata identificata una correlazione tra orientamento
sessuale, esposizione agli androgeni in epoca prenatale e comportamento mascolino nell’infanzia (MeyerBahlburg et al., 2008).
Fertilità
Le femmine affette da sindrome adrenogenitale possono avere problemi di fertilità per varie ragioni, inclusa non-ovulazione, sindrome dell’ovaio policistico,
irregolarità mestruali, alti livelli di progesterone non
soppressi dalla terapia. La fertilità è ridotta specialmente nelle femmine con la forma classica (Mulaikal
et al., 1987). Studi recenti hanno dimostrato che l’adeguatezza della terapia con i glucocorticoidi è una
variabile importante, capace di migliorare i livelli di
fertilità individuale (Premawardhana, et al., 1997).
Anche nei maschi affetti dalla forma classica, studi a
80
lungo termine hanno indicato che, se trattati adeguatamente, essi mostrano uno sviluppo puberale normale, così come normale spermatogenesi e fertilità
(Trinh et al., 2006). Al contrario, se la patologia non è
ben controllata con la terapia, si possono osservare
un ridotto numero di spermatozoi e testicoli di ridotte dimensioni o con noduli iperplasici (Cabrera et al.,
2001).
Terapia
L’obiettivo della terapia nella sindrome adrenogenitale
è di correggere il deficit di cortisolo e di abolire l’iperproduzione di ACTH. Un trattamento adeguato con
corticosteroidi riduce la stimolazione della sintesi degli androgeni, prevenendo un’ulteriore virilizzazione e
normalizzando le fasi dello sviluppo. Lo scopo della
terapia è di somministrare la minor dose richiesta per
un controllo ottimale. Nei bambini la terapia deve essere monitorata spesso nelle prime fasi, più raramente in seguito. Negli adulti, è consigliato il monitoraggio
a lungo termine per problemi di sovrappeso, densità
ossea, fertilità e rischio cardiovascolare. Nei periodi di
malattia o particolare stress o in occasione di un intervento chirurgico la dose di mantenimento può essere
aumentata.
Trattamento chirurgico
Nel passato, nei neonati con genitali ambigui era raccomandata la correzione chirurgica precoce. Più recentemente, questa pratica è diventata controversa a
causa della mancanza di dati sugli effetti funzionali a
lungo termine. Pertanto per accompagnare le scelte
dei genitori dei pazienti nel caso di assegnazione del
sesso e correzione chirurgica, è consigliato un approccio multidisciplinare, che coinvolga l’endocrinologo pediatra, l’urologo, il genetista, e lo psicologo nella
valutazione del singolo caso (Schnitzer e Donahoe,
2001).
Diagnosi ormonale
La diagnosi biochimica del deficit di 21-idrossilasi può
essere confermata dalla valutazione ormonale. Misurando la concentrazione di 17-idrossiprogesterone (il
precursore dell’enzima) su un prelievo di sangue, si
può fare diagnosi di forma classica. Il test di elezione per la diagnosi ormonale nella forma non-classica
è il test da stimolo con l’ormone adrenocorticotropo
(ACTH-test), nel quale i livelli di 17-idrossiprogesterone e di alpha4-androstenedione vengono misurati al
tempo zero e dopo 60’ dalla stimolazione endovenosa con ACTH. Per definire la gravità clinica, i valori
ottenuti sono confrontati con quelli di riferimento, riportati in letteratura (nomogramma di New) (New et
al., 1983).
Sindrome adrenogenitale: più comune di quanto si pensi
Genetica
Il gene codificante per la 21-idrossilasi è un citocromo
P450 (citocromo P450, famiglia 21, subfamiglia A, polipeptide 21, CYP21A2), localizzato sul braccio corto
del cromosoma 6, all’interno della regione dei geni di
classe III del complesso maggiore di istocompatibilità
(MHC) (Fig. 2) (Dupont et al., 1977). CYP21A2 e il
suo omologo, lo pseudogene CYP21A1P, sono alternati ai geni C4B e C4A, che codificano due isoforme
del quarto componente del sistema del complemento.
CYP21A2 e il suo pseudogene contengono 10 esoni
ciascuno e sono omologhi al 98% negli esoni, e al
96% negli introni (White et al., 1986).
Nel gene CYP21A2 sono state descritte più di 200 varianti patogenetiche, tra queste, sostituzioni nucleotidiche puntiformi, piccole delezioni e inserzioni e riarrangiamenti complessi (Human Cytocrome P450 Allele Nomenclature Committee Institute of Environmental Medicine, Karolinska Institutet, Stockholm, Sweden – www.cypalleles.ki.se/cyp21.htm) (The Human
Gene Mutation Database (HGMD), Cardiff – www.
hgmd.cf.ac.uk/ac/all.php) (New et al., 2013). Le varianti patogenetiche più comuni, identificate in circa
il 95% dei pazienti, sono il risultato di due tipi di riarrangiamento tra il gene CYP21A2 e lo pseudogene
CYP21A1P: i) crossing over diseguale, in seguito a
un anomalo appaiamento durante la meiosi, che ha
come conseguenza la generazione di estese delezioni; ii) eventi di conversione genica che provocano il
trasferimento nel gene CYP21A2 di varianti patogenetiche puntiformi o di piccola-media scala presenti
5'
nello pseudogene CYP21A1P (Fig. 3A). Le varianti
patogenetiche derivate dallo pseudogene sono le più
frequenti e mostrano una distribuzione variabile nelle
varie etnie (Wilson et al., 2007; Carrera et al., 1996;
Bobba et al., 1999; White e Speiser, 2000; New et al.,
2013). Il rimanente 5% delle varianti patogenetiche
sono varianti puntiformi, rare o private, più spesso localizzate nella regione 3’ del gene.
In figura 4 sono riportate le varianti patogenetiche comuni raggruppate in base all’attività enzimatica residua, misurata attraverso studi di espressione in vitro
(White e Speiser, 2000). Poiché il deficit di 21-idrossilasi è una malattia autosomica recessiva, è necessaria la combinazione di due varianti patogenetiche
per dare il fenotipo affetto e, generalmente, è la variante meno severa che determina il fenotipo (Fig. 4).
Possiamo quindi affermare che la forma clinica del
deficit di 21-idrossilasi è dipendente dalla combinazione delle varianti alleliche nel genotipo del soggetto
in esame. Anche se la predizione del fenotipo è risultata inizialmente non del tutto accurata (Speiser et
al., 1992), studi recenti hanno permesso di stabilire
con più precisione la correlazione genotipo-fenotipo e
struttura proteica-fenotipo nel deficit di 21-idrossilasi
(Haider et al., 2013; New et al., 2013).
Diagnosi molecolare
L’identificazione delle varianti patogenetiche è possibile attraverso il test molecolare. Esso prevede la
combinazione di due protocolli: i) per l’identificazione
dei grossi riarrangiamenti, come la delezione genica
3'
Figura 2. Viene mostrata la localizzazione del gene CYP21A2 all’interno dei geni HLA del complesso maggiore di istocompatibilità sul cromosoma 6.
81
P. Carrera et al.
Figura 3. A. Assetti genomici osservati in alleli normali e in alleli con riarrangiamenti patogenetici. B. Esempio di uno
studio familiare per l’analisi dei grandi riarrangiamenti mediante Southern blotting. I genitori sono portatori (eterozigoti) di
una delezione estesa di 30 kb che coinvolge I geni CYP21A2 e C4B; il soggetto affetto (SAG) ha ereditato da entrambi
i genitori la delezione estesa; il fratello è sano-non portatore, avendo ereditato da entrambi i genitori l’allele non-mutato.
e le conversioni geniche estese sono utilizzati protocolli basati su Multiple Ligation Probe Assay (MLPA)
oppure Southern blotting; in figura 3B un esempio di
uno studio familiare per l’identificazione dei grossi
riarrangiamenti; ii) per l’identificazione delle variazioni puntiformi e di piccole indels (riarrangiamenti
che sono costituiti da inserzioni o delezioni nucleotidiche), la metodica di elezione è il sequenziamento
diretto con il metodo Sanger. Affinché il risultato del
sequenziamento sia corretto, è cruciale selezionare
in modo specifico la sequenza del gene CYP21A2,
ad esempio mediante amplificazione con Polymerase
Chain Reaction (White e Speiser, 2000).
Per quanto riguarda il test genetico per il deficit di
21-idrossilasi, l’accesso al test è sempre preceduto da
consulenza genetica. Generalmente, essendo l’esordio neonatale o pediatrico, la consulenza coinvolge i
genitori. Quando viene identificato un soggetto affetto,
in base alla diagnosi clinica o in seguito a screening
neonatale, si esegue il test genetico per confermare la diagnosi e vedere quali varianti sono presenti.
Il test è richiesto anche nei familiari e nei partner dei
soggetti affetti o portatori, allo scopo di sapere se si
è portatori sani e quindi stabilire se esiste un rischio
riproduttivo.
82
Diagnosi e terapia prenatale
Nelle famiglie con un precedente figlio affetto da forma classica, e nella quale sono state identificate le
due varianti patogenetiche, si può offrire la diagnosi prenatale e la terapia con desametasone (Fig. 5).
La terapia prenatale prevede una somministrazione
orale di desametasone alle madri a rischio per ridurre la virilizzazione nelle femmine affette; l’indicazione è di iniziare il trattamento prima della settima
ed entro l’ottava settimana di gestazione, (Forest et
al., 1989). Dopo il risultato della diagnosi prenatale,
il trattamento è sospeso in caso di feto maschio o di
femmina sana, mentre continuerà per tutta la gravidanza in caso di feto femmina affetta. Sono stati
riportati risultati contrastanti sull’effetto della terapia
prenatale sulle madri e sul feto (New et al., 2003;
Pang et al., 1992). Gli effetti collaterali riportati includono un eccessivo aumento di peso, un aumento
delle strie gravidiche, una risposta iperglicemica al
carico orale di glucosio.
Più recentemente, alcuni studi sugli effetti a lungo termine nei bambini trattati con desametasone non hanno evidenziato in generale criticità tranne un effetto
a lungo termine a livello cognitivo (New et al., 2003;
Sindrome adrenogenitale: più comune di quanto si pensi
Figura 4. Le varianti patogenetiche più comuni del gene CYP21A2 sono raggruppate in base all’attività enzimatica residua. In rosso, le varianti severe (nulle); in arancione, le varianti intermedie; in giallo, le varianti meno gravi. La variante
c.293-13A-C > G è un caso particolare in quanto si associa più spesso alla forma SW ma anche alla forma SV.
Figura 5. Studio familiare: famiglia con due figli affetti da forma classica SW (II.1, II.2), inviata al test genetico per conferma diagnostica. Identificate le mutazioni: padre asintomatico con genotipo criptico (combinazione di una variante
severa, CV, con una variante lieve, p.Val281Leu). Madre eterozigote per la mutazione severa CV. Figli affetti entrambi
omozigoti per la variante severa CV (conversione genica estesa). Questo caso evidenzia l’importanza dello studio familiare; se avessimo fatto il test genetico solo ai due soggetti affetti non avremmo definito correttamente il rischio riproduttivo
della famiglia.
Diagnosi prenatale (II.3): in una gravidanza successiva, la madre ha iniziato la terapia per la prevenzione della virilizzazione. La DPN: risultato genotipo non-classico (combinazione della variante paterna lieve, p.Val281Leu, con la variante
materna severa, CV); fenotipo atteso: forma non-classica, quindi sospensione terapia desametasone.
83
P. Carrera et al.
Meyer-Bahlburg et al., 2004; Hirvikoski et al., 2007).
Gli autori concludono che questi dati andranno tuttavia verificati in ulteriori studi.
Conclusione
La conoscenza del deficit di 21-idrossilasi è progreBibliografia
Allen DB, Hoffmann GI, Fitzpatrick P,
et al. Improved precision of newborn
screening for congenital adrenal hyperplasia using weight adjusted criteria for
17-hydroxyprogesterone levels. J Pediatr
1997;130:128-33.
Balsamo A, Cacciari E, Piazzi S, et al.
Congenital adrenal hyperplasia: neonatal mass screening compared with clinical diagnosis only in the Emilia-Romagna
region of Italy, 1980-1995. Pediatrics
1996;98:362-7.
Barnes RB, Rosenfield RL, Ehrmann DA,
et al. Ovarian hyperandrogynism as a result
of congenital adrenal virilising disorders:
evidence for perinatal masculinization of
neuroendocrine function in women. J Clin
Endocrinol Metab 1994;79:1328-33.
Bobba A, Marra E, Giannattasio S, et al.
21-hydroxylase deficiency in Italy: a distinct distribution pattern of CYP21 mutations in a sample from southern Italy. J
Med Genet 1999;36:648-50.
Brunelli V, Russo G, Bertelloni S, et al. Final height in congenital adrenal hyperplasia
due to 21-idroxylase deficiency: the Italian
experience. J Pediatr Encocrinol Metab
2003;16:277-83.
Cabrera M, Vogiatzi M, New M. Long
term outcome in adult males with classic
congenital adrenal hyperplasia. J Clin Endocrinol Metab 2001;86:3070-80.
Carrera P, Ferrari M, Beccaro F, et al. Molecular characterization of 21-hydroxylase
deficiency in 70 Italian families. Hum Hered
1993;43:190-6.
Cartigny-Maciejewski M, Guilley N, Vanderbecken S, et al. Neonatal screening of congenital adrenal hyperplasia due to 21-hydroxylase deficiency. Arch Pediatr 1999;6:151-8.
Cutfield WS, Webster D. Newborn screening for congenital adrenal hyperplasia in
New Zealand. J Pediatr 1995;126:118-21.
Dupont B, Oberfield SE, Smithwick
EM, et al. Close genetic linkage between
HLA and congenital adrenal hyperplasia (21-hydroxylase deficiency). Lancet
1977;2:1309-12.
Forest MG, Betuel H, David M. Prenatal
treatment in congenital adrenal hyperplasia
due to 21-hydroxylase deficiency: update
88 of the French multicentric study. Endocr
Res 1989;15:277-301.
84
dita molto nel corso del tempo, con un impatto molto
positivo sulle procedure diagnostiche e terapeutiche.
In particolare, grazie a una gestione multidisciplinare
integrata (endocrinologo, chirurgo, genetista, psicologo), è ora possibile ottenere un normale sviluppo dei
pazienti, così come il mantenimento della loro salute
nel corso della vita.
Ghali I, David M, David L. Linear growth
and pubertal development in treated congenital adrenal hyperplasia due to 21-hydroxylase deficiency. Clin Endocrinol
1977;6:425-36.
Haider S, Islam B, D’Atri V, et al. Structure-phenotype correlations of human
CYP21A2 mutations in congenital adrenal hyperplasia. Proc Natl Acad Sci USA
2013;110:2605-10.
** Non tutte le nuove varianti del gene
CYP21A2 sono state caratterizzate a livello
biochimico, con studi funzionali. Per cercare di supplire a questa carenza, gli autori
fanno delle predizioni sulla patogenicità
delle varianti, modellando i mutanti sulla
struttura cristallizzata dell’omologo bovino
del gene. Viene proposta la correlazione tra
dominio/funzione interessata dalla variante
e forma clinica.
Hines M, Brook C, Conway GS. Androgen
and psychosexual development: core gender identity, sexual orientation and recalled
childhood gender role behaviour in women
and men with congenital adrenal hyperplasia (CAH). J Sex Res 2004;41:75-81.
Meyer-Bahlburg HF, Dolezal C, Baker
SW, et al. Sexual orientation in women with
classical or non-classical congenital adrenal hyperplasia as a function of degree of
prenatal androgen excess. Arch Sex Behav
2008;37:85-99.
Mulaikal RM, Migeon CJ, Rock JA. Fertility rates in female patients with congenital
adrenal hyperplasia due to 21-hydroxylase
deficiency. N Engl J Med 1987;316:178-82.
New MI, Lorenzen F, Lerner AJ, et al.
Genotyping steroid 21-hydroxylase deficiency: hormonal reference data. J Clin
Endocrinol Metab 1983;57:320-6.
** Dati di correlazione tra dosaggio ormonale e forma clinica, proponendo i valori
di riferimento.
New MI. Diagnosis and management of
congenital adrenal hyperplasia. Annu Rev
Med 1998;49:311-28.
New MI, Carlson A, Obeid J, et al. Prenatal diagnosis for congenital adrenal hyperplasia in 595 pregnancies. Endocrinologist
2003;13:233-9.
New MI, Moolamannil A, Gonzalez B, et
al. Genotype-phenotype correlation in 1507
families with congenital adrenal hyperplasia owing to 21-hydroxylase deficiency.
Proc Natl Acad Sci USA 2013;110:2611-6.
** La più ampia casistica di deficit di
21-idrossilasi, mai riportata (1507 famiglie), correlazione genotipo-fenotipo dallo
storico gruppo di Maria New.
Pang S, Murphey W, Levine LS, et al.
A pilot newborn screening for congenital
adrenal hyperplasia in Alaska. J Clin Endocrinol Metab 1982;55:413-20.
Pang S, Wallace MA, Hofman L, et al.
Worldwide experience in newborn screening for classical congenital adrenal hyperplasia due to 21-hydroxylase deficiency.
Pediatrics 1988;81:866-74.
Pang S, Clark AT, Freeman LO, et al. Maternal side-effect of prenatal dexamethasone theraphy for phetal congenital Adrenal hyperplasia. J Clin Endocrinol Metab
1992;76:249-53.
Pang S, Clark A. Congenital Adrenal hyperplasia due to 21-hydrpxylase deficiency: newborn screening and its relationship
to the diagnosis and treatment of the disorder. Screening 1993;2:105-39.
Prader A, Gurtner HP. The syndrome
of pseudohermaphrodism in congenital
adrenocortical hyperplasia without overproduction of androgens. Helv Paediatr
Acta 1955;10:397-412.
Premawardhana L, Hughes I, Read G, et
al. Longer term outcome in females with
congenital adrenal hyperplasia (CAH):
the Cardiff experience. Clin Endocrinol
1997;46:327-32.
Schnitzer J, Donahoe P. Surgical treatment of congenital adrenal hyperplasia. Endocrinol Metab Clin North Am
2001;30:137-54.
Speiser PW, Dupont B, Rubstein, et
al. High frequency of nonclassic steroid
21-hydroxylase deficiency. Am J Hum Genet 1985;37:650-67.
Speiser PW, Dupont J, Zhu D, et al. Disease expression and molecular genotype
in congenital adrenal hyperplasia due to
21-hydroxylase deficiency. J Clin Invest
1992;90:584-95.
Tajima T, Fujieda K, Nakae J, et al. Molecular basis of nonclassical steroid 21-hydroxylase deficiency detected by neonatal
mass screening in Japan. J Clin Endocrinol
Metab 1997;82:2350-6.
Therrel BLJ, Berenbaum SA, ManterKapanke V, et al. Results of screening 1.9
millio Texas newborns for 21-hydroxylase
Sindrome adrenogenitale: più comune di quanto si pensi
deficient congenital adrenal hyperplasia.
Pediatrics 1998;101:583-90.
Annual Meeting. Boston, USA, June 2427, 2006, p. 368.
Thil’en A, Nordenstrom A, Hagenfeld I,
et al. Benefits of neonatal screening for
congenital adrenal hyperplasia (21-hydroxylase deficiency) in Sweden. Pediatrica
1998;101:E11.
White PC, New MI, Dupont B. Structure
of the human steroid 21-hydroxylase genes.
Proc Natl Acad Sci USA 1986;83:5111-5.
Trinh L, Nimkarn S, Obeid J, et al.
Growth and puberal characteristics in
patients with congenital adrenal hyperplasia due to 21-hydroxylase deficiency.
ENDO 2006 The Endocrine Society’s 88th
* Descrizione della struttura e della sequenza del gene CYP21A2 e del suo pseudogene CYP21A1P.
White PC, Speiser PW. Congenital adrenal hyperplasia due to 21-hydroxylase deficiency. Endocrine Rev 2000;21:245-91.
** Anche se non recentissima, rimane
una delle più dettagliate e omnicomprensive review sull’argomento.
Wilson RC, Nimkarn S, Dumic M, et al.
Ethnic specific distribution of mutations in
716 patients with congenital adrenal hyperplasia owing to 21-hydroxylase deficiency.
Mol Genet Metab 2007;90:414-21.
* Distribuzione delle varianti patogenetiche del gene CYP21A2 in base all’etnia
in 716 pazienti. Evidenziate differenze tra
gruppi etnici.
Corrispondenza
Paola Carrera
IRCCS Ospedale San Raffaele, via Olgettina 60, 20132 Milano - Tel. +39 02 26434759 - Fax +39 02 26434351 E-mail: [email protected]
85