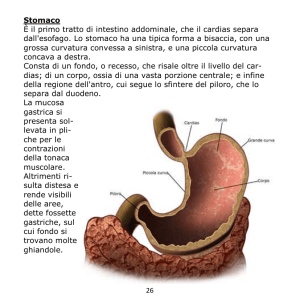
CAPITOLO 26
IL CANCRO DEL CARDIAS
Il cancro del cardias mostra una decisa controtendenza nei confronti delle neoplasie gastriche in generale,
essendo riferito in netto incremento nelle principali casistiche dei paesi occidentali, passando dal 15% al 40% di
tutti i tumori dello stomaco (1-7).
Questo trend non trova conferma nel nostro Paese: infatti, facendo riferimento ai dati relativi alla casistica
ACOI - Italian Stomach Cancer Group relativa ai periodi 1961-1985 e 1986-1990, oggetto di analisi retrospettive
e prospettiche, l’incidenza del cancro del cardias appare stazionaria, attestandosi in entrambi i periodi intorno al
7% del totale dei cancri dello stomaco (vedi Cap. 22).
La scelta del trattamento è tuttora oggetto di controversia, non solo per quanto riguarda il tipo di approccio
chirurgico, ma anche in relazione alla entità della exeresi. Dai risultati di un questionario sottoposto a 22 centri
Europei su un totale di 1200 pazienti pubblicato da Holscher e Siewert nel 1985, sono emerse ben sette tecniche
chirurgiche diverse in relazione alla entità della exeresi (8). Le cause di tale incertezza dal punto di vista
terapeutico sono essenzialmente dovute alla mancanza di risultati certi a favore dell’una o dell’altra metodica, da
imputare soprattutto alle controversie esistenti sulla definizione stessa di carcinoma del cardias, utilizzata con
troppa ambiguità nell’ambito della letteratura internazionale.
Definizione
“At the lower end of the esophagus confusion reigns”: le conclusioni alle quali sono pervenuti De Meester e
Barlow nel 1988 sembrano ancora valide a tutt’oggi (9, 10).
Infatti, nonostante la maggioranza degli Autori tenda ad identificare il cancro del cardias con un
adenocarcinoma del terzo prossimale dello stomaco, numerosi studi epidemiologici ne sottolineano la stretta
correlazione con le neoplasie dell’esofago (11-13).
In effetti, il carcinoma del cardias presenta alcune caratteristiche peculiari che lo differenziano dalle altre
neoplasie gastriche: la distribuzione etnico-geografica (maggiore incidenza nei paesi occidentali), l’età di
comparsa più elevata (intorno ai 65 anni), il rapporto sesso maschile/femminile più alto (fino a 6:1),
l’associazione con l’ernia iatale e con il reflusso gastro-esofageo (40% dei casi), il comportamento biologico
molto più aggressivo, la prognosi più sfavorevole (14-16).
Da un punto di vista puramente anatomico la definizione di “cardias” andrebbe sostituita con quella più
corretta di “giunzione esofago-gastrica”, riferendosi al tratto di canale alimentare situato tra la porzione terminale
dell’esofago e quella prossimale dello stomaco, laddove la muscolatura del primo si continua direttamente con
quella del secondo; questa regione non coincide necessariamente con la linea Z.
Siewert definisce il territorio cardiale come una struttura a limiti convenzionali, compresa tra i 5 cm a monte
e i 5 cm a valle dello sfintere esofageo inferiore (17). Di conseguenza nella definizione di cancro del cardias
vengono ad essere compresi tre differenti tipi di neoplasia (Fig. 1):
a) tipo I . Adenocarcinoma su brachiesofago (esofago di Barrett): il centro della neoplasia e più del 75%
della sua massa sono situati nell’esofago tubulare (18);
b) tipo II. Carcinoma del cardias propriamente detto, il cui centro giace entro 2 cm dal cardias anatomico
(19);
c) tipo III. Carcinoma del fondo dello stomaco o della regione sottocardiale, quando questo infiltri la
giunzione esofago-gastrica (cardias anatomico) e/o il terzo inferiore dell’esofago.
Attualmente il cancro del cardias viene per lo più ritenuto una entità nosologica autonoma in considerazione
delle sue particolari caratteristiche cliniche (la disfagia è il sintomo comune a tutti i pazienti) e delle sue peculiari
modalità evolutive (infiltrazione dell’esofago per via sottomucosa, metastasi linfonodali mediastiniche) (20-25):
la tendenza più diffusa è comunque quella di distinguere le forme a partenza esofagea (rare) e quelle a partenza
gastrica (quasi il 90% di tutte le neoplasie del cardias) (26).
a) Neoplasie del versante esofageo
Sono rappresentate da due istotipi diversi, il carcinoma malpighiano e l’adenocarcinoma. Del carcinoma
malpighiano, che è la forma più frequente, sono stati identificati i fattori di rischio nell’abuso di alcool, di tabacco
e di bevande e cibi molto caldi e le lesioni precancerose rappresentate dalla sindrome di Plummer-Vinson, dalla
stenosi da caustici e dall’acalasia (27).
Recentemente Clark ha sottolineato l’importanza dello stretto legame esistente tra il reflusso gastroesofageo
e l’aumentato rischio di insorgenza della neoplasia, al fine di attuare programmi di prevenzione e/o diagnosi
precoce nei soggetti a rischio più elevato (28).
Gli adenocarcinomi, al contrario, corrispondono solo al 10% circa dei carcinomi esofagei e sono
rappresentati soprattutto da carcinomi su brachiesofago o esofago di Barrett: tale lesione è costituita da una
metaplasia colonnare secondaria ad una esofagite da reflusso ed è considerata una lesione precancerosa ad alto
rischio (26, 29-31).
Dal punto di vista terapeutico per entrambi gli istotipi valgono le regole generali della chirurgia del cancro
dell’esofago, tenendo conto che tali neoplasie, pur raggiungendo raramente dimensioni considerevoli al momento
della diagnosi, sono caratterizzate da una frequente invasione linfonodale mediastinica e addominale e da una
estesa infiltrazione sottomucosa della parete esofagea verso l’alto e di quella gastrica verso il basso (14, 32).
b) Adenocarcinomi del versante gastrico
In questa categoria sono compresi tutti i carcinomi dello stomaco che, nascendo dal fondo gastrico,
raggiungono la giunzione esofago-gastrica o la superano fino a raggiungere l’esofago distale.
Già dalla definizione si evince che la loro frequenza è di gran lunga superiore a quella dell’omologo
esofageo (rapporto 10:1), dal quale si differenziano per alcune caratteristiche di ordine epidemiologico già riferite,
anatomopatologico (per la varietà delle forme macroscopiche ed istologiche descritte), eziopatogenetico (i fattori
di rischio sono quelli comuni a tutte le neoplasie gastriche) e chirurgico (il trattamento è basato principalmente
sulla gastrectomia totale) (26).
Stadiazione
La stadiazione del cancro del cardias risente delle difficoltà incontrate per la sua definizione: a questa
neoplasia infatti mal si adattano le classificazioni del sistema TNM del 1983 relative sia allo stomaco che
all’esofago.
Nell’edizione TNM del 1988 la stadiazione delle neoplasie dell’esofago è stata modificata in tal senso, con
l’aggiunta del parametro T4 per indicare l’invasione delle strutture adiacenti (precedentemente inquadrate come
T3) e con la suddivisione del II stadio in IIa e IIb in dipendenza della coesistenza o meno di metastasi linfonodali.
Ellis (33) ha paragonato i due sistemi classificativi applicandoli alla medesima casistica. I dati concernenti
265 pazienti con carcinoma del cardias o del terzo inferiore dell’esofago sottoposti ad esofago-gastrectomia nel
periodo 1970-88, sono stati riesaminati e riclassificati secondo i nuovi criteri: la comparazione con le risultanze
della vecchia stadiazione non sono state entusiasmanti, specie nell’ottica della valutazione prognostica. Il nuovo
staging non si è dimostrato in grado di fornire una migliore discriminazione degli stadi correlata ai risultati a
distanza: infatti, la sopravvivenza dei pazienti in stadio IIA risultava molto simile a quella dei pazienti al I stadio,
mentre quella dei pazienti in stadio IIB era sovrapponibile a quella del III stadio. Dal momento che i principali
fattori prognostici indipendenti erano rappresentati dalla profondità di invasione parietale e dall’estensione del
coinvolgimento linfonodale, è stata successivamente applicata ai medesimi casi la classificazione WNM proposta
da Skinner (34), che si fonda proprio su tali parametri (Tab. 1). Questa stadiazione ha consentito correlazioni tra
reperti patologici e sopravvivenza maggiormente distinti tra i differenti stadi, dimostrandosi più precisa ed utile
dal un punto di vista prognostico, come confermato da altri recenti studi (35).
Tabella 1 - Classificazione WNMdi Skinner
Groups
WNM Classification
Early
W0 N0
W0 N1
W1 N0
W1 N1
Intermediate
W0 N2
W1 N2
W2 N0
W2 N1
Late
W2 N2
Wall penetration
W0 = Tumor penetration through the basement membrane of the mucosa but not through the muscularis mucosa
W1 = Tumor penetration through the muscularis mucosa and into but not through muscle layers
W2 = Tumor penetration through muscle layers
Lymph node involvement
N0 = No lymph node involvement
N1 = One to four lymph nodes involved
N2 = Five or more lymph nodes involved
Systemic metastasis
M0 = No metastasis
M1 = Distant metastasis
Holscher (36) e Siewert (21) fanno notare che la mancanza di rivestimento sieroso a livello dell’esofago
terminale, del cardias e della parete posteriore del fondo gastrico puo’ condizionare fortemente la definizione di
due parametri oncologici fondamentali per la classificazione TNM: il parametro T e la diffusione linfatica.
Secondo questi Autori, l’assenza della tonaca sierosa comporta che una buona percentuale di neoplasie affioranti
alla superficie del viscere e infiltranti il grasso periviscerale vengano comunque classificate come pT2, quando in
altre regioni verrebbero definite come pT3 perchè infiltranti la sierosa. La riclassificazione di queste neoplasie
come pT3 rende predominanti gli stadi avanzati in questa regione, facendo giustizia dell’alta incidenza fatta
registrare dalla categoria pT2 e della contemporanea bassa incidenza della pT1; il downstaging risultante da
questo errore di fondo dà la falsa impressione che i tumori del cardias siano per lo più neoplasie precoci con
pessima prognosi (37, 38). La loro ridefinizione comporta che i risultati del trattamento dei carcinomi cardiali
diventano assai più simili a quelli delle neoplasie di altre regioni dello stomaco.
Questo rilievo è stato recepito dalla commissione sul TNM che nel supplemento pubblicato nel 1993 prevede
una suddivisione del parametro pT2 in due sottogruppi: pT2a, quando il tumore invade la muscolare propria,
pT2b quando la neoplasia sconfina da essa (39).
La particolare situazione anatomica del terzo superiore dello stomaco può anche influenzare le vie di
diffusione per via linfatica delle neoplasie proprie di questa sede: la collocazione retroperitoneale potrebbe infatti
favorire una precoce colonizzazione delle stazioni paraortiche, dell’ilo renale, dell’ilo splenico (l6 a1,2; b1,2; 10,
11) che andrebbero forse rilette come stazioni di I o II livello e non più di III e IV livello come d’uso per le
neoplasie delle altre sedi.
Diffusione
È fortemente caratterizzata da spiccata tendenza alla infiltrazione ascendente per via sottomucosa lungo le
pareti dell’esofago e da precoci metastasi linfonodali.
a) Diffusione per via sottomucosa
La ricca rete linfatica della sottomucosa gastrica prosegue lungo la parte esofagea senza soluzioni di
continuità: la diffusione verso l’esofago è di conseguenza quasi esclusivamente dovuta alla permeazione dei
linfatici sottomucosi e può avvenire anche con mucosa sovrastante indenne, dando luogo al fenomeno delle “skip
lesions”. Si intuisce facilmente come questo possa rappresentare uno dei maggiori problemi nella ricerca della
radicalità: infatti lo stabilire dove far cadere il margine di sezione prossimale è uno dei principali interrogativi non
risolti nella terapia chirurgica del carcinoma cardiale. Né la scelta riveste un semplice significato teorico in quanto
comporta precise opzioni di carattere chirurgico (vie di accesso, estensione dell’exeresi etc.) ed il rischio della
temibile evenienza rappresentata dalla recidiva anastomotica prossimale.
La definizione dell’entità della resezione esofagea e quindi del margine di clearance prossimale varia
ampiamente nelle diverse esperienze: così Autori che adottano un margine intorno ai 2 cm riportano percentuali di
recidiva superiori al 30% (40-42), che si riducono al 12% (43-45) con un margine di 5 cm e a meno del 5% con
una clearance di almeno 6 cm (32, 46); proprio il valore di 6 cm è stato per lungo tempo considerato il margine di
sicurezza nella chirurgia del cancro del cardias (47, 48). Tuttavia, con le recenti acquisizioni anatomopatologiche
sulle strutture linfatiche della regione e con il moltiplicarsi delle esperienze, si è andato sempre più affermando il
principio della necessità di una resezione esofagea più ampia, supportato dal notevole miglioramento delle
percentuali di sopravvivenza (49, 50), dalla netta diminuzione dell’incidenza delle recidive anastomotiche fino
alla loro virtuale scomparsa con margine di sicurezza prossimo ai 10 cm (51-53). Inoltre, in caso di istotipo
diffuso di Lauren, caratterizzato da crescita discontinua (17, 20, 23, 54), esiste una precisa indicazione alla ricerca
di un margine di clearance il più ampio possibile.
Nei confronti della diffusione in senso distale esistono ancora oggi alcune controversie. Nella maggior parte
dei casi, rimangono valide le norme già stabilite per la chirurgia del cancro del terzo superiore dello stomaco, cioè
l’indicazione alla Gastrectomia Totale (GT) di principio (17, 19, 53, 55-59).
Per la verità la GT non si è mai dimostrata realmente superiore alla Resezione Polare Superiore (RPS) in
termini di sopravvivenza: Jackl riporta la sua esperienza su una popolazione di 125 pazienti con adenocarcinoma
del cardias in cui l’entità della resezione non ha influenzato in alcun modo la sopravvivenza a 5 anni, che è stata
del 18% per la GT contro il 17% per la RPS (60); il reale vantaggio offerto dalla GT consisterebbe esclusivamente
in una più precisa stadiazione postoperatoria.
Tuttavia, in presenza di una neoplasia non affiorante alla superficie del viscere (T1 e T2), nella quale i
linfonodi delle stazioni n 5 e 6 sono indenni in un’altissima percentuale di casi (61), sembra ancora giustificata
l’adozione della RPS (62), tenendo in considerazione la possibilità di una linfectomia inadeguata ed il rischio di
patologia secondaria rappresentata dalla malattia da reflusso.
b) Diffusione per via linfatica
La diffusione linfatica del cancro gastrico alle stazioni linfonodali mediastiniche è ancora molto discussa
(63).
Maruyama (64) riporta tre vie fondamentali di drenaggio linfatico a partenza dal cardias:
1) via ascendente, lungo il decorso della parete esofagea fino al mediastino;
2) via destrorsa, dalla piccola curva, lungo i rami cardio-esofagei e l’arteria gastrica sinistra, fino al tripode
celiaco;
3) via sinistrorsa, dalla parete posteriore, attraverso la grande curva ed il bordo superiore del pancreas, fino
all’ilo splenico ed alle strutture retroperitoneali (stazioni 10, 11, 14, 15, 16).
Husemann ha osservato un interessamento dei linfonodi regionali in percentuale uguale agli altri carcinomi
dello stomaco; al contrario, nei soli carcinomi del cardias, i linfonodi paracardiali e paraesofagei erano interessati
rispettivamente nel 48% e 37% dei casi (20).
In un accurato studio prospettico viene confermato l’interessamento linfonodale mediastinico nel cancro del
cardias: i linfonodi paraesofagei inferiori e diaframmatici risultarono positivi nel 18,2% dei casi (53); anche Clark
riporta percentuali simili, con interessamento dei linfonodi diaframmatici nel 35% dei casi e di quelli paraesofagei
nel 28% (65).
c) Diffusione per via ematica
La neoplasia metastatizza principalmente attraverso il sistema portale ed il fegato rappresenta quindi
l’organo bersaglio più frequente (oltre la metà dei casi), seguito da peritoneo, polmoni, ecc. in percentuali
significamente minori (14, 21, 24, 66).
Fattori prognostici
La prognosi del carcinoma del cardias è decisamente sfavorevole, dal momento che nell’ultimo decennio
vengono riportate percentuali di sopravvivenza a 5 anni dopo chirurgia resettiva tra il 10% ed il 25% (Tab. 2).
Tabella 2 - Sopravvivenza dopo resezione per carcinoma del cardias:
risultati della Letteratura.
Autore
Anno
Numero di Pazienti
ALLUM (68)
MEYER (69)
PERACCHIA (32)
HENNESSY (70)
1986
1987
1987
1988
265
214
168
128
Sopravvivenza a 5 anni
9,8 %
25,3 %
19,1%
24,1%
ELLIS (43)
MOREAUX (44)
VISSET (67)
STIPA (22)
BLOMJOUS (66)
JACKL (60)
1988
1988
1992
1992
1993
1995
127
81
71
211
112
125
22,4 %
18,5 %
10,2 %
16,7 %
24 %
15 %
Alcune casistiche riportano percentuali di sopravvivenza a 5 anni del 5% (71) o inferiori (72).
Una delle cause principali di una prognosi così severa è rappresentata dalla elevata incidenza degli stadi
avanzati, specie alla luce di quanto sottolineato da Siewert (21): considerando che il 30% della superficie della
regione cardiale non è coperta da sierosa, una notevole percentuale di neoplasie classificate come T2 sono in
effetti T3, facendo spostare l’asse d’incidenza per stadio verso le forme più avanzate.
Dall’esperienza di Siewert si ricava inoltre che, dopo aver effettuato la “correzione” trasformando i T2
affioranti alla superficie del viscere in T3 effettivi, l’incidenza della neoplasia agli stadi I e II passa dal 44.1% al
24.6, contro il 45% fatto rilevare dai carcinomi del terzo medio ed inferiore (21).
Senz’altro la variabile del “T3 fantasma” può risultare di grande importanza nella prognosi oltremodo severa
di questa neoplasia, sottolineando ancora di più la necessità della diagnosi precoce soprattutto per i carcinomi di
questa particolare regione.
Sta di fatto che le sopravvivenze a 5 anni per gli early cancers cardiali risultano molto soddisfacenti, con
percentuali che vanno dal 65% (69, 73) fino a più del 90% (44, 74). Tuttavia l’incidenza delle neoplasie cardiali
in fase early nelle diverse casistiche è piuttosto bassa, variando tra il 3% e l’11% (20, 22, 24, 25, 73): Mori riporta
che solo nell’1% di 2237 pazienti con early gastric cancer la neoplasia era localizzata nel cardias (75). In accordo
con questi dati, anche nella casistica ACOI tale incidenza è risultata del 5,6%.
Strettamente correlati alla stadiazione sono i parametri T ed N.
La profondità di invasione parietale della neoplasia non è direttamente dipendente dal suo diametro massimo
(76): quest’ultimo inoltre non sembra avere valenze prognostiche, non correlandosi con la sopravvivenza a
distanza (40, 66, 77).
Wang ha valutato la relazione esistente tra frequenza di metastasi linfonodali e profondità di invasione del
tumore primitivo (53). Nella sua esperienza il 52% dei pazienti presentava linfonodi positivi e ciò era direttamente
proporzionale al grado di infiltrazione parietale.
Ohno non riscontra alcuna metastasi linfonodale negli early cancers cardiali; al contrario, nei tumori
infiltranti la muscularis propria o lo strato sottosieroso, il 78% dei pazienti era classificato N+ ed un terzo di essi
presentava metastasi nelle stazioni extragastriche, mentre i tumori affioranti alla superficie del viscere o infiltranti
gli organi vicini mostravano metastasi nei linfonodi extaregionali nel 60.5% dei casi (24).
Tanigawa riporta metastasi nelle stazioni linfonodali mediastiniche in un quarto dei pazienti con invasione
della sierosa; al contrario, per T meno avanzati, i linfonodi si dimostrano costantemente negativi (62). Ne deriva
che una estesa dissezione linfonodale dovrebbe essere riservata ai tumori estesi oltre lo strato sottomucoso, mentre
una linfadenectomia relativamente conservativa sembrerebbe sufficiente per i tumori confinati allo strato
sottomucoso.
Da una recente analisi multifattoriale eseguita su una casistica retrospettiva, la profondità di invasione
parietale del tumore è il principale fattore predittivo indipendente di sopravvivenza, insieme alla presenza di
margini di sezione istologicamente positivi per residuo neoplastico; la significatività risulta più elevata rispetto
alla presenza di metastasi linfonodali ed al tipo di intervento adottato (60).
Anche la positività dei margini di sezione viene ritenuta fattore di grande importanza prognostica (22, 67),
anche se essa viene rapportata non tanto alla sopravvivenza, quanto ad una maggiore incidenza di metastasi
linfonodali (66).
Blomjous su una casistica di 112 pazienti con adenocarcinoma del cardias, riporta significative differenze
nelle percentuali di sopravvivenza a distanza quando messe in relazione con i sottogruppi della classificazione
TNM (T1-2 versus T3-4, N0 versus N1-2, M0 versus M1, Stadio I-II versus Stadio III-IV); inoltre il Grading
istologico si è dimostrato correlato con l’incidenza di metastasi linfonodali e con la sopravvivenza (66) (Tab. 3),
come già sottolineato in esperienze precedenti (20, 78).
Tabella 3 - Grading istologico e parametro N vs sopravvivenza a 5 anni.
Grading
1-2
1-2
3-4
3-4
N
Sopravvivenza a 5 anni (%)
0
1-2
0
1-2
53
12
21
14
L’importanza del grading viene sottolineata anche in un altro studio comprendente 168 pazienti con cancro
del cardias infiltrante l’esofago, in cui le varianti più indifferenziate si sono rivelate statisticamente correlate a
neoplasie di diametro maggiore, con invasione sierosa più pronunciata, metastasi linfonodali nell’86% dei casi,
alta percentuale di resezioni ritenute non curative e sopravvivenza a distanza significativamente più sfavorevole
(54).
Principi di chirurgia
La terapia chirurgica delle neoplasie della giunzione esofago gastrica è oggetto di numerose controversie.
Se da una parte considerazioni di strategia operatoria forzano il chirurgo ad affrontare il tumore del cardias
come se fosse un cancro dell’esofago, dall’altra acquisizioni di carattere oncologico lo spingono a considerarlo un
carcinoma dello stomaco (20, 66).
Coesistono oggi due opinioni sul trattamento chirurgico di questo tumore, l’una fedele a criteri di radicalità
oncologica, favorevole quindi a resezioni sempre più allargate (35), l’altra orientata verso exeresi più limitate, a
causa dei risultati comunque deludenti (71, 72).
Riservando ormai solo una meritata citazione, per il loro valore storico, alle modeste resezioni
esofago-gastriche sec. Lewis-Tanner del primissimo periodo (79), la chirurgia dei carcinomi cardiali ha ricevuto
un grosso contributo nell’ultimo ventennio dai notevoli progressi compiuti nei campi della chirurgia oncologica,
della anestesiologia e della tecnica chirurgica.
Già alla metà degli anni ’70 l’intervento di scelta era rappresentato dalla esofagectomia subtotale associata
alla resezione gastrica prossimale condotta in basso lungo la piccola curva: veniva sempre associata una accurata
linfectomia mediastinica ed addominale, come descritto nella tecnica originaria di Akiyama (80). La continuità
alimentare veniva ripristinata attraverso una anastomosi tra l’esofago e lo stomaco residuo, con tecnica manuale
se eseguita al collo, meccanica o manuale a seconda delle preferenze se intratoracica; questa metodica presentava
indubbi vantaggi di ordine tecnico e di tempi rispetto a quelle che contemplavano la sostituzione dell’esofago con
il digiuno o il colon.
Dal momento che lo stadio del tumore è il parametro che condiziona in maniera più significativa la
sopravvivenza, è un fatto che il tipo di intervento può influenzare la prognosi negli stadi iniziali della neoplasia (I
e II); nei pazienti con tumori al III e IV stadio, lo scopo dell’intervento è quello di rimuovere la massa neoplastica
ed eliminare la disfagia, riducendo al minimo le possibilità di una recidiva locale di malattia sull’anastomosi
prossimale. Va sottolineato comunque che alcuni Autori riportano risultati molto soddisfacenti in termini di
sopravvivenza anche per pazienti al III stadio (43, 62), per i quali non è quindi corretto parlare di chirurgia
palliativa.
Una delle questioni più largamente dibattute è quella riguardante la necessità della toracotomia: l’approccio
toracoaddominale (42 ,56, 81), la toracotomia sinistra (43, 82) o destra (25, 26), la tecnica di Ivor-Lewis (83) e la
resezione transiatale (55, 84-87) hanno avuto ciascuna i propri sostenitori nel corso degli anni.
L’approccio toracoaddominale è stato ritenuto per molto tempo l’unico idoneo nel trattamento di queste
particolari neoplasie situate al confine tra il torace e l’addome: i vantaggi di questa duplice via d’accesso nel
consentire un’intervento a finalità curativa e nel migliorare la prognosi sono stati ampiamente illustrati (22, 35,
88, 89); tale procedura, tuttavia, comporta spesso una elevata incidenza di complicanze operatorie (22, 53, 56, 71,
72, 90).
Recentemente Nakane ha confermato l’opportunità di un esteso intervento per via toracoaddominale per
rimuovere una neoplasia risalente per più di 2 cm al di sopra della giunzione esofago-gastrica: la metodica è stata
in grado di assicurare un adeguato margine di resezione sul viscere ed una completa dissezione dei linfonodi
mediastinici (23).
In favore della via combinata si dichiara anche Hagen nel riportare i risultati ottenuti con l’esofagectomia
“en bloc”, che prevede la resezione dell’esofago insieme al tessuto cellulo-adiposo ed ai linfonodi locoregionali
per via combinata laparotomica e toracica destra, e con la semplice esofagectomia a torace chiuso: la
sopravvivenza globale a distanza è risultata significamente migliore con la prima tecnica rispetto alla seconda
(41% versus 14%) in un due serie omogenee di pazienti (91).
Come ampiamente dimostrato in un successivo studio dagli stessi Autori, l’incidenza delle metastasi
linfonodali si dimostra strettamente legata alla profondità di invasione della neoplasia (33% negli intramucosi,
67% negli intramurali, 89% nei transmurali), mentre la percentuale complessiva di recidive a partenza dai
linfonodi locoregionali si attesta sul 40%, a testimonianza della necessità di resezioni ampie e di linfoadenectomie
estese (65).
L’esofagectomia senza toracotomia o transiatale è stata originariamente descritta da Turner nel 1933 (92) e
successivamente rilanciata alla fine degli anni 70’ per estendere le indicazioni chirurgiche anche ai pazienti ad
alto rischio per ridotta funzionalità cardiorespiratoria.
Questa tecnica è sicuramente in grado di ridurre la mortalità operatoria e risulta meglio tollerata dai pazienti
(55, 84, 93-95): tuttavia essa non consente una completa radicalità oncologica a livello mediastinico e non è priva
di serie complicanze, alcune specifiche come l’emorragia e le lesioni ricorrenziali (62, 84, 86, 96, 97).
Ampie prospettive in tal senso sembrano offrire le moderne tecniche toracoscopiche in grado di far eseguire
la dissezione esofagea nel mediastino sotto diretta visione e quindi con maggiore sicurezza e facilità di
esecuzione.
Una variante estremamente interessante della esofagectomia a torace chiuso per via transiatale è stata
proposta da Pinotti (98), che propone la sezione della porzione anteriore del diaframma sul piano mediano in
modo da poter effettuare la dissezione dell’esofago sino all’altezza della vena polmonare inferiore, avendo cura di
non ledere il pericardio ed i foglietti pleurici; l’intervento può essere portato a termine senza cambiamento di
posizione del paziente, con indubbio risparmio sui tempi operatori.
Tanigawa (62) propone un ampia dissezione della porzione di diaframma periatale, comprendente non solo il
muscolo crurale ma anche tutto il tessuto cellulo-adiposo diaframmatico che circonda lo iato esofageo, basandosi
sul concetto che la diffusione tumorale spesso coinvolge proprio le strutture adiacenti ad esso (99). L’incidenza
delle complicanze minori è stata piuttosto elevata (50% circa), la soppravvivenza cumulativa a 5 anni per gli stadi
I-III è stata a del 62% mentre, per i pazienti al IV stadio non si è registarata alcuna sopravvivenza oltre i due anni.
A prescindere da singoli risultati riportati da centri altamente specializzati, l’esperienza ha sostanzialmente
dimostrato che, per quanto riguarda i risultati immediati (mortalità e morbidità), tale procedura è pressoché
sovrapponibile agli interventi con toracotomia, mentre i risultati globali in termini di sopravvivenza a distanza
rimangono comunque molto modesti per entrambe. Una ulteriore conferma in proposito viene da Fok e Wong, su
una recente revisione della loro casistica comprendente ben 785 pazienti resecati per carcinoma dell’esofago e del
cardias (100).
La constatazione della spiccata tendenza alla infiltrazione linfatica sottomucosa ed alle metastasi linfonodali
ha spinto alcuni Autori ad interventi molto più estesi in grado di assicurare una maggiore radicalità (57, 101, 102):
è stata quindi proposta la esofagogastrectomia totale con ricostruzione mediante utilizzo del colon destro o
sinistro. In attesa di risultati definitivi di maggiore significatività, si può prendere atto per il momento che questo
intervento non è gravato da una mortalità operatoria particolarmente elevata (7%-13,5%), ma è senza dubbio
molto più impegnativo per il paziente e di lunga durata, tanto che a volte non può essere portato a termine in una
singola seduta operatoria.
Tuttavia non è ancora chiaro se questo intervento debba essere adottato in neoplasie iniziali e clinicamente
favorevoli (stadio I e II) come sostenuto da De Meester (101), oppure debba essere riservato agli stadi più
avanzati (III e IV), come sostenuto invece da Siewert (57): controversa appare la posizione assunta da
Moreno-Gonzalez che, pur riconoscendo l’opportunità di una soluzione radicale come l’esofago-gastrectomia
totale, la realizza per via transiatale a torace chiuso (102).
Terapie complementari
Risultati incerti sono stati riportati sull’efficacia della chemioterapia adiuvante nel prevenire la recidiva
postoperatoria di malattia (103), mentre altri sono stati positivi nei confronti del controllo locale ma non in
termini di sopravvivenza (104).
Dati incoraggianti sono invece venuti da un gruppo di studio Americano che ha dimostrato un sorprendente
effetto benefico da parte della chemioterapia neoadiuvante in un gruppo di 100 pazienti (105). Considerando la
mortalità operatoria, il 60% dei pazienti non operati contro il 20 % dei pazienti operati risultavano vivi a 3 anni.
Ferguson riporta i risultati di un trial sulla terapia multimodale per il carcinoma della giunzione
esofago-gastrica (106): dapprima è stata valutata la risposta al trattamento chemioterapico e l’operabilità dopo un
ciclo di chemioterapia neoadiuvante; successivamente dopo aver valutato valutato l’impatto della triplice terapia
(chemioterapia preoperatoria, resezione chirurgica e radiochemioterapia postoperatoria) sulla sopravvivenza a
distanza. è stata ottenuta una buona risposta al trattamento, senza nessun aumento significativo della mortalità o
della morbidità dopo resezione ed incoraggianti risultati in termini di sopravvivenza.
Trattamento palliativo
A dispetto del fatto che il tasso di operabilità è molto cresciuto negli ultimi anni e le percentuali di
resecabilità sono oggi considerevolmente migliorate, variando nelle principali casistiche dal 50% (22, 68, 71, 107)
al 75% (19, 26, 60, 108), per arrivare addirittura all’80% in alcuni centri altamente specializzati (21, 23, 25, 66,
67, 82), la prognosi dei pazienti con carcinoma del cardias resta, decisamente sfavorevole.
Molto spesso il trattamento di questa neoplasia deve essere considerato palliativo: a questo scopo, un ruolo
importante rivestono oggi le procedure attuabili per via endoscopica.
Le endoprotesi metalliche e la laser terapia possono infatti fornire eccellenti risultati in termini di
prolungamento dell’intervallo di tempo libero dalla disfagia e quindi di qualità di vita in pazienti selezionati (109,
110): è da tener presente che anche in questi casi i carcinomi del cardias sono caratterizzati da una maggiore
incidenza di complicanze (111).
L’esperienza ACOI-ISCG (Italian Stomach Cancer Group)
Nell’ambito dei 4278 casi di cancro dello stomaco reclutati nel periodo 1986-1990 (vedi Cap. 22), i
carcinomi del cardias sono stati 271, pari al 6.4%.
La suddivisione in base al TNM ha fatto rilevare un’alta incidenza di T3 e di N1, se paragonati con i dati
globali dell’intera popolazione considerata (Tab. 4).
La classificazione in stadi ha messo in evidenza una bassa incidenza di neoplasie allo stadio IA ed un’alta
incidenza allo stadio IIIB (Tab. 5).
Le neoplasie si sono rivelate scarsamente differenziate nel 37.6% dei casi, moderatamente differenziate nel
32%
La gastrectomia totale è stata eseguita nel 71.9% dei casi; in 33 casi è stata eseguita una resezione polare
superiore (12.2%), in 21 casi una LE (7.7%), in 14 casi fu posizionata una endoprotesi.
Tab. 4 - Suddivisione per TNM.
Param.T
n. paz.
%
Param N
n. paz.
%
Param.M
n. paz.
%
T1
15
5.5
N0
75
27.6
212 78.2
T2
50
18.5
N1
89
32.8
40 14.8
T3
116
42.8
N2
72
26.6
19
T4
74
27.3
N3
15
5.5
Tx
16
5.9
Nx
20
7.4
Totale
271
271
7
271
Tab. 5 - Suddivisione per stadio.
Stadio
n. paz.
%
IA
12
4.4
IB
28
10.3
II
42
15.5
IIIA
52
19.2
IIIB
62
22.9
IV
73
26.9
Scon.
2
0.7
Totale
271
L’intervento è stato eseguito a finalità curativa nel 73% dei casi.
La mortalità operatoria è stata del 12.7%.
La sopravvivenza a 5 anni per interventi a finalità curativa è risultata del 30.3% (Fig. 2).
BIBLIOGRAFIA
1) Wang HH, Antonioli DA, Goldman H. Comparative features of esophageal and gastric adenocarcinomas: recent changes in type and
frequency. Hum Pathol 17:482, 1986.
2) Meyers WC, Damiano RJ, Postlethwait RW, Rotolo FS. Adenocarcinoma of the stomach: changing patterns over the last 4 decades.
Ann Surg 205:1, 1989.
3) Blot WJ, Devesa SS, Kneller RW, Fraumeni JF. Rising incidence of adenocarcinoma of the esophagus and gastric cardia. JAMA 265:
1287, 1991.
4) Kampschoer GHM, Nakajima T, Van de Velde CJH. Changing patterns in gastric adenocarcinoma. Br J Surg 76:914, 1989.
5) Paterson IM, Easton DF, Corbishley CM, Gazet JC. Changing distribuition of adenocarcinoma of the stomach. Br J Surg 74: 481,
1987.
6) Ward MH, Dosemeci M, Cocco P. Mortality from gastric cardia and lower esophagus cancer and occupation. J Occup Med
36(11):1222, 1994.
7) Powell J, McConkey CC. The rising trend in oesophageal adenocarcinoma and gastric cardia. Eur J Cancer Prev 1(3):265, 1992.
8) Holscher AH, Siewert JR. Surgical treatment of the adenocarcinoma of the gastroesophageal junction. Results of an European
questionnaire. Dig Surg 2:1, 1985.
9) DeMeester TR, Barlow AP. Surgery and current management for cancer of the esophagus and cardia. Part I Curr Probl Surg 66:480,
1988.
10) DeMeester TR, Barlow AP. Surgery and current management for cancer of the esophagus and cardia. Part II Curr Probl Surg 66:541,
1988.
11) Gray JR, Coldman AJ, MacDonald WC. Cigarette and alcohol use in patients with adenocarcinoma of the gastric cardia and lower
esophagus. Cancer 69:2227, 1992.
12) Picton TD, Owen DA, MacDonald WC. Comparison of esophagocardiac and more distal gastric cancer in patients with prior ulcer
surgery. Cancer 71:5, 1993.
13) Heidl G, Langhans P, Mellin W et al. Adenocarcinomas of esophagus and cardis in comparison with gastric carcinoma. J Cancer Res
Clin Oncol 120 (1-2):95, 1993.
14) Sons HU, Bochard F. Cancer of the distal esophagus and cardia. Incidence, tumorous infiltration and metastatic spread. Ann Surg
203:188, 1986.
15) MacDonald WC, MacDonald JB. Adenocarcinoma of the esophagus and and/or gastric cardia. Cancer60:1094, 1987.
16) Heidl G, Langhans P, Krieg V et al. Comparative studies of cardia carcinoma and infracardial gastric carcinoma. J Cancer Res Clin
Oncol 120 (1-2):91, 1993.
17) Holscher AH, Schuler M, Siewert JR. Surgical treatment of gastric cancer: carcinomas of the gastroesophageal junction. In: Hotz J,
Meyer HJ, Schmoll HJ, eds. Gastric carcinoma. Classification, diagnosis and therapy. Springer Berlin, Heidelberg, New York,
London Paris Tokyo, pp.60, 1989.
18) Haggit RC, Tryzelaar J, Ellis FH, Colcher H. Adenocarcinoma complicating epitheliumlined esophagus. Am J Clin Pathol 70:1, 1978.
19) Siewert JR, Holscher AH, Becker K, Gossner W. Kardiakarzinom: Versuch einer therapeutisch relevanten Klassifikation. Chirurg
58:25, 1987.
20) Husemann B. Cardia carcinoma considered as a distinct clinical entity. Br J Surg 76:136, 1989.
21) Siewert JR, Bottcher K, Stein HJ et al. Problem of Proximal Third Gastric Carcinoma. World J Surg 19:523, 1995.
22) Stipa S, Di Giorgio A, Ferri M. Surgical treatment of adenocarcinoma of the cardia. Surgery 111:386, 1992.
23) Nakane Y, Okamura S, Boku T et al. Prognostic Differences of Adenocarcinoma Arising from the Cardia and the Upper Third of the
Stomach. Am Surg 59(7):423, 1993.
24) Ohno S, Tomisaki S, Oiwa H et al. Clinicopathologic characteristics and outcome of adenocarcinoma of the human gastric cardia in
comparison with carcinoma of other regions of the stomach. J Am Coll Surg 180:577, 1995.
25) Binda GA, Trizio F, Venturi GC, Binda PG. Il trattamento chirurgico del carcinoma del cardias. Chirurgia 4:459,1991.
26) Tonelli L, Tonelli P. La terapia chirurgica del carcinoma cardiale. Giornale Italiano di Chirurgia Vol. XLVII:85, 1993.
27) Cullen JW. Principles of cancer prevention: Tobacco. In: De Vita VT, Hellman S, Rosenberg SA, eds. Cancer: Principle and
Practice of Oncology, ed. 3. Philadelphia: JB Lippincott, pp. l81, 1989.
28) Chow WH, Finkle WD, McLaughlin JK et al. The relation of gastroesophageal reflux disease and its treatment to adenocarcinoams
of the esophagus and gastric cardia. JAMA 274(6):474, 1995.
29) Clark GW, Smyrk TC, Burdiles P et al. Is Barrett’s metaplasia the source of adenocarcinaomas of the cardia? Arch Surg 129(6):609,
1994.
30) Hamilton SR, Smith RR, Cameron JL. Prevalence and characteristics of Barrett esophagus in patients with adenocarcinoma of the
esophagus or esophago-gastric junction. Hum Pathol 19:942, 1988.
31) Kalish RJ, Clancy PE, Orringer MB et al. Clinical, epidemiologic and morphologic comparison between adenocarcinomas arising in
Barrett’s esophageal mucosa and in the gastric cardia. Gastroenterology 86:461,1984.
32) Peracchia A, Bardini R, Bonavina L et al. Adenocarcinoma of the cardia: the choice of surgical treatment. It J Surg Sci 17:123, 1987.
33) Ellis FH Jr, Watkins E Jr, Krasna MJ et al. Staging of carcinoma of the esophagus and cardia: a comparison of different staging
criteria. J Surg Oncol 52:231, 1993.
34) Skinner DB, Little AG, Ferguson MK et al. Selection of operation for esophageal cancer based on staging. Ann Surg 204:391,1986.
35) Hagen JA, Peters JH, DeMeester TR. Superiority of extended en bloc esophagogastrectomy fpr carcinoma of the lower esophagus and
cardia. J Thorac Cardiovasc Surg 106:850, 1993.
36) Holscher AH, Bollschweiler E, Siewert JR. Carcinoma of the gastric cardia. Ann Chir Gynaecol 84(2):185, 1995.
37) Craanen ME, Dekker W, Blok P et al. Time trends in gastric carcinoma: changing patterns of type and location. Am J Gastroenterol
87:572, 1992.
38) Wanebo HJ, Kennedy BJ, Chmiel J et al. Cancer of the stomach. Ann Surg 218:583, 1994.
39) Hermanek P, Heuson DE, Hutter R, Sobin LH, eds. UICC: TNM Supplement 1993. Berlin, Springer Verlag, pp.120, 1993.
40) Papachristou DN, Fortner JG. Adenocarcinoma of the gastric cardia. The choice of gastrectomy. Ann Surg 192:58,1980.
41) Husemann B. Recurrence rate after resection of cardia cancer in relation to histological type according to Lauren and resection
margins. In: Siewert JR, Holscher AH, eds. Disease of the esophagus. Berlin, Heidelberg, New York, Tokyo, Springer, pp.627, 1988.
42) Molina EJ, Lawton BR, Myers WO, Umprey EW. Esophagogastrectomy for adenocarcinoma of the cardia: ten year’s experience and
current approach. Ann Surg 195:146, 1982.
43) Ellis FH, Gibb SP, Watkins E. Limited esophagogastrectomy for carcinoma of the cardia. Indications, technique and results. Ann
Surg 208:354,1988.
44) Moreaux J, Msika S. Carcinoma of the gastric cardia: surgical management and long-term survival. World J Surg 12:229, 1988.
45) Saubier EC, Gouillat C, Janati R, Michaelides A. Le traitement chirurgical du cancer du cardia. Bilan de 86 observations. Lyon Chir
80:123, 1984.
46) Ribet M, Quandalle P, Wurtz A et al. Resultats du traitement chirurgical de l’adenocarcinome du cardia en fonction de l’etendue de
l’exerese. Ann Chir 41:5, 1987.
47) Papachristou DN, Agnanti N, D’Agostino H, Fortner JG. Histologically positive esophageal margin in the surgical treatment of
gastric cancer. Am J Surg 139:711, 1980.
48) Bozetti F, Bonfani G, Bufalino R et al. Adequacy of margins of resection in gastrectomy for cancer. Ann Surg 196:685,1982.
49) Giuli R. Surgical complications and reasons for failure. In: DeMeester TR, Levin B, eds. Cancer of the esophagus. Grune & Stratton,
Orlando, pp. 198, 1985.
50) Husemann B. Gelten die Kriterien der Magenkarzinomchirurgie auch beim Kardiakarzinom. In: Langhans P et al., eds. Aktuelle
Therapie des Kardia-karzinom. Springer Verlag, Berlin, pp. 86, 1988.
51) Wong J. Esophageal resection for cancer: The rationale of current practise. Am J Surg 153:18, 1987.
52) Tam PC, Siu KF, Cheung HC et al. Local recurrences after subtotal esophagectomy for squamous cell carcinoma. Ann Surg 205:189,
1987.
53) Wang LS, Wu CW, Hsieh MJ et al. Lymph Node Metastasis in Patients with Adenocarcinoma of Gastric Cardia. Cancer
71:1948,1993.
54) Maehara Y, Takahashi I, Okuyama T et al. Diagnostic Factors in Gastric Cardia Invading the Esophagus. Cancer 71:302, 1993.
55) Goldfaden D, Orringer MB, Appelman HD, Kalish R. Adenocarcinoma of the distal esophagus and gastric cardia. Comparison of
results of transhiatal esophagectomy and thoracoabdominal esophagogastrectomy. J Thorac Cardiovasc Surg 91:242, 1986.
56) Griffin SM, Chung SCS, Woods SDS. Adenocarcinoma of the cardia: treatment by thoracoabdominal R3 radical gastrectomy. Br J
Surg 77:937, 1990.
57) Santoro E, Garofalo A, Scutari F et al. Cancro dello stomaco. Studio retrospettivo multicentrico su 3024 pazienti operati. Chirurgia
3:319,1990.
58) Kirk RM. A trial of total gastrectomy, combined with total thoracic esophagectomy without formal thoracotomy, for carcinoma at or
near the cardia of the stomach. Br J Surg 68:577, 1981.
59) Iida F, Koike S, Koide N. Extended Total Gastrectomy for Carcinoma of the Cardia. Hepato-Gastroenterol 40:103, 1993.
60) Jakl RJ, Miholic J, Koller R et al. Prognostic Factors in Adenocarcinoma of the Cardia. Am J Surg 169:316, 1995.
61) Omori Y, Honda I. Selection of surgical treatment for cardiac cancer: Special reference to postoperative prognosis. Gastroenterol
Surg 10:953,1987.
62) Tanigawa N, Shimomatsuya T, Horiuchi T et al. En Bloc Resection for Cancer of the Gastric Cardia Without Thoracotomy. J Surg
Oncol 54:23, 1993.
63) Yoshida C. Experimental study for Iymphatic routes of the cardia and diaphragm. Jpn J Surg Soc 93:691,1992.
64) Maruyama K, Miwa K, Kawamura U et al. Lymphatic flow of gastric cardia. A study by endoscopiclymphography. Stomachlntest
13:1535,1978.
65) Clark GW, Peters JH, Ireland AP et al. Nodal metastasis and sites of recurrence after en bloc esophagectomy for adenocarcinoma.
Ann Thorac Surg 58(3):646, 1994.
66) Blomjous JGA, Hop WCJ, Langenhorst BLAM et al. Adenocarcinoma of the Gastric Cardia. Recurrence and Survival after
Resection. Cancer 70:569, 1992.
67) Visset J, Couderc JP, Letessier E et al. Le cancer du cardia. Facteurs pronostiques, traitement. Chirurgie 118(9):541,1992.
68) Allum WH, Roginki C, Fielding JWL et al. Adenocarcinoma of the cardia: a 10-year regional review. World J Surg 10:462,1986.
69) Meyer HJ, Ennker J, Pichlmayr R. Surgical treatment of adenocarcinoma of the upper third of the stomach and gastroesophageal
junction. In: Siewert JR, Holscher AH, eds. Disease of the esophagus. Berlin, Heidelberg, New York, Tokyo, Springer, pp.617, 1988.
70) Hennessy TPJ, Keeling P. Adenocarcinoma of the esophagus and cardia. In: Siewerl JR, Holscher AH, eds. Disease of the esophagus.
Berlin, Heidelberg, New York, Springer, pp.579, 1988.
71) Makela JT, Juvonen T, Laitinen S, Kairaluoma MI. Adenocarcinoma of the gastric cardia. Surg Oncol 4(2):75, 1995.
72) Wilson NW, Geall A, Kittermaster R, Bentley PG. Thoracoabdominal total gastrectomy in the management of adenocarcinoma of the
cardia. Is it worth it? Ann Royal Coll Surg Eng 72:329, 1990.
73) Moghissi K. Surgical resection for stage I cancer of the esophagus and cardia. Br J Surg 79(9):935, 199274) Kakegawa T, Takeda J, Hashimoto K et al. Thoracoabdominal approach as a routine procedure for adenocarcinoma of the
gastroesophageal junction. In: Siewert JR, Holscher AH, eds. Disease of the esophagus. Berlin, Heidelberg, New York, Tokyo,
Springer, pp.603, 1988.
75) Mori M, Kitagawa S, lida M et al. Early carcinoma of the gastric cardia. A clinicopathologic study of 21 cases. Cancer 59:1758,
1987.
76) Ming SC. Adenocarcinoma. In: Firminger HI, ed. Tumors of the esophagus and stomach (Atlas of tumor pathology). Washington, DC:
UAREP, pp. 145, 1973.
77) Lu YK, Li YM, Gu YZ. Cancer of the esophagus and esophagogastric junction: analysis of results of 1025 resections after 5 to 20
years. Ann Thorac Surg 43:176, 1987.
78) Schneeberger AL, Finley RJ, Troster M et al. The prognostic significance of tumpor ploidy and pathology in adenocarcinoma of the
esophsgogastric junction. Cancer 65:1206, 1990.
79) Lewis I. The surgical treatment of carcinoma of the esophagus with special reference to a new operation for the growths of the middle
third. Br J Surg 34:18, 1946.
80) Akiyama H, Tsurumaru M, Kawamura T et al. Principle of surgical treatment for carcinoma of the esophagus: Analysis of Iymph
node involvement. Ann Surg 194:438, 1981.
81) Akiyama H, Miyazono H, Tsurumaru T et al. Thoracoabdominal approach for carcinoma of the cardia of the stomach. Am J Surg
137:345, 1979.
82) Sabanathan S, Eng J. Left thoracotomy approach for resection of carcinoma of the oesophagus and cardia. Ann Ital Chir 63(1):25,
1992.
83) King MR, Pairolero PC, Trastek VF et al. Ivor Lewis esophagogastrectomy for carcinoma of the esophagus: Early and late functional
results. Ann Thorac Surg 44:119, 1987.
84) Wong J. Transhiatal esophagectomy for carcinoma of the thoracic esophagus. Br J Surg 73:89,1986.
85) Orringer MB. Transhiatal esophagectomy without thoracotomy for carcinoma of the thoracic esophagus. Ann Surg 200:282, 1984.
86) Orringer MB, Marshall B, Stirling MC. Transhiatal esophagectomy for benign and malignant disease. J Thorac Cardiovasc Surg
105:265, 1993.
87) Finley RJ, Hobson J, Duff J. Esophagogastrectomy without thoracotomy for adenocarcinoma of the cardia and lower esophagus. In:
Siewert JR, Holscher AH, eds. Disease of the esophagus. Berlin, Heidelberg, New York, Springer, pp.586, 1988.
88) Okamura T, Korenaga D, Baba H et al. Thoracoabdominal approach for cure of patients with an adenocarcinoma of the upper third
of the stomach. Am Surg 55:248, 1989.
89) Hill S, Cahill J, Wastell C. The right approach to carcinoma of the cardia: preliminary results. Eur J Surg Oncol 18(3):282, 1992.
90) Kimose HH, Lund O, Hasenkam JM et al. Indipendent predictors of operative mortality and postoperative complications in surgically
treated carcinoma of the esophagus and cardia. Is the aggressive surgical approach worthwile? Acta Chir Scand 156:373, 1990.
91) Skinner DB. En bloc resection for neoplasms of the esophagus and cardia. J Thorac CardiovascSurg 85:59,1983.
92) Turner Grey G. Excision of thoracic oesophagus for carcinoma, with construction of extrathoracic gullet. Lancet II: 1315, 1933.
93) Holscher AH, Schuler M, Siewert JR. Surgical tretment of adenocarcinomas of the gastroesophageal junction. Diseases of the
esophagus 1:35, 1987.
94) Hankins JR, Attar S, Coughlin TR et al. Carcinoma of the esophagus: a comparison of the results of transhiatal versus transthoracic
resection. Ann Thorac Surg 47:700, 1989.
95) Gelfand GA, Finley RJ, Nelems B et al. Transhiatal esophagectomy for carcinoma of the esophagus and cardia. Experience with 160
cases. Arch Surg 127(10):1164, 1992.
96) Giuli R, Sancho-Garnier H. Diagnostic, therapeutic and prognostic features of cancer of the esophagus: results of the international
prospective study conducted by the OESO group (790 patients). Surgery 99:614, 1986.
97) Finley RJ, Inculet RI. The results of esophagogastrectomy without thoracotomy for adenocarcinoma of the esophagogastric junction.
Ann Surg 210:535, 1989.
98) Pinotti HW, Ellenbogen G, Zilberstein B et al. Esophagectomy by cervicoabdominal approach, incision of diaphragm and
transmediastinal extrapleural dissection. Surg Gastroenterol 12:223,1978.
99) Umetani H. Experimental and clinical study for spread of cardiac cancer to the diaphragm. Jpn J Surg Soc 91:1567, 1990.
100) Fok M, Wong J. Cancer of the esophagus and gastric cardia. Standard oesophagectomy and anastomotic technique. Ann Chir
Gynaecol 84(2):179, 1995.
101) DeMeester TR, Zaninotto G, Johansonn KE. Selective therapeutic approach to cancer of the lower esophagus and cardia. J Thorac
Cardiovasc Surg 95:42, 1988.
102) Moreno Gonzalez E, Gomez Gutierrez M, Calleja Kempin J et al. Extended total esophagogastrectomy as surgical treatment of
cancer of the cardia. In: Siewert JR, Holscher AH, eds. Disease of the esophagus. Berlin, Heidelberg, New York, Springer, pp.589,
1988.
103) Fein R, Kelsen DP, Geller N et al. Adenocarcinoma of the esophagus and gastroesophageal junction. Cancer 56:25 12,1985.
104) MacFarlane SD, Hill LD, Jolly PC et al. Improved results of surgical treatment for esophageal and gastroesophageal junction
carcinomas after preoperative combined chemotherapy and radiation. J Thorac C ardiovasc Surg 95:415,1988.
105) Lackey VL, Reagan MT, Smith A, Anderson WJ. Neoadjuvant chemotherapy of squamous cell carcinoma of the esophagus: role of
resection and benefit in partial responders. Ann Thorac Surg 48:218,1989.
106) Ferguson MK, Reeder LB, Hoffman PC et al. Intensive multimodality therapy for carcinoma of the esophagus and gastroesophageal
junction. AADE Ed J 2(2):101, 1995.
107) Sasse W, Bunte H, Heinicke A. Zur Prognose der Kardiacarcinoms. Langenbecks Arch Chir 365:205,1985.
108) Ellis FH Jr, Maggs PR. Surgery for carcinoma of the lower esophagus and cardia. World J Surg 5:527, 1981.
109) Hoffman W. Laser therapy and tube implantation for palliative treatment of inoperable esophageal and cardia cancer. Bildgebung
60(3):157, 1993.
110) Tranberg KG, Stael von Holstein C, Ivancev K, Cwikiel W. The YAG laser and Wallstent endoprosthesis for palliation of cancer in
the esophagus or gastric cardia. Hepato-Gastroenterol 42(2):139,1995.
111) Spinelli P, Cerrai FG, Ciuffi M et al. Endoscopic stent placement for cancer of the lower esophagus and gastric cardia. Gastrointest
Endosc 40(4):455, 1994.