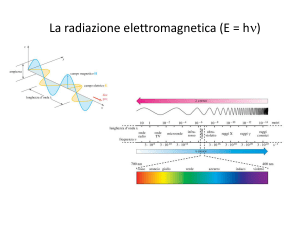
IL DUALISMO ONDA-PARTICELLA
LA DIFFRAZIONE DEGLI ELETTRONI
L’IPOTESI DI DE BROGLIE
a cura di Gianfranco Metelli
PREMESSA
L’argomento riguardante il dualismo onda-particella presenta indubbiamente una certa complessità.
Esso rientra nella Fisica Moderna e spesso nei libri di testo non si scrive molto a riguardo; anche
perché è più facile, pure per gli studenti, trattare di dinamica, cinematica, statica, oppure di onde,
luce, acustica… dato che in questi moduli gli effetti sono macroscopici e meglio esemplificabili.
Iinvece, discutere di fisica atomica non è immediato, anche perché risulta sicuramente più difficile
spiegare argomenti che trattino realtà microscopiche, purtroppo poco concrete all’immediatezza dei
nostri occhi.
OBIETTIVI
-
Sapere che l’aspetto corpuscolare ed ondulatorio sono due manifestazioni di una realtà
connesse all’esperimento
-
Conoscere la relazione fra la quantità di moto di una particella e lunghezza d’onda ad essa
associata (legge di De Broglie)
-
Osservare un’applicazione del comportamento ondulatorio dell’elettrone, comprendendo i
principi su cui si basa il funzionamento del microscopio elettronico
-
Visionare i principali aspetti della fisica moderna
pag. 1
CONTENUTI
L’interrogativo relativo alla natura ondulatoria della luce ha costituito, nella storia della fisica,
motivo di vivaci discussioni e di contrasti.
Solo in tempi recenti il quesito è stato riproposto nei termini di quali siano le manifestazioni
possibili della radiazione, in relazione all’esperimento in atto. Ciò ha consentito di chiarire gli
equivoci sorti nell’interpretazione dei fenomeni associati alla radiazione.
La teoria dei quanti, l’interpretazione di Einstein dell’effetto fotoelettrico, l’effetto Compton hanno
fornito significativi contributi alla giustificazione del comportamento corpuscolare della
radiazione. Così, la teoria di Louis Victor De Broglie, sull’associazione di una lunghezza d’onda
ad una particella in moto, comprovata da esperimenti effettuati dapprima con elettroni e poi con
altre particelle, come ad esempio il neutrone, ha dato una spiegazione delle manifestazioni
ondulatorie delle particelle. Dunque, come si era osservato che una radiazione elettromagnetica
poteva avere manifestazioni corpuscolari, si poteva supporre che, viceversa, una particella potesse
aver manifestazioni ondulatorie.
Queste interpretazioni, oltre a fornire un contributo fondamentale alle conoscenze fisiche, hanno
suggerito la realizzazione di molte applicazioni pratiche nei più svariati settori, come quelli dei
raggi X e della microscopia elettronica.
Problemi connessi alla teoria dei quanti
Analizzando l’ipotesi dei quanti, si è potuto dare una soddisfacente interpretazione di molti
fenomeni riguardanti il mondo delle particelle microscopiche e della radiazione elettromagnetica,
attraverso l’effetto fotoelettrico e l’effetto Compton, la stabilità degli atomi e lo spettro dell’atomo
di idrogeno.
Accanto a questi successi che, a poco a poco, convinsero tutti i fisici dell’epoca ad accettare
l’ipotesi quantistica, esistevano però motivi, tutt’altro che trascurabili, per giustificare la
continuazione delle ricerche sia relativamente alle sue applicazioni sia relativamente ai suoi
fondamenti.
Per quanto riguarda le applicazioni, basterà ricordare, ad esempio, che mediante la teoria di Bohr
non si era in grado né di prevedere in modo soddisfacente lo spettro degli atomi complessi né di
giustificare la diversa intensità delle righe spettrali degli atomi anche più semplici.
Per quanto riguarda i fondamenti, i problemi irrisolti erano forse ancora più gravi.
Da una parte non si comprendeva, ad esempio, perché le leggi dell’elettromagnetismo potessero
pag. 2
essere applicate con successo al calcolo del potenziale generato dal protone dell’atomo di idrogeno
sul suo elettrone e fallissero invece quando prevedevano l’irraggiamento dell’elettrone medesimo
con conseguente caduta sul nucleo.
D’altra parte rimaneva il problema di capire come la radiazione elettromagnetica, che nell’effetto
fotoelettrico e nell’effetto Compton poteva essere descritta come un fascio di corpuscoli (quanti),
generasse poi altri effetti tipici dell’ottica ondulatoria quali l’interferenza e la diffrazione.
Questa mescolanza fra proprietà ondulatorie e corpuscolari della radiazione trovava un preciso
riscontro nella combinazione dei principi dell’elettromagnetismo e della quantistica. Infatti, dai
primi si deduceva la relazione:
p=
E
c
(1)
con p ed E che indicano l’impulso e l’energia della radiazione elettromagnetica;
dai secondi la relazione:
E = hf
(2)
dove f indica la frequenza della radiazione e h la costante di Planck.
Dalla (1) e dalla (2) si ottiene dunque la relazione:
p=
(dato che c = λf ⇒
E hf
h
=
=
c
c
λ
(3)
f
1
= ).
c λ
Nella (3) compaiono simultaneamente grandezze che la meccanica classica manteneva ben separate:
l’impulso p, tipica grandezza corpuscolare e la lunghezza d’onda λ, tipica grandezza ondulatoria,
legati fra loro dalla costante di Planck.
I problemi ai quali si è accennato e soprattutto l’ambiguità di comportamento del quanto di
radiazione imponevano dunque un approfondimento di natura teorica, che precisasse i limiti di
applicabilità dei concetti di onda e di corpuscolo per la radiazione.
La prima conseguenza di questo tentativo di approfondimento fu l’estensione del dualismo,
introdotto per la radiazione, all’intera materia.
pag. 3
Estensione del dualismo onda-corpuscolo alla materia
Le considerazioni di fondo di De Broglie: una lunghezza d’onda per le particelle
L’estensione del dualismo onda-corpuscolo dal campo fenomenico della radiazione alle particelle
microscopiche fu proposta per la prima volta dal fisico francese Louis Victor De Broglie nel 1923.
Proponiamo il suo ragionamento attraverso il lungo brano seguente:
“Riassumiamo anzitutto le ragioni che ci hanno condotto, tra il 1923 e il 1924, ad enunciare le idee
fondamentali della meccanica ondulatoria. In quell’epoca, la scoperta dell’effetto Compton e lo studio
dell’effetto fotoelettrico dei raggi X avevano confermato la concezione dei quanti di luce di Einstein.
La struttura discontinua delle radiazioni e l’esistenza dei fotoni non si potevano più mettere in dubbio. Si
imponeva allora, sempre più acuto, il temibile dilemma delle onde e dei corpuscoli per quel che
riguardava la natura della luce. Bisognava di buona o di mala voglia ammettere che il modello delle onde e quello dei corpuscoli dovevano essere volta a volta utilizzati nella descrizione completa delle
proprietà della radiazione e la relazione tra frequenza ed energia posta da Einstein a base della teoria
dei fotoni legava intimamente questo dualismo della radiazione all’esistenza dei quanti.
Ci si poteva chiedere perciò se questo strano dualismo di onde e corpuscoli, di cui la luce fornisce un
esempio tanto notevole e sconcertante, non traducesse poi nei fenomeni la natura profonda e nascosta del
quanto d azione e se non si dovesse trovare lo stesso dualismo dovunque fosse presente la costante di
Planck.
Sorgeva allora spontanea una domanda: poiché l’esistenza degli stati stazionari nell’atomo dimostra
l’intervento del quanto d’azione nelle proprietà dell’elettrone, non presenterà l’elettrone un dualismo
analogo a quello della luce?
A prima vista quest’idea pareva molto audace, perché l’elettrone si era sempre comportato come un
punto materiale elettricamente carico e obbediente alle leggi della meccanica classica (corretta in certi
casi dal relativismo di Einstein). L’elettrone non aveva mai manifestato proprietà nettamente ondulatorie
analoghe a quelle della luce nei fenomeni d’interferenza e diffrazione. In assenza di ogni prova
sperimentale, l’attribuire all’elettrone delle proprietà ondulatorie poteva sembrare una fantasia di
carattere poco scientifico. Tuttavia, avuta l’idea di attribuire all’elettrone e, più generalmente, ai
corpuscoli materiali un aspetto ondulatorio, singolari constatazioni si presentavano allo spirito. [..]
Altre constatazioni ci spingevano nel medesimo verso.
Se era vero che l’elettrone nei fenomeni macroscopici si era sempre comportato come un semplice
corpuscolo, non si era dovuto imporgli delle strane condizioni di quantizzazione in cui comparivano dei
numeri interi per esprimere il suo modo di comportarsi nell’interno degli atomi?
Un tale modo di completare, restringendola, l’applicazione della dinamica classica all’elettrone ne
indicava abbastanza bene l’insufficienza e stabiliva nettamente che le proprietà dell’elettrone non erano
sempre quelle di un semplice corpuscolo. Riflettendovi, l’intervento dei numeri interi per caratterizzare
gli stati stazionari degli elettroni atomici appariva sintomatico. Infatti i numeri interi si incontrano in
tutti i rami della fisica in cui si considerano delle onde: in elasticità, in acustica, in ottica. Essi
intervengono nei fenomeni di onde stazionarie, di interferenze e di risonanza. Si poteva dunque pensare
che l’interpretazione delle condizioni di quantizzazione condurrebbe ad introdurre un aspetto
ondulatorio degli elettroni atomici.
Appariva dunque urgente e fecondo attribuire all’elettrone e, più generalmente, a tutti i corpuscoli una
natura dualistica analoga a quella del fotone dotandoli di un duplice aspetto, ondulatorio e corpuscolare,
fondato sul quanto di azione.
Tratto da: L. De Broglie, I quanti e la fisica moderna, Einaudi
Il conferimento del carattere ondulatorio alle particelle microscopiche (in particolare all’elettrone)
venne stabilito da De Broglie semplicemente capovolgendo il significato della relazione (3).
pag. 4
Riscritta nella forma:
λ=
h
h
=
p mv
(4)
quella relazione sembrava indicare la possibilità di associare una lunghezza d’onda λ a una
particella dotata di quantità di moto p, ovvero a una particella di massa m e velocità v.
De Broglie osservava che tutte le particelle possono presentare, potenzialmente, manifestazioni
ondulatorie. Certo è che se le particelle hanno una grande massa ed una elevata velocità, cioè una
grande quantità di moto mv, la lunghezza d’onda ad esse associata sarà molto piccola, così piccola
che non si potranno mettere in evidenza fenomeni quali quelli di interferenza e di diffrazione, tipici
del comportamento ondulatorio.
Tali fenomeni vengono infatti evidenziati solamente se si dispone di reticoli con passi (o di
fenditure con larghezze) confrontabili con la lunghezza d’onda λ; ma sia i reticoli costruiti che
quelli esistenti in natura, come i cristalli, hanno un passo molto più grande della lunghezza d’onda
associata ad una particella di quantità di moto di valore elevato. Un corpo della massa di una mela,
ma anche di un granello di sabbia, virtualmente ha un aspetto ondulatorio, ma esso non potrà mai
essere osservato.
ESEMPIO
Proviamo a valutare la lunghezza d’onda associata ad una mela di massa m=0,2 kg che
venga lanciata ad una velocità di 5m/s. Dalla relazione di De Broglie si ricava che:
λ=
h
6,63 ⋅ 10 −34 Js
=
= 6,63 ⋅ 10 −34 m .
mv 0,2kg ⋅ 5m / s
Con una lunghezza d’onda così piccola come quelle ora calcolata, non è pensabile di realizzare
esperimenti che mettano in evidenza fenomeni ondulatori. Il comportamento della mela potrà essere
descritto completamente dalle leggi della meccanica che governano i corpi materiali. Con un
elettrone, invece, di non eccessiva velocità, data la sua massa molto piccola, la quantità di moto non
sarà grande e quindi la lunghezza d’onda λ ad esso associata secondo la relazione di De Broglie non
sarà tanto piccola. Essa potrebbe allora essere confrontabile con le spaziature fra gli atomi di un
cristallo e si potrebbero così osservare fenomeni ondulatori.
E’ ciò che mostrarono nel 1925 i fisici Davisson e Germer, come si riporterà nei paragrafi
successivi.
pag. 5
Lunghezza d’onda di De Broglie e stabilità degli atomi
L’idea di De Broglie, per quanto apparentemente incredibile, aveva
un’immediata applicazione nell’interpretazione della stabilità delle
orbite elettroniche degli atomi.
Infatti, se l’elettrone ha proprietà ondulatorie, il suo stato dinamico
attorno a un nucleo deve essere concepito non tanto come il moto di
un corpuscolo attorno a un centro attrattore, quanto come la
vibrazione di un’onda stazionaria chiusa su se stessa (figura 1).
figura 1: rappresentazione
ondulatoria dell’elettrone attorno
al protone nell’atomo di idrogeno
Quindi, per tale onda stazionaria, deve valere che la misura della circonferenza dell’orbita di raggio
a deve essere uguale ad un numero intero n di lunghezze d’onda, ovvero deve valere la condizione:
2 π a=n λ
(5)
da cui, tenendo presente la (4) si avrà:
2 π a=n
h
p
p a=n
h
2π
ovvero:
(6)
Si noti che nel primo membro della (6) c’è il modulo del momento della quantità di moto
dell’elettrone; dunque la (6) coincide con la formula che Bohr aveva proposto per la quantizzazione
del momento della quantità di moto dell’elettrone nelle sue orbite stazionarie. Ricordiamo però che,
se si prescinde dal suo indubitabile successo pratico, l’ipotesi quantistica di Bohr appariva
sostanzialmente come un’ipotesi ad hoc, scarsamente giustificabile sulla base di principi più
fondamentali. Ora, invece, la quantizzazione delle orbite perde il suo carattere di arbitrarietà
divenendo conseguenza diretta delle leggi relative alle onde e, più in profondità, conseguenza di una
nuova e più complessa concezione della materia.
Lunghezza d’onda di De Broglie e livelli energetici
Una seconda straordinaria conseguenza della concezione ondulatoria di De Broglie è costituita dalla
possibilità di dedurre da essa l’esistenza di livelli energetici discreti per particelle confinate entro
pag. 6
spazi limitati. Supponiamo, ad esempio, che una particella di massa m e velocità v, che si muove
secondo una direzione orizzontale, sia contenuta in una buca a pareti infinitamente alte e di
larghezza L (figura 2). Da un punto di vista classico, relativamente ai parametri dinamici ed
energetici della particella, si potrà dire che, poiché l’energia cinetica
Ek =
1 2
mv
2
della particella è infinitamente più piccola dell’energia potenziale gravitazionale che essa avrebbe
nei punti esterni della buca (calcolata rispetto al fondo della buca), la particella non potrà mai
uscire da questa, rimanendovi quindi imprigionata.
U =∞
U =∞
figura 2: rappresentazione schematica dell’energia
potenziale U di una particella posta in una buca a pareti
infinitamente alte. Assumendo come livello di
riferimento il fondo della buca, si avrà in quella
posizioni U=0, mentre ai bordi U = ∞ .
L
U=0
Poniamoci ora dal punto di vista dell’ipotesi di De Broglie. La particella ha un carattere ondulatorio
e perciò, trovandosi vincolata in una buca, essa dovrà comportarsi come un’onda stazionaria
caratterizzata da ampiezza nulla in corrispondenza dei confini dello spazio entro cui si produce.
La particella entro la buca deve dunque essere descritta come un’onda stazionaria di lunghezza
d’onda espressa dalla relazione:
λ=
2L
n
(7)
con n = 1, 2, 3,...
In base alla relazione di De Broglie si ha allora:
p=
h
λ
=
hn
2L
e quindi l’energia cinetica E k della particella risulta data da (ricordando che p=mv):
Ek =
1 2 p2
h2 2
mv =
n
=
2
2m 8mL2
Questa relazione mette in evidenza una profonda differenza con i risultati della fisica classica. In
base a essa, infatti, si deduce che l’energia della particella non può essere qualsivoglia, ma risulta
quantizzata, dovendo essere un multiplo della quantità
h2
secondo i valori 1, 4, 9 ecc. (figura 3).
8mL2
pag. 7
energia
n=3
n=2
a
b
n=1
figura 3: Schema dei possibili livelli energetici di una particella in una buca a pareti
infinitamente alte nel caso della meccanica classica (a) e nel caso della meccanica
ondulatoria (b).
Il numero n che compare nell’espressione dell’energia della particella è detto numero quantico.
Nel caso esaminato l’energia della particella è caratterizzata da un solo numero quantico; in casi più
complessi, i valori dell’energia possono dipendere da più di un numero quantico.
Quanto finora detto mette in evidenza che l’ipotesi ondulatoria di De Broglie e le sue immediate
applicazioni mutano profondamente gli attributi della materia ai quali ci aveva abituato la
meccanica classica di Newton.
Termini come massa, quantità di moto, posizione della particella, devono essere affiancati da altre
caratteristiche che, in precedenza, venivano utilizzate solo per la descrizione delle onde.
Verifica sperimentale delle proprietà ondulatorie della materia
Si immagini che un fascio di elettroni venga accelerato da una d.d.p. di 50 V.
Al termine del loro volo essi avranno acquistato una quantità di moto, calcolabile con la relazione
seguente:
E = e ΔV =
1 2 1 p2
.
mv =
2
2 m
Il valore di p sarà quindi dato da:
p = 2m e ΔV = 2 ⋅ 9,1 ⋅ 10 −31 Kg ⋅ 1,6 ⋅ 10 −19 C ⋅ 50V = 3,8 ⋅ 10 − 24 kg
m
.
s
Pertanto, la lunghezza d’onda associata a ciascun elettrone vale:
h
6,626 ⋅ 10 −34 Js
λ= =
= 1,74 ⋅ 10 −10 m
− 24
p 3,8 ⋅ 10 kg m / s
Tale valore è dello stesso ordine di grandezza delle distanze interatomiche di un cristallo.
Si deve perciò concludere che, se l’ipotesi di De Broglie è vera, un fascio di elettroni incidente su
pag. 8
un cristallo dovrà essere riflesso da questo non come un fascio di corpuscoli, ma come una
sequenza di fronti d’onda.
In particolare, il fascio riflesso dovrà manifestare effetti di interferenza costruttiva e distruttiva, in
dipendenza dell’angolo formato dal fascio incidente con i piani reticolari del cristallo.
Questa idea fu per la prima volta verificata sperimentalmente nel 1927 dal fisico americano Clinton
Joseph Davisson con la collaborazione di L. H. Germer . Un fascio di particelle (elettroni) veniva
emesso da un’opportuna sorgente e collimato su un bersaglio costituito da un pezzo di cristallo
(figura 4). Il fascio diffratto veniva, invece, raccolto da un rivelatore posto simmetricamente alla
sorgente. I risultati sperimentali dimostrarono che il fascio diffratto presentava una serie di massimi
di intensità quando fosse verificata la seguente relazione tra la lunghezza d’onda di De Broglie λ
degli elettroni e la separazione d tra i diversi piani reticolari del cristallo:
2dsenα = nλ
dove α è l’angolo formato dal fascio di elettroni e la superficie del cristallo, mentre n è un numero
intero.
sorgente di elettroni
α
rivelatore
del fascio
diffratto
α
Piani
cristallini
cristallo
Atomi del
cristallo
figura 4: schema dell’apparato di Davisson e Germer
per la diffrazione di un fascio di elettroni da parte di
un cristallo
figura 5: condizione di interferenza costruttiva per il
fascio di elettroni (condizione di Bragg)
La spiegazione di questo esperimento risulta semplice se si considera cosa avviene a livello
microscopico quando il fascio di elettroni interagisce col cristallo. La situazione, illustrata nella
figura 5, corrisponde a un fascio di particelle che, riflesse dai diversi piani reticolari, finiscono col
creare un fenomeno di interferenza sul rivelatore. Come noto dall’ottica, quando due fasci luminosi
emessi da due sorgenti coerenti (cioè a differenza di fase costante e stessa lunghezza d’onda)
compiono, per arrivare a un rivelatore, dei cammini ottici che differiscono per un numero intero di
lunghezze d’onda, allora si manifesta il fenomeno di interferenza costruttiva. Sul rivelatore, cioè, si
osservano dei massimi di diffrazione.
Analizzando il cammino ottico percorso dai diversi fasci di elettroni (si veda la figura 5) si deduce
pag. 9
immediatamente che la condizione di massimo fascio diffratto osservata nell’esperimento di
Davisson e Germer corrisponde proprio a quella di interferenza costruttiva nota in ottica
(condizione di Bragg). In altre parole, l’esperimento in questione dimostra che un fascio di
particelle (elettroni) si comporta esattamente come un’onda luminosa, di lunghezza d’onda λ data
dalla relazione di De Broglie. Questo esperimento, quindi, è la migliore dimostrazione pratica che
l’ipotesi ondulatoria espressa anche a proposito di particelle materiali è vera.
E’ possibile osservare in dettaglio l’applicazione che Davisson-Germer e, indipendentemente, il
fisico inglese George Paget Thomson fecero per verificare l’ipotesi di De Broglie. Essi diressero
dei raggi catodici, cioè fasci di elettroni di energia pari a 54eV, su bersagli sottili (Davisson su un
monocristallo di nichel, Thomson sull’oro) ed osservarono frange d’interferenza e fenomeni di
diffrazione. La lunghezza d’onda, ricavata sperimentalmente dalle frange d’interferenza, risultò
quasi esattamente uguale a quella prevista dalla relazione di De Broglie (come mostra
l’applicazione seguente). Per queste ricerche De Broglie (nel 1929), Davisson e Thomson (nel
1937) furono insigniti del premio Nobel.
APPLICAZIONE
Nel tubo catodico del loro esperimento, Davisson e Germer applicarono tra l’anodo e il
catodo una d.d.p. di 54 V. L’energia cinetica acquistata dagli elettroni era:
1 2
mv = 54 eV = 54 ⋅ 1,6 ⋅ 10 −19 J = 8,64 ⋅ 10 −18 J .
2
Ricavando da questa espressione il valore della velocità con cui gli elettroni arrivano
sull’anodo
v=
2 ⋅ 8,64 ⋅ 10 −18
m / s = 4,36 ⋅ 10 6 m / s
− 31
9,1 ⋅ 10 kg
e sostituendo nella relazione di De Broglie, otteniamo il valore di λ:
λ=
h
6,63 ⋅ 10 −34 Js
=
= 1,67 ⋅ 10 −10 m .
mv (9,1 ⋅ 10 −31 kg ) ⋅ (4.36 ⋅ 10 6 m / s )
La lunghezza d’onda misurata da Davisson e Germer fu di 1,65 ⋅ 10 −10 m , molto vicino
quindi al valore qui calcolato secondo la formula di De Broglie.
Una lunghezza d’onda di 1,6 ⋅ 10 −10 m è confrontabile con il passo reticolare del reticolo
cristallino di nichel. Ciò giustifica il comportamento ondulatorio degli elettroni.
Le figure 6 e 7 riproducono verifiche sperimentali della relazione di De Broglie. In figura 6 è
pag. 10
rappresentato il risultato della diffrazione di elettroni da sottili fogli metallici; in figura 7 il risultato
della diffrazione di atomi di elio.
figura 6: nell’ordine, da sinistra verso destra: a) diffrazione di raggi X da polveri cristalline di ZrO2;
b) diffrazione di elettroni dallo stesso materiale; c) diffrazione di raggi X da un monocristallo di oro;
d) diffrazione di elettroni dallo stesso monocristallo
intensità
figura 7: spettro di diffrazione
ottenuto con atomi di elio lanciati su
un cristallo di floruro di litio
20° 15° 10° 5° 0° 5° 10° 15° 20°
Il principio del microscopio elettronico
Il
sensazionale
fenomeno
del
comportamento
ondulatorio
dell’elettrone fu subito sfruttato per realizzare microscopi basati su
fasci di elettroni.
L’ingrandimento e la risoluzione di un microscopio aumentano con
l’aumentare della frequenza e quindi con il diminuire della
lunghezza d’onda della radiazione impiegata per visualizzare
l’oggetto.
Con la luce visibile l’ingrandimento è limitato a poche centinaia di
volte, e la risoluzione (distanza minima fra due oggetti distinguibili) a circa 0,3 ⋅ 10 −6 m . Con i
pag. 11
microscopi elettronici, data la piccola lunghezza d’onda ad essi associata, si possono raggiungere
ingrandimenti fino a 10 5 e risoluzioni molto spinte, fino a 10 −9 m .
Per avere un’idea dei valori delle frequenze e lunghezze d’onda in gioco esaminiamo la seguente
applicazione numerica.
APPLICAZIONE
Valutiamo la lunghezza d’onda λ di un elettrone accelerato, in un microscopio
elettronico, da una differenza di potenziale di ΔV volt.
L’energia cinetica acquistata dall’elettrone è data dalla relazione
1
me v 2 = − q e ΔV
2
dove me e q e rappresentano rispettivamente la massa e la carica negativa dell’elettrone.
Da questa relazione ricaviamo il valore della velocità v dell’elettrone
− 2q e ΔV
me
v=
che sostituiamo poi nella relazione di De Broglie per avere il valore di λ:
λ=
h
=
me v
h
me
− 2qe ΔV
me
=
h
− 2q e me ΔV
.
Se ora in questa espressione sostituiamo a h, me e q e i loro valori numerici, otteniamo:
λ=
6,63 ⋅ 10 −34
2 ⋅ 1,6 ⋅ 10 −19 ⋅ 9,1 ⋅ 10 −31 ΔV
m=
1,23 ⋅ 10 −9
ΔV
m.
Abbiamo così ottenuto la relazione fra la lunghezza d’onda λ associata all’elettrone e la
differenza di potenziale ΔV cui l’elettrone è sottoposto.
Se la d.d.p. è pari a 10 5 volt, come avviene in un microscopio elettronico, si ha
λ = 3,8 ⋅ 10 −12 m . Questo valore va confrontato con la lunghezza d’onda della luce di un
microscopio ottico (ricordiamo che la lunghezza d’onda della luce varia da 4 ⋅ 10 −7 m a
8 ⋅ 10 −7 m ). Con una tale lunghezza d’onda si potrebbe pensare di ottenere risoluzioni di
qualche 10 −12 m . In effetti le aberrazioni delle lenti che nei microscopi elettronici sono di
tipo elettromagnetico e lo stato del campione che deve essere osservato riducono la
risoluzione di almeno un fattore 100.
L’invenzione del microscopio elettronico ha messo a disposizione dei biologi e dei fisici un potente
pag. 12
strumento di indagine della struttura microscopica.
Di recente, nel campo della microscopia, sono stati messi a punto sistemi, come la microscopia
ionica ad emissione di campo, con i quali è possibile localizzare atomi. Ancor più recentemente è
stato sviluppato il microscopio a forza atomica (“Atomic force microscope”) che, attraverso la
scansione di una sonda sensibile ai campi atomici, consente di visualizzare in tre dimensioni la
configurazione degli atomi appartenenti alla superficie di un campione.
figura 8: Osservazioni al microscopio elettronico della punta di un ago (a) e di una sua
piccola porzione (b); la seconda fotografia evidenzia la presenza di batteri sull’ago
Concludendo: onde o corpuscoli?
Sulla base di quanto esposto, viene spontaneo chiedersi che cosa sia in definitiva una particella. E’
onda o corpuscolo?
Il quesito, secondo tale formulazione, è mal posto. La domanda dovrebbe infatti essere formulata in
questi altri termini: “Quali sono le possibili manifestazioni di una particella?”
La risposta potrebbe essere la seguente.
L’aspetto ondulatorio e l’aspetto corpuscolare di una particella materiale sono due
manifestazioni di una medesima realtà, che si evidenziano a seconda delle condizioni che si
realizzano in un dato esperimento nei confronti della lunghezza d’onda della particella.
In altre parole, sommando l’ipotesi di Einstein sui fotoni (dimostrata dall’effetto fotoelettrico) e
quella di De Broglie sulle onde materiali (dimostrata dalla diffrazione di elettroni) possiamo
enunciare compiutamente il concetto di dualismo onda-corpuscolo: ogni fenomeno naturale si
pag. 13
manifesta, a seconda dei casi, o in modo ondulatorio, o in modo corpuscolare. Nel mondo
macroscopico (quello legato alla nostra esperienza quotidiana) le particelle massive sono ben
descritte da corpuscoli che seguono la meccanica classica, mentre i fenomeni di propagazione del
campo elettromagnetico sono efficacemente descritti dalle leggi dell’ottica (geometrica o fisica). Al
contrario, spesso il mondo microscopico (che sfugge alla nostra diretta esperienza sensoriale) si
manifesta in modo opposto: la radiazione elettromagnetica è efficacemente descritta come fascio di
corpuscoli o fotoni, mentre le particelle obbediscono alle leggi tipiche delle onde (come, ad
esempio, la diffrazione).
pag. 14