TAVOLA PERIODICA
I circa 100 tipi di atomi o elementi sono stati ordinati in una tabella in ordine di numero
atomico crescente, dal più leggero, l'Idrogeno, al più pesante, l'Uranio (il peso atomico dipende
essenzialmente dal numero totale dei protoni e dei neutroni (nucleoni) che si trovano nel
nucleo e quindi dal numero atomico).
La tabella é stata impostata verso la metà dell'Ottocento (1869) dal chimico russo Mendeleev il
quale si accorse che, passando da elementi più leggeri ad elementi a più elevato peso atomico,
le caratteristiche chimiche già incontrate in precedenza si ripresentavano periodicamente negli
elementi più pesanti. Mendeleev sistemò allora gli elementi in una tabella in modo tale che gli
elementi che presentavano proprietà simili si incolonnassero.
Spostandosi lungo una linea orizzontale (periodo) il numero atomico cresce di una unità per
volta e le proprietà chimiche variano con continuità.
Scendendo lungo una colonna (gruppo) il numero atomico cresce di parecchie unità per volta,
ma le proprietà chimiche rimangono praticamente costanti.
La somiglianza chimica tra elementi appartenenti ad un medesimo gruppo é dovuta al tipo di
distribuzione degli elettroni attorno al nucleo. Gli elettroni orbitano infatti intorno al nucleo
secondo schemi particolari, scoperti solamente nella prima metà del Novecento.
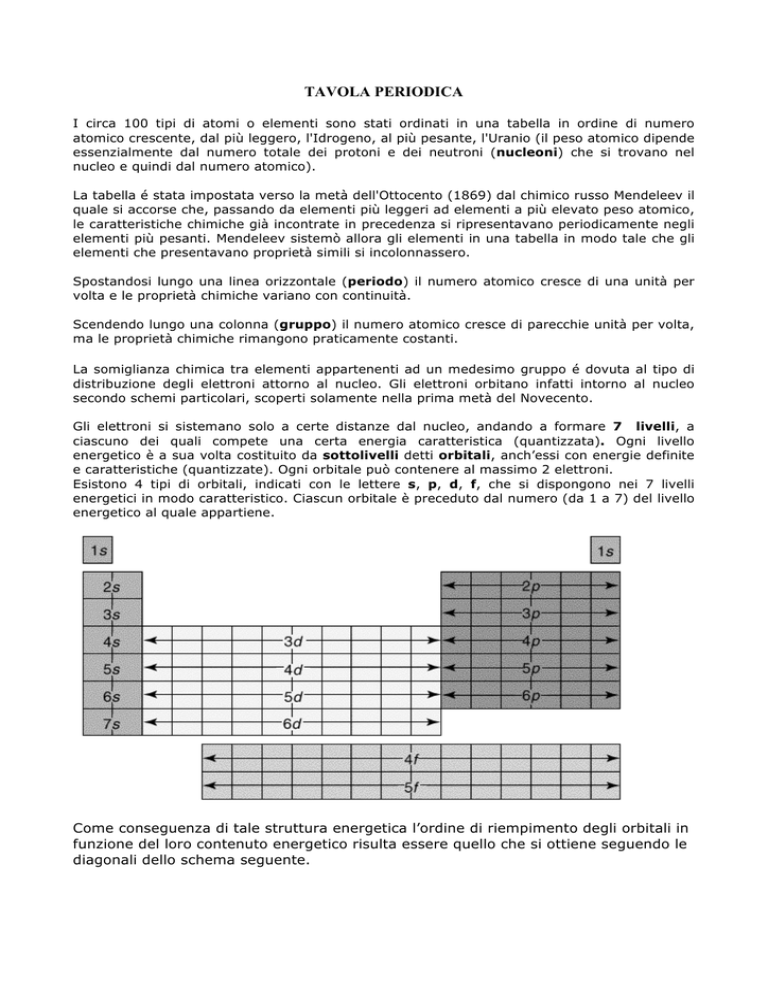
Gli elettroni si sistemano solo a certe distanze dal nucleo, andando a formare 7 livelli, a
ciascuno dei quali compete una certa energia caratteristica (quantizzata). Ogni livello
energetico è a sua volta costituito da sottolivelli detti orbitali, anch’essi con energie definite
e caratteristiche (quantizzate). Ogni orbitale può contenere al massimo 2 elettroni.
Esistono 4 tipi di orbitali, indicati con le lettere s, p, d, f, che si dispongono nei 7 livelli
energetici in modo caratteristico. Ciascun orbitale è preceduto dal numero (da 1 a 7) del livello
energetico al quale appartiene.
Come conseguenza di tale struttura energetica l’ordine di riempimento degli orbitali in
funzione del loro contenuto energetico risulta essere quello che si ottiene seguendo le
diagonali dello schema seguente.
E dunque
1s → 2s → 2p → 3s → 3p → 4s → 3d → 4p → 5s → 4d → 5p → 6s → 4f → 5d → 6p →
7s → 5f → 6d
Gli atomi utilizzano prevalentemente gli elettroni del loro livello energetico più esterno
(elettroni di valenza) per interagire e legarsi tra loro. Il comportamento chimico di un atomo
dipende dunque dal numero e dalla disposizione degli elettroni dell’ultimo livello energetico.
Gli elementi che possiedono 8 elettroni di valenza (GAS NOBILI) risultano particolarmente
stabili, inerti, nel senso che manifestano pochissima tendenza a reagire con altri elementi
chimici.
Gli altri elementi che possiedono configurazioni elettroniche simili a quella dei gas nobili
tendono a perdere (metalli) o ad acquistare elettroni (non metalli) per raggiungere tale
configurazione particolarmente stabile. Molte reazioni chimiche possono essere spiegate
proprio in virtù della tendenza di molti elementi ad acquisire la configurazione ad 8 elettroni
esterni dei gas nobili (regola dell'ottetto).
Nella maggior parte dei casi gli elettroni coinvolti nelle reazioni chimiche sono i 2 + 6 = 8
elettroni contenuti nell’orbitale s e nei tre orbitali p del livello energetico più esterno. Per
questo motivo tali elettroni vengono convenzionalmente rappresentati utilizzando un metodo
introdotto da Lewis.
Secondo tale metodo i 2 + 6 elettroni degli orbitali s e p del livello più esterno (elettroni di
valenza) vengono rappresentati come punti o coppie di punti disposte ai quattro lati del
simbolo chimico dell'elemento. Idealmente, ogni lato del simbolo chimico è associato ad un
orbitale.
Elemento
Litio
Berillio
Boro
Carbonio
Azoto
Configurazione
superficiale
2s1
2s2
2s22p1
2s22p2
2s22p3
Ossigeno
2s22p4
Fluoro
2s22p5
Neon
2s22p6
Configurazione
di Lewis
Come si vede, le coppie di elettroni vengono anche rappresentate con una barretta.
E’ evidente che tutti gli elementi che appartengono ad un medesimo gruppo chimico,
possedendo la medesima configurazione elettronica superficiale, presentano la stessa
struttura di Lewis
Si definisce elettronegatività la forza con cui un atomo attira a sé gli elettroni condivisi. I
valori di elettronegatività (Pauling) si trovano tabulati nella tabella periodica e presentano il
valore minimo in basso a sinistra (Francio = 0.7) e crescono diagonalmente fino ad assumere il
valore massimo in alto a destra (Fluoro = 4).
Elettronegatività (Pauling)
H
2.20
He
Li
Be
0.98 1.57
B
C
N
O
F
Ne
2.04 2.55 3.04 3.44 3.98
Na Mg
0.93 1.31
Al
Si
P
S
Cl
1.61 1.90 2.19 2.58 3.16
K
0.82
Ca
1.0
Ar
Sc
Ti
V
Cr
Mn
Fe
Co
Ni
Cu Zn Ga Ge As
Se
Br
Kr
1.36 1.54 1.63 1.66 1.55 1.83 1.88 1.91 1.90 1.65 1.81 2.01 2.18 2.55 2.96 2.9
Rb
Sr
Y
Zr
Nb Mo
0.82 0.95 1.22 1.33 1.6 2.16
Tc
1.9
Ru Rh Pd Ag Cd
In
Sn Sb
Te
I
Xe
2.2 2.28 2.20 1.93 1.69 1.78 1.80 2.05 2.1 2.66 2.6
Cs
Ba
La
0.79 0.89 1.10
Fr
0.7
Ra
0.9
Ac
Hf
1.3
Ta
W
1.5 2.36
Re
1.9
Os
Ir
Pt
Au Hg
Tl
Pb
Bi
Po
2.2 2.20 2.28 2.54 2.00 1.62 1.87 2.02 2.0
Rf
Db
Bh
Hs
Sg
Mt
Ds
Rg
Pa
U
Np Pu Am Cm Bk Cf
1.5 1.38 1.36 1.28 1.3 1.3 1.3 1.3
Rn
Uub Uut Uuq Uup Uuh Uus Uuo
Ce
Pr Nd Pm Sm Eu Gd Tb Dy Ho
Er Tm Yb Lu
1.12 1.13 1.14 1.14 1.17 1.2 1.29 1.2 1.22 1.23 1.24 1.25 1.1 1.27
Th
1.1
At
2.2
Es
1.3
Fm
1.3
Md
1.3
No
1.3
Lr












