3.3 - GLI STATI FISICI DELLA MATERIA
In natura, i materiali si presentano in diversi stati fisici, detti anche stati
di aggregazione; essi riflettono il grado di interazione fra le particelle
costituenti.
Gli stati di aggregazione della materia sono tre: solido, liquido e
aeriforme. Oggi si considera anche un quarto stato della materia, il
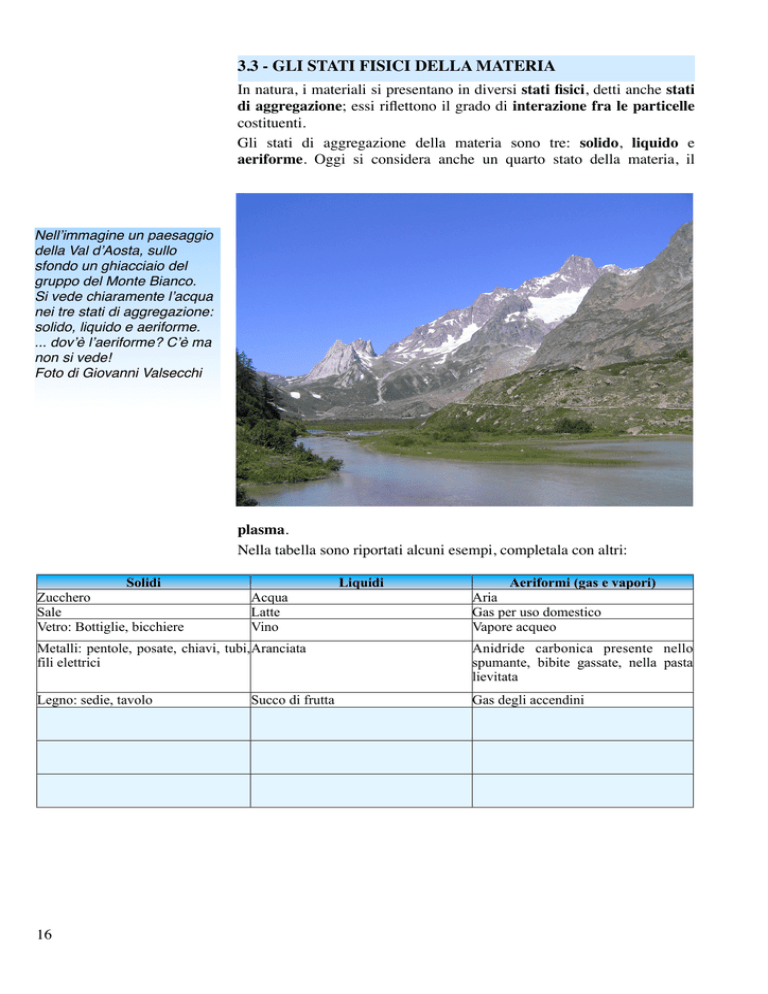
Nell’immagine un paesaggio
della Val d’Aosta, sullo
sfondo un ghiacciaio del
gruppo del Monte Bianco.
Si vede chiaramente l’acqua
nei tre stati di aggregazione:
solido, liquido e aeriforme.
... dov’è l’aeriforme? C’è ma
non si vede!
Foto di Giovanni Valsecchi
plasma.
Nella tabella sono riportati alcuni esempi, completala con altri:
Solidi
Zucchero
Sale
Vetro: Bottiglie, bicchiere
Liquidi
Acqua
Latte
Vino
Aeriformi (gas e vapori)
Aria
Gas per uso domestico
Vapore acqueo
Metalli: pentole, posate, chiavi, tubi, Aranciata
fili elettrici
Anidride carbonica presente nello
spumante, bibite gassate, nella pasta
lievitata
Legno: sedie, tavolo
Gas degli accendini
16
Succo di frutta
3.3.1 - Fattori che influiscono sugli stati della materia
Se ci guardiamo intorno e facciamo riferimento alla nostra esperienza
quotidiana abbiamo a che fare con corpi che possono essere solidi, liquidi
o gassosi: è un gas l’aria che respiriamo, sono liquide l’acqua e tutte le
bevande che beviamo, sono solidi sostanze come lo zucchero, il sale e
molti oggetti di cui ci serviamo.
Vari fattori influiscono sullo stato fisico dei materiali.
È abbastanza intuitivo che lo stato fisico dei materiali dipende, almeno in
parte, dalla loro composizione chimica. Sulla superficie terrestre, ad
esempio il ferro è solido, l’alcol è liquido, l’ossigeno aeriforme.
Sappiamo anche che lo stato fisico dipende in parte dalla temperatura.
Al livello del mare, lo stato fisico dell’acqua varia a seconda della
temperatura: al di sotto di 0°C è solida, tra 0°C e 100°C è liquida o
aeriforme, sopra a 100°C è solo aeriforme.
Quello che è meno ovvio e meno conosciuto è che lo stato fisico dipende
anche dalla pressione. A temperatura ambiente, il gas degli accendini e
delle bombole (una miscela di propano e butano) è liquido quando è
conservato in un recipiente sotto pressione, mentre è aeriforme alla
pressione atmosferica.
3.3.2 - Materiali solidi
Nei materiali allo stato solido, le
particelle sono disposte in modo regolare,
ordinato, sono legate saldamente le une
alle altre e non hanno una grande libertà di
movimento: possono soltanto vibrare
mantenendo le loro reciproche posizioni.
Gli spazi tra le particelle sono molto
piccoli.
!
Un corpo solido ha forma e volume
propri: ciò significa che se lo metto in
recipienti diversi mantiene la sua forma originaria e non si adatta a quella
del recipiente che lo contiene.
3.3.3 - Materiali liquidi
Nei materiali allo stato liquido, le particelle sono
disposte in modo disordinato, sono legate tra loro in
modo meno forte rispetto ai corpi solidi e quindi
hanno una certa libertà di movimento; tale movimento
è piuttosto caotico. Come per i solidi, gli spazi tra le
particelle sono molto piccoli.
Un materiale liquido ha volume proprio, ma la sua
forma dipende dal recipiente che lo contiene: un litro
!
d’acqua è sempre un litro sia che io lo versi in una vasca da bagno sia che
lo metta in una bottiglia, ma la sua forma varia a seconda del contenitore.
Lo stato solido e lo stato liquido si definiscono anche stati condensati
della materia, poiché in entrambi i casi le particelle sono a contatto le une
con le altre. Per questo motivo, i materiali solidi e liquidi sono
praticamente incomprimibili.
17
3.3.4 - Materiali aeriformi
Nei materiali allo stato aeriforme, le particelle sono completamente
slegate e lontane tra di loro; esse sono in rapido movimento e si muovono
in modo disordinato.
Proprio perché le particelle possono muoversi
in completa libertà, i materiali aeriformi non
hanno un loro volume né una loro forma, ma
occupano tutto il volume disponibile,
assumendo la forma del recipiente.
I
materiali
aeriformi
sono,
inoltre,
comprimibili: se si esercita una pressione su di !
essi, il loro volume si riduce. Per verificarlo,
possiamo riempire d’aria una siringa, tirando indietro lo stantuffo. Poi
togliamo l’ago, mettiamo il pollice sul foro d’entrata e premiamo sullo
stantuffo: il gas contenuto nella siringa riduce notevolmente il suo
volume.
!
3.3.5 - Il plasma
Il plasma è considerato il quarto della materia. Sul nostro pianeta non è
comune poiché si genera solo in condizioni di temperature elevatissime.
In queste condizioni, i materiali passano allo stato aeriforme e gli atomi
perdono i loro elettroni. Lo stato di plasma consiste quindi in una sorta di
gas di atomi ionizzati, circondati e immersi in un “mare” di elettroni;
questo stato di aggregazione è tipico dei materiali che formano le stelle)
18
3.4 - I PASSAGGI DI STATO
E’ stato precedentemente detto che la materia è tutto ciò che occupa
spazio, possiede massa ed energia e che può anche non essere percepita
dai nostri sensi.
Essa può trasformarsi in modo naturale (le nubi derivano dalla
trasformazione naturale dell’acqua presente sul nostro pianeta che
subisce cambiamenti di temperatura per effetto dell’alternarsi del caldo e
del freddo), oppure in modo indotto (una tazzina di latte diventa dolce se,
al mattino, tu aggiungi alla stessa dello zucchero). Le stesse
trasformazioni, naturali o indotte potranno a loro volta differenziarsi in
trasformazioni fisiche e trasformazioni chimiche.
I passaggi di stato sono quelle trasformazioni nel corso delle quali la
materia cambia il suo stato di aggregazione. Si tratta di trasformazioni
fisiche poiché non varia la composizione chimica dei materiali interessati
dal processo.
DA A
TRASFORMAZIONE
SOLIDO
LIQUIDO
FUSIONE
LIQUIDO
AERIFORME
VAPORIZZAZIONE
AERIFORME LIQUIDO
CONDENSAZIONE
LIQUIDO SOLIDO SOLIDIFICAZIONE
AERIFORME
SOLIDO
BRINAMENTO
SOLIDO
AERIFORME
SUBLIMAZIONE
Ogni sostanza chimica fonde e bolle a una temperatura costante e
caratteristica, definita punto di fusione e punto di ebollizione.
In generale, fornendo ad un materiale energia sotto forma di calore si
favorisce il passaggio da uno stato di aggregazione in cui le particelle
sono associate in modo compatto e ordinato (stato solido) o solamente
19
compatto ma poco ordinato (stato liquido) a uno stato in cui esse sono si
muovono in maniera autonoma e indipendente (stato aeriforme).
Il contrario avviene se il materiale considerato cede calore all’ambiente
circostante.
Analizziamo ora i diversi passaggi di stato. L’analisi verrà condotta
considerando le coppie di opposti passaggi di stato.
3.4.1 - Fusione e solidificazione
La fusione è il passaggio di un materiale dallo stato solido allo stato
liquido. Affinché un materiale fonda, occorre che dall’ambiente gli sia
fornito calore, pertanto il passaggio è definito endoenergetico.
La solidificazione è il passaggio di un materiale dallo stato liquido allo
stato solido. Contrariamente al senso comune, la solidificazione, essendo
l’opposto della fusione, è un processo esoenergetico; questo significa
che, anche se sembra impossibile, un materiale mentre solidifica libera
calore nell’ambiente circostante.
A pressione costante, fusione e solidificazione hanno in comune la
temperatura caratteristica cui avvengono: si tratta del cosiddetto punto di
fusione.
Il punto di fusione è la temperatura alla quale una data sostanza solida,
se riscaldata, inizia a fondere e coincide con la temperatura alla quale la
stessa sostanza allo stato liquido inizia a solidificare quando viene
raffreddata. Per esempio, se si scalda un cubetto di ghiaccio, esso inizia a
fondere a 0°C. Allo stesso modo se si raffredda una porzione di acqua
liquida, essa inizia a solidificare a 0°C.
Se la pressione varia,
cambia il valore del
punto di fusione. I
pattinatori scivolano
sul ghiaccio perché la
fortissima
pressione
esercitata dalla lama
sul ghiaccio fa sì che il
punto di fusione della
coppia ghiaccio/acqua
si
abbassi
e
di
conseguenza
il
ghiaccio
fonde
formando una pellicola
Giocatore di Hockey.
di acqua sulla quale si scivola.
Foto di Giovanni Valsecchi
3.4.2 - Vaporizzazione e condensazione
La vaporizzazione è il passaggio di un materiale dallo stato liquido allo
stato aeriforme. Affinché un materiale vaporizzi, occorre che
dall’ambiente gli sia fornito calore, pertanto anche questo passaggio,
come la fusione, è endoenergetico.
La vaporizzazione può avvenire secondo due diverse modalità, dette
evaporazione ed ebollizione.
20
L’evaporazione è un processo superficiale: consiste nel progressivo
distacco di particelle dalla superficie del materiale liquido e avviene in
tutto l’intervallo di temperatura compreso tra il punto di fusione e il
punto di ebollizione. Al livello del mare, l’evaporazione dell’acqua può
avvenire a qualsiasi temperatura compresa tra 0°C e 100°C: come è noto
è molto lenta a valori prossimi a 0°C e molto rapida a valori prossimi a
100°C.
L’ebollizione è la trasformazione
tumultuosa di un materiale dallo stato
liquido allo stato aeriforme. Tale
Approfondimento
trasformazione avviene in tutta la massa
In laboratorio potrai
del liquido e si verifica in corrispondenza
verificare
che
la
di un preciso valore di temperatura, detto
temperatura alla quale
punto di ebollizione; per l’acqua tale
avvengono i passaggi di
temperatura è pari a 100°C.
stato rimane costante fin
Il punto di ebollizione è fortemente
quando tutta la sostanza
dipendente dalla pressione ambientale
non ha cambiato stato di
alla quale si fa avvenire il processo:
aggregazione
minore è la pressione, più bassa è la
temperatura di ebollizione di una data
sostanza. Ad esempio, l’acqua in montagna bolle a temperatura inferiore
a 100°C, poiché la pressione atmosferica è minore rispetto a quella
presente al livello del mare. Un curioso fenomeno fisico - gastronomico
dovuto alla pressione è per esempio quello che riguarda le uova: in cima
al Monte Bianco non si possono fare le uova sode. Infatti per ottenerle
occorre una temperatura di 100 °C e invece l'acqua lassù bolle a circa 80
°C, temperatura non sufficiente a produrre la trasformazione chimica che
noi chiamiamo "fare le uova sode".
La condensazione è il passaggio di un materiale dallo stato aeriforme
allo stato liquido. La condensazione è il passaggio opposto della
vaporizzazione, pertanto si tratta di un processo esoenergetico. Anche in
questo caso il comune modo di pensare è contrario alla realtà.
Al livello del mare, la condensazione può avvenire in tutto l’intervallo di
temperatura compreso tra 0°C e 100°C.
3.4.3 - Sublimazione e brinamento
La sublimazione è il passaggio di un materiale dallo stato solido allo
stato aeriforme. A livello industriale è importantissimo. La
liofilizzazione consiste infatti in un metodo che prevede prima il
congelamento dell’alimento e successivamente la sublimazione
dell’acqua solida in esso contenuta, lavorando sotto vuoto, cioè a
pressioni estremamente basse. Altro esempio di sublimazione è la
trasformazione delle palline di naftalina (allo stato solido) che vengono
poste nei vestiti per prevenire le tarme; esse subiscono con il calore della
stanza la trasformazione diretta in vapore senza passare dallo stato
liquido.
Affinché un materiale vaporizzi, occorre che dall’ambiente gli sia fornito
calore, pertanto anche questo passaggio, come la fusione e la
vaporizzazione, è endoenergetico.
21
Il brinamento è il passaggio di un materiale dallo stato aeriforme allo
stato solido, senza passare per lo stato liquido. Come la solidificazione e
la condensazione, anche il brinamento è un processo esoenergetico, in
quanto un materiale, mentre brina, cede calore all’ambiente.
Il brinamento è di quel fenomeno che si osserva d'inverno quando l'acqua
aeriforme contenuta nell'aria a contatto con superfici che hanno una
temperatura inferiore a 0° si trasforma in ghiaccio (brina).
3.4.4 - Calore e temperatura
Il calore è una forma di energia.
L’energia è stata definita come la capacità di compiere un lavoro, cioè di
indurre un movimento: il calore induce il movimento delle particelle
dei materiali che lo assorbono.
Il calore si propaga nel vuoto e nei materiali ad esso trasparenti in forma
di radiazione infrarossa; all’interno di materiali non trasparenti, il calore
si propaga spontaneamente da materiali a temperatura maggiore, cioè più
caldi, verso materiali a temperatura minore, cioè più freddi.
Effetti del calore.
Quando materiali solidi e liquidi assorbono calore, a livello
microscopico aumenta la vibrazione delle particelle costituenti: questo
comporta un leggero aumento della distanza tra di esse. Di conseguenza,
a livello macroscopico aumenta il volume dei solidi e dei liquidi: questo
fenomeno prende il nome di dilatazione termica.
Quando materiali aeriformi assorbono calore, a livello microscopico
aumenta la velocità delle particelle.
Se il materiale aeriforme non è confinato in un ambiente chiuso - è il
caso di una massa d’aria riscaldata dal Sole - esso si espande - cioè
aumenta di volume - poiché aumenta la distanza media tra le sue
particelle. Occorre notare che per i materiali aeriformi, la dilatazione
termica è molto maggiore che per solidi e liquidi. Se il materiale
aeriforme è confinato in un ambiente chiuso - è il caso del gas presente
in una bombola - le particelle non possono allontanarsi l’una dall’altra:
l’aumento della loro velocità si traduce in un aumento della pressione che
il materiale aeriforme esercita sulle pareti del recipiente.
La temperatura è una misura dello stato termico di un materiale, cioè
dell’energia cinetica media delle particelle che lo costituiscono.
Le variazioni di temperatura sono gli effetti di un trasferimento di
calore tra un materiale e l’ambiente circostante o di una generazione di
calore all’interno di un materiale: quando un materiale assorbe calore
dall’ambiente o quando al suo interno si genera calore, l’effetto è un
aumento della sua temperatura, mentre si ha riduzione della temperatura
quando un materiale cede calore all’ambiente circostante.
3.4.5 - Calore, temperatura e passaggi di stato
Cosa succede se faccio avvenire dei passaggi di stato tenendo controllata
la temperatura del materiale che sto utilizzando? Supponiamo di prendere
dal congelatore dei cubetti di ghiaccio. Infilo tra di essi un termometro e,
dopo aver messo il recipiente sul fornello, registriamo la temperatura a
intervalli di tempo regolari: per esempio ogni due minuti.
22
Ecco di seguito la tabella che raggruppa ordinatamente i dati raccolti:
tempo in
minuti
temperatura
°C
4m
0 °C
6m
0 °C
8m
0 °C
10m
5 °C
12m
20 °C
14m
40 °C
16m
60 °C
18m
80 °C
20m
100 °C
22m
100 °C
24m
100 °C
26m
100 °C
!
Ora proviamo a costruire un grafico: in ascissa scriviamo i tempi in cui
abbiamo effettuato la misurazione e in ordinata scriviamo i valori della
temperatura registrati, espressi in gradi centigradi.
Se vogliamo LEGGERE il grafico diremo che:
✓ la linea rossa rappresenta l’andamento della temperatura al
passare del tempo,
✓ la linea rossa non è una linea retta, ma una linea spezzata,
✓ lungo questa linea spezzata si vedono due “pianerottoli”: essi ci
dicono che la temperatura durante quegli intervalli di tempo non
è aumentata anche se si continua a riscaldare,
Se vogliamo SPIEGARE il grafico diremo che:
✓ i due “pianerottoli” rappresentano due periodi di tempo detti soste
termiche,
✓ durante le soste termiche accade che il calore fornito non va ad
aumentare la velocità con cui si muovono le particelle (aumento
della temperatura), ma va a rompere i legami che le tengono unite,
aumentando la loro libertà di movimento (passaggio di stato).
Il calore che viene fornito a un dato materiale
durante un passaggio di stato indebolisce i legami
tra le sue particelle e si chiama calore latente.
La perdita di calore da parte di un materiale nell’ambiente
circostante durante un passaggio di stato è determinata
dalla formazione di legami tra particelle;
anch’esso è definito calore latente.
23












