ATOMI E MOLECOLE
Psicobiologia – Lezione nr. 1
Prof. Lasaponara
• La struttura dell’atomo
• I legami chimici e le molecole
• I componenti elementari della materia vivente
20 miliardi di anni fa
Caratteristiche dell’atomo
Atomo
Nucleo
L’atomo può essere di diversi tipi
a seconda della particella
costituente.
Una delle principali caratteristiche che
contraddistingue i diversi tipi di atomi è
il numero atomico.
Questo valore indicato di norma
con la lettera Z, specifica il numero
di protoni presente nel nucleo.
Tuttavia gli atomi sono di norma neutri
dal punto di vista elettrico, pertanto il
numero atomico indica anche il
numero degli elettroni.
Idrogeno (H)
Z= 1; A= 1
Carbonio (C)
Z= 6; A= 12
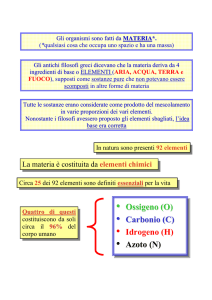
I vari tipi di atomi, caratterizzati
ciascuno da un diverso numero
atomico sono detti elementi.
Ogni elemento è contraddistinto da un
simbolo di una o due lettere, e possono
avere un numero atomico che va da 0
a 92, con un massimo di 146 neutroni.
Oltre che dal numero atomico, gli
atomi sono caratterizzati anche dal
numero di massa, cioè il numero totale
dei suoi protoni e neutroni (nucleo),
indicato dalla lettera A.
Atomi che appartengono allo stesso elemento ma con un diverso numero di
neutroni (i.e. uguale valore di Z e diverso valore di A) sono detti isotopi.
A causa dell’esistenza dei vari isotopi di norma il numero di massa è un
parametro variabile. Si preferisce utilizzare quindi un parametro detto peso
atomico, il quale corrisponde alla media ponderale delle masse dei diversi
isotopi.
L’unità di misura del peso atomico è il dalton, definito come 1/12 della massa
dell’isotopo 12C (i.e. il peso di 1 protone o di un neutrone).
Alcuni isotopi di vari elementi, sono per
loro natura, instabili e tendono a
modificare la loro configurazione
«decadendo» in atomi più stabili.
Tale processo avviene di norma
attraverso la perdita di una particella
del nucleo. L’energia emessa durante
questa trasformazione viene detta
radiazione.
Gli isotopi che presentano tale
proprietà vengono quindi definiti
radioattivi o radioisotopi.
PET: Sfrutta radio-isotopi dall’emivita brevissima
come: Carbonio11, Azoto13 e Ossigeno15. Porta
all’analisi quantitativa del flusso sanguigno.
Le proprietà chimiche di un atomo
derivano dal numero e dalla
distribuzione dei suoi elettroni nello
spazio attorno al nucleo.
Questi si distribuiscono in vari livelli
energetici. Gli elettroni con meno
energia sono più vicini al nucleo, quelli
con più energia sono più distanti.
Il primo livello viene chiamato K
Il secondo livello viene chiamato L
Un dato livello energetico può essere
occupato da uno o più elettroni solo se
i livelli energetici precedenti sono pieni.
All’interno di ciascun livello energetico
gli elettroni si muovono intorno al
nucleo, venendosi a trovare con
maggiore probabilità in regioni di
forma definita e statisticamente
predicibili dello spazio perinucleare
dette orbitali.
Ogni orbitale accoglie due elettroni.
Ogni livello energetico accoglie un
numero sempre maggiore di orbitali.
K può avere un solo orbitale di forma
circolare, indicato dalla lettera s
L può avere sino a 4 orbitali di forma
definita a manubrio fra loro ortogonali,
indicati dalla lettera p
All’interno di ciascun livello energetico gli elettroni si muovono non solo intorno
al nucleo ma anche sul loro stesso asse. Questo tipo di movimento è definito
spin.
All’interno di ogni orbitale, i due elettroni che vi si trovano, hanno spin opposto
In conclusione il valore Z dell’atomo determina la capacità dell’atomo stesso di
interagire con altri atomi e quindi le sue proprietà chimiche.
Gas Nobili - inerti
Alogeni – manca un solo elettrone per completare il livello energetico più
esterno
Metalli alcalini – hanno un solo elettrone nel loro livello energetico più esterno
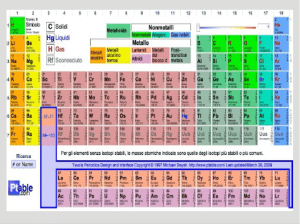
N. Di elettroni posseduti dagli atomi all’interno di ogni livello
Tavola di Mendelev
Livelli elettronici principali
Carbonio (C)
Z= 6; A= 12
A qualsiasi livello di organizzazione la materia tende a raggiungere condizioni di
massima stabilità energetica.
Ne consegue che tutti gli atomi tendono a formare delle associazioni interatomiche, eccetto i Gas Nobili.
La natura di tali associazioni dipende dal tipo di legame chimico che le
stabilisce.
Atomi legati fra loro da uno stabile legame chiamato COVALENTE formano una
MOLECOLA
Caratteristiche delle molecole
La somma dei pesi atomici degli atomi che compongono una molecola è definito peso molecolare
Es. H2O = PM 18 Dalton (1 x 2 H, 16 O)
La quantità in grammi corrispondente al valore di dalton del suo peso molecolare è definita mole
Es. H2O = 18 dalton 18 g
Una mole di una sostanza comprende sempre lo stesso numero di molecole, pari al numero di Avogadro =
6,02296 x 1023 molecole
La concentrazione di una data sostanza chimica in una soluzione si esprime col termine molarità ed è
definita come il numero delle moli presenti in un litro di soluzione.
Es. PM glucosio = 180 dalton mole di glucosio = 180 g
QUINDI
una soluzione 0,1 M di glucosio in acqua, contiene 0,1 moli (corrispondente a 18 g) di glucosio in ogni litro
della soluzione acquosa finale.
I legami che formano le molecole
• Legame covalente
• Legame ionico
• Legami deboli
• Forze di Van der Waals
• Legame idrogeno
I legami che formano le molecole
•
Legame covalente
•
Legame ionico
•
Legami deboli
•
Forze di Van der Waals
•
Legame idrogeno
Atomi elettronegativi
Atomi a cui mancano
pochi elettroni per saturare
il livello energetico più
esterno
Atomi elettropositivi
Atomi che avendo pochi
elettroni nel livello
energetico più esterno,
tendono a cederli
Idrofoba
Idrofila
Tabella 1.2
Tabella 1.3
Figura 1.4
Figura 1.5
Libro basi
biologiche
Tabella 1.4
Libro basi
biologiche
Legame covalente non polare
Legame covalente polare
I legami che formano le molecole
Catione
•
Legame covalente
•
Legame ionico
•
Legami deboli
•
Forze di Van der Waals
•
Legame idrogeno
Anione
Legame ionico
I legami che formano le molecole
• Forza dipolo indotto istantaneo-dipolo indotto
istantaneo (o forza di dispersione di London)
Le forze di dispersione di London, sono forze
intermolecolari deboli che si formano a causa delle
forze tra dipoli temporanei in molecole che non
presentano momento dipolare permanente.
Per esempio, nelle molecole non polari come gli
alogeni, gli elettroni che si muovono intorno alle
molecole si distribuiscono in modo non equilibrato
istante per istante: nel momento in cui gli elettroni
non sono disposti equamente si forma un dipolo
temporale che interagisce con altri dipoli vicini e
induce le altre molecole nelle quali, a loro volta, si
formano dipoli indotti. Nel vuoto le forze di London
sono le forze intermolecolari più deboli, tuttavia
restano le principali forze attrattive di molecole non
polari, come per esempio il metano, e dei gas nobili:
senza di esse, infatti, i gas nobili non potrebbero
presentarsi in stato liquido.
•
Legame covalente
•
Legame ionico
•
Legami deboli
•
Forze di Van der Waals
•
Legame idrogeno
I legami che formano le molecole
• Forza dipolo permanente-dipolo indotto (o forza di
Debye)
Le forze di Debye sono forze intermolecolari, risultato
dell'interazione tra un dipolo permanente e un
dipolo indotto (quest'ultimo noto anche come
polarizzazione).
Questo tipo di forza si trova tra una molecola polare
e una apolare. La prima induce sulla seconda una
separazione di carica (dipolo indotto); i due dipoli,
permanente e indotto, si attraggono. L'interazione
dipende dalla polarizzabilità, cioè la facilità con cui
la nuvola elettronica di una molecola apolare (o un
atomo) può essere deformata, la quale aumenta
con le dimensioni atomiche/molecolari.
•
Legame covalente
•
Legame ionico
•
Legami deboli
•
Forze di Van der Waals
•
Legame idrogeno
I legami che formano le molecole
•
forza dipolo permanente-dipolo permanente (o forza di
Keesom)
Le forze di Keesom (anche dette interazioni dipolo-dipolo)
sono forze attrattive che si hanno quando dipoli
permanenti (molecole polari) si allineano tra loro con il polo
positivo di una molecola diretto verso quello negativo di
un'altra molecola vicina.
Il legame a idrogeno è considerato l'estremo di questo
genere di interazioni. L'energia media delle forze dipolodipolo è circa 4 KJ/mole, molto debole se comparata a
quella di un legame covalente (circa 400 KJ/mole).
Bisogna fornire energia per distruggere tale tipo di
interazione. Questo è (in parte) il motivo per cui bisogna
riscaldare (cioè fornire energia) un solido polare per farlo
fondere o un liquido per provocarne l'ebollizione. Le
interazioni dipolo-dipolo sono comunque più deboli delle
forze tra gli ioni e declinano rapidamente con la distanza.
•
Legame covalente
•
Legame ionico
•
Legami deboli
•
Forze di Van der Waals
•
Legame idrogeno
I legami che formano le molecole
http://news.nationalgeographic.com/news/2002/08/
0828_020828_gecko_2.html
•
Legame covalente
•
Legame ionico
•
Legami deboli
•
Forze di Van der Waals
•
Legame idrogeno
Forze di Van der Waals
I legami che formano le molecole
•
Legame covalente
•
Legame ionico
•
Legami deboli
•
Forze di Van der Waals
•
Legame idrogeno
La lunghezza del legame idrogeno è circa
il doppio di quella di un legame covalente
Ne consegue che la sua energia è circa
10-20 volte inferiore. Ma comunque molto
più elevata di quelle delle forze di Van der
Waals
Legame idrogeno