ISTITUTO ZOOPROFILATTICO SPERIMENTALE DELLA
LOMBARDIA E DELL’EMILIA ROMAGNA “BRUNO UBERTINI”
CENTRO EMILIANO ROMAGNOLO DI EPIDEMIOLOGIA VETERINARIA
Lettera di informazione n. 60 - giugno 2005
IN QUESTO NUMERO:
Genotipizzazione batterica
Tossinfezioni da ST a Imola
Genotipizzazione degli agenti batterici
di tossinfezione alimentare:
significato e metodiche
1. Significato e considerazioni generali
Con il termine di genotipizzazione batterica si intende, in
senso lato, l’assegnazione di uno stipite batterico ad un
particolare gruppo (“tipo”) di individui, appartenenti ad
una determinata categoria tassonomica (generalmente definita fenotipicamente), aventi in comune le stesse caratteristiche genetiche, così come esse sono evidenziabili dalle
tecniche utilizzate per la genotipizzazione.
Così, ad esempio, uno stipite di una data specie e di un
determinato sierotipo viene assegnato ad un particolare tipo genetico, con una specifica tecnica, mentre un altro stipite della stessa specie e sierotipo viene assegnato, con la
stessa tecnica, ad un diverso tipo genetico.
Il fine principale delle attività di genotipizzazione è quindi
quello di distinguere stipiti geneticamente diversi ma indistinguibili con le tecniche fenotipiche normalmente utilizzate, come quelle normalmente utilizzate per
l’identificazione diagnostica tradizionale di specie ed
eventualmente sierotipo o biotipo.
Poter fare queste distinzioni tra stipiti è importante in due
ambiti fondamentali e distinti:
a) l’analisi epidemiologica di focolai di infezione
(per stabilire se ci si trova sempre di fronte allo
stesso stipite e poterne capire la provenienza);
b) lo studio della popolazione di un patogeno e
della sua evoluzione (epidemiologia molecolare).
E’ importante sottolineare che, in questa attività esistono
diversi elementi di relatività i quali si riferiscono tanto
all’approccio teorico praticabile quanto all’applicazione
pratica possibile. C’è una relatività tecnica (quali metodi
usare), una biologica (per quali specie o categorie tassonomiche è possibile utilizzare una data tecnica o avere determinate risposte pratiche) e una legata alla finalità della
genotipizzazione (analisi di focolaio o studio di popolazione).
Dal punto di vista tecnico e biologico è importante sottolineare come non vi siano riferimenti assoluti quanto alla
superiorità di un metodo rispetto ad altri, anzi: per una data
specie gli stessi metodi fenotipici possono essere molto efficaci e superiori a quelli genotipici, per altre specie la situazione si inverte, inoltre alcuni metodi genetici hanno
applicabilità molto variabile tra specie diverse (alcuni sono
specie-specifici) ed efficacia altrettanto variabile. Ancora,
1
3
diverse categorie tassonomiche hanno variabilità genetica
molto diversa (dovuta alla effettiva diversa clonalità che le
caratterizza) per cui, a prescindere dai metodi utilizzati,
risulterà più difficile differenziare tipi genetici in un gruppo tassonomico geneticamente uniforme rispetto ad uno
variabile (ovviamente se questo non si tiene in dovuta considerazione si potrebbero giudicare epidemiologicamente
correlati stipiti che non lo sono ma che risultano geneticamente indistinguibili con la tecnica utilizzata).
Per quanto attiene alle finalità della genotipizzazione, va
considerato che le metodologie utilizzate per l’analisi di
focolai devono avere una elevata capacità differenziale
(per poter distinguere anche stipiti simili ma diversi),
mentre nello studio di popolazioni è fondamentale poter
riconoscere le differenze che identificano in modo chiaro
linee evolutive distinte.
Dal quadro delineato, sia pure a grandi linee, emerge una
realtà tecnica e biologica che impone, a chi fa ricorso alla
genotipizzazione, scelte consapevoli delle metodologie legate all’organismo target ed alla finalità.
2. Le principali tecniche di genotipizzazione utilizzate
Non si vuole in questa sede descrivere in modo esauriente
il panorama delle tecniche esistenti (richiederebbe spazi
che vanno oltre lo scopo di queste righe) ma presentare in
modo conciso le tecniche oggi più rappresentative evidenziandone le caratteristiche salienti.
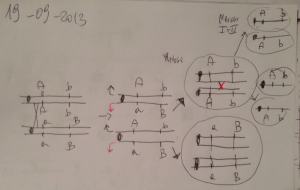
a) PFGE (pulsed field gel electrophoresis)
È stata tra le prime ad essere utilizzata e per quasi tutte le
specie batteriche resta la tecnica di riferimento per
l’elevata capacità differenziale unita alla ottima riproducibilità (gold standard per la valutazione comparativa di
nuovi metodi); ha un limite: è laboriosa e richiede tempi di
esecuzione mediamente lunghi (alcuni giorni), richiede anche una certa perizia tecnica ed esperienza da parte
dell’operatore.
Il principio è semplice: l’intero genoma viene digerito con
un enzima di restrizione scelto in modo da effettuare pochi
tagli nel genoma batterico in esame, in modo da ottenere
circa 8-15 frammenti. Essendo pochi i frammenti, questi
sono grandi (da decine a centinaia di migliaia di coppie di
basi) tanto da non poter essere separati in sistemi elettroforetici tradizionali, per cui si ricorre al campo pulsato come
sistema elettroforetico per separare tali frammenti. Il risultato è un profilo di bande che può variare da ceppo a
ceppo per numero di bande e peso molecolare delle stesse,
in funzione della collocazione nel genoma dei siti di restrizione dell’enzima utilizzato.
I vantaggi
Il Bollettino CEREV è redatto e stampato dal Centro
tecnici di
Emiliano Romagnolo di Epidemiologia Veterinaria.
tale metoResponsabile: Marco Tamba.
dica sono
Indirizzo: Via Fiorini, 5 - 40127 Bologna.
la
sua
Telefono 051-4200032. Fax 051-4200038
Mailto: [email protected]
Internet: http://www.bs.izs.it/cerev/index.htm
2
Lettera di informazione CEREV n. 60 – Giugno 2005
universalità (applicabile a qualsiasi genoma), la flessibilità
(si possono usare diversi enzimi) il non richiedere apparecchiature molto costose.
Per quanto riguarda la citata riproducibilità della tecnica
(capacità di dare lo stesso risultato se eseguita in laboratori
e momenti diversi), essa deriva dalla precisione con cui gli
enzimi di restrizione riconoscono le sequenze bersaglio,
per cui, se correttamente eseguita la digestione originerà
sempre gli stessi frammenti da un dato genoma.
Nel complesso è quindi molto affidabile e dimostra un potere differenziale che la rende ottimale per analisi di focolaio ma valida anche per lo studio di popolazione.
E’ la metodologia su cui si basano i circuiti nazionali ed
internazionali di genotipizzazione attivati in Nord America
ed in Europa.
b) RAPD (random amplified polymorphic DNA)
Metodo basato sull’uso della PCR con la quale, utilizzando
brevi (di solito decanucleotidi) primers non specifici e
condizioni di reazione a bassa stringenza, si amplificano
numerosi tratti del genoma posto in reazione. I tratti di genoma amplificati risultano in altrettante bande elettroforetiche. Le differenze di sequenza di genomi diversi comportano differenze nei profili di amplificazione che ne derivano.
Il sistema basa la propria capacità discriminante sulla sensibilità di questa PCR non specifica al variare delle condizioni di reazione (in teoria della sola sequenza target); tuttavia se questo da un lato conferisce elevato potere differenziale, dall’altro rende il sistema instabile e quindi poco
riproducibile, pertanto la metodica è realmente valida solo
se gli stipiti da analizzare sono posti in reazione in parallelo nella stessa seduta. Questo è l’unico svantaggio (ma
molto rilevante) di questa metodica che presente molti
vantaggi: la semplicità, l’economicità, il buon potere differenziale, la rapidità e la generalità di impiego.
Alla luce dei suoi limiti e dei suoi vantaggi, la RAPD non è
utilizzabile in studi di popolazione ma resta valida nell’uso
mirato in analisi di focolai.
c) AFLP (amplified fragment length polymorphism)
Questa metodica nel cui dettaglio tecnico non si entrerà
(essendo piuttosto articolata) evidenzia polimorfismi sulla
base della digestione del DNA genomico con due enzimi di
restrizione e della successiva selezione e visualizzazione
dei prodotti di digestione con PCR e rivelazione radioattiva
(ormai abbandonata) o fluorescente (con l’uso degli attuali
sequenziatori capillari). Il risultato è una serie di bande o
picchi in numero di alcune decine con un ottimo potere differenziale e una buona riproducibilità. E’ una tecnica con
ottime prestazioni ma richiede, nella versione fluorescente,
apparecchiature costose.
d) RIBOTIPIZZAZIONE
E’ stata una delle prime metodiche di genotipizzazione
batterica utilizzate, nella sua versione classica manuale.
Consente di valutare polimorfismi di restrizione
nell’ambito e nell’intorno degli operoni ribosomali nei genomi in esame (nei genomi batterici è presente più di un
operone dei geni codificanti per gli RNA ribosomali). In
pratica il DNA genomico viene digerito con enzimi di restrizione, i frammenti vengono separati elettroforeticamente quindi ibridati con sonde che riconoscono i geni de-
gli RNA ribosomali che quindi mettono in evidenza solo i
frammenti che contengono tali geni (o tratti di essi). Poiché
tali geni sono disposti nel genoma in modo da dare frammenti di restrizione diversificati, ne risulta un polimorfismo tra stipite e stipite.
Il sistema ha un buon potere differenziale, un’ottima riproducibilità e una discreta generalità di impiego, ma è lungo
e laborioso da impiegare.
Per ovviare agli inconvenienti, da alcuni anni viene commercializzata una variante automatizzata ma il costo
dell’apparecchiatura è molto elevato.
e) MLST (multilocus sequenze typing)
Forse il futuro dei metodi di genotipizzazione in quanto in
grado di dare risposte positive ai bisogni di oggettività e di
riproducibilità dei dati analitici, oltre che di elevato contenuto informativo (quindi di potere differenziale) e di gestibilità informatica in “data base” condivisi.
Consiste nella acquisizione delle sequenze nucleotidiche di
circa 500 paia di basi di un certo numero (una decina) di
geni “housekeeping” (geni che codificano per funzioni basilari del metabolismo cellulare, quindi sempre espressi);
mediante le sequenze si identifica il tipo di allele presente
in ognuno dei loci considerati per ciascuno stipite analizzato. Ne deriva che il genotipo di ciascuno stipite viene
codificato con una serie numerica in cui ogni numero corrisponde al tipo di allele presente per ognuno dei loci considerati. Il sistema prevede quindi la codifica numerica di
ogni allele esistente e la costituzione di banche dati rispetto
alle quali effettuare l’identificazione dei tipi allelici e dei
genotipi, il che non è un problema poichè il tipo di dato
non è un tracciato elettroforetico ma un dato di sequenza
(quindi perfettamente trattabile informaticamente). Esistono schemi di genotipizzazione MLST per diversi patogeni:
i più consolidati oggi sono quelli di Neisseria meningitidis,
Campylobacter jejuni, Streptococcus pneumoniae e
Staphylococcus aureus. Questi sistemi sono fondamentali
per studi evolutivi di popolazione ma si sono rivelati efficaci anche per analisi di focolai.
f) VNTR (variable number of tandem repeats)
Il sequenziamento di molti genomi batterici completi ha
consentito in tempi recenti di identificare in diversi di essi
(compresa Salmonella enterica ad esempio) sequenze ripetute tipo VNTR precedentemente note nei genomi di organismi superiori ed anche in questi utilizzate ai fini di
identificazione individuale. Si tratta di sequenze ripetute
un numero variabile di volte da un individuo all’altro; determinando il numero di ripetizione è possibile distinguere
individui diversi (nel caso dei batteri occorre parlare di linee diverse). E’ recente l’impiego di queste sequenze per
la genotipizzazione batterica ma la potenzialità è elevata
perché lo strumento ha caratteristiche di rapidità e riproducibilità molto elevate.
3. Considerazioni finali
Alcuni elementi devono essere evidenziati in conclusione:
- l’uso della genotipizzazione non prescinde da, nemmeno sostituisce, le informazioni epidemiologiche,
- la scelta delle tecniche deve essere guidata dalle finalità,
- spesso la genotipizzazione ha significato solo se applicata a gruppi di stipiti, la tipizzazione di singoli
3
Lettera di informazione CEREV n. 60 – Giugno 2005
stipiti al di fuori di schemi di riferimento non ha significato,
- oggi non esiste una tecnica ideale e spesso l’uso di
più tecniche è necessario alla produzione di dati utili.
Presso la Sezione Diagnostica IZSLER di Modena si svolgono dal 1998 attività di genotipizzazione batterica con
varie metodologie (RAPD, PFGE, Ribotipizzazione quelle
attuali, AFLP, VNTR, MLST quelle rese possibili dalla
dotazione tecnica). L’esperienza acquisita riguarda Salmonella e Listeria ma come spesso accade molte di queste
tecniche possono essere estese ad altre specie in funzione
delle necessità. Questi strumenti possono quindi essere tenuti in considerazione in occasione di specifiche esigenze
epidemiologiche.
Stefano Pongolini. Sezione di Modena – IZSLER
Tossinfezioni da S.typhimurium nella
A.USL di Imola.
Nel periodo ottobre 2004 - gennaio 2005 sono stati rilevati
un numero di tossinfezioni da Salmonella typhimurium
insolitamente alto. Gli episodi tossinfettivi hanno interessato singoli individui, residenti nei 10 comuni della AUSL
di Imola senza un nesso apparente tra di loro, ossia non direttamente collegabili a banchetti o occasioni similari
In seguito al coinvolgimento del Servizio Veterinario è
stata valutata la possibilità di applicare la genotipizzazione
crociata tra i ceppi isolati in umana e quelli isolati dagli
alimenti che gli interessati avevano ancora in casa e dichiaravano di aver consumato.
A tale scopo sono stati raccolti ed analizzati presso
l’Istituto Zooprofilattico Sperimentale 11 ceppi di
S.typhimurium provenienti da casi umani (7 ceppi) e da
alimenti di origine animale (4 ceppi). La genotipizzazione
effettuata tramite RAPD ha evidenziato come 10 degli 11
ceppi esaminati fossero geneticamente molto simili, evidenziando come probabile una fonte comune di infezione
per 6 dei 7 casi umani e per tutti gli alimenti esaminati.
Nel raffrontare i risultati degli esami e delle indagini sul
campo, è quindi stato possibile evidenziare un nesso tra gli
episodi, di per sé senza alcun apparente collegamento tra di
loro, risalendo all’utilizzo di carni suine fresche che sono
state diversamente impiegate e consumate sotto forma di
ripieno per tortellini, come braciola, come salume fatto in
casa o come salume industriale.
Alla luce di questa esperienza si vuole sottolineare come
sia indispensabile che le informazioni e le collaborazioni
siano tempestive tra l’ospedale, il laboratorio analisi
dell’ospedale, il servizio di sanità pubblica, il servizio Veterinario e l’Istituto Zooprofilattico in modo da poter mettere in rete preziose e tempestive informazioni che altrimenti non renderebbero possibile risalire a quanto si è verificato.
Per quanto riguarda la parte più prettamente veterinaria, si
suggerisce una particolare attenzione al ricevimento delle
carni non disgiunto dalla lavorazione e dalla stagionatura,
senza dimenticare i processi che avvengono a monte sia al
macello che negli allevamenti.
Pertanto dall’esame dei dati in possesso si espongono le
seguenti considerazioni:
A) Siamo verosimilmente in presenza di quello che si può
configurare come un focolaio di malattia alimentare “ad
alta dispersione nel tempo e nello spazio” (Tauxe, 2002),
una realtà complessa che, per la mancanza di una certezza
di causa/effetto, può essere ricondotta a un allevamento di
suini che abbia avuto dei portatori asintomatici di Salmonella tra gli animali.
B) Non è da escludere, tuttavia, che vi possa essere anche
un portatore asintomatico fra gli operatori del settore,
che possa avere quanto meno contribuito alla diffusione
del batterio.
Sono ancora in corso indagini per individuare con certezza
la fonte del contagio. Tuttavia i risultati ottenuti, anche se
parziali, confermano l’utilità della genotipizzazione batterica in corso di indagini epidemiologiche in seguito a episodi di tossinfezione.
Agnese Bosco; Alessandro Brunori. A.USL Imola
Lia Bardasi. Sezione di Bologna – IZSLER
Tabella 1 – Informazioni relative ai ceppi esaminati mediante RAPD ed esito della tipizzazione genetica
Ceppo
Origine del ceppo di
Salmonella tiphymurium
Gruppo
assegnato
mediante RAPD
Informazioni raccolte sul ceppo
1
Paziente A. 4 anni
Gruppo I
2
Paziente B. 30 anni
Gruppo II
3
Paziente C. 3 anni
Gruppo I
4
Paziente D. 1,5 anni
Gruppo I
5
Paziente E. 6 anni
Gruppo I
6
Tortellini
Gruppo I
7
Salame felino
Gruppo I
8
Paziente F. 12 anni
Gruppo I
Correlato a consumo di salame casalingo
Prelevato in corso di indagine scaturita da caso umano (Paziente F – ceppo 8). Fatto in
casa con carne proveniente dal medesimo stabilimento in cui è stato prelevato il salame
felino (ceppo 7)
9
Salame casalingo
Gruppo I
10
Paziente G.
Gruppo I
11
Salame contadino
Gruppo I
Altri 3 casi in famiglia a distanza di un mese l’uno dall’altro
Prelevati in corso di indagine scaturita da caso umano (ceppo non disponibile). Fatti in casa con ripieno acquistato in gastronomia
Campione prelevato a dic.2004 nel reparto stagionatura di un salumificio. Carni giunte allo
stabilimento in ott.2004
Prelevato in corso di indagine scaturita da caso umano (ceppo non disponibile).