Microbiologia
Batteriologia Generale
Classificazione, Struttura e Replicazione dei Batteri
I batteri sono le cellule più piccole e possono vedersi solamente con il microscopio; i
più piccoli sono di 0,1-0,2 μm (Chlamydia e Rickettsia), mentre i più grandi sono di
alcuni μm; comunque la maggior parte ha il diametro di 1 μm. Il cromosoma
batterico tipico è una singola molecola circolare di DNA con 5 milioni di coppie di
basi e una lunghezza di 1,3 mm; i batteri hanno un ribosoma più piccolo, il 70S e
nella maggior parte dei batteri una barriera di peptidoglicano circonda le membrane
cellulari per proteggerle dall'ambiente esterno, così che possano vivere in condizioni
estreme cui una cellula eucariote non potrebbe.
- Classificazione dei Batteri
L'aspetto al microscopio, come grandezza e morfologia dei microrganismi e la loro
capacità di trattenere la colorazione di Gram sono i principali mezzi per distinguere i
batteri. Ad esempio lo Staphylococcus è sferico, è un cocco; l'Escherichia Coli è un
bastoncello, bacillo; il Treponema Pallidum è uno spirochete; Nocardia e Actinomyces
hanno aspetto filamentoso come i funghi. Alcuni batteri poi formano degli aggregati,
come lo Staphylococcus Aureus, a forma di grappolo d'uva o diplococchi in Neisseria o
catenelle come per lo Streptococcus.
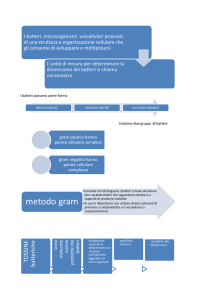
La colorazione di Gram consente di distinguere tra le due classi principali di batteri.
Vengono fatti asciugare su un vetrino, fissati col calore e coloranti come il
cristalvioletto, un colorante che è precipitato da una soluzione iodurata di Gram; poi
con un lavaggio con un decolorante a base di H2O e Acetone; infine una colorazione
di contrasto con la Safranina Rossa viene aggiunta per le cellule che si erano
precedentemente decolorate. Il risultato per i Gram Positivi è che diventano viola
color porpora, la colorazione rimane tra le maglie del peptidoglicano (p-porporapositivo); per i Gram Negativi, invece, che hanno uno strato sottile di peptidoglicano
il quale non trattiene la colorazione e la colorazione successiva di contrasto da un
colore rosso. Quello che succede è che il cristalvioletto della colorazione di Gram è
precipitato dallo iodio e intrappolato nello spesso strato di peptidoglicano dei Gram+
; il decolorante disperde la membrana esterna Gram- e lava così via il cristalvioletto
Microbiologia Preston
1
dal sottile strato di peptidoglicano; i batteri Gram- sono quindi visualizzati grazie alla
colorazione di contrasto in rosso. A causa della degradazione del peptidoglicano, il
test di Gram non è affidabile per i batteri in carenza di nutrienti (colture vecchie) o
trattati con antibiotici. I batteri non classificabili con Gram comprendono i
Micobatteri, che hanno una parete ricca di cere e lipidi e si possono osservare con una
colorazione di Ziehl-Nellsen con dei coloranti acido-resistenti, e i Micoplasmi, che nn
hanno il peptidoglicano.
Un altro livello di caratterizzazione di basa sul metabolismo, come la necessità di
ambienti anaerobi o aerobi, di sostanze nutritive specifiche e la produzione di
metaboliti specifici e di enzimi specifici. Un ceppo batterico può essere identificato
utilizzando gli anticorpi per rilevare antigeni caratteristici presenti (sierotipizzazione).
Il metodo più preciso di classificare batteri è rappresentato dall'analisi del loro
materiale genetico. Distingue i batteri rilevando sequenze specifiche caratteristiche di
DNA, come Ibridazione del DNA, la sua amplificazione mediante reazione
polimerasica a catena (PCR).
- Struttura
Il Citoplasma è formato all'80% da acqua. Le strutture cellule batteriche hanno DNA
cromosomiale, mRNA, ribosomi, proteine e metaboliti. Il DNA circolare chiuso
(cromosoma) è in un'area separata non chiusa, il Nucleoide; ci sono i Plasmidi, del
DNA extracromosomiale circolare più piccolo, maggiormente nei batteri Gram-, che
non sono essenziali, ma conferiscono resistenza ad uno o più antibiotici. Per via
dell'assenza di membrana nucleare, traduzione e trascrizione sono accoppiate, infatti
i ribosomi possono legarsi all'mRNA e sintetizzare la proteina mentre l'mRNA è in
corso di sintesi ed è ancora legato al DNA. Il ribosoma è di 70S (30+50) diverso
dall'80S (40+60). La membrana citoplasmatica è lipidica a doppio strato , ma non
possiede steroli (eccezion fatta per i Micoplasmi) sostituiti dai Terpenoidi ed ha molte
funzioni, come il trasporto di e- e la produzione di energia. I componenti della aprete
cellulare sono peculiari del batterio e le loro strutture ripetitive stimolano negli esseri
umani risposte di tipo innato. Protegge dalla lisi osmotica; strati rigidi di
Microbiologia Preston
2
peptidoglicano (mureina) circondano le membrane citoplasmatiche della maggior
parte dei procarioti.
BATTERI GRAM POSITIVI
Hanno 3 importanti caratteristiche che sono la presenza di una spessa parete di
Peptidoglicano , poi la presenza di Acido Tecoico e Acido Lipotecoico.
Nei batteri Gram positivi è presente una spessa parete cellulare multistrato formata
principalmente da Peptidoglicano (150-500 Å) che circonda la membrana
citoplasmatica; questa è essenziale per la sopravvivenza nelle condizioni ostili in cui
crescono i batteri, perché regola il passaggio dei metaboliti dall'esterno e si oppone
al passaggio di macromolecole idrofobiche come i sali biliari. E' degradabile se
trattato con Lisozima (presente nelle lacrime e nel muco) perché degrada il glicano
che protrude dalla membrana plasmatica come setole a formare dei legami crociati
con brevi catene polipeptidiche. Senza il peptidoglicano i batteri morirebbero a causa
della differenza di pressione osmotica notevole presente sulla membrana
citoplasmatica e si liserebbero. Sulla parete dei Gram positivi inoltre ci sono gli Acidi
Tecoici (glicerolo-fosfato legato al peptidoglicano) essenziali e gli Acidi Lipotecoici
(Acido tecoico legato a lipidi) ancorati sulla membrana citoplasmatica. Sono
importanti fattori di virulenza, sono antigeni di superficie e promuovono l'adesione
ad altri batteri.
BATTERI GRAM NEGATIVI
La struttura è più complessa rispetto a quella dei positivi; ha diverse strutture
caratteristiche, come la Membrana Esterna, lo Spazio Periplasmatico, le Porine e
l'LPS.
La porzione più esterna è formata da un sottile strato di Peptidoglicano (10-15%) e
non troviamo né Acido Tecoico, né Lipotecoico. Subito sulla parte più esterna
troviamo la Membrana Esterna, che è peculiare dei Gram negativi, e tra questa e la
membrana citoplasmatica troviamo lo Spazio Periplasmatico, un comparto
contenente i sistemi di trasporto del ferro, proteine, zuccheri,metaboliti e poi
contiene enzimi idrolitici importanti perché disgregano macromolecole di grosse
Microbiologia Preston
3
dimensioni e per le molecole idrofobiche, inoltre mantiene la struttura batterica e al
suo interno sono presenti enzimi che aggrediscono alcuni farmaci antibatterici
conferendo al batterio proprietà di farmaco-resistenza. E' altamente asimmetrica
perché il foglietto esterno è simile ad un normale strato lipidico di qualsiasi
membrana cellulare, ma il foglietto interno invece contiene LPS o Lipopolisaccaride
e si trova solo qui. Troviamo delle proteine transmembrana che attraversano la
membrana esterna, le Porine che consentono la diffusione passiva attraverso la
membrana di molecole idrofile di massa inferiore a 700 Da come glucidi, aminoacidi,
metaboliti e determinati ioni. La membrana esterna è collegata al Peptidoglicano
grazie alla lipoproteina (che è legata covalentemente al peptidoglicano e ancorata alla
membrana esterna), ed invece è legata in siti adesione con la membrana
citoplasmatica. La membrana esterna è tenuta insieme da legami di cationi bivalenti
come magnesio e calcio tra i fosfati sulle molecole di LPS e le interazioni idrofobiche
tra LPS e proteine. Questa membrana è forte, ma può essere spezzata da antibiotici
come la polimixina o dall'eliminazione di magnesio e calcio grazie alla chelazione con
tetraciclina; ciò rompe la membrana e aumentando la permeabilità alle molecole
idrofobiche di grosse dimensioni indebolisce il batterio. L'aggiunta di Lisozima
produce sferoplasti, che come i protoplasti (nei Gram positivi) sono sensibili alla
differenza di pressione osmotica, che porta a lisi.
STRUTTURE ESTERNE
Sia batteri Gram positivi che negativi sono circondati da una Capsula, strato proteico
lasso o polisaccaridico, che nel caso in cui sia un materiale scarsamente aderente e
poco uniforme per densità e spessore viene detto strato mucoso. Ha 4 funzioni:
1) Può favorire l'aderenza ad altri batteri o a superfici tissutali dell'ospite.
2) Possiede attività antifagocitica ed è un fattore di virulenza.
3) Mimetismo Immunitario, con il quale il batterio si premunisce di un "mantello"
che può essere Acido Ialuronico simile al tessuto connettivo.
4) Previene l'essiccamento.
Alcuni batteri in certe condizioni producono un Biofilm, una complessa struttura
formata da materiale capsulare contenente numerosi batteri che possono invadere:
Zone assai ampie di mucosa, come Pseudomonas nella mucosa respiratoria e Fasce
connettivali intermuscolari, come la Fascite Necrotizzante da Sterptococcus Pyogenes, e
non è penetrabile, una sede inaccessibile a farmaci ed immunità cellulare. Un biofilm
Microbiologia Preston
4
è una comunità strutturata di cellule batteriche racchiuse in una matrice polimerica
autoprodotta e adesa ad una superficie inerte o vivente, come le superfici connettivali
delle valvole cardiache oppure materiali inerti come fili di sutura e impianti protesici
quali i cateteri vescicali, le protesi vascolari, protesi valvolari cardiache, shunt arterovenosi e lenti a contatto.
Troviamo i Flagelli, che sono costituiti da subunità di Flagellina avvolte ad elica che
forniscono motilità verso i nutrienti o di allontanarsi da sostanze tossiche.A seconda
della disposizione dei flagelli sulla cellula, i batteri vengono distinti in monotrichi,
quando hanno un unico flagello ad un polo, lofotrichi, quando hanno un ciuffo di
flagelli ad un polo, amfotrichi, con un ciuffo di flagelli ai due poli, e peritrichi quando
hanno flagelli distribuiti si tutta la superficie del batterio. Il flagello è ancorato alla
membrana citoplasmatica, al peptidoglicano e alla parete esterna dei batteri da una
serie di anelli, indicati come L,P,S e M, all'interno dei quali il corpo basale dei flagelli
può ruotare su sé stesso fornendo un moto rotatorio a tutta la struttura flagellare che
genera la spinta per il movimento, La presenza di una sostanza chimica che esercita
un'attrazione (zuccheri, amminoacidi) è captata da specifici recettori sulla membrana
cellulare che attivano processi bioenergetici che forniscono l'energia per la rotazione
dei flagelli permettendo al batterio di avvicinarsi alla sorgente di attrazione
(chemiotassi positiva). Una concentrazione di sostanze riconosciute dal batterio come
tossiche possono attivare al contrario la chemiotassi negativa che allontana il batterio
dalla fonte di sostanze repellenti.
Troviamo poi le Fimbrie o Pili, appendici superficiali formate da Pilina, che hanno un
diametro minore del flagello (3-8 nm rispetto a 10-20 nm) e non sono elicoidali come
il flagello; si trovano perimetralmente e sono importanti per l'aderenza al batterio o
all'ospite. Sono distinti in due classi : i pili ordinari, che rappresentano i fattori di
adesività, in cui le punte delle fimbrie contengono proteine (lectine) che legano
specifici zuccheri (ad esempio mannosio) presenti sulla cellula dell'ospite . Il pilo
sessuale o F invece, è responsabile dell'attacco della cellula donatrice alla cellula
ricevente nel fenomeno della coagulazione batterica con il quale avviene il
trasferimento di materiale genetico tra cellule batteriche.
Ancora vediamo le Adesine, delle proteine della parete cellulare esterna dei batteri
che riconoscono specifici recettori sulla cellula ospite e permettono al batterio di
aderire saldamente e colonizzare gli organi dell'ospite. Sia pili che adesine
favoriscono l'adesività al batterio ad altri batteri per formare colonie o agli organi
dell'ospite per colonizzare i tessuti ed iniziare il processo infettivo. Sono importanti
Microbiologia Preston
5
fattori di virulenza: le fimbrie di tipo 1, le fimbrie P e l'adesina Dr di alcuni ceppi di
Escherichia Coli uropatogeni si legano selettivamente sulle cellule della mucosa
urinaria. La pilina di Neisseria gonorrhoeae media l'attacco iniziale del batterio alle
cellule non ciliate dell'epitelio vaginale, delle tube di falloppio e della cavità buccale.
L'acido lipotecoico in associazione con la proteina M dello Streptococcus pyogenes
forma microfibrille che facilitano l'aderenza del batterio alle cellule epiteliali della
bocca. La tossina della pertosse o esotossina PT o Tox, oltre a diffondere
nell'ambiente extracellulare, quando ancorata alla parete della Bordetella pertussis, è
una adesina che permette il legame all'epitelio ciliato e ai macrofagi.
PARETE CELLULARE DEI MICOBATTERI
I micobatteri hanno un diverso peptidoglicano, legato con legame covalente a un
polimero di arabinogalattano e circondato da un rivestimento lipidico-ceroso di acido
micolico (acido grasso a catena lunga), fattore cordale (un particolare componente
derivato dagli acidi micolici, fattore di virulenza del M.Tuberculosis), tubercolina, cera
D e sulfolipidi che hanno una potente azione adiuvante la patogenicità. Sono detti
Acidoresistenti ed hanno attività antifagocitaria. I Micoplasmi non hanno il
peptidoglicano e incorporano gli steroidi dall'ospite all'interno delle loro membrane.
Il liparobinomannano è un complesso glicolipide micobatterico che svolge una
potente attività di regolazione di funzioni correlate con l'immunità cellulo-mediata
quale la soppressione della proliferazione di cellule T, l'inibizione delle funzioni di
IFN-γ e di chinasi, l'eliminazione degli intermediari tossici dell'ossigeno e la
secrezione di chemochine da parte di polimorfonucleati.
STRUTTURA E BIOSINTESI DEI PRINCIPALI COMPONENTI DELLA PARETE CELLULARE
PEPTIDOGLICANO
Mureina o Mucopeptide Batterico. E' formato da un reticolo rigido costituito da
catene di polisaccaridi lineari tenuti assieme da legami crociati peptidici. Il
polisaccaride è composto da disaccaridi ripetuti quali NAG o N-Acetilglucosamina e
NAM o Acido N-Acetilmuramico; le catene glicaniche di questi due sono legate con
legami trasversali mediante ponti tetrapeptidici. Nei Gram positivi, il peptidoglicano
forma degli strati multipli ed è spesso tridimensionalmente reticolato, così da essere
molto rigido e resistente; al contrario nei Gram negativi mostra un solo strato
molecolare. Il legame β(1-4) è il sito di scissione da parte del Lisozima o dalla
Muraminidasi prodotto dai granulociti, macrofagi e polimorfonucleati. Nell'infezione
interferisce con la fagocitosi, è mitogeno per i linfociti ed ha attività pirogena.
Microbiologia Preston
6
--> Sintesi del Peptidoglicano
Il precursore del Peptidoglicano deriva da un'unità prefabbricata contenente un
pentapeptide attaccato al NAM. Il peptide è insolito perché contiene sia amminoacidi
D, che L e questo peptide viene prodotto per via enzimatica e non da un ribosoma. Il
terzo amminoacido è molto importante per la Reticolazione perché è sempre un
amminoacido Diaminico, quindi come la Lisina. La reticolazione peptidica è formata
tra NH2 libero e la D-Alanina in 4a posizione di un'altra catena. La D-Alanina
terminale viene rilasciata durante la reticolazione e quindi il precursore ha una DAlanina interna. Questo dipeptide è necessario per la reticolazione ed è la base per
l'azione degli antibiotici β-lattamici e della vancomicina.
La sintesi del peptidoglicano avviene in 5 fasi:
1) La Glucosamina viene convertita in NAM e viene attivata per via energetica da una
reazione con UTP, con produzione di UDP+NAM.
2) Viene assemblato il precursore UDP+NAM+Pentapeptide.
3) UDP+NAM+Pentapeptide viene legato al Bactoprenolo attraverso un legame
pirofosfato con rilascio di UMP; e poi viene aggiunto NAG per creare il
disaccaride.
4) Il Bactoprenolo trasloca il precursore verso l'esterno della cellula; NAM+NAG
viene attaccato ad una catena di peptidoglicano utilizzando il legame Pirofosfato
che esiste tra sé e il Bactoprenolo come energia per alimentare questa reazione
detta Transglicosilasi; il Pirofosfato-Bactoprenolo viene riconvertito in
fosfobactoprenolo e poi riciclato (la Bacitricina blocca tale ciclo).
5) Fuori dalla cellula, ma molto vicino alla superficie della membrana, le catene
peptidiche dalle catene di glicano adiacenti sono reticolare le une alle altre da uno
"scambio di legame peptidico" o Transpeptidazione tra ammina libera
dell'amminoacido in terza posizione del pentapeptide (lisina) o il dominio Nterminale della catena di pentaglicina agganciata e la D-Alanina in quarta
posizione, rilasciando la D-Alanina terminale (questa fase non richiede energia,
perché scambiati). La reazione di Reticolazione è catalizzata da enzimi
Transpeptidasi legati alla membrana; le Carbossipeptidasi eliminano le D-Alanine
terminali; le Transglicosidasi catalizzano la transglicosilasi; le Endopeptidasi
catalizzano l'idrolisi dei legami peptidici interni alla catena. Questi quattro enzimi
sono chiamati PBP o Proteine leganti la Penicillina, perché sono bersagli per la
Microbiologia Preston
7
penicillina e altri antibiotici β-lattamici. I batteri penicillino-resistenti modificano
la struttura delle PBP; la Vancomicina interagisce con la struttura D-Alanina-DAlanina terminale per bloccare la formazione dei ponti; è attiva contro i batteri
Gram positivi resistenti a β-lattamici e contro stafilococchi oxacillina-resistenti; è
inattiva invece su Gram negativi, perché è una molecola grande che non passa la
membrana esterna di questi batteri.
ACIDO TECOICO E LIPOTECOICO
Sono polimeri di Ribosio legati covalentemente al peptidoglicano e presenti solo nei
Gram positivi, legati covalentemente allo strato di peptidoglicano. Gli Acidi Tecoici
sono altamente antigenici ed hanno una notevole diversità di composizione fra le
diverse specie di gram positivi, da venir utilizzati per caratterizzare i sierotipi;
promuovono l'adesione con altri batteri o con i recettori delle cellule animali .
L'acido Tecoico è un fattore di virulenza, e l'acido Lipotecoico ha anche attività
endotossica.
LPS o ENDOTOSSINA
Ha tre regioni strutturali: Antigene O (altamente variabile), il Core Rugoso (2-cheto-3desossi-ottanato e il Lipide A (disaccaride di Glucosamina fosforilata).
1) L'Antigene O è attaccato al core e si estende verso l'esterno della parete batterica;
è un polisaccaride lineare formato da 50-100 unità saccaridi che che si
estroflettono; permette di distinguere tra sierotipi o ceppi di una stessa specie
batterica; questa regione è altamente variabile e fornisce una notevole compattezza
al batterio.
2) Il Core è un polisaccaride ramificato essenziale per la struttura dell'LPS e per la
vitalità.
3) Il Lipeide A è un componente base, essenziale per la vitalità batterica e
responsabile dell'attività endotossica dell'LPS; è formata da un disaccaride di
Glucosamina fosforilata e acidi grassi.
DIVISIONE CELLULARE
È una scissione binaria che avviene in tre fasi: una prima estensione della parete,
seguita dalla replicazione del materiale genetico, che nel caso dei batteri è un'unica
molecola di DNA ancorata alla membrana citoplasmatica, ed infine, si forma il setto.
SPORULAZIONE
Microbiologia Preston
8
È una caratteristica solo di alcuni Gram positivi. La Spora è una struttura disidratata,
pluristratificata e protettiva che permette al batterio di sopravvivere in uno stato di
vitalità sospesa. In condizioni ambientali difficili, come la mancanza di nutrienti,
possono passare dallo stato vegetativo a dormiente. In condizioni di delezione
nutrizionale, la cellula batterica forma un'unica spora interna che viene liberata
nell'ambiente esterno quando la cellula va incontro ad autolisi. La spora ha una
membrana interna, due strati di peptidoglicano e un rivestimento proteico cheratinosimile che permettono al batterio quiescente di sopravvivere in condizioni sfavorevoli
per un lungo periodo di tempo, anche per anni; le spore possono sopravvivere infatti
all'essiccazione, ai disinfettanti ed alla bollitura per parecchie ore. La spora contiene
una copia completa del cromosoma, concentrazioni minime di proteine essenziali e
ribosomi, alta concentrazione di calcio legato all'acido dipicolinico. Quando le
condizioni ambientali tornano favorevoli, la spora germina (sporulazione) e forma una
nuova cellula vegetativa che riprende la divisione cellulare con conseguente
moltiplicazione del batterio. Le spore hanno un ruolo importante nell'epidemiologia
di infezioni umane quali l'Antrace, il Tetano e la Gangrena gassosa. Le spore hanno
come funzione quella di proteggere così il DNA genomico dal calore, anche più di
100 gradi , dalla penetrazione di sostanze esterne, dall'essiccamento e dalle radiazioni
UV e raggi γ.
Microbiologia Preston
9
Metabolismo e Genetica dei batteri
METABOLISMO BATTERICO
I batteri per la crescita hanno bisogno di alcuni requisiti minimi, come C, N, H2O,
energia e ioni vari. I batteri patogeni ricavano energia dal metabolismo di zuccheri,
grassi e proteine. In base alla fonte di carbonio utilizzata per la crescita, i batteri
possono essere distinti in: Autotrofi, se utilizzano il solo carbonio inorganico (CO2), o
Eterotrofi, se utilizzano carbonio di composti organici.
L'O2 per quanto essenziale per l'ospite umano, in realtà è tossico per molti batteri.
Troviamo batteri Aerobi Obbligati, come il Mycobacterium Tuberculosis, che
necessitano di O2 molecolare per la propria crescita; ci sono gli Anaerobi Obbligati,
come il Clostridium Tetani, che crescono solo in completa assenza di O2; la maggior
parte però può crescere sia in presenza che in assenza di O2 e quindi sono Anaerobi
Facoltativi.
Il termine metabolismo indica l'insieme delle reazioni biochimiche necessarie per
ricavare ed utilizzare energia immagazzinata in grosse molecole. Le cellule per
sopravvivere devono ricavare energia dalla disgregazione di substrati organici come
lipidi, carboidrati e proteine e la impacchettano come ATP. Questo processo di
disgregazione per formare energia è detto Catabolismo; l'energia prodotta, ora, viene
utilizzata nella sintesi dei costituenti cellulari con l'Anabolismo. Questi due processi
correlati sono il Metabolismo intermedio. Lo scopo finale del metabolismo batterico è
la duplicazione delle strutture necessarie per procedere alla divisione in due cellule
figlie. L'energia che impiega la cellula nelle reazioni di biosintesi è quella rilasciata
dall'idrolisi dell'ATP in ADP. Per rigenerare ATP il batterio necessita di nuova
energia che ottiene dalla degradazione di vari substrati organici, quali carboidrati,
proteine e lipidi.
La sintesi dell'acido piruvico rappresenta un passaggio fondamentale sia dei processi
fermentativi che di quelli respiratori. I batteri possono utilizzare diverse vie
metaboliche per la sintesi del piruvato: la glicolisi (la più comune, presente anche
nelle cellule eucariotiche e che si realizza in condizioni di anaerobiosi); lo shunt dei
pentosi; la via di Enter-Doudoroff.
Microbiologia Preston
10
Il destino del piruvato può essere poi:
La Fermentazione, un processo catabolismo che oltre a rifornite la cellula di ATP
determina l'accumulo nel mezzo ambiente di diversi prodotti terminali organici,
caratteristici delle diverse specie batteriche, come ad esempio l'acido lattico nel caso
dei lattobacilli, potenzialmente ancora ricchi di energia non ulteriormente utilizzabile
attraverso la via fermentativa . La Respirazione, un processo più complicato che
richiede la presenza di O2 e che consente, attraverso il ciclo di Krebs, la completa
degradazione della sorgente energetica ad H2O e CO2, il che garantisce alla cellula
un apporto di ATP notevolmente maggiore rispetto alla fermentazione.
Abbiamo visto quindi che la fosforilazione dell'ADP in ATP può avvenire attraverso
due meccanismi, la fosforilazione a livello di substrato (fermentazione) e la
fosforilazione mediante il trasporto di elettroni (respirazione)
FASI DELLA CRESCITA BATTERICA
1) Lag o latenza, dove le cellule aumentano di volume ma non di numero, i batteri si
adattano al nuovo ambiente.
2) Log o fase logaritmica, dove si moltiplicano con un tempo di duplicazione che
dipende dal ceppo e dall'ambiente.
3) Stat o fase stazionaria, dove i batteri smettono di crescere per mancanza di
metaboliti o per l'accumulo di sostanze tossiche.
4) Death o morte cellulare, una fase esponenziale ed è una riduzione lineare del
numero di cellule vitali nel tempo. Il tasso di mortalità aumenta fino a raggiungere
un livello costante.
GENETICA BATTERICA
Nella cellula batterica è presente del materiale genetico a livello di: Cromosoma
batterico, Plasmidi, Elementi genetici trasponibili e DNA fagico.
1) Il Cromosoma batterico è un unico cromosoma presente nel Nucleoide ed ha
circa 5 milioni di coppie di basi per una lunghezza di 1,3 mm; è circolare a doppio
filamento, superspiralizzato e non presenta istoni.
2) I Plasmidi sono elementi genetici extracromosomici, generalmente circolari che
hanno una replicazione indipendente dagli altri elementi genici; hanno circa
1000/2000 coppie di basi ed a seconda di quante coppie hanno sono divisi in
Plasmidi minori (5-10 Kb) e Plasmidi maggiori (50-200 Kb); alcuni plasmidi
denominati coniugativi possiedono un set di geni tra o "di trasferimento" che
Microbiologia Preston
11
sono in grado di promuovere il loro trasferimento in cellule diverse (trasmissione
orizzontale) attraverso un ponte citoplasmatico ; codificano per funzioni non
indispensabili alla sopravvivenza della cellula batterica, ma garantiscono notevoli
vantaggi, come : Coniugazione, Plasmide F, meccanismo di trasferimento genico,
che porta ad un trasferimento unidirezionale di DNA da una cellula donatrice ad
una ricevente, attraverso il Pilo sessuale (il plasmide F è definito coniugatuvo
perché trasporta tutti i geni necessari al proprio trasferimento, compresa la
capacità di produrre pili sessuali); la Resistenza agli antibiotici, Plasmide R,
plasmide contenente geni che conferiscono resistenza a numerosi farmaci
antibatterici, come alla degradazione enzimatica (penicillina),poi possono
contenere diversi altri geni tra cui geni che determinano resistenza a ioni
metallici, raggi ultravioletti, all'azione delle colicine, all'azione battericida del siero
umano, geni che permettono il metabolismo di diversi zuccheri ((lattosio,
saccarosio), geni che codificano per fattori Ent (fattori tossici che determinano la
produzione di enterotossine ed altri fattori di virulenza); la Virulenza, fattori di
invasione, produzione di tossine e colicine; Metabolismo e Catabolismo, produzione
di siderofori.
3) Elementi Genetici Trasponibili : Sono segmenti di DNA mobili in grado di traslocare
nell'ambito della stessa cellula; hanno un movimento casuale e non sono capaci di
autoreplicarsi; la trasposizione viene mediata da trasposasi in siti di
ricombinazione specifici. La maggior parte dei batteri patogeni può scambiare
materiale genetico andando incontro a fenomeni di ricombinazione omologa e
non omologa e ciò può avvenire in tre diversi modi: Trasformazione, o
acquisizione di nuovi marcatori genetici attraverso l'incorporazione di DNA
esogeno (alcune specie come Neisseria, Streptococcus Pneumoniae, Bacillus e
Haemofilus Influenzae sono naturalmente capaci di assumere il DNA esogeno e
sono così definiti competenti); Coniugazione, o scambio di materiale genetico da
un batterio donatore ad uno ricevente attraverso il pilo sessuale (il plasmide F è
coniugativo perché trasporta tutti i geni necessari al proprio trasferimento
compresa la capacità di produrre pili sessuali e di iniziare la sintesi di DNA
all'origine del trasferimento Orit del plasmide - se la sequenza è integrata nel
cromosoma batterico, la cellula viene designata cellula Hfr ad alta frequenza di
ricombinazione); Trasduzione, ricombinazione genetica attraverso un'infezione
fagica, quindi alcuni virus batterici o batteriofagi possono trasferire geni batterici
da una cellula all'altra (l'infezione può portare lisi cellulare ed allora si parla di
Microbiologia Preston
12
Ciclo litico oppure l'integrazione del genoma batterico può non portare a lisi
cellulare ed allora si parla di Ciclo lisogenico.
PATOGENESI BATTERICA
Il corpo umano è un insieme di nicchie ambientali che forniscono calore, umidità e
nutrimento necessari alla crescita del batterio. Molti meccanismi che utilizza il
batterio per conservare la sua nicchia e i prodotti metabolici che derivano dalla
crescita batterica, come acidi e gas, danneggiano e causano problemi all'ospite. Le
manifestazioni della malattia risultano spesso dalla combinazione del danno causato
dai batteri e dalle conseguenze delle risposte innate e immunitarie all'infezione. Non
tutti i batteri però sono patogeni, o meglio provocano una malattia, infatti il corpo
umano è colonizzato da numerosi microrganismi (flora normale), la maggior parte dei
quali svolge funzioni importanti per l'ospite, come la digestione del cibo, la
produzione di vitamine o la protezione dalla colonizzazione da parte di
microrganismi patogeni; questi batteri risiedono normalmente nel tratto
gastrointestinale, nella bocca, nella pelle, nel tratto respiratorio superiore; in
condizioni normali, questi non invadono il corpo umano , ma può accadere che
questi entrino in dei siti sterili causando una malattia. I batteri virulenti promuovono
la crescita nell'ospite a danno della funzionalità dei tessuti e degli organi per l'ospite;
i batteri opportunisti, per crescere, approfittano di patologie pre-esistenti, come
immunodepressione, che aumenta la suscettibilità ad una malattia. La malattia è il
risultato del danno e della risposta infiammatoria dell'ospite.
Nell'ambito dei rapporti ospite-parassita distinguiamo:
- Mutualismo, un particolare tipo di relazione dalla quale derivano benefici reciproci
per entrambi i partners e dove i membri sono metabolicamente dipendenti l'uno
dall'altro.
- Commensalismo, una relazione simbiotica dove un organismo, commensale, trae da
essa beneficio, mentre l'altro, l'ospite, non viene danneggiato né favorito, come
l'Escherichia Coli nel colon.
- Parassitismo, una relazione in cui il batterio patogeno si insedia nei tessuti
dell'ospite, superandone i meccanismi di difesa e alterandone il funzionamento.
Microbiologia Preston
13
Nell'ambito delle interazioni ospite-microrganismo troviamo invece:
- Contaminazione, in cui l'ospite entra in contatto con un microrganismo che
raggiunge le superfici cutanee o mucose.
- Colonizzazione, la presa di possesso di un distretto superficiale dell'ospite dove il
microrganismo trova condizioni idonee per il proprio insediamento.
- Infezione, che indica l'insediamento dei microrganismi nell'ospite che stabiliscono
un rapporto di equilibrio con le difese dell'ospite, generalmente senza causare danno,
ma lasciando una traccia nel sistema immunitario. Le infezioni sono definite acute
autolimitanti, croniche o prsistenti e latenti.
- Malattia, è la moltiplicazione dei microrganismi nell'ospite in grado di causare
danno.
Le infezioni possono essere distinte in endogene ed esogene: le infezioni endogene,
dove in seguito all'abnorme espansione di una o più specie presenti nella
popolazione microbica normale di un distretto dell'organismo (terapia antibiotica) o
determinate dal trasferimento di microrganismi presenti nella flora microbica di un
distretto corporeo in sedi diverse da quelle normalmente colonizzate; le infezioni
esogene, invece, sono quelle infezioni in cui il microrganismo patogeno proviene da
una sorgente esterna, quali materiali inanimati, animali infetti (zoonosi) o esseri
umani infetti.
La capacitò di indurre una malattia, o patogenicità, è la risultante di vari fattori e
meccanismi che permettono al microrganismo patogeno di invadere i tessuti di un
organismo e di moltiplicarvisi, alterando il funzionamento dell'organismo ospite
attraverso la produzione di una o più sostanze tossiche specifiche. E' caratterizzata da
fattori e meccanismi di virulenza, dalla carica batterica (numero iniziale di batteri
infettanti) e dallo stato di salute, in particolare lo stato immunitario, dell'ospite.
I microrganismi che colonizzano l'uomo sia per brevi periodi che in modo
permanente, in genere, non alterano le normali funzioni dell'ospite. La malattia si
instaura quando l'interazione tra microrganismo ed ospite induca un processo
patologico caratterizzato da un danno per l'ospite. Il processo patologico può
dipendere da prodotti e fattori microbici, come ad esempio un danno causato dalla
moltiplicazione batterica, produzione di enzimi e tossine, oppure da un'alterata
risposta immunitaria dell'ospite contro il microrganismo. La patogenicità è
Microbiologia Preston
14
colonizzazione batterica nell'ospite, che è la capacità di invadere e moltiplicarsi di un
batterio; questa è strettamente associata a una serie di meccanismi di virulenza che
permettono al microrganismo di I) Aderire alle cellule dell'ospite, II) Invadere i
tessuti dell'ospite, III) Resistere all'immunità innata, IV) Evadere l'immunità
adattativa, V) Competere per i nutrienti.
La maggior parte delle infezioni è causata da patogeni opportunisti facenti parte della
normale flora batterica apatogena dell'ingividuo (S.Aureus, E.Coli, Candida Albicans)
che scatenano malattia ad esempio quando si introducono in siti non protetti, tessuti
o circolo ematico, o a causa di terapie o immunodepressione.
La persistenza è la permanenza a tempo indefinito di un microrganismo nell'ospite,
in assenza di danni conclamati (latenza clinica). E' possibile che si verifichi una
riattivazione del processo infettivo, con il passaggio dallo stato di infezione a quello di
malattia. Ad esempio, il Mycobacterium Tuberculosis, a seguito di una infezione
primaria, può persistere per anni in maniera latente e silente nell'organismo
(polmone, linfonodi). La riattivazione e passaggio a malattia potranno avvenire per
una riduzione dell'immunità cellulo-mediata, evento comune con l'avanzare dell'età.
La fase di portatore è una forma di persistenza che può instaurarsi nell'organismo
ospite dopo il superamento di una malattia. Nella catena epidemiologica delle
malattie da infezione, una figura importante è quella del portatore sano, paziente che
ha superato la malattia, ma che non ha eliminato il microrganismo, il quale risiede in
specifici siti anatomici (ad esempio la localizzazione di Salmonella typhi nella colecisti
di portatori sani. Il portatore sano è in grado di trasmettere l'infezione, non
presentano i segni clinici della malattia.
- Tappe del processo infettivo
Sono 1) Ingresso, 2) Adesione, Colonizzazione e Invasione dei tessuti, 3) Elusione
delle Risposte Immunitarie e 4) Produzione del Danno (tossigenicità dei batteri)
1. Ingresso.
I batteri devono penetrare nel corpo umano affinché l'infezione abbia inizio,
superando i meccanismi di difesa naturale e le barriere, quali pelle, mucose, epitelio
ciliato e le secrezioni, che contengono sostanze ad azione antibatterica.
Microbiologia Preston
15
Le principali vie di accesso al corpo umano sono:
- Cute, che rappresenta un'eccellente barriera fisica, la cui integrità deve essere
compromessa per permettere l'ingresso, come tagli, ferite e così via.
- Congiuntiva, che rispetto alla cute può essere oltrepassata anche se integra per
contatto con acqua o liquidi contaminati, per deposizione meccanica di
microrganismi (mani, fomiti, strumenti diagnostici) e per microtraumi o ferite.
- Apparato Respiratorio, perché l'aria è il più comune veicolo di infezione per il
passaggio di microrganismi da soggetto a soggetto, per inalazione dei microrganismi
presenti nell'ambiente, immessi tramite goccioline di saliva eliminate con i colpi di
tosse o gli starnuti e per uso di attrezzature diagnostiche o terapeutiche contaminate.
E' la trasmissione oro-faringea caratteristica della tubercolosi, influenza e affezione
da virus respiratori.
- Apparato Digerente, di cui la più comune modalità di trasmissione è quella orofecale, attraverso la quale i microrganismi eliminati con le feci arrivano in un nuovo
ospite veicolati da mani, fomiti , acqua, alimenti, insetti (colera, tifo, epatite di tipo A).
- Apparato Genitourinario, attraverso i rapporti sessuali o per cateterismo.
- Una situazione a sé è rappresentata dalla trasmissione materno-fetale per via
transplancetare (trasmissione verticale) e per via ascendente a causa di lesioni delle
membrane fetali, e dalle infezioni contratte nel canale del parto.
2. Adesione, Colonizzazione e Invasione dei tessuti.
A tale scopo i batteri hanno sviluppato degli specifici meccanismi.
L'Adesione microbica alla superficie delle mucose dell'ospite aiuta i microrganismi a
stabilire una base attraverso la quale penetrare nei tessuti o invadere le cellule. Ad
esempio alcuni microrganismi aderiscono attraverso le fibrille, strutture sottili sulle
pareti batteriche che legano gli streptococchi alle cellule epiteliali umane. Altri
batteri, come le Enterobacteriaceae (ad esempio E.Coli), hanno organi specifici di
adesività, chiamati fimbrie o pili. Le fimbrie (di cui abbiamo già parlato nella
struttura dei batteri) offrono al microrganismo la possibilità di aderire a quasi tutte le
cellule umane, inclusi i neutrofili, le cellule epiteliali nel tratto GU, nel cavo orale e
nell'intestino. I recettori microbici sul tessuto dell'ospite, così come le adesine,
determinano se l'infezione si verificherà o meno. I recettori dell'ospite sono le
molecole o i ligandi a cui le adesine microbiche si legano per iniziare il processo di
Microbiologia Preston
16
colonizzazione; questi comprendono i residui glucidici del glicocalice e le proteine di
superficie quali la fibronectina, che facilitano l'adesione di alcuni microrganismi
Gram positivi (ad es. Stafilococchi). L'interazione del microrganismo si può realizzare,
oltre che con superfici cellulari , anche con proteine del siero o con polipeptidi della
matrice extracellulare, come ad esempio il legame del clumping factor di S.Aureus al
fibrinogeno che promuove l'adesione batterica ai trombi sulla superficie delle valvole
cardiache. Inoltre, è possibile che ceppi batterici possano aderire solo in particolari
situazioni patologiche che favoriscono l'esposizione di recettori cellulari, come nel
caso delle cellule epiteliali del tratto respiratorio le quali in condizioni fisiologiche
sono ricoperte da fibronectina, che rappresenta una barriera protettiva nei confronti
dei batteri Gram negativi. In alcune situazioni patologiche, come la fibrosi cistica, un
eccesso di enzimi proteolitici, presenti nelle secrezioni mucose, distrugge la barriera
di fibronectina esponendo in tal modo i recettori che vengono ora riconosciuti dalle
adesine presenti sulla parete di Gram negativi. Infine, in altri casi, l'adesione avviene
su superfici modificate dallo stesso microrganismo, come nel caso di ceppi di E.Coli
enteropatogeni (EPEC) che sintetizzano proteine che attivano le vie di trasduzione
del segnale nella cellula ospite, con risultato di fosforilare la proteina Hp 90. Tale
proteina modificata rappresenta ora il recettore per le adesine EPEC.
I microrganismi possono anche aderire a presidi medici, come i cateteri urinari e
quelli vascolari, protesi vascolari e materiale di sutura. L'adesione è facilitata dalla
ruvidità dei materiali, dalla composizione chimica e dall'idrofobicità. La capacità di
alcuni microrganismi di produrre il biofilm, facilita la colonizzazione di queste
superfici. Un biofilm è un'aggregazione complessa di microrganismi contraddistinta
dalla secrezione di una matrice adesiva e protettiva. La formazione di un biofilm
inizia con l'ancoraggio di microrganismi liberamente fluttuanti ad una specie. I primi
"cloni" aderiscono alla superficie inizialmente attraverso deboli e reversibili forze di
Van der Waals. Se i batteri colonizzatori non sono immediatamente separati dalla
superficie, possono ancorarsi più stabilmente utilizzando molecole di adesione
cellulare, come i pili. I primi colonizzatori facilitano l'arrivo di altre cellule, mettendo
a disposizione diversi siti di adesione cellulare, ed iniziano a costruire la matrice che
permette l'integrità del biofilm. Alcune specie non sono in grado di attaccarsi
autonomamente ad una superficie, ma spesso riescono ad ancorarsi alla matrice o ai
colonizzatori precedenti. Una volta che la colonizzazione ha avuto inizio, il biofilm
cresce tramite divisioni cellulari e integrazione di batteri esterni, anche di altre
specie. Un biofilm contenente differenti specie prende solitamente il nome di
Microbiologia Preston
17
consorzio batterico, ed è quantitativamente più frequente di biofilm composti da
singole specie, più rari e possibili solo a determinate condizioni. Ogni specie
presente nel consorzio svolge differenti funzioni metaboliche e presenta, solitamente,
diverso trofismo, richieste di ossigeno o nicchia ecologica. In questo modo, il
consorzio è più efficiente, senza che le diverse specie entrino in conflitto tra loro. Il
biofilm è consolidato e protetto da una matrice di composti polimerici escreti. La
matrice protegge le cellule all'interno, e facilita la comunicazione tramite segnali fisici
o chimici (quorum sensing). Un beneficio del biofilm è l'aumentata resistenza a
detergenti e antibiotici, dato che la densa matrice extracellulare e lo strato esterno
delle cellule protegge la parte interna della comunità. In alcuni casi, la resistenza agli
antibiotici può aumentare di mille volte. Il biofilm può comprendere una singola
specie microbica o più specie, e può formarsi su ampio range di superfici abiotiche o
biotiche. Nonostante i biofilm misti predominino in molti ambienti, quelli composti
da una singola specie hanno un forte interesse medico, in quanto causa di una
grande varietà di infezioni, dal momento che possono formarsi sulla superficie di
impianti medici. Pseudomanas aeruginosa è la specie più studiata tra i batteri Gram
negativi che formano niofilm singoli, ma anche altri microrgamismi sono produttori
di biofilm, come P.fluorescens, E.Coli e Vibrio cholerae. Mentre tra i Gram positivi
troviamo Staphylococcus epidermidis, S.aureus e gli enterococchi. I biofilm sono composti
principalmente da cellule microbiche e matrice extracellulare (EPS). La percentuale
di EPS si aggira tra il 50% ed il 90% ed è considerata la materia prima del biofilm.
Inoltre questa matrice può associarsi con ioni metallici, cationi divalenti, ad altre
macromolecole, come proteine, DNA e lipidi. A causa della sua elevata idratazione, la
matrice previene l'essiccamento di alcuni biofilm naturali. Inoltre, può contribuire
alla resistenza agli antibiotici, impedendo il trasporto di massa e la diffusione di
queste molecole attraverso il biofilm, probabilmente legando queste molecole
direttamente. Alcuni studi hanno mostrato che la stabilità della struttura del biofilm è
legata alla presenza di zuccheri neutri, polisaccaridi acidi ed aminozuccheri. Molti
biofilm hanno notevoli implicazioni in medicina. La placca dentale è un biofilm
prodotto dai batteri nel cavo orale, come Streptococcus sanguinis. Biofilm possono
crescere sulla superficie di impianti solidi nel corpo. Biofilm si propagano lungo tubi,
o fili impiantati, possono generare infezioni nei pazienti, Staphylococcus epidermidis
può produrre ad esempio biofilm su cateteri venosi. Pseudomonas aeruginosa e
S.aureus possono produrre biofilm sull'epitelio respiratorio dei polmoni,
complicando il decorso dei pazienti affetti da fibrosi cistica. Le cellule del SI, come i
macrofagi, non sono infatti in grado di contrastare la presenza di biofilm, ma solo di
Microbiologia Preston
18
generare un'infiammazione cronica. La terapia si basa su farmaci anti-infiammatori
(come alcuni FANS) e molecole disgreganti. Biofilm possono crescere anche su lenti a
contatto non sufficientemente pulite. Biofilm su pavimenti e superfici di lavoro
possono rendere difficile l'igiene nelle aree adibite alla preparazione del cibo.
Il sistema regolatore quorum sensing, che corrisponde a una modalità di
comunicazione tra i batteri, è basato sulla produzione di sostanze diffusibili, che
correlano direttamente con la densità cellulare in un determinato ambiente. Nei
batteri Gram negativi, la comunicazione cellulare avviene attraverso l'attività delle
molecole di omoserina lattone acetilata (AHLS). Queste piccole molecole segnale,
dette autoinduttori, sono rilasciate dalle cellule e si accumulano nelle colture, in
funzione della densità cellulare. Ad una densità di popolazione soglia, quorum, gli
AHLS accumulati possono interagire con i recettori situati sulla superficie della
cellula batterica ed indurre dei segnali intracellulari, in grado di regolare
l'espressione genica. Anche nei batteri Gram positivi è stato descritto il meccanismo
di comunicazione cellulare e di regolazione dei geni definito quorum sensing; è
diversa però, la natura degli autoinduttori: infatti in questo caso le molecole segnale
sono dei piccoli peptidi. Un esempio di interazione tra quorum sensing e biofilm
sono le infezioni croniche da Pseudomonas aeruginosa nella fibrosi cistica. I polmoni
della maggior parte dei pazienti con fibrosi cistica vengono facilmente colonizzati dal
batterio Pseudomonas aeruginosa. Un difetto genetico, tipico della fibrosi cistica, porta
alla perdita del canale transmembrana regolatore del cloro, canale presente nelle
membrane apicali delle cellule epiteliali delle vie respiratorie. Questo difetto
favorisce la colonizzazione dell'epitelio da parte di P.aeruginosa, che diventa causa di
infezione persistente, sostenuta dalla produzione di biofilm. All'interno del biofilm,
raggiunto il quorum, gli autoinduttori prodotti da Pseudomonas interagiscono con
attivatori trascrizionali (LasR e RhlR), che coordinano l'espressione di un pool di
geni, correlati alla virulenza. L'attivazione dei geni di virulenza induce la produzione
di fattori come alginato, proteasi, esotossina A, emolisine e pigmenti che facilitano la
persistenza del microrganismo nel polmone. E' stato anche descritto che ceppi di
Pseudomonas aeruginosa, mutati per alcuni fattori del sistema quorum sensing,
formano biofilm piatti e indifferenziati, mentre ceppi selvaggi formano biofilm con
strutture più complesse. Questa osservazione supporta l'idea che il quorum sensing
giochi un ruolo importante negli stadi di maturazione del biofilm, e delle sue
architetture, e questo lo rende un obiettivo molto interessante per lo sviluppo di
nuovi agenti antimicrobici.
Microbiologia Preston
19
Recentemente è stato dimostrato in modelli animali, che una sostanza sintetica, un
sale di furanone, è capace di agire sul sistema regolatore quorum sensing di
Pseudomonas aeruginosa, inibendo la produzione di fattori di virulenza e lo sviluppo
del biofilm, riducendo in tal persistenza dei batteri infettanti nell'organismo animale.
Si intravede, pertanto, una nuova strategia di cura nell'infezione broncopolmonare,
prevenendo la formazione di biofilm dannoso.
Numerosi geni, raggruppati in particolari e distinte zone del cromosoma batterico,
definite isole di patogenicità, determinano la produzione di tossine, di fimbrie che
favoriscono l'adesione alle cellule, di invasine per la penetrazione nelle cellule
bersaglio e di prodotti ad alto peso molecolare, necessari per la moltiplicazione
intracellulare, Altro fattore genomico di patogenicità è il Mar (multiple antibiotic
resistance), gruppo di geni che determina la possibilità di elaborare un maggior
numero di meccanismi di virulenza, finalizzati alla colonizzazione e all'invasione degli
organi, e alla predisposizione all'antibiotico.resistenza.
La colonizzazione, dipende dalla capacità che il patogeno ha di competere con
successo con la microflora dell'ospite, per poter acquisire le sostanze nutritive
necessarie per la crescita e la riproduzione.
Nell'invasione dei tessuti, i batteri possono penetrare nei tessuti profondi
dell'organismo ospite, attraverso due meccanismi principali:
1) La distruzione enzimatica dell'epitelio, che consente al batterio di raggiungere la
sottomucosa riccamente vascolarizzata. La capacità dei batteri di penetrare e
diffondere nei tessuti profondi è condizionata dalla produzione di esoenzimi, i cui
bersagli sono i componenti tissutali dell'ospite. Gli esoenzimi sono anche una
delle componenti del danno tissutale diretto indotto dai batteri. Questi esoenzimi
comprendono la Ialuronidasi (che idrolizza l'Acido Ialuronico, i mucopolisaccaridi
acidi presenti nella matrice acellulare del connettivo), Pneumolisima ( di
S.Pneumoniae, che distrugge le cellule epiteliali ciliate del polmone) e Mucinasi (di
H.Pylori, che degrada la mucosa gastrica).
2) L'induzione di meccanismi invasivi, che permettono al microrganismo di
penetrare direttamente all'interno delle cellule epiteliali. Diversi batteri, dopo la
fase di adesione, hanno sviluppato la capacità di essere internalizzati dalla cellula
ospite, nella quale si moltiplicano. Ad esempio , il riarrangiamento dei filamenti di
actina del citoscheletro, attraverso la microiniezione di invasine batteriche nel
Microbiologia Preston
20
citosol della cellula ospite, facilita la formazione di un vacuolo che internalizza il
batterio.
In vivo, in alcuni patogeni enterici, incapaci di penetrare l'epitelio attraverso la
superficie apicale, sono internalizzati da cellule epiteliali specializzate, le cellule M,
che rivestono le placche di Peyer, caratterizzate da uno strato di muco più sottile,
microvilli più piccoli e un meccanismo attivo di endocitosi e pinocitosi rispetto alle
cellule colonnari. Equivalenti delle cellule M, sono presenti in regioni linfatiche
organizzate, adiacenti alle superfici mucose, che includono l'intestino crasso,
nasofaringe e albero bronchiale. Shigella e Yersinia, sono capaci di invadere l'epitelio
sotto la superficie basolaterale e non attraverso quella apicale. Questo apparente
mistero, si spiega tenendo conto della capacità di tali microrganismi di essere
internalizzati nelle cellule M, che , a loro volta, consentono l'accesso al polo
basolaterale delle cellule adiacenti. Un'ulteriore spiegazione è fornita dalla possibilità
che leucociti polimorfonucleati (PMN), richiamati da molecole chemiotattiche, quali
IL-8, trasmigrino attraverso le tight junctions tra le cellule epiteliali e possano
inglobare i batteri, che riescono così a penetrare la barriera epiteliale raggiungendo
le superfici basolaterali delle cellule epiteliali polarizzate.
Una volta raggiunta la sottomucosa, il processo infettivo può rimanere localizzato nei
tessuti subepiteliali; oppure può, attraverso la Diffusione, superare le barriere
epiteliali, che comportano la penetrazione nei tessuti sub-epiteliali, e per alcuni
batteri, il raggiungimento dei linfonodi, il passaggio nel circolo linfatico, e quindi nel
circolo ematico, con lo sviluppo di una batteriemia ed evbentualmente di una
setticemia, con l'instaurarsi di uno stato settico.
La batteriemia, è quando batteri responsabili di processi morbosi localizzati
(polmoni, enteriti) invadono, anche se transitoriamente, il circolo ematico; non si
hanno segni clinici, anche se possono essere presenti sintomi e segni di infezione
locale, che rappresentano la fonte dell'immissione in circolo dei batteri.
La setticemia, invece, è quando si instaura una costante e massiccia presenza di
batteri e dei loro prodotti tossici in circolo, associata a segni di shock settico, ad
esempio tachicardia e ridotta pressione sanguigna; è spesso una complicanza di
un'infezione localizzata, ad esempio polmonite, meningite.
In ogni caso, la risposta infiammatoria dell'ospite e l'azione lesiva del batterio,
cooperano a determinare il danno tissutale che si manifesterà a livello clinico, con
Microbiologia Preston
21
una serie di segni e di sintomi di gravità differente, a seconda delle diverse
circostanze.
3. Elusione delle risposte immunitarie da parte dei batteri.
Nel processo di diffusione, il batterio, deve necessariamente sviluppare meccanismi
di evasione delle difese dell'ospite. L'azione patogena del batterio, e la capacità di
generare un processo infettivo, non può prescindere dalle difese microbiche, nei
confronti delle quali, i batteri hanno sviluppato vari meccanismi per sfuggire al
riconoscimento e all'uccisione delle cellule fagocitiche, e per inattivare o evadere il
sistema del complemento e anticorpale. Alcuni batteri, possono sottrarsi alla risposta
immunitaria, moltiplicandosi intercellularmente.
Sono presenti vari tipi di meccanismi di evasione delle difese dell'ospite che i batteri
hanno sviluppato nel corso dell'evoluzione. Ad esempio, la capsula polisaccaridica,
di cui sono dotati alcuni batteri patogeni, sottrae le componenti antigeniche del
batterio al riconoscimento dei SI, ostacola la fagocitosi e protegge il batterio dal
fagolisosoma, nel macrofago o nel leucocita. Queste proprietà, fanno della capsula,
un importante fattore di virulenza. Tra gli altri meccanismi di elusione della risposta
immunitaria troviamo, il cambiamento della struttura antigenica del batterio, la
produzione di enzimi o proteine contro le Ig, la distruzione dei fagociti, l'inibizione
della chemiotassi e della fagocitosi, l'elusione dal killing intracellulare attraverso
l'inibizione della fusione facolisosomica, la resistenza agli enzimi lisosomali e
l'adattamento alla replicazione intracitoplasmatica. Inoltre è importante
l'inattivazione del complemento, prevenendo la formazione della C3 convertasi, così
da non far produrre l'opsonina C3b; Neisseria meningitidis e S.Pyogenes producono
una capsula polisaccaridica, formata da Acido Sialico, che previene la lisi del
complesso di attacco alla membrana MAC; molti Gram negativi attaccano l'acido
sialico all'LPS e antigeni, per prevenire; S.pyogenes, produce proteasi che clivano C5a,
mentre Yersinia pestis, produce una proteina che degrada C3b.
Evasione dell'immunità umorale - Batteri aderenti alle superfici mucose, hanno
sviluppato strategie per eludere le difese specifiche umorali dell'ospite. Il ruolo
protettivo, svolto dalle IgA, a livello delle mucose, può essere annullato dalla
secrezione, da parte di alcuni patogeni, quali Neisseria meningitidis e gonorrhoeae,
Haemophilus influenzae, Streptococcus sanguis, Streptococcus Pneuomoniae e Proteus
mirabilis, di proteasi capaci di scindere IgA. Alcune metalloproteasi, secrete da
Pseudomonas Aeruginosa, degradano IgG e IgM.
Microbiologia Preston
22
Alcuni batteri, hanno la capacità di legare proteine dell'ospite, mascherando quindi i
loro antigeni di superficie, non più in grado di evocare una risposta immunitaria
(mascheramento antigenico). L'adesina FHA, di Bordetella pertussis, lega molecole
dell'ospite, quali eparina, glicoproteine, glicolipidi, Il batterio, può inoltre produrre
molecole di superficie, che mimano i normali costituenti dell'ospite (mimetismo
antigenico). Ad esempio Helicobacter pylori, esprime un carboidrato di superficie,
Lewis X, che riduce la rispsta delle cellule T, essendo riconosciuto come antigene self.
Neisseria mningitidis, gruppo B, esprime un antigene capsulare, che cross-reagisce con
proteine dell'ospite. L'acido ialuronico, di Streptococcus pyogenes, presenta
determinanti antigenici comuni all'acido ialuronico, presente nel tessuto
connettivale. Una frequente strategia, per evadere la risposta immunitaria umorale, è
rappresentata dalle variazioni antigeniche di alcune strutture, come pili, flagelli, LPS,
capsula, strato S, proteine della membrana esterna o di alcuni prodotti solubili, come
enzimi. Tali variazioni si osservano frequentemente, nei batteri che colonizzano le
superfici mucose, rispetto a quelli che crescono nel compartimento intracellulare.
Una delle più frequenti variazioni antigeniche riguarda i pili di Neisseria gonorrhoeae.
Nel cromosoma, Neisseria, presenta numerosi geni, che codificano per diversi pili.
Evidentemente, si verificano continuamente, dei riarraniamenti genetici, che
condizionano l'espressione fenotipica di geni silenti, e la comparsa di una diversa
pilina. Tali variazioni sono responsabili di infezioni recidivanti, che si osservano in
soggetti guariti da precedenti infezioni. Le variazioni antigeniche delle proteine della
membrana esterna di Borrelia recuuuuurrentis, condizionano il particolare
andamento della malattia (febbre ricorrente). Un meccanismo addizionale, per
eludere le difese anticorpali, è rappresentato dalla capacità di sintetizzare proteine
leganti le immunoglobuline: ad esempio la proteina A di Staphylococcus aureus,
proteina G e proteina H di Streptococchi e la proteina legante fibronectina (Fn) di
Streptococcus pyogenes: tali proteine leganti la regione Fc delle IgG rappresentano
esempi di un meccanismo che favorisce l'evasione immunitaria.
Elusione della fagocitosi e sopravvivenza intracellulare - Alcuni patogeni, riescono ad
evitare di essere ingeriti dai fagociti. Ad esempio, membri del genere Yersina,
compresa Yersina pestis, utilizzano nn sistema di secrezione di tipo III, per inoculare
nel fagocita, proteine che bloccano la polimerizzazione dell'actina, un componente
del citoscheletro indispensabile per l'ingestione e la formazione del fagosoma. Una
ulteriore strategia, è l'espressione di strutture di superficie, come la capsula o la
proteina M che circonda Streptococcus pyogenes, che impediscono la deposizione di
Microbiologia Preston
23
fattori opsonizzanti del complemento, inibendo la fagocitosi. Ciò avviene attraverso il
legame preferenziale con componenti del complemento, che ne inibiscono
l'attivazione, come il fattore H. Inoltre, la capsula ricopre alcuni PAMPs, che
sarebbero altrimenti riconoscibili da parte di PRRs solubili, o presenti sulla
superficie del fagocita.. I patogeni dotati di capsula evadono l'internalizzazione da
parte dei fagociti, e possono resistere all'interno di compartimenti corporei ricchi di
sostanze antibatteriche, come il sangue. Alcuni patogeni, non solo non ostacolano il
processo di ingestione, ma lo utilizzano per sopravvivere all'interno delle cellule
dell'opsite, macrofagi compresi. Ciò, è possibile, perché questi microrganismi
riescono a controllare il proprio destino all'interno del fagocita, spostandosi in
compartimenti favorevoli, creandone di nuovi. Esistono due strategie principali:
evasione da vacuoli fagocitari e replicazione all'interno di vacuoli modificati. Esempi
della prima strategia, sono patogeni come Shigella o Listeria, che forano la membrana
del fagosoma, sfuggendo nel citosol, dove si replicano per poi diffondersi alle cellule
adiacenti. Spesso, i patogeni intracelulari, persistono in vari tipi di vacuoli modificati.
E' il caso di membri del genere Mycobacterium, Salmonella, Chlamydia, Brucella,
Leishmania e Toxoplasma. Queste specie, adottano strategie differenti per generare un
ambiente favorevole alla propria replicazione. Ad esempio, i micobatteri impediscono
l'acidificazione del fagosoma, che non può quindi interagire con endosomi tardivi, o
con i lisosomi. Altri patogeni, come Chlamydia, intercettano le vescicole esocitiche,
prima che queste riversino all'esterno i propri contenuti secretori. Infine, Toxoplasma
gondii, Brucella e Legionella pneumophila, interagiscono con il reticolo endoplasmatico,
un ambiente ideale per la propria replicazione. L'IFN-γ riesce a sovvertire le strategie
evasive dei patogeni intracellulari, conferendo ai macrofagi un'amplificata capacità di
eliminazione. Questa citochina si lega a specifici recettori, presenti sul fagocita,
inducendo un'aumentata espressione di diversi geni. I più importanti, sono quelli
che codificano per il complesso NADPH-ossidasi, per la NO sintetasi inducibile
(iNOS), per NRAMP1 (natural-resistance-associated-macrophage protein1), per IDO
(indoleamine 2,3-dioxygenase) e per la famiglia delle p47GTPasi. E' stato già descritto
il ruolo di questi prodotti come fattori microbicidi (NADPH ossidasi e iNOS) o
nutriprivi (NRAMP ed IDO). Le p47GTPasi hanno destato molto interesse, in quanto
regolano la maturazione del fagosoma, e la fusione dei lisosomi con i fagosomi.
Queste funzioni dipendono dalla localizzazione delle varie p47GTPasi in
compartimenti cellulari diversi e dalla loro capacità di controllare il trasporto di
questi vacuoli e di regolare fattori che promuovono i processi di fusione e di
maturazione del fagosoma.
Microbiologia Preston
24
La capacitò di molti batteri di indurre malattia, è correlata alla produzione di una
capsula o di uno strato mucoide, che protegge l'agente infettivo dalla fagocitosi. Pur
non essendo in genere un potente antigene, l'ospite monta una risposta anticorpale
contro la capsula, che favorisce il processo di opsonizzazione e di lisi mediata dal
complemento. Un caso particolare è rappresentato dall'Haemophilus influenzae di tipo
B (Hib). Il motivo per cui le patologie meningee da Hib sono particolarmente gravi
nei primi anni di vita, risiede nella struttura polisaccaridica della capsula, contro la
quale produce un particolare tipo di IgG, le IgG di tipo 2. Il bambino di età inferiore
a 24 mesi, per una fisiologica immaturità del proprio sistema immunitario, produce
una quantità estremamente bassa di IgG di tipo 2, per cui non è in grado di
difendersi da patologie sostenute da batteri provvisti di capsula polisaccaridica.
Esistono altre strategie dei microrganismi per contrastare le difese aspecifiche
dell'opsite, come inibizione della chemiotassi dei polimorfonucleati e macrofagi
( emolisime di S.aureus e S.pyogenes), uccisione dei fagociti (B.pertussis causa apoptosi
dei macrofagi e le emolisine), mancato inglobamento da parte dei fagociti (come le
fimbrie di Neisseria, la proteina M di S.pyogenes e capsula di S.pneuomoniae), inibizione
della fusione del fagosoma con i lisosomi (come nel Mycobacterium tuberculosis,
Bordetella perutssis che causano aumento intracellulare di cAMP), fuoriuscita del
microrganismo dal fagosoma (ad esempio in Listeria monocytogenes), moltiplicazione
nei fagociti ( ad esempio Chlamydia).
I batteri, inoltre, alterano la presentazione dell'antigene nella risposta cellulomediata.
TOSSIGENICITA' DEI BATTERI
Il danno, il quale sfocia nella malattia, è il risultato di una serie di eventi diretti,
indiretti e su base immunitaria. Il danno diretto avviene a causa del metabolismo
batterico, enzimi batterici e relative tossine; il danno indiretto, è causato da
infiammazione, attivazione del complemento, produzione delle citochine e induzione
dell'appoptosi, quindi di quei meccanismi che vanno a difendere il corpo, ma che
portano dei danni collaterali e quindi indirettamente causano danno; il danno su
base immunitaria, avviene ad opera di immunocomplessi, reazioni cellulo-mediate,
superantigeni e autoimmunità. In ogni caso, la risposta infiammatoria dell'ospite e
l'azione lesiva del batterio, cooperano a determinare il danno tissutale che si
manifesterà a livello clinico con una serie di segni e sintomi di gravità differente, a
seconda delle diverse circostanze.
Microbiologia Preston
25
I principali enzimi batterici sono:
-Aerobactina: sideroforo, che veicola il ferro all'interno del batterio, dopo essere stata
prodotta e secreta dallo stesso batterio.
-Catalasi: che converte il perossido di idrogeno ad acqua e ossigeno.
-Coagulasi: che causa la formazione di fibrina, che può depositarsi sulla superficie del
microrganismo ed inibire la fagocitosi.
-Collagenasi: che digerisce il collagene del t.connettivo.
-Emolisine: che lisano i globuli rossi e le altre cellule del sangue.
-Fosfolipasi: che lisano le cellule del sangue.
-Ialuronidasi: che scinde la lecitina, componente delle membrane citoplasmatiche.
-Streptochinasi o fibrinolisina: che trasforma il plasminogeno in plasmina, che
digerisce la fibriba.
-Superossido-dismutasi: che catalizza la conversione del superossido in perossido di
H ed ossigeno molecolare.
-Elastasi: che distrugge l'elastina.
-Leucocidina: che causa la lisi dei globuli bianchi.
Il metabolismo batterico, specialmente la fermentazione, produce acidi, gas e altre
sostanze dannose per i tessuti. Inoltre, molti batteri rilasciano enzimi degradativi per
danneggiare i tessuti e procurare così il nutrimento per la loro crescita e promuovere
la loro diffusione. Ad esempio, clostridium perfringens, è parte della normale flora
del tratto GI, ma si comporta come un patogeno opportunista, che può infettare i
tessuti privi di ossigeno e causare una gangrena gassosa. Questi batteri anaerobici,
producono enzimi, tossine, acidi e gas, che danneggiano i tessuti.
Le tossine sono molecole prodotte dai batteri, che danneggiano direttamenteo i
tessuti, o innescano attività biologiche distruttive. I microrganismi possono liberare
tossine che interagiscono con cellule adiacenti o distanti. Queste tossine possono
aggravare il processo della malattia, o esserne totalmente responsabili (botulismo,
tetano, colera, difterite). La maggior parte delle tossine, si lega a recettori specifici
delle cellule da colpire. Ad eccezione delle tossine preformate, responsabili delle
Microbiologia Preston
26
tossicoinfezioni alimentari, le tossine vengono prodotte dai microrganismi durante il
decorso in un'infezione locale o sistemica. Includono enzimi citolitici e proteine che
legano un recettore i quali alterano la funzione o uccidono la cellula. Il gene della
tossina è codificato da un plasmide o da un fago lisogeno.
Le esotossine, sono proteine dimeriche, formate dalle componenti A e B, prodotte dai
batteri gram positivi e gram negativi, e rilasciate nell'ambiente esterno. Il legame
della subunità B (binding) a specifici recettori sulla superficie cellulare, consente il
trasferimento della porzione tossica A (attiva) all'interno della cellula dove viene
introdotto il danno cellulare.
In base al meccanismo di azione, possiamo classificare le esotossime in:
- Tossine emolitiche (emolisine e citolisine), enzimi che producono pori nella
membrana cellulare, digeriscono materiali cellulari, alterano la composizione della
membrana.
- Tossine che alterano il contenuto intracellulare di AMP ciclico; l'adenilato ciclasi
converte l'ATP in AMP ciclico cAMP, secondo messaggero in grado di indurre attività
di diversi geni e funzioni cellulari; la funzione dell'enzima è regolata da due proteine
G, quali GS o proteina G stimolatoria, che attiva l'adenilato ciclasi, e GI, o proteina G
inibitoria, che inibisce l'adenilato ciclasi; la GS è bersaglio della tossina colerica, che
la immobilizza nello stato attivato, con aumento della quantità intracellulare di cAMP;
la GI è bersaglio della tossina della pertosse, in cui non è più in gradi di inibire
l'adenilato ciclasi, con sonseguente aumento della quantità citoplasmatica di cAMP.
La tossina colerica che nelle cellule della mucosa intestinale induce un accumulo di
cAMP con una ipersecrezione di elettroliti ed acqua che produce la profusa diarrea
acquosa caratteristica del colera; ancora la tossina del Bacillus anthracis, causa
dell'antrace, che nella sua forma più letale (antrace polmonare), causa l'aumento di
cAMP nelle cellule bersaglio, con edema localizzato.
- Tossine che inibiscono la sintesi proteica cellulare, come ad esempio la tossina
difterica, che nelle cellule epiteliali della faringe blocca la sintesi proteica e causa la
morte cellulare.
- Tossine neurotrope, che interferiscono con il rilascio dei neurotrasmettitori, come la
tossina tetanica, che causa una diminuzione nel rilascio dei neurotrasmettitori dai
neuroni inibitori che determina la paralisi spastica, caratteristica del tetano, e la
Microbiologia Preston
27
tossina botulinica, che causa la diminuzione del rilascio di acetilcolina nelle sinapsi
periferiche, con paralisi flaccida, caratteristica del botulismo alimentare.
Le anatossine o tossoidi, sono esotossine alle quali è stato artificialmente eliminato il
potere tossico, preservando le proprietà antigeniche. Sono i costituendi dei principali
vaccini antibatterici (antitetanico, andidifterico e antipertosse).
L'endotossina è il lipopolisaccaride LPS, una delle strutture che costituiscono il
rivestimento esterno dei batteri gram negativi. E' presente e prodotta per lisi della
cellula batterica solo dai gram negativi. I batteri gram negativi rilasciano
l'endotossina durante l'infezione. Quest'ultima, si lega a specifici recettori presenti
sulla superficie delle cellule del sistema immunitario, stimolando così la produzione
di citochine pro-infiammatorie, che alimentano la reazione flogistica acuta. Nel caso
di sepsi da Gram negativi, i livelli di endotossina nel sangue possono raggiungere
valori molto alti, scatenando una risposta infiammatoria eccessiva, non più protettiva,
ma addirittura dannosa, che conduce allo shock settico e nei casi più gravi, al
decesso. I meccanismi di azione delle endotissine sono vari, come la liberazione
massiccia di alcune citochine, l'interazione con gli endoteli vascolari, l'attivazione del
complemento per la via alternativa, la cascata di eventi legati alla coagulazione del
sangue, la produzione di mediatori come TNF ed IL-1 e l'aumento della permeabilità
vascolare, vasodilatazione, ipotensione, shock emodinamico e aumento del
catabolismo proteico (cachessia).
Esotossine ed Endotossine mostrano notevoli diversità: ad esempio le esotossine
sono di natura proteica, termolabili, neutralizzabili da anticorpi, vengono prodotte sia
da gram positivi che negativi, hanno un profilo di azione molto diferenziato, hanno
un'estrema potenza ed alcune sono attive per ingestione; le endotossine, invece, sono
di natura lipopolisaccaridica, termostabili, prodotte solo dai gram negativi, non sono
neutralizzabili da anticorpi, hanno dei profili di azione poco differenziati, sono meno
potenti delle esotossine e sono inattive per ingestione.
La sepsi indica la risposta infiammatoria sistemica (SYRS, Systemic Inflammatory
Response Syndrome) in organi o apparati (polmoni, addome, vie urinarie), sostenuta
da gravi infezioni, principalmente da gram negativi. In misura minore, il
peptidoglicano e prodotti di degradazioni, quali acidi tecoici e lipotecoici, dei battteri
gram positivi e componenti strutturali di miceti, possono stimolare una risposta
pirogena della fase acuta endotossino-simile. La sepsi è caratterizzata dalla massiccia
produzione di elevate quantità di fattori infiammatori (PG,TNF, IL-1, IL-6, IL-8 e
Microbiologia Preston
28
IL-12). Le citochine pro-infiammatorie innescano l'alterazione degli endoteli
vascolari, con collasso ipotensivo (sepsi ipotensiva), la cascata della coagulazione con
la formazione di diffuse coagulazioni intravasali (DIC) ed estesi fatti emorragici, con
la grave compromissione di diversi organi (shock settico) ed effetti fatali per il
paziente.
Shock Settico è un termine utilizzato per raggruppare una serie di eventi
fisiopatologici, che portano al collasso del sistema circolatorio, causando il quadro
clinico della sindrome da insufficienza multipla di organi (MOFS), che può provocare
la morte del paziente. Lo shock settico è spesso causato da bacilli gram negativi,
acquisiti in ospedale e si manifesta comunemente in pazienti immunocompromessi e
in quelli con patologie croniche. In circa 1/3 dei pazienti, tuttavia, è causato da cocchi
gram positivi e dalla Candida. Lo shock causato da tossine stafilococciche è
denominato shock tossico, una condizione incontrata più frequentemente nelle
ragazze. Inizialmente si verifica vasodilatazione della arterie e delle arteriole, che
fanno diminuire la resistenza arteriosa periferica, con una gettata cardiaca normale o
aumentata, anche se la frazione di eiezione può risultare diminuita all'aumentare del
battito cardiaco. Successivamente, la gittata cardiaca diminuisce, e le resistenze
periferiche possono aumentare. Malgrado una gittata cardiaca aumentata, il flusso
sanguigno verso i capillari di scambio risulta diminuito, come diminuito è il rilascio
dei substrati vitali, in particolare O2 e la rimozione della CO2 e dei prodotti del
catabolismo. Questa condizione di diminuita perfusione dell'organo colpisce
particolarmente, reni e cervello, con conseguente danneggiamento di uno o più
organi viscerali. Alla fine, la gittata cardiaca diminuisce, e compare il quadro tipico
dello shock. Fattori predisponenti allo shock settico comprendono il diabete mellito,
cirrosi, stati leucopenici, specialmente quelli associati al tratto urinario, biliare o GI,
presidi invasivi, inclusi i cateteri, i tubi di drenaggio e altri corpi estranei. Inoltre,
costituiscono fattori predisponenti una precedente terapia con antibiotici,
corticosteroidi o interventi strumentali per la ventilazione. Lo shock settico si verifica
più spesso nei neonati, nei pazienti con più di 35 anni, nelle donne in gravidanza e
nelle persone con un grave grado di immunocompressione, indotto da patologie di
base o nei casi di complicanze iatrogene.
Microbiologia Preston
29
I Superantigeni, sono proteine batteriche ad azione tossino-simile, che attivano i
linfociti T CD4+, in genere senza presenza di Ag specifico, legandosi
contemporaneamente sia al TCR presente sui linfociti e all'MHC II presente sulle
cellule presentanti l'antigene. Il meccanismo d'azione è quindi aspecifico, che stimola
un rilascio incontrollato di interleuchine, con danni cellulari irreversibili ed
alterazioni nella risposta immunitaria. I superantigeni attivano un grande numero di
linfociti T contemporaneamente ed inducono il rilascio di grandi quantità di
interleuchine (tempesta citochinica), quali IL-1, TNF e IL-2, causando una risposta
simile a quella autoimmunitaria, rischiosa per la vita del paziente. Mentre un antigene
stimola un clone di linfociti Ag-specifico, il superantigene può quindi indurre uno
stato di attivazione di più cloni linfocitari, inducendo nel linfocita uno stato cronico
di non responsività o anergia (mancata responsività dopo una stimolazione
antigenica- che viene causato quando ad esempio manca il segnale costimolatorio),
che può portare ad apoptosi con conseguente perdita di un notevole numero di
linfociti T (specifici) e ad una deficienza della capacità di risposta immunitaria. I
superantigeni sono la tossina dello shock tossico di S.Aureus, le enterotossine
stafilococciche dello Staphylococcus Aureus, le tossine eritrogeniche A e C dello
S.pyogenes (tossine pirogeniche), le Sta (heat-stable toxins) di ceppi enterotossigenici
di Escherichia Coli (ETEC); superantigeni associati a Streptococcus Pyogenes possono
essere responsabili della psoriasi e antigeni di Mycobacterium tuberculosis, del virus
rabbico e di HIV possono essere considerati superantigeni.
MODALITA' DI TRASMISSIONE DEGLI AGENTI INFETTIVI
1) Ingestione di alimenti o bevande contaminate: Le malattie infettive che si
trasmettono per via alimentare, sono quelle nelle quali l'agente infettante viene
eliminato con le feci e, in presenza di cattive condizioni igieniche, riesce a
raggiungere il cibo, realizzando quel circuito di infezione che prende il nome di
trasmissione oro.fecale (colera, tifo, epatite di tipo A). Le intossicazioni alimentari,
invece, fanno seguito all'ingestione di cibi contaminati da batteri che si
moltiplicano negli alimenti, producendo la tossina: quindi le patologie sono
causate dall'ingestione di cibo contaminato dalla tossina, come ad esempio nel
botulismo o nelle patologie dovute alle tossine prodotte dallo Staphylococcus
aureus o dal Clostridium perfringens.
Microbiologia Preston
30
2) Via Aerea: Attraverso l'inalazione di microrganismi presenti nell'aria, su polveri o
immessi tramite goccioline di saliva eliminate con i colpi di tosse o gli starnuti. E'
la trasmissione oro-faringea caratteristica della tubercolosi, pertosse, influenza e
affezioni sostenute da virus respiratori.
3) Contatto diretto Cutaneo-Mucoso, Contagio Sessuale: Per un certo numero di
microrganismi, che penetrano attraverso la cute o le mucose esposte, la
trasmissione tra soggetto ammalato a soggetto sano si realizza per contatto diretto,
come ad esempio nelle malattie veneree (sifilide e gonorrea) e diverse infezioni
cutanee, causate da Staphylococcus aureus, da Bacillus Anthracis, etc. . In questa
categoria, si possono annoverare le infezioni che si instaurano al momento del
passaggio attraverso il canale del parto (infezioni perinatali, come in Neisseria
Gonorrhoeae).
4) Trasmissione attraverso artropodi vettori: Infezione di tessuti onel sangue
circolante, da parte di microrganismi patogeni o virus veicolati da un animale
infetto (rabbia, peste) o in seguito a puntura di un artropode ematofogo che si sia
nutrito di sangue di un soggetto infetto (malaria). I vettori più comuni sono zecche,
pulci, mosche, zanzare etc. .
5) Trasmissione per Contaminazione di oggetti: La contaminazione di biancheria,
utensili, aghi, siringhe, strumenti medici, favorisce la trasmissione di
microrganismi, responsabili di patologie cutanee, respiratorie, urinarie e
intestinali. Tale modalità di trasmissione è particolarmente attiva in ambito
ospedaliero (infezioni nosocomiali), dove dispositivi sanitari, quali cateteri, tubi
endotracheali, apparecchi per ventilazione meccanica, tubi da dialisi etc.,
rappresentano una importante fonte di contagio.
Inoltre vanno ricordate la trasmissione trans-placentare, che comporta il
trasferimento dell'agente infettivo dalla madre al feto attraverso la placenta, e la
trasmissione per ferite accidentali, chirurgiche, graffi, morsi con infezioni sostenute
da Clostridium tetani, Escherichia Coli e Staphylococcus Aureus.
Microbiologia Preston
31
Farmaci Antibatterici
Le caratteristiche ideali di un farmaco sono: in primis, quella di essere ad ampio
spettro, lo spettro antibatterico è l'intervallo di attività di un antimicrobico contro i
batteri, quindi un antibiotico ad ampio spettro può inibire numerosi batteri gram
positivi e negativi, mentre uno antibiotico a spettro ristretto è attivo solamente contro
un numero limitato di batteri, o positivi, o negativi; che non sia tossico per l'ospite e
che eviti di causare dei danni collaterali; che non sia allergico; che sia inattivo contro
la flora normale dell'ospite; che sia capace di penetrare nel sito di infezione; e che
abbia una bassa frequenza di induzione di una resistenza. Il farmaco può essere
somministrato da solo, oppure in associazione ad altri farmaci e la potenza totale può
variare; la combinazione di antibiotici può essere utilizzata per ampliare lo spettro
antibatterico nella terapia empirica o per il trattamento di infezioni polimicrobiche,
per prevenire l'insorgenza di microrganismi resistenti durante la terapia, e per
ottenere un effetto antibatterico sinergico. Un farmaco può essere addizionale, se la
somma dei due farmaci ad esempio come efficacia è 2, come tra Penicillina e
Vancomicina; può essere anche 0 la somma ed allora si parlerà di farmaco
antagonista; ancora due farmaci possono agire in modo sinergico, se la somma dei
due farmaci per efficacia è 3 ad esempio, quindi viene amplificata al massimo
l'efficacia e la combinazione quindi aumenta moltissimo il rapporto di efficienza.
L'attività batteriostatica è il livello di attività che inibisce la crescita di un
microrganismo. E' determinato, in vitro, saggiando una concentrazione standard di
batteri con differenti diluizioni di antibiotico. L'attività battericida è il livello di
attività antibatterica che uccide il batterio in esame. E' determinato, in vitro,
esponendo una concentrazione standard di batteri a differenti diluizioni
dell'antibiotico. La concentrazione più bassa capace di uccidere il 99,9% della
popolazione è definita minima concentrazione battericida (MBC).
Gli antibiotici hanno diversi meccanismi di azione, che comprendono l'inibizione
della sintesi della parete cellulare, l'inibizione della sintesi proteica e l'inibizione
della sintesi degli acidi nucleici.
Microbiologia Preston
32
- 1) Inibizione della sintesi della parete cellulare
Di questa categoria fanno parte gli antibiotici β-lattamici, quali penicilline,
cefalosporine, cefamicine, carbapenemici, monobattamici e inibitori della β-lattamasi
(acido clavulanico). Questi antibiotici sono così chiamati, perché hanno in comune
una struttura formata da un anello β-lattamico; gli altri antibiotici che non
possiedono questo anello, ma interferiscono con la sintesi della parete batterica, sono
la Vancomicina, Bacitracina, e altri farmaci antimicobatterici (i micobatteri infatti
hanno una struttura esterna nettamente differente dai batteri gram negativi e
positivi), quali isoniazide, etambutolo, cicloserina ed etionammide.
La maggior parte degli antibiotici, attivi sulla parete batterica, sono classificati come
β-lattamici, che agiscono come battericidi, inducendo la morte della cellula batterica,
attraverso il blocco di specifici enzimi, detti proteine leganti la penicillina (PBP),
implicati nella sintesi del peptidoglicano, componente strutturale della parete delle
cellule batteriche. La reazione di formazione di legami crociati è una
transpeptidizzazione, in cui i ponti pentapeptidici e i ponti di pentaglicina, sono
catalizzati da transpeptidasi, transglicosidasi, endopeptidasi e carbossipeptidasi,
enzimi definiti PBP. Le PBP sono quindi i bersagli per la penicillina e altri antibiotici
β-lattamici ed i batteri penicillino-resistenti, vanno a modificare la struttura della
PBP. PBP-1A e PBP-1B, intervengono nei processi di accrescimento e l'inibizione
dell'attività di questi enzimi determina una rapida lisi batterica. L'inibizione di PBP-2
porta alla formazione di corpi batterici sferici, facilmente lisabili. PBP-3 è interessata
alla formazione del setto, per cui l'inibizione di questo enzima produce strutture
filamentose e lisi. PBP-4 non rappresenta un enzima essenziale, in quanto l'attività
endopeptidasica, che consiste nella rottura del legame D-alaninmesodiaminopimelico del peptidoglicano, può essere sostituita da altre PBPs. PBP-4
non svolge solo funzione idrolitica, ma in certe condizioni svolge attività
transpeptidasica, catalizzando la formazione dei legami crociati tra le catene di
peptidoglicano. PBP-5 e PBP-6, catalizzano il processo di rimozione della D-alanina
terminale della catene pentapeptidiche dai filamenti di peptidoglicano neoformati. I
batteri sviluppano resistenza agli antibiotici β-lattamici mediante tre meccanismi,
quali il blocco dell'interazione tra l'antibiotico e il PBP bersaglio, l'inibizione del
legame dell'antibiotico al PBP e l'idrolisi dell'antibiotico da parte della β-lattamasi
(che inattivano gli antibiotici β-lattamici).
Microbiologia Preston
33
- Penicilline
Sono degli antibiotici molto efficaci e con una tossicità bassa. Riconosciamo tre
gruppi di penicilline: penicilline naturali, penicilline penicillinasi-resistenti e
penicilline ad ampio spettro.
Le cefalosporine e le cefamicine, assieme a monobattamici e carbapenemici e
penicilline, agiscono legando le PBP e gli enzimi responsabili della sintesi del
peptidoglicano
Le penicilline naturali comprendono la penicillina G (Benzilpenicillina) e la
penicillina V (Fenossimetil penicillina). Queste sono attive contro gli streptococchi β/
emolitici, meningococchi e anaerobi gram positivi; hanno un'azione limitata contro
gli stafilococchi e bacilli gram negativi.
Le penicilline resistenti alle penicillinasi, come Meticillina sono utilizzate per trattare
infezioni causate da stafilococchi sensibili, sono come le naturali, ma sono attive
contro gli stafilococchi (di cui le naturali sono limitate).
Le penicilline ad ampio spettro sono come le naturali, ma sono attive contro i batteri
gram negativi (di cui le naturali sono limitate).
Gli inibitori di β-lattamaasi, come l'Acido clavulanico (Sulbactam), vengono
combinati con penicilline (ampicillina, amoxicillina, piperacillina), per trattare batteri
che producono β-lattamasi. Gli inibitori legano e inattivano le β-lattamasi e
permettono alle penicilline di entrare nella cellula batterica, senza subire la
degradazione enzimatica.
-Vancomicina
Altera la sintesi della parete cellulare nei batteri gram positivi in crescita. Và ad
interagire con la D-alanina-D-alanina terminale delle catene laterali pentapeptidiche, interferendo con la formazione dei ponti. E' utilizzata per il trattamento
di infezioni causate da stafilococchi oxacillino-resistenti e altri batteri gram positivi
resistenti ai β-lattamici. E' però inattiva sui gram negativi, perché questa è una
molecola grande, che non passa la membrana esterna dei gram negativi e raggiungere
così il peptidoglicano. Alcuni microrganismi sono intrinsecamente resistenti alla
Vancomicina, come alcune specie di Enterococchi, quali Enterococcus gallinarum,
Enterococcus casseliflavus, ma anche Lactobacillus etc. ; alcuni batteri hanno evoluto
Microbiologia Preston
34
una resistenza alla Vancomicina, quali Enterocuccus faecalis ed Enterococcus faecium. La
resistenza alla Vancomicina avviene perché i batteri sostituiscono una D-alanina con
un D-lattato, che non lega l'antibiotico.
- Bacitracina
Altera il trasporto dei precursori del peptidoglicano. Viene utilizzata per il
trattamento delle infezioni cutanee causate da batteri gram positivi. I batteri gram
negativi sono resistenti a questo farmaco. Inibisce la sintesi della parete cellulare,
interferendo con la defosforilazione del lipide trasportatore dei precursori del
peptidoglicano. E' una miscela di polipeptidi per uso topico (creme, unguenti, spray).
- Polimixine (non inibiscono la sintesi, ma alterano la permeabilità della membrana)
Le polimixine sono antibiotici che si inseriscono nelle membrane batteriche come
detergenti, che interagendo con i lipopolisaccaridi e i fosfolipidi nella membrana
esterna, causano un aumento della permeabilità della cellula e infine morte cellulare.
Le polimixine B ed E, possono causare gravi fenomeni di nefrotossicità, per questo
viene utilizzato questo antibiotico essenzialmente al trattamento esterno di infezioni
localizzate, come otite esterna, infezioni oculari e cutanee. Sono più attivi contro i
batteri gram negativi, perché i gram positivi non hanno una membrana esterna.
I Micobatteri hanno una parete cellulare particolare, diversa dai batteri gram positivi
e negativi; una struttura complessa di natura polisaccaridica e proteica, i cui lipidi
complessati con le cere, formate dagli acidi grassi a lunga catena (acidi micolici),
hanno una potente azione adiuvante la patogenicità. Lipidi con acidi micolici sono
presenti anche nei Corinebatteri e Nocardia. Per questo motivo serviranno degli
antibiotici diversi, da quelli utilizzati per i Gram positivi e negativi. Antibiotici attivi
sulla parete cellulare, utilizzati per il trattamento da infezioni di micobatteri.
- Isoniazide e etionamide: influenzano la sintesi dell'acido micolico.
- Etambutolo: impedisce la sintesi dell'arabinogalattano.
- Cicloserina: altera i legami crociati degli strati di peptidoglicano; inibisce due
enzimi, la D-alanina sintetasi e l'alanina racemasi, che catalizzano la sintesi della
parete.
La resistenza a questi antibiotici deriva dalla ridotta assunzione dei farmaci e
dall'alterazione dei siti bersaglio.
Microbiologia Preston
35
- 2) Inibizione della sintesi proteica
Gli inibitori della sintesi proteica sono gli Amminoglicosidi, Tetracicline,
Cloramfenicolo, Macrolidi e Clindamicina.
- Amminoglicosidi
Sono la prima scelta per infezioni da bacilli di gram negativi. Streptomicina,
Kanamicina, Gentamicina, Tobramicina e Amikacina. Si legano irreversibilmente alle
proteine 30S dei ribosomi ed esplicano un'azione battericida mediante due effetti: la
produzione di ptoreine aberranti e l'interruzione della sintesi per rilascio prematuro
di mRNA; sono Battericidi. I principali meccanismi di resistenza agli amminoglicosidi
sono, la mutazione del sito legante il ribosoma, la ridotta penetrazione nella cellula
batterica e la modificazione enzimatica dell'antibiotico mediante fosforilazione,
adenilazione o acetilazione dei gruppi amminici e idrossilici.
- Tetracicline
Tetraciclina, Doxiciclina, Minociclina. Sono antibiotici ad ampio spettro contro
batteri gram positivi ed alcuni gram negativi; si legano alle subunità ribosomiali 30S e
bloccando in tal modo il legame dell'aminoacil-RNA transfer (tRNA) al complesso
ribosoma 30S-mRNA. Sono efficaci nel trattamento delle infezioni provocate da
Chlamydia, Rickettsia e Mycoplasma. I principali meccanismi di resistenza alle
tetracicline sono, la diminuita penetrazione dell'antibiotico, l'efflusso attivo (pompe
di efflusso), le alterazioni del sito bersaglio ribosomale, con produzione di fattori
simili, che legano l'antibiotico, senza che la sintesi proteica sia alterata ed infine, la
modificazione enzimatica dell'antibiotico.
- Cloramfenicolo
Ha un ampio spettro, ma viene utilizzato solo nel trattamento della febbre tifoide,
perché tossico per le cellule del midollo, fino a produrre anemia aplastica. Hanno un
effetto batteriostatico con l'inibizione della sintesi proteica, attraverso il legame della
subunità ribosomale 50S e blocco dell'allungamento del peptide. Il principale
meccanismo di resistenza al cloramfenicolo, è l'alterazione del legame alla subunità
50S, dopo acetilazione del gruppo ossidrilico della molecola antibiotica.
Microbiologia Preston
36
- Macrolidi
L'Eritromicina è il macrolide di riferimento. Eritromicina, Azitromicina e
Claritromicina; questa classe di antibiotici presenta nella struttura, un anello lattone
macrociclico legato a due zuccheri, desosamina e cladinosio (la modificazione della
struttura del macrolide ha portato alla formazione dell'azitromicina e della
claritromicina). Sono ad ampio spettro, sono attivi contro i batteri gram positivi e
alcuni gram negativi (Neisseria, Legionella, Treponema, Mycoplasma e Chlamydia). I
macrolidi si legano, reversibilmente, al ribosoma 50S e bloccano l'allungamento del
polipeptide. Possiedono un'azione batteriostatica. I principali meccanismi di
resistenza ai macrolidi sono, la metilazione dell'RNA ribosomale 23S, che impedisce il
legame dell'antibiotico, la distruzione enzimatica dell'anello lattonico e l'efflusso
attivo dell'antibiotico.
- 3) Inibizione della sintesi degli acidi nucleici (DNA e RNA)
Di questa categoria, i più importanti sono i Chinoloni (DNA), Rifampicina e
Rifabutina (RNA) ed infine Metronidazolo (composti citotossici che distruggono il
DNA).
- Chinoloni
I Chinoloni sono una delle classi di antibiotici più utilizzate a livello clinico. Sono dei
chemioterapici di sintesi che inibiscono la DNA topoisomerasi batterica di tipo II
(girasi) o la topoisomerasi di tipo IV, necessarie per la replicazione, la ricombinazione
e la riparazione del DNA. La subunità A della DNA girasi è il principale bersaglio dei
chinoloni, nei batteri gram negativi, mentre la topoisomerasi di tipo IV, è il bersaglio
principale nei batteri gram positivi. Tra i chinoloni riconosciamo l'acido nalidixico,
ciprofloxacina, levofloxacina, ofloxacina etc. L'acido Nalidixico ha uno spettro
ristretto, è infatti attivo contro bacilli gram negativi, ma non verso gram positivi,
mentre sono ad ampio spettro Ofloxacina, Norfloxacina e Ciprofloxacina. I principali
meccanismi di resistenza ai chinoloni sono, la ridotta assunzione del farmaco per
alterazione delle porine di membrana e le modificazioni delle DNA girasi.
Microbiologia Preston
37
- Rifampicina
Si lega all'RNA polimerasi DNA-dipendente ed inibisce l'inizio della sintesi
dell'RNA. E' battericida per Mycobacterium Tuberculosis. Il principale meccanismo
di resistenza è la mutazione nella subunità β dell'RNA polimerasi DNA-dipendente; i
gram negativi sono naturalmente resistenti, poiché l'antibiotico idrofobico non
supera la parete esterna.
- 4) Antimetaboliti
- Sulfamidici
Sono efficaci su un gran numero di gram positivi e gram negativi; sono utilizzati nel
trattamento di infezioni acute del tratto urinario provocate da batteri sensibili come
E.Coli. Competono con l'acido p-amminobenzoico, impedendo la sintesi di acido
folico, richiesto come vitamina dai mammiferi che non lo sintetizzano. I principali
meccanismi di resistenza ai sulfamidici sono, le barriere di impermeabilità e una
ridotta affinità per la idrolato riduttasi.
- 5) Alterazione delle membrane cellulari
- Polimixina e Bacitracina, che alterano la membrana citoplasmatica del batterio.
- I principali meccanismi di resistenza ai farmaci antibatterici sono:
1) L'alterazione ed interferenza nel trasporto del farmaco, ad esempio modificazioni
nelle porine, che formano le pareti dei pori, possono alterare le dimensioni e la
carica dei canali e provocare l'esclusione dell'antibiotico, un alterato trasporto
attraverso la membrana cellulare. I principali meccanismi coinvolti da tale
meccanismo sono, i β-Lattamici, la Bacitracina, farmaci contro la parete dei
micobatteri, Amminoglicosidi, Chinoloni, Rifampicina e Antimetaboliti.
2) Attivazione di pompe di efflusso; cioè il trasporto dell'antibiotico all'esterno della
cellula batterica.
3) Modificazione del sito bersaglio dell'antibiotico, ad esempio con la produzione di
proteine simili ai fattori di allungamento, che proteggono il ribosoma 30S, ai quali
l'antibiotico si lega senza che la sintesi proteica venga alterata. Alterati ribosomi ed
altri targets dell'antibiotico. I principali antibatterici coinvolti in tale meccanismo
sono, β-Lattamici (alterate PBP), Vancomicina (sostituzione del peptidoglicano del
Microbiologia Preston
38
terminale del pentapeptide da D-alanina in D-lattato o D-serina), Amminoglicosidi
(mutazione del sito legante il ribosoma), Tetracicline (produzione di proteine simili
al fattore di allungamento che protegge il ribosoma 30S), Macrolidi (metilazione
dell'RNA ribosomiale 23S, che impedisce il legame dell'antibiotico), Chinoloni
(alterazione della subunità α della DNA girasi), Rifampicina (modificazione della
subunità β dell'RNA polimerasi) ed infine Sulfamidici (ridotta affinità di idrofolato
riduttasi).
4) Distruzione o inattivazione del farmaco, ad esempio la modificazione enzimatica,
mediante fosforilazione, adenilazione o acetilazione dei gruppi amminici e
idrossilici degli antibiotici. I principali antibattericicoinvolti da tale meccanismo
sono i β-Lattamici (β-lattamasi), Amminoglicosidi (fosforilazione, adenilazione e
acetilazione della molecola), Cloramfenicolo (acetilazione), Macrolidi (distruzione
dell'anello lattonico da parte di una eritromicina esterasi) e Sulfamidici
(produzione di timidina come antagonista).
5) Modulazione dell'espressione genica, per produrre un maggior numero di siti
bersaglio (competizione con il substrato).
Sterilizzazione, disinfezione e antisepsi
La Sterilizzazione, è un uso di procedure fisiche o di agenti chimici finalizzato alla
distruzione di tutte le forme microbiche, incluse le spore batteriche. La Disinfezione,
è l'uso di procedure fisiche o di agenti chimici finalizzato alla distruzione della
maggior parte delle forme microbiche; le spore batteriche e gli altri microrganismi
relativamente resistenti (per esempio, micobatteri, virus e funghi) possono rimanere
vitali; i disinfettanti sono suddivisi in agenti ad attività elevata, intermedia e bassa.
L'Antisepsi, è l'uso di agenti chimici sulla cute o su altri tessuti vivi con lo scopo di
inibire o eliminare i microbi; non c'è azione sporicida. Germicidi, sono quegli agenti
chimici capaci di uccidere i microbi; le spore possono sopravvivere. Sporicidi, sono
germicidi capaci di uccidere le spore batteriche. Il Risanamento, è il processo
attraverso il quale la contaminazione microbica, sulle superfici inanimate è ridotta a
livelli di "sicurezza".
Microbiologia Preston
39
Batteriologia Speciale
Staphylococcus e cocchi gram-positivi correlati
I cocchi gram-positivi sono un gruppo etereogeneo di batteri, con circa 16 specie
patogene per l'uomo; le caratteristiche che li accomunano sono la forma sferica, la
relazione alla colorazione di gram e l'assenza di endospore. Il nome Staphylococcus si
riferisce al fatto che questi cocchi gram-positivi crescono con una disposizione che
assomiglia ad un grappolo d'uva (staphylè: grappolo d'uva), anche se nel materiale
clinico possono apparire come singole cellule, appaiate o in corte catene (diagnosi
microscopica). Hanno un diametro compreso tra 0,5-1 μm, sono immobili, sono
anaerobi facoltativi e catalasi-positivi (catalasi: enzima che catalizza la trasformazione
del perossido di idrogeno in acqua e ossigeno gassoso); inoltre sono in grado di
crescere in un terreno contenente un'alta concentrazione di sale (NaCl al 10%).
Questi batteri sono presenti sulla pelle dell'uomo e sulle mucose. Gli stafilococchi
sono patogeni importanti per l'uomo e lo Staphylococcus Aureus è sicuramente il più
virulento, di color giallo oro in coltura per i pigmenti carotenoidi, ed è l'unico
batterio patogeno per l'uomo che produce l'enzima coagulasi. Riconosciamo inoltre
altre specie, quali, Stapylococcus epidermidis, saprophyticus, haemoliticus e lugdunensis.
Come detto, sono dei patogeni importanti per l'uomo, che possono portare a malattie
sistemiche anche letali, infezioni cutanee, infezioni opportunistiche e malattie del
tratto urinario. I microrganismi classificati come Micrococcus, sono quelli che
colonizzano più frequentemente la superficie cutanea dell'uomo, sono simili agli
stafilococchi e possono essere confusi con i coagulasi-negativi.
Fisiologia e Struttura
Riconosciamo varie strutture nella parete di uno stafilococco, come la capsula,
peptidoglicano, acidi tecoici, proteina A (solo Aureus), coagulasi etc. .
Lo strato più esterno della parete cellulare della maggior parte degli stafilococchi è
rivestito da una capsula polisaccaridica. La capsula protegge i batteri, inibendo la
fagocitosi; lo S.aureus è in grado di evitare la fagocitosi, di replicarsi e invadere i
tessuti fino a quando gli anticorpi contro il gruppo O-acetyl del polisaccaride non ne
Microbiologia Preston
40
pellicola chiamata strato gelatinoso, costituita da monosaccaridi, proteine e piccoli
peptidi, la quale lega i batteri ai tessuti e ai corpi estranei, come cateteri, trapianti,
valvole artificiali, protesi articolari e shunt.
La superficie della maggior parte dei ceppi di S.aureus, ma
non degli stafilococchi coagulasi-negativi, è rivestita dalla
proteina A. Questa proteina è legata allo strato di
peptidoglicano o alla membrana citoplasmatica e possiede
una particolare affinità di legame per il recettore Fc delle
immunoglobuline IgG1, IgG2 e IgG4. Una forma
extracellulare inibisce gli anticorpi, formando
immunocomplessi. Proteina A di S.Aureus e la proteina M di S.pyogenes, impediscono
l'opsonizzazione legando il frammento Fc delle Ig. La presenza di questa proteina è
stata utilizzata in alcuni saggi sierologici, inoltre il rilevamento di questa proteina può
essere utile come test di identificazione (diagnosi di laboratorio) specifico per questo
stafilococco.
Gli acidi tecoici sono un elemento fondamentale della parete cellulare e formano il
30-50% del suo peso secco. Il polisaccaride A è un acido tecoico, che media l'attacco
alle superfici mucose attraverso il legame alla fibronectina; sebbene gli acidi tecoici,
come il polisaccaride A, non siano immunogeni o lo siano poco, quando sono legati
al peptidoglicano sono antigenici, perché stimolano una risposta anticorpale.
La superficie esterna della maggior
parte dei ceppi di S.Aureus contiene
un fattore di coagulazione, o
coagulasi. La coagulasi può essere
libera o legata alla parete, ed è un
importante fattore di virulenza,
infatti lega il fibrinogeno,
convertendolo in fibrina insolubile
andando così a causare
l'aggregazione degli stafilococchi. Il
rilevamento di coagulasi è un test
per l'identificazione dello S.aureus.
Metà del peso della parete cellulare però è costituito dal peptidoglicano,
caratteristica comune a tutti i batteri gram-positivi, formato da molti legami
Microbiologia Preston
41
trasversali, che rendono la parete più rigida. Gli enzimi che catalizzano la costruzione
dello strato di peptidoglicano sono denominati proteine leganti le penicilline e sono
i bersagli delle penicilline e dei β-lattamici.
La resistenza batterica alla meticillina e ad altre penicilline è mediata
dall'acquisizione di un gene (mecA), il quale codifica per una nuova proteina legante
la penicillina PBP2', che non è legata alla penicillina, ma conserva attività enzimatica.
Il gene mecA è localizzato sulla regione cromosomica mec (SCCmec) dello stafilococco
e sono state descritte 5 sequenze geniche (tipi I-V) per questa regione. Questa
informazione è importante, poiché i ceppi di S.Aureus meticillina-resistente
(MRSA), in passato confinati a infezioni acquisite in ospedale, ora sono responsabili
della maggior parte delle infezioni da stafilococco.
Patogenesi e Immunità
La patologia delle infezioni stafilococciche dipende dall'abilità del batterio di eludere
la fagocitosi, produrre le proteine di superficie che mediano l'aderenza del batterio ai
tessuti dell'ospite (matrice) ed elaborare le tossine ed enzimi idrolitici.
I capsulati legano le opsonine, ma la capsula batterica li protegge, inibendo la
fagocitosi, così come anche lo strato gelatinoso e la proteina A, che legano le
immunoglobuline.
Le Tossine stafilococciche sono molte e varie:
- Citotossine 1) α, che altera il muscolo liscio dei vasi sanguigni ed è tossica per molti tipi di
cellule del sangue, come eritrociti, leucociti e piastrine, nonché per cellule di altri
tessuti, come gli epatociti. Questa si integra nelle regioni idrofobiche della
membrana cellulare dell'ospite, formando pori di 1-2 nm, provocando così lisi
osmotica. E' considerata un importante mediatore del danno tissutale e può
causare necrosi.
2) β, nota anche come sfingomielasi C, è tossica per diverse cellule e catalizza
l'idrolisi dei fosfolipidi delle membrane cellulari; assieme alla tossina α, è
responsabile della formazione di ascessi e permette allo stafilococco di proliferare
durante la risposta infiammatoria.
Microbiologia Preston
42
3) γ, lisa gli eritrociti umani, di pecora, di coniglio e anche linfoblasti umani.
4) Leucocidina (PV) o tossina di Panton-Valentine, è una tossina bicomponente,
costituita da due catene polipeptidiche (come la γ). Sono due molecole che in
combinazione favoriscono cambi strutturali nella membrana cellulare, formano
pori e modificano la permeabilità verso i cationi. E' tossica per i leucociti.
- Tossine Esfoliative Nota anche come tossina epidermolitica, è responsabile della Sindrome stafilociccica
della cute scottata (SSSS); sono serin-proteasi che causano la rottura dei ponti
cellulari (desmosomi) nello strato granuloso dell'epidermide. Causa anche shock
tossico.
- Tossina-1 della sindrome da shock tossico (TSST-1) Si stma che il 90% dei ceppi di S.aureus responsabili della sindrome dello shock
tossico (TSS) associata alla mestruazione e la metà dei ceppi responsabili delle altre
forme di TSS, producano TSST-1. E' nota anche come esotossina pirogena, o
enterotossina F, è una tossina che causa appunto la sindrome da shock tossico,
caratterizzata da febbre, ipotensione ed eruzione cutanea e coinvolgimento di diversi
apparati. E' un superantigene, che stimola il rilascio di citochine, producendo la
perdita di cellule endoteliali a basse concentrazioni e un effetto citotossico ad alte
concentrazioni. La capacità di TSST-1 di penetrare le barriere mucose, anche se
l'infezione resta localizzata alla vagina o al sito di una ferita, è responsabile degli
effetti sistemici della TSS.
- Enterotossine E'stata trovata una famiglia di enterotossine stafilococciche (A->E), tra le quali
l'enterotossina A è associata comunemente alle intossicazioni alimentari; le
enterotossine C e D si ritrovano in prodotti caseari contaminati, e l'enterotossina B
provoca enterocolite pseudomembranosa stafilococcica. 5 tossine resistenti agli
enzimi gastrici, stabili al calore fino a 100° per 30 minuti, quindi quando un prodotto
alimentare è stato contaminato, sarà inutile riscaldarlo o esporlo ad acidi per
decontaminarlo. Favoriscono la peristalsi intestinale e hanno effetto sul SNC (nausea
e vomito).
Microbiologia Preston
43
- Enzimi Stafilococcici Coagulasi, che forma uno strato di fibrina intorno all'ascesso provocato dagli
stafilococchi, localizzando l'infezione; Ialuronidasi, che idrolizza gli acidi ialuronici, i
mucopolissaccaridi della matrice acellulare del tessuto connettivo e facilita la
diffusione del batterio; Fibrinolisina, nota anche come stafilochinasi, è attivatore del
plasminogeno e scioglie i coaguli di fibrina, è un fattore di diffusione; Lipasi, che
idrolizzano i lipidi, essenziale per la sopravvivenza del batterio nelle zone sebacee, e
permettono di invadere i tessuti cutanei sviluppando infezioni cutanee superficiali
(favi e foruncoli); Penicillinasi o enzimi β-lattamici, che conferiscono resistenza agli
antibiotici; infine Catalasi, che convertono il perossido di idrogeno in acqua e
ossigeno, contribuendo alla virulenza perché impedisce in questo modo il killing
intracellulare.
Epidemiologia
Gli stafilococchi sono ubiquitari, infatti tutti quanti hanno sulla pelle una certa
quantità di stafilococchi coagulasi-negativi ed è comune una colonizzazione
passeggera delle pieghe umide della pelle da parte dello S.aureus, così come la
colonizzazione del residuo del cordone ombelicale, della pelle e dell'area perineale.
Circa il 15% degli adulti sono portatori di S.aureus nel nasofaringe e tutti albergano il
batterio sulla pelle. Per gli operatori sanitari, sono necessarie opportune tecniche di
lavaggio. Gli stafilococchi sono sensibili alle elevate temperature, ai disinfettanti e agli
antisettici. Tuttavia, i microrganismi possono sopravvivere su superfici secche per
lunghi periodi. Essi possono essere trasferiti a un soggetto suscettibile sia mediante
contatto diretto, sia mediante oggetti (abiti contaminati, biancheria da letto). Per
questo motivo il personale medico deve usare adeguate tecniche di lavaggio delle
mani per prevenire il trasferimento di stafilococchi ai pazienti o tra i pazienti.
Lo Staphylococcus Aureus provoca malattia mediante tossine o per invasione diretta
e distruzione dei tessuti.
Microbiologia Preston
44
- Sindrome stafilococcica della cute scottata (SSSS) Oggi chiamata malattia di Ritter, è caratterizzata dall'improvvisa
insorgenza di un eritema periorale localizzato (rossore e
infiammazione intorno alla bocca), che copre l'intero corpo in
due giorni. Una leggera pressione rimuove la pelle (segno
positivo di Nikolsky), e subito dopo si formano grandi bolle o
vesciche cutanee, seguite da desquamazione dell'epitelio. Le
vesciche contengono liquido limpido, ma non contengono né
leucociti, né microrganismi. Dopo circa 7-10 giorni l'epitelio
torna intatto, con comparsa di anticorpi contro la tossina. Non
rimarranno cicatrici, perché si desquama solo lo strato superficiale dell'epidermide.
Questa malattia riguarda principalmente i neonati, infatti il feto
contrae l'infezione al momento della nascita (infezioni connatali),
e la tossina diffonde per via sistemica. La mortalità è inferiore al
5% ed è causata da infezione batterica secondaria delle zone di
carne viva.
L'impetigine bollosa, è una forma localizzata di SSSS.
Riscontriamo bolle localizzate, sulla superficie cutanea. L'edema
non si estende oltre i bordi della bolla e non è presente il segno di
Nikolsky. Questa forma si verifica solamente nei neonati e nei
bambini piccoli ed è altamente
contagiosa.
- Sindrome da shock tossico (TSS) E' causata da ceppi di S.Aureus, produttori di tossina
TSST-1, che replicandosi liberano la tossina. In passato,
era associata all'uso di tamponi mestruali iperassorbenti,
nei quali il batterio si moltiplicava e produceva la tossina,
e dopo il ritiro dal commercio di questi tamponi,
l'incidenza della malattia nelle donne in periodo
mestruale diminuì. La malattia ha inizio con la crescita
localizzata di ceppi di S.aureus, produttori di tossina, nella
vagina (50%) o in una ferita, seguita dal rilascio della
Microbiologia Preston
45
tossina nel sangue. La produzione di tossina richiede un ambiente aerobico e un pH
neutro. Le manifestazioni cliniche iniziano improvvisamente e comprendono febbre,
ipotensione e una diffusa eruzione cutanea eritematosa maculare. Sono coinvolti
diversi apparati, quale l'apparato gastrointestinale, muscolare, renale, epatico, ematico
ed il sistema nervoso centrale; l'intera pelle si desquama, inclusi il palmo delle mani
e la pianta dei piedi. In passato, la percentuale di morte era molto alta (65%). Oggi le
conoscenze eziologiche ne limitano la letalità.
- Infezioni cutanee Le infezioni piogene da stafilococchi localizzate sono l'impetigine, la follicolite, i
foruncoli e i favi.
L'impetigine è un'infezione piogena superficiale sul viso e
sugli arti che colpisce maggiormente i bambini. Inizialmente
si vede una piccola macula (macchia rossa piatta) e poi si
sviluppa una vescicola piena di pus (pustola) su base
eritematosa. La formazione di croste si verifica dopo la
rottura della pustola.
La follicolite è un'infezione piogena dei follicoli piliferi e nei
dotti delle ghiandole sudoripare di ascella, faccia e glutei. La
base del follicolo si rialza e si arrossa, e c'é una piccola
formazione di pus sotto la superficie dell'epidermide, e se si verifica prende il nome
di orzaiolo.
I foruncoli sono una derivazione della follicolite, sono grossi noduli ascessuali in
rilievo, con raccolta sottostante di tessuto necrotico. Possono essere multipli o solitari;
vengono drenati spontaneamente oppure mediante incisione chirurgica.
I favi si producono quando i foruncoli si uniscono e si estendono al tessuto
sottocutaneo più profondo. I pazienti con i favi, a differenza di quelli con foruncoli e
follicolite, hanno brividi di freddo e febbre, che indicano la diffusione sistemica degli
stafilococchi.
Le infezioni di ferite possono verificarsi, invece, a seguito di traumi o interventi
chirurgici, con microrganismi che colonizzano la pelle e penetrano nella ferita. Gli
stafilococchi, in ospiti immunocompetenti, non sono in grado di stabilire
Microbiologia Preston
46
un'infezione, se non quando sono presenti dei corpi estranei nella ferita (suture,
schegge, sporcizia). Le infezioni sono caratterizzate da edema, dolore e un accumulo
di materiale purulento. L'infezione può essere facilmente gestita se la ferita è
riaperta, estraendo il corpo estraneo ed il materiale purulento. Se la ferita non si
rimargina, o se si osservano segnali come la febbre, è indicata una terapia antibiotica
specifica per lo S.aureus.
A seguito di traumi cranici o ferite profonde con corpi estranei, possiamo osservare
meningiti (anche da stafilococchi coagulasi-negativi). Gli ascessi cerebrali avvengono
in presenza di patogeni in un'area cerebrale ischemica o devitalizzata per danni
pregressi.
- Avvelenamento Alimentare provocato da stafilococchi L'avvelenamento da cibo, provocato da stafilococchi, è una delle più comuni malattie
di origine alimentare, un'intossicazione. La malattia è causata dall'ingestione di cibo
contaminato dalla tossina, piuttosto che dall'effetto diretto del microrganismo. I cibi
che sono più comunemente contaminati sono la carne lavorata, come il prosciutto e il
maiale salato (il batterio resiste a concentrazioni saline del 10-15%), pasticceria
(crema, gelato) e insalata di patate. L'avvelenamento alimentare da stafilococchi è
causato dalla contaminazione del cibo da parte di un portatore umano; sebbene sia
possibile prevenire la contaminazione, impedendo ai portatori di evidenti infezioni
cutanee di preparare i cibi, circa la metà delle infezioni ha origine da portatori con
colonizzazione nasofaringea asintomatica. Dopo che il batterio ha raggiunto il cibo,
attraverso uno starnuto o una mano contaminata ad esempio, quest'ultimo deve
rimanere a temperatura ambiente, o più elevata, affinché proliferi e rilasci la tossina. I
cibi contaminati non presentano alterazioni dell'aspetto, né del sapore. Un successivo
riscaldamento del cibo ucciderà i batteri, ma non inattiverà la tossina. Dopo
l'ingestione del cibo, l'insorgenza dell'intossicazione è rapida, circa 4 ore, perché è
causata da una tossina preformata. Gli stafilococchi ingeriti non producono una
nuova tossina, per cui la malattia ha un decorso rapido con sintomi che durano di
solito un giorno. Questo tipo di avvelenamento da cibi è contraddistinto da vomito
violento, diarrea, dolori addominali o nausea. Possono verificarsi sudorazione, mal di
testa, ma non febbre. La diffusione ematogena della tossina causa shock tossico. Il
trattamento riduce i crampi addominali e la diarrea e reintegra i liquidi; non è
indicata una terapia antibiotica, in quanto, la malattia è connessa con una tossina
Microbiologia Preston
47
preformata e non con la replicazione dei batteri. Alcuni ceppi inoltre possono
causare enterocolite, che si manifesta con diarrea acquosa profusa e non
sanguinolenta e può provocare febbre ed una disidratazione a causa di una
consistente perdita di liquidi. E' causata da battei che producono enterotossina A e
leucotossina. L'enterocolite si verifica soprattutto in quei pazienti sottoposti a terapia
di antibiotici ad ampio spettro, che uccidono la flora normale intestinale e
permettono così la crescita di S.aureus. La diagnosi di enterocolite stafilococcica può
essere compravata solo dopo che è stata esclusa la più comune causa di infezione, la
colite del Clostridium difficile.
- Infezioni sistemiche Lo S.aureus è una causa comune di batteriemia, la presenza di batteri o prodotti
tossici nel sangue, persistente, che può degenerare in sepsi e shock settico. Se lo
shock si instaura generando MOFS (Multiple Organs Failure Syndrome, Sindrome
da Insufficienza Multipla di Organi), la mortalità può raggiungere anche il 70% dei
pazienti colpiti. Lo shock è una serie di eventi che portano al collasso del sistema
circolatorio, con conseguente MOFS.
L'Endocardite acuta, con mortalità del 50%, è una malattia grave provocata da
S.aureus; i pazienti inizialmente non mostrano segni specifici di tipo influenzale, ma le
loro condizioni si aggravano velocemente e possono provocare la distruzione di una
valvola cardiaca, con comparsa di emboli settici periferici. Senza un immediato
intervento medico e chirurgico, la prognosi è negativa. Lo Staphylococcus Aureus
presenta sulla propria superficie proteine leganti il fibrinogeno (Clf) e leganti il
collagene (Cbp) per aderire alle strutture valvolari cardiache.
Lo S.aureus può causare malattie respiratorie dopo l'aspirazione di secrezioni orali o
per diffusione ematica del microrganismo. Una polmonite, malattia respiratoria
acuta, che si contrae per diffusione ematica del batterio. Si può osservare in pazienti
molto giovani, anziani e in soggetti affetti da fibrosi cistica. La polmonite è comune in
pazienti con batteriemia o endocardite. Le polmoniti nosocomiali, vengono contratte
in ambiente ospedaliero, problema importante per la circolazione di ceppi
meticillino-resistenti.
L'Osteomielite da S.aureus può essere causata dalla disseminazione ematogena
all'osso, o può essere provocata da danni locali. Nei bambini la diffusione ematogena
Microbiologia Preston
48
origina spesso da un'infezione cutanea e di solito interessa la metafisi delle ossa
lunghe, un'area molto vascolarizzata di crescita ossea. Questa infezione è
caratterizzata da improvvisa comparsa di dolore sull'osso coinvolto e da febbre alta.
Negli adulti si manifesta in forma di osteomielite vertebrale e raramente in forma di
infezione alle ossa lunghe. L'ascesso di Brodie è un focolaio di osteomielite
stafilococcica, che si origina nella metafisi di un osso lungo, dopo un intervento
chirurgico o un trauma e si verifica soltanto negli adulti. I ceppi di S.aureus
possiedono adesine (recettori) per collagene, fibronectina e per la sialoproteina
dell'osso. L'infezione si instaura per l'abbondante produzione di polisaccaride
capsulare, che produce biofilm. L'infiammazione del tessuto osseo porta alla
formazione di microinfarti, con sequestro osseo: può evolvere in una osteomielite
cronica.
L'artrite settica è un'infezione infiammatoria dell'articolazione, causata da
disseminazione ematogena del batterio, che si manifesta nelle grosse articolazioni
(spalle, ginocchia, anca e gomito). Lo S.aureus è la causa principale di tale infezione
nei bambini piccoli e negli adulti che sono stati sottoposti a iniezioni intra-articolari
o che hanno articolazioni anormali dal punto di vista meccanico. L'artrite
stafilococcica è caratterizzata da un'articolazione dolente ed eritematosa, con
materiale purulento raccolto per aspirazione. La necrosi del tessuto può causare
danni irreparabili.
- Staphylococcus epidermidis e altri stafilococchi coagulasi negativi Gli stafilococchi sono una delle principali cause di endocardite delle valvole
artificiali, raramente delle naturali. I microrganismi vengono introdotti al momento
della sostituzione della valvola, e l'infezione ha un tipico decorso lento, con segni e
sintomi clinici che non si sviluppano prima di un anno dall'intervento.
Possono causare infezioni da cateteri e shunt. Gli stafilococchi coagulasi-negativi
sono predisposti a causare queste infezioni, perché possono produrre una capsula
gelatinosa polisaccaridica, capace di legarli ai cateteri e agli shunt, che li protegge
dagli antibiotici e dalle cellule immunitarie.
Possono causare infezioni di protesi articolari, particolarmente dell'anca, ed il
trattamento prevede la sostituzione dell'articolazione e della terapia antibiotica.
Microbiologia Preston
49
Infezioni persistenti causano batteriemia (presenza di batteri o prodotti tossici nel
sangue), persistente che può degenerare in sepsi e shock tossico.
Lo Staphylococcus Saprophyticus causa infezioni del tratto unitario in donne giovani,
attive sessualmente. Colonizza in maniera asintomatica. Le donne infettate
presentano generalmente disuria (dolore durante la minzione), piuria (pus nelle
urine) e numerosi microrganismi nelle urine. Generalmente i pazienti rispondono
alla terapia antibiotica, quindi sono sensibili agli antibiotici.
Diagnosi di Laboratorio
Si effettua un esame microscopico inizialmente, in cui lo S.aureus può apparire in
piccoli gruppi o singole cellule; tutto dipende dal tipo di infezione, e dalla qualità del
campione inviato per l'analisi. Viene fatta poi una coltura, un esame colturale, in cui
S.aureus viene isolato su terreni selettivi, come l'agar sale-mannitolo, contenente
NaCl (cloruro di sodio) al 7,5%, che inibisce la maggior parte degli altri batteri, e
mannitolo (che è fermentato solamente da S.aureus, ma non dagli altri batteri).
Vengono effettuati dei test sierologici, con anticorpi diretti contro gli acidi tecoici .
Per identificare lo S.aureus, si possono usare test per la coagulasi, nucleasi
termostabile e fosfatasi alcalina.
Trattamento, profilassi e controllo
Gli stafilococchi, hanno sviluppato una resistenza alle penicilline naturali e
semisintetiche, come meticillina e oxacillina. Questa resistenza è dovuta all'enzima
penicillinasi, che idrolizza l'anello β-lattamico della penicillina. Oltre il 50% degli
isolati ospedalieri manifesta resistenza. La somministrazione di vancomicina per via
endovenosa è il trattamento di elezione per le infezioni di stafilococchi resistenti alla
penicillina.
Microbiologia Preston
50
Streptococcus
Il genere Streptococcus è un insieme
eterogeneo di cocchi gram-positivi,
disposti tipicamente in coppie o catenelle.
Sono degli anaerobi facoltativi, che
crescono in un terreno arricchito con
sangue o siero, cresce in agar-sangue.
Sono capsulati, immobili e asporigeni. I
carboidrati sono fermentati, con
produzione di acido lattico, metabolismo
omolattico, e, sono catalasi-negativi. La
classificazione di questo genere è complicata. Ce ne sono tre di tipi di classificazione:
il primo riguarda le caratteristiche antigeniche o gruppi di Lancefield, poi le
caratteristiche emolitiche (gruppo α con emolisi incompleta, gruppo β con emolisi
completa e gruppo γ con emolisi assente) ed infine caratteristiche biochimiche. La
difficoltà della classificazione degli streptococchi sta nel fatto che gli schemi di
classificazione non si escludono a vicenda.
Streptococcus
E' un cocco sferico, con diametro 0,5-1 micron, che in un campione clinico forma
catene corte e coltivate in terreni liquidi formano catene lunghe. La crescita è
ottimale se il terreno è arricchito con sangue, ma viene inibita dall'alta
concentrazione di glucosio; dopo 24h di incubazione si formano colonie con ampie
zone di β-emolisi.
La struttura di base della parete è formata da peptidoglicano (gram-positivo) e acidi
tecoici, ma sono presenti anche proteine tipo specifiche. Il carboidrato gruppospecifico o antigene del gruppo A di Lancefield è un dimero di N-acetilglucosamina e
ramnosio.
Vediamo poi la proteina M, la principale proteina tipo-specifica associata ai ceppi
virulenti, che è formata da due catene polipeptidiche, che si assemblano a formare
un'α-elica, ancorata alla membrana citoplasmatica e sporge al di fuori della superficie
cellulare; l'estremità C-terminale è ancorata alla membrana ed è altamente
Microbiologia Preston
51
conservata, mentre l'estremità N-terminale è
responsabile di più di 80-100 sierotipi,
quindi è responsabile della diversità
antigenica osservata tra sierotipi specifici
delle proteine M. Le proteine M sono
suddivise in due classi: la classe I, che
presenta gli antigeni esposti, e la classe II,
che non ha antigeni esposti; entrambi i
ceppi possono causare infezioni suppurative
e glomerulonefriti, ma solamente la classe I
può causare febbre reumatica ed inoltre hanno sequenze omologhe con proteine
dell'ospite (che saranno responsabili di autoimmunità, perché si formeranno
anticorpi specifici diretti contro quell'epitopo specifico, condiviso con l'ospite). Le
proteine M costituiscono le fibrille e promuovono l'aggregazione delle cellule
batteriche, l'adesione e lega anche fattori del complemento. La proteina M lega il
fattore H serico, che destabilizza il C3b, quindi va ad impedire l'attivazione della via
alternativa del complemento, evitando che C3b si depositi sulla superficie del
batterio, evitando così opsonizzazione e conseguente fagocitosi.
Il secondo marcatore epidemiologico dello S.pyogenes è la proteina T, o tripsinaresistente.
Ci sono altre proteine e componenti di superficie, come la proteina di superficie tipoM, che sono codificate da un gruppo di geni (più di 20), che costituiscono la
superfamiglia del gene emm, geni deputati alla sintesi della proteina M, tipo-M ed
altre che legano le Ig. Questa proteina lega il frammento Fc delle IgG e IgA e la
macroglobulina α2, un inibitore della proteasi che inibisce gli enzimi dei fagociti. La
proteina F e l'acido lipotecoico, che legano la fibronectina della matrice
extracellulare dell'ospite. La proteina F è un recettore per la fibronectina, ed è la
principale adesina per le cellule epiteliali della faringe e della pelle.
La capsula esterna è infine composta da acido ialuronico, indistinguibile da quella
del tessuto connettivo dell'ospite e non produce opsonizzazione.
La virulenza degli streptococchi di gruppo A è determinata dalla loro capacità di
aderire alla superficie delle cellule ospiti, invadere le cellule epiteliali, ed evitare
opsonizzazione e conseguente fagocitosi, in più dalla capacità di produrre tossine ed
enzimi.
Microbiologia Preston
52
Le esotossine pirogene streptococciche (Spe), sono dette anche tossine
eritrogeniche, prodotte da ceppi lisogeni, che agiscono come superantigeni ( sono tre
SpeA, B, C), mediando così shock e collasso che caratterizza alcune malattie
streptococciche, quali fascite necrotizzante, sindrome streptococcica da shock tossico,
così come eritema della scarlattina.
La streptolisina S è un'emolisina ossigeno-stabile, non immunogena e legata alla
cellula, che può lisare eritrociti, leucociti e piastrine; inoltre può stimolare il rilascio
di contenuti lisosomiali, dopo inglobamento, con morte del fagocita. E' prodotta nel
siero ed è responsabile della β-emolisi.
La streptolisina O è un'emolisina ossigeno-labile, che lisa i leucociti. E' immunogena
ed è utilizzata per individuare un'infezione streptococcica, perché gli anticorpi antistreptolisina O si formano molto rapidamente. Questa è inibita dal colesterolo e
quindi quei pazienti affetti da infezioni cutanee non sviluppano anticorpi antistreptolisina O, per il contenuto dei lipidi nella pelle.
Possiedono almeno due forme di streptochinasi (A e B), che lisano il plasminogeno,
rilasciando plasmina, proteasi che a sua volta degrada la fibrina e il fibrinogeno,
provocando lisi dei coaguli e dei depositi di fibrina, e favorendo così la diffusione nei
tessuti infetti.
Sono state identificate poi, quattro tipi di Desossiribonucleasi (DNAsi), che
depolimerizzano il DNA libero presente nel pus. Ciò riduce la viscosità del materiale
dell'ascesso e facilita la diffusione.
Possiedono Peptidasi C5a, la quale, inattiva il processo infiammatorio, degradando il
C5a, che media l'infiammazione andando a reclutare i fagociti (il C5a deriva dal
clivaggio della componente C5 del complemento, di cui la subunità a va in forma
solubile, mentre la parte b andrà invece a legare le altre componenti del
complemento, durante la via litica).
Infine troviamo la Ialuronidasi come fattore di diffusione.
- Epidemiologia Gli streptococchi possono colonizzare l'orofaringe di ragazzi e giovani adulti sani in
assenza di malattia clinicamente osservabile. La colonizzazione asintomatica è
transitoria e dipende dalla capacità dell'individuo di reagire contro la proteina M e
dalla presenza di microrganismi competitivi nell'orofaringe. I pazienti non trattati
Microbiologia Preston
53
producono anticorpi anti-proteina M, ma questa risposta può diminuire in pazienti
sottoposti a terapia antibiotica.
- Faringo-tonsillite E' implicato lo S.pyogenes di gruppo A, che
interessa principalmente bambini di età
compresa tra 5 e 15 anni, ma è a rischio anche
per neonati e adulti. Il contagio avviene per via
aerea, goccioline di Flugge. Il periodo di
incubazione è di 2-4 giorni, quindi si manifesta
dopo questo tempo dal momento
dell'esposizione, con improvvisa comparsa di
mal di gola (infiammata), febbre, malessere e
cefalea. La faringe posteriore può apparire
eritematosa, con essudato bianco-giallastro sulle
tonsille, ugola, palato molle e possiamo trovare
linfoadenopatia cervicale. Nella faringite
streptococcica si può osservare edema,
accompagnato da petecchie del palato molle e
dell'ugola (2a immagine). Senza trattamento la
faringite si risolve in circa 3-4 giorni. Può essere
seguita però dalla malattia reumatica in quei casi
in cui la faringite sia provocata da ceppi reumatogeni. Nonostante sia difficile
prelevare i campioni da bambini mediante tampone faringeo, il tampone deve essere
effettuato dall'orofaringe posteriore (tonsille); nelle aree anteriori della bocca è
presente un minor numero di microrganismi e la bocca, in particolare la saliva, è
colonizzata da batteri che inibiscono la crescita dello S.pyogenes. Una diagnosi
tempestiva viene effettuata col tampone faringeo, isolamento e caratterizzazione (βemolisi, resistenza alla bacitracina, prove sierologiche per individuare il ceppo);
l'antibiogramma è obbligatorio.
Dalla faringite può scatenarsi il caratteristico esantema "scarlattina" (eruzione
cutanea con macchie o vescicole di un rosso intenso che caratterizza anche altre
esantematiche come morbillo, rosolia, varicella o anche vaiolo). E' codificata da un
fago lisogeno che stimola la produzione della esotossina pirogena. Entro uno o due
Microbiologia Preston
54
giorni dalla comparsa dei primi sintomi di faringite,
appare sulla porzione superiore del torace una diffusa
eruzione eritematosa cutanea, quindi il periodo di
incubazione è di 1-2 giorni. Successivamente si diffonde
alle estremità. Rash eritematoso, dolore al torace, addome
e diffusione dell'eritema, che risparmia solamente la
bocca (pallore circumorale), il palmo delle mani e la pianta
dei piedi. La lingua viene ricoperta da una patina bianco-giallastra e poi si spella,
andando a rivelare una superficie sottostante rossa e scorticata, o "lingua a fragola".
Il rash scompare dopo 5-7 giorni ed è seguito da desquamazione. Troviamo rari
ascessi peritonsillari e retrofaringee, e le complicazioni rare interessano cervello,
cuore, ossa ed articolazioni.
- Piodermite La piodermite o impetigine, da pyo=purulenta e derma=pelle, è un'infezione
circoscritta purulenta della pelle, che colpisce prevalentemente le aree esposte.
L'infezione avviene dopo il contatto diretto con persone o oggetti infetti, poi il
microrganismo si introduce nei tessuti sottocutanei attraverso una lesione.
Inizialmente si sviluppano vescicole, che diventano pustole, vescicole piene di pus; in
seguito a rottura delle pustole si ha la fuoriuscita di un essudato sieroso, che
essiccandosi da luogo ad una crosta giallastra. Il pus è un essudato di una
infiammazione purulenta; è formato da siero, leucociti più o meno degenerati e da
detriti cellulari. L'essudato e la crosta contengono numerosi streptococchi, che
possono infettare zone contigue di cute. E' tipica la diffusione secondaria
dell'infezione, causata dal grattarsi. Spesso può verificarsi la sovrapposizione di
infezioni da S.aureus. L'infezione può propagarsi per uso promiscuo di indumenti o
asciugamani. Non è associata a comparsa di febbre reumatica (i ceppi che producono
infezioni della pelle non danno generalmente faringiti).
- Erispela Erispela, o pelle rossa, è un'infezione acuta della pelle, che si diffonde rapidamente
sul volto e sugli arti inferiori. I pazienti presentano edema della cute (tipicamente
sollevata), eritema marcato, dolori e segni sistemici di infezione, quali febbre e
Microbiologia Preston
55
linfoadenopatia. L'infezione è intradermica, i batteri non sono
presenti sulla superficie cutanea. Abitualmente si verifica nei
bambini piccoli o negli anziani, nei quali ultimi il quadro è più
grave e va trattato immediatamente.
- Cellulite E' un'infiammazione acuta del tessuto connettivo sottocutaneo, caratterizzata da
dolore localizzato, eritema ed edema. L'area eritematosa è di un colore rosa pallido
rispetto a quella che si osserva nell'erispela. Si scatena in seguito a lesioni cutanee o
da focolai vicini, come nel caso del foruncolo o follicolite.
- Fascite Necrotizzante La fascite necrotizzante, chiamata anche gangrena streptococcica, è un'infezione che
si verifica in profondità nel tessuto sottocutaneo, si diffonde nei piani fasciali ed è
caratterizzata da distruzione estensiva del muscolo e del grasso, e per questo motivo
lo streptococcus pyogenes è denominato il batterio che mangia la carne. E' causata da
alcuni ceppi di S.pyogenes di gruppo A produttori di tossine pirogeniche; il batterio
penetra nei tessuti da piccoli tagli, traumi, scottature o lesioni chirurgiche.
Inizialmente c'è segno di cellulite, poi bolle, gangrena (necrosi di tessuti: le infezioni
generano un'occlusione arteriosa). Avviene una rapida progressione fino alla morte,
che interviene nel quadro di uno shock tossico in seguito a massiccia necrosi delle
fasce muscolari.
- Ostiomielite acuta E' un'infezione ossea, generalmente ematogena. Nei neonati, che hanno meno di un
mese, sono a causarla gli streptococchi di gruppo B, mentre negli adulti è lo
S.pyogenes, che penetra dopo infezioni, traumi o interventi chirurgici; nei pazienti
diabetici è il gruppo D, il gruppo degli enterococchi che causano questa patologia.
Microbiologia Preston
56
- Sindrome streptococcica da shock tossico E' un'infezione caratterizzata da tossicità multisistemica. Inizialmente vediamo
un'infiammazione dei tessuti molli, con febbre, brividi, malessere, nausea e vomito,
ma questa malattia progredisce poi verso lo shock e il collasso degli organi, reni
polmoni, fegato e cuore.Nonostante tutte le età sono suscettibili a questa infezione,
alcune categorie di persone sono più a rischio, come sieropositivi, diabetici, alcolisti e
pazienti con malattie cardiache. Se lo shock si instaura generando MOFS (sindrome
da insufficienza multipla di organi), la mortalità può raggiungere anche il 70% dei
pazienti colpiti. E' un'infezione simile a quella della Sindrome da shock tossico
stafilococcica.
Oltre a malattie streptococciche suppurative, ne abbiamo altre non suppurative, come
la Febbre reumatica, Glomerulonefrite acuta ed Eritema nodoso.
- Febbre reumatica o Reumatismo articolare acuto E' una complicanza non suppurativa della faringite provocata da S.pyogenes. E'
caratterizzata da alterazioni infiammatorie di cuore (danno cronico e progressivo
delle valvole cardiache), articolazioni e tessuti sottocutanei. E' una malattia
autoimmune, evocata dall'infezione streptococcica, dove alcuni epitopi della proteina
M del batterio sono comuni con proteine del tessuto cardiaco (miosina, fosforilasi ed
altre) e nei confronti del quale si scatena una risposta immunitaria anticorpale e
cellulo-mediata (lesioni dei tessuti valvolari) indotta dal batterio. La febbre reumatica
è associata a faringite, ma non ad infezioni cutanee. E' molto comune in età scolare e
spesso è un'infezione asintomatica o lieve, nel circa 1/3 dei pazienti. Presenta cinque
manifestazioni principali, quali eritema marginato, noduli sottocutanei, còrea
(sindrome nervosa con movimenti involontari), poliartrite e cardite. La malattia
insorge dopo 3-4 settimane dall'infezione acuta, Spesso ricorrente se non si effettua
terapia antibiotica. La ricerca di anticorpi contro la streptolisina O è utile per la
diagnosi di infezioni recenti, soprattutto nel sospetto di malattia reumatica.
Microbiologia Preston
57
- Glomerulonefrite acuta E' una complicazione non suppurativa di una malattia streptococcica, caratterizzata
da un'infiammazione acuta dei glomeruli renali con edema, ipertensione, ematuria
(sangue nelle urine), iperazotemia (sostanze azotate nel sangue). Deriva da una
pregressa infezione streptococcica acuta (generalmente cutanea come piodermiti, ma
anche faringea), con abnorme risposta anticorpale contro antigeni dello streptococco
(esoenzimi, tossine, acidi tecoici). I complessi antigene-anticorpo si depositano a
livello del filtro renale. E' un processo infiammatorio con distruzione del parenchima
renale. Esiste un'ipotesi autoimmunitaria, dovuta alla presenza di omologie
antigeniche fra la membrana basale del glomerulo renale e strutture della parete
cellulare batterica.
- Eritema nodoso Noduli eritematosi a livello degli arti inferiori; è la deposizione di complessi antigeneanticorpo a livello dei capillari del derma e del sottocutaneo; ci sono processi
infiammatori localizzati con vasculite (infiammazione di un vaso sanguigno o
linfatico).
Streptococcus Agalactiae
E' l'unica specie che presenta l'antigene di gruppo B, quindi detto anche
Streptococcus di gruppo B.
Sono gram-positivi con crescita disposti in catene, che lo rendono indistinguibile da
uno S.pyogenes, ma a differenza di questo, la zona di emolisi nella coltura è
nettamente più piccola. E' identificabile grazie alla presenza di questo antigene B
polisaccaridico gruppo-specifico della parete (ramnosio, N-acetilglucosamina e
galattosio). Il fattore di virulenza più importante di questo batterio è la capsula
polisaccaridica, che interferisce con la fagocitosi, fino a che il paziente non genera
anticorpi specifici. E' uno dei più importanti agenti di infezioni neonatali, quali
meningite. Colonizzano il tratto gastrointestinale inferiore e il tratto genitourinario,
spesso presente come componente della popolazione microbica commensale
dell'uretra maschile e della vagina e può essere trasmesso attraverso i rapporti
sessuali.
Microbiologia Preston
58
Le donne portatrici presentano un rischio che va dal 40 al 60% di trasmettere il
batterio al prodotto del concepimento durante il parto (canale infetto), con
conseguenze talora molto gravi quali, sindrome polmonare acuta, sepsi, meningite
neonatale purulenta (altri agenti eziologici di meningite neonatale sono
L.monocytogenes, E.Coli, H.influenzae di tipo B). Altri fattori di rischio sono la rottura
prolungata delle acque e la febbre durante il parto. La malattia nei neonati con meno
di 7 giorni è chiamata malattia a esordio precoce, mentre è a esordio tardivo se la
malattia è nel periodo compreso tra 1 settimana e 3 mesi di vita.
La malattia neonatale ad esordio precoce è acquisita nell'utero o alla nascita e si
sviluppa, come detto, nella prima settimana di vita. E' caratterizzata da batteriemia,
polmonite o meningite. La percentuale di mortalità è meno del 5%, ma il 15-30% dei
neonati ha sequele neurologiche, come sordità, cecità e ritardi mentali.La malattia
neonatale ad esordio tardivo viene acquisita da una fonte esogena, ad esempio dalla
madre o da un altro neonato e si sviluppa da una settimana a 3 mesi dalla nascita. La
manifestazione predominante è batteriemia con
meningite.Immediatamente dopo la gravidanza si possono
verificare inoltre endometriti pos partum, infezioni da ferita e
infezioni del tratto urinario. Per l'identificazione di questo
batterio si effettua una ricerca dell'antigene polisaccaridico di
gruppo B o la reazione CAMP. Gli streptococchi di gruppo B
producono infatti una proteina diffusibile e stabile al calore,
che potenzia la β-emolisi di S.aureus, sono β-emolitici.
Streptococcus Pneumoniae
E' un cocco gram-positivo capsulato, catalasi negativo.
Le cellule hanno una forma ovale e sono disposte a
coppia, diplococchi. Le colonie sono α-emolitiche su
agar-sangue, se incubate in aerobiosi, ma se cresciute
in anaerobiosi possono essere β-emolitiche. L'αemolisi è dovuta alla produzione di pneumolisina, un
enzima che degrada l'emoglobina, che produce una
sostanza di color verde. Ha come detto una capsula
polisaccaridica, il peptidoglicano (gram+) e acidi tecoici. L'acido tecoico è presente in
Microbiologia Preston
59
due forme, una che è esposta sulla superficie cellulare e l'altra che è legata
covalentemente ai lipidi della membrana citoplasmatica. L'acido tecoico si lega al
peptidocglicano e si estende attraverso la capsula esterna. Questa struttura è
chiamata polisaccaride C o sostanza C, acido tecoico legato alla fosforilcolina; questa
reagisce selettivamente con la proteina C-reattiva di fase acuta (CRP) dell'ospite,
prodotta durante il processo infiammatorio.
Le manifestazioni patologiche sono causate sostanzialmente dalla risposta dell'ospite
all'infezione, piuttosto che dalla produzione di fattori tossici dal microrganismo. Lo
S.pneumoniae colonizza l'orofaringe e poi si diffonde fino ai polmoni, ai seni
paranasali e all'orecchio; inoltre per via ematica può raggiungere siti distanti come il
cervello. Inizialmente il batterio colonizza l'orofaringe per mezzo di adesine proteiche
di superficie, ma possono essere ricoperti dal muco prodotto dalle cellule mucipare
dei bronchi e rimossi dalle cellule epiteliali; i batteri però producono proteasi di IgA
secretorie o sIgA e una pneumolisina. La sIgA va a legarsi con la porzione Fc alla
mucina e con la porzione legante l'antigene al microrganismo, inibendo di fatto
l'interazione tra microrganismo e mucina. In questo modo possono sfuggire alla
fagocitosi. La pneumolisina lega il colesterolo della membrana della cellula ospite e
crea dei pori, attività che può distruggere le cellule epiteliali ciliate e fagociti.
Lo S.pneumoniae è comunemente presente nella gola e nel nasofaringe di persone
sane, nelle prime vie respiratorie quindi, a partire dalle quali, in presenza di
situazioni particolari, quali traumi toracici, infezioni virali etc. , può raggiungere le vie
respiratorie profonde, provocando così polmonite. La colonizzazione è più comune
nei bambini e negli adulti che vivono con bambini. La malattia pneumococcica, come
detto, compare quando i batteri che colonizzano nasofaring e orofaringe si
diffondono in siti distali, come polmoni (polmonite), seni paranasali (sinusite)
orecchie (otite media) e meningi (meningite).
- Bronchite Possono causare bronchite, un'infiammazione della mucosa bronchiale, che viene
preceduta da un'infezione acuta delle vie aeree superiori e che si presenta con tosse
con o senza secrezione.
Microbiologia Preston
60
- Polmonite E' un'infezione infiammatoria del parenchima polmonare. Si sviluppa quando i
batteri si moltiplicano negli spazi alveolari. Dopo l'aspirazione, i batteri crescono
rapidamente nell'edema, ricco di nutrienti. La guarigione avviene quando sono
prodotti anticorpi anticapsulari specifici, che facilitano la fagocitosi del
microrganismo e l'eradicazione dei batteri. I primi sintomi sono una febbre alta, tra
39-41° e violenti brividi di freddo. Successivamente troviamo una tosse produttiva,
causata da danni all'epitelio bronchiale, com formazione dell'escreato con materiale
purulento ricco di leucociti polimorfonucleati; in alcuni casi l'escreato si presenta
con strie ematiche color ruggine e il paziente presenta dolore al torace. Il
riempimento degli alveoli con liquido essudatizio e cellule infiammatorie si apprezza
all'auscultazione, dove c'è scomparsa del murmure vescicolare (murmure,
caratteristico fruscio nel torace sano, sia nella respirazione superficiale che profonda);
la consolidazione dell'essudato provoca ottusità alla percussione. Il quadro più
comune è la broncopolmonite (infiltrati densi dovuti a foci multipli di infezioni che
circondano i bronchioli); questo quadro può progredire ad interessare un intero lobo
polmonare. La polmonite si verifica quando i batteri presenti nel cavo orale vengono
aspirati, quindi la localizzazione è solitamente ai lobi polmonari inferiori. E' spesso
associata e scatenata da una precedente malattia respiratoria virale, come influenza e
morbillo. Può essere scatenata anche da condizioni che interferiscono con
l'eliminazione del batterio, come malattie polmonari croniche, alcolismo e diabete
mellito. Anche i pazienti con disfunzione splenica o splenectomia possono contrarre
una malattia pneumococcica grave, a causa della minore eliminazione batterica dal
torrente ematico e della produzione insufficiente di anticorpi precoci; in questi
pazienti però la malattia è associata a un decorso fulminante e ad un elevato tasso di
mortalità.
- Sinusite e Otite media S.pneumoniae è una causa comune di infezioni acute dei seni paranasali e
dell'orecchio. La malattia è normalmente preceduta da un'infezione virale del tratto
respiratorio superiore. L'infezione dell'orecchio medio (otite media) è riscontrata
principalmente nei bambini piccoli.
Microbiologia Preston
61
- Meningite S.pneumoniae può diffondere al
sistema nervoso centrale dopo
batteriemia, infezioni dell'orecchio o
dei seni nasali o un trauma cranico
che provoca una comunicazione tra
spazio eubaracnoideo e nasofaringe. E'
riscontrabile in neonati e adulti
immunodepressi. Generalmente è
pediatrica.
DIAGNOSTICA
La colorazione di Gram dei campioni di espettorato è un
sistema rapido di diagnosi; i microrganismi appaiono
tipicamente in diplococchi (anche per immunofluorescenza).
Il polisaccaride C dello pneumococco ha un'escrezione
urinaria e quindi può essere ricercato utilizzando un saggio
sierologico commerciale.
Non è difficile isolare S.pneumoniae da campioni di liquido cerebrospinale, se la
terapia antibiotica non è iniziata prima della raccolta del campione; se infatti è stata
somministrata anche solo una dose di antibiotico, il campione è compromesso e i
risultati saranno negativi.
Per l'identificazione può essere usato il test di solubilità alla bile, infatti
S.pneumoniae è lisato quando le autolisine batteriche sono attivate dopo esposizione
alla bile. Ancora può essere identificato questo batterio per la sensibilità
all'optochina.
TERAPIA, CONTROLLO E PROFILASSI
La penicillina è l'antibiotico di elezione, tuttavia esistono ceppi resistenti (almeno 1/3
di quelli isolati) a causa di una minore affinità dell'antibiotico alle PBP. Quindi in
caso di infezioni pneumococciche gravi è raccomandato il trattamento con un
fluorochinone (levofloxacina) o con vancomicina associata a ceftriaxone.
Microbiologia Preston
62
A scopo profilattico ci si può vaccinare contro la maggior parte degli pneumococchi
in circolazione. Il vaccino è costituito da 23 diversi polisaccaridi capsulari ed è
raccomandato per adulti e bambini di età superiore a 2 anni.
Streptococchi Viridanti
E' un gruppo eterogeneo di streptococchi α-emolitici e non emolitici. Il nome deriva
dal latino "virdis", verde, perché molti di questi batteri producono un pigmento verde
su agar-sangue. Sono presenti nell'orofaringe, nell'apparato gastroenterico e
genitourinario. Sono commensali del cavo orale, dove svolgono un ruolo essenziale
nella patogenesi della carie dentale, mentre diventano responsabili di gravi quadri
morbosi nel momento in cui penetrano accidentalmente nel torrente circolatorio.
Producono glucani responsabili dell'adesione allo smalto dentale, all'endocardio e
alle valvole cardiache. Le principali patologie che causano sono endocardite, ascessi
parodontali, cerebrali ed intestinali, oltre alle carie dentali. Gli streptococchi viridanti
sono generalmente sensibili alla penicillina.
Microbiologia Preston
63
Enterococcus
Vennero inizialmente classificati come streptococchi di gruppo D, poiché possiedono
l'antigene di gruppo D nella parete cellulare; successivamente sono stati riclassificati
nel nuovo genere Enterococcus, che include 38 diverse specie di cui solo poche sono
patogene per l'uomo. Le specie più comunemente isolate sono l'Enterococcus Faecalis
ed Enterococcus Faecium. Di minor importanza troviamo Enterococcus Gallinarum ed
Enterocuccus Casseliflavus, ma di rilievo perché resistenti alla vancomicina. Sono quasi
indistinguibili microscopicamente rispetto a Streptococcus pneumonie, vista la
disposizione in diplococchi, sferici, gram positivi e catalasi negativi; la caratteristica
che differenzia questi batteri è sicuramente la capacità di crescita con alte
concentrazioni di NaCl e bile.
Non producono tossine potenti ed hanno una relativa potenzialità di causare una
malattia, tuttavia la resistenza agli antibiotici è un fattore di rischio importante.
Questi batteri colonizzano normalmente il tratto gastrourinario ed il colon, e quindi
in pazienti che stanno facendo un trattamento con antibiotici, può capitare che
questi diffondano in altre sedi causando patologia, causando difficoltà nel curarli
vista la loro resistenza.
Gli enterococchi sono i più comuni patogeni acquisiti nell'ospedale e quindi delle
infezioni nosocomiali, sono comuni in pazienti con cateteri urinari o intravascolari, in
pazienti ospedalizzati per lungo tempo e per quelli trattati con antibiotici ad ampio
spettro. Una complicanza grave è l'endocardite, con una mortalità abbastanza alta.
Per la diagnosi, sappiamo che crescono bene in agar-sangue e agar-cioccolato e viene
differenziato da altri microrganismi tramite il PYR-test o "test spot da 5 minuti",
catalasi-negativi e disposti in diplococchi. La terapia è difficoltosa come più volte
detto.
Sono, per la maggior parte, resistenti a penicillina, vancomicina, ad aminoglicosidi e
ampicillina; attualmente si usa un cocktail di aminoglicoside e di un antibiotico attivo
sulla parete (come ampicillina e vancomicina), ma sono stati sperimentati nuovi
farmaci come linezolid, fluorochinoloni selezionati e quinupristin/dalfopristin;
tuttavia stanno cominciando a resistere anche a questo tipo di antibiotici, quindi la
profilassi, l'igiene e l'utilizzo di indumenti ospedalieri adeguati può facilitare.
Microbiologia Preston
64
Bacillus
La famiglia delle Bacillaceae comprende diversi gruppi di batteri, vari; comprende
aerobi ed anaerobi, cocchi e bastoncini e gram (+ )e (-). L'unica caratteristica in
comune è rappresentata dalla capacità di formare endospore. Sono molti i generi, ma
quelli di interesse sono due dal punto di vista clinico, e sono il Bacillus e il
Clostridium. Le due specie più rappresentative del Bacillus sono il Bacillus anthracis e
il Bacillus cereus.
Bacillus anthracis
E' un microrganismo di grandi dimensioni (1x3-8 μm), che appare disposto come
cellule singole, o a coppie o come lunghe catene serpentiformi (canna di bambù).
Sono gram positivi, sporigeni, capsulati aerobi/anaerobi facoltativi. Le spore non si
osservano nei campioni clinici, ma sono visibili dopo 2-3 giorni in coltura. Il ceppo
virulento ha sostanzialmente due caratteristiche altamente virulente, la tossina
prodotta e la capsula. La tossina non è unica, sono di due tipi, formate
dall'associazione di due componenti proteiche. Un gene presente sul plasmide pXO1,
codifica infatti per tre proteine; queste proteine sono l'antigene protettivo (PA), il
fattore edematoso (EF) ed il fattore letale (LF); da sole non sono tossiche, ma
combinandosi danno origine a due tossine importanti. La proteina PA, è una
proteina di 83 kDa, che va a legarsi a due recettori sulla superficie delle cellule ospiti
di numerosi tessuti e dopo che si lega, le proteasi dell'ospite la tagliano, rilasciando
un piccolo frammento di 20 kDa e trattenendo quello più grosso di 63 kDa sulla
superficie della cellula. Questi frammenti si autoassemblano in una struttura
eptamerica (7 frammenti) per formare un "pre-poro"; questo complesso lega
entrambe le altre due proteine, quindi LF ed EF, contemporaneamente o
separatamente; dopo che si legano, viene stimolata l'endocitosi verso un
compartimento acido. In questo microambiente si forma un poro transmembrana ed
LF e/o EF vengono rilasciate nel citoplasma. PA, in associazione con LF, dà origine
alla tossina letale, mentre in associazione con EF, dà origine alla tossina edematosa.
LF è una proteina zinco-dipendente, che taglia le MAP chinasi, e stimola i macrofagi
a produrre TNF-α, IL-1 e citochine proinfiammatorie, conducendo alla morte, mentre
EF aumentando la concentrazione citoplasmatica di cAMP, aumentando la quantità
di liquidi, provoca edema. Sia LF, che EF, inibiscono il sistema immunitario innato
Microbiologia Preston
65
dell'ospite. Il secondo elemento di virulenza come detto è la capsula polipeptidica,
codificata dai geni capA,capB e capC, localizzati sul plasmide pXO2. Il Bacillus
anthracis causa l'antrace. E' una malattia degli erbivori ed il contagio avviene con
animali infetti o con oggetti contaminati. E' alto il rischio nei paesi dove la
vaccinazione degli animali è problematica, come in Africa e fino a che nel 2001
l'attacco terroristico alle stazioni postali degli USA non ha portato a molti casi, si
contavano 5 casi nell'arco di 20 anni. L'uomo può infettarsi in tre modi:
1) L'antrace cutaneo, è una patologia che si verifica dopo inoculazione di spore del
Bacillus attraverso la cute esposta ed è il 95% delle infezioni da Bacillus anthracis.
Inizia con lo sviluppo di una papula non dolente nel punto di contaminazione, che
rapidamente diventa un'ulcera; la percentuale di mortalità di pazienti non trattati
è del 20%.
2) L'antrace gastrointestinale viene contratto molto raramente, perché contratto per
ingestione. La malattia invade progressivamente l'apparato digerente, non
lasciando scampo ai pazienti, con una mortalità del 100%.
3) L'antrce da inalazione si contrae inalando le spore dell'antrace, e normalmente
avveniva durante la lavorazione delle pellicce, sempre fino al 2001. Questa
patologia può manifestarsi dopo anche due mesi, quindi ha una grande latenza
asintomatica; sono latenti negli orifizi nasali oppure raggiunge le vie respiratorie
inferiori, dove i macrofagi alveolari ingeriscono le spore inalate e li trasportano ai
linfonodi del mediastino. I primi sintomi non sono specifici, ma troviamo febbre,
mialgie e tosse non produttiva, ma nello stadio successivo la situazione è ben più
grave, con aumento rapido della febbre, edema ed aumento dei linfonodi
mediastinici, insufficienza respiratoria e sepsi. Questi casi portano il paziente alla
morte entro tre giorni dai primi sintomi, se non si sospetti il carbonchio.
Le diagnosi di laboratorio non sono così complicate, perché i microrganismi
colonizzano le ferite e si possono osservare nel sangue come lunghi e sottili bacilli
gram-positivi. Le spore come detto si osservano nelle colture, ma non
immediatamente. La capsula si osserva col blu di metilene oppure con
immunofluorescenza. Le colonie sono non-emolitiche ed immobili. Si può usare la
PCR. Il trattamento migliore è sicuramente la prevenzione, quindi la vaccinazione
degli animali, ma il farmaco di elezione è la ciprofloxacina per l'antrace cutaneo,
mentre per l'antrace da inalazione è sempre la ciprofloxacina, assieme ad uno o due
antibiotici aggiuntivi, come la vancomicina. Sensibili a penicillina.
Microbiologia Preston
66
Bacillus Cereus
Il Bacillus cereus è ubiquitario e tutte le infezioni originano da una sorgente
ambientale. La specie cereus è comune nel causare delle gastroenteriti ed infezioni
oculari. La gastroenterite è causata da una delle due enterotossine di questo batterio,
quali l'enterotossina stabile al calore e l'enterotossina labile al calore. Questo
bacillo è responsabile di due forme di intossicazione alimentare. La forma labile al
calore stimola il sistema dell'adenilato ciclasi-adenosina monofosfato ciclico nelle
cellule epiteliali intestinali, causando una profusa diarrea acquosa, quindi causa una
forma diarroica della malattia. Il meccanismo di quella stabile è sconosciuta, ma
causa vomito o forma emetica dell'intossicazione. La forma emetica è causata dal
consumo di riso contaminato, dove la maggior parte dei batteri viene uccisa durante
la cottura iniziale del riso, ma le spore sopravvivono e se il riso avanzato non viene
refrigerato, le spore germinano e i batteri possono replicarsi rapidamente. La forma
emetica della malattia è un'intossicazione causata dall'ingestione dell'enterotossina e
non dei batteri, che ha un incubazione di circa 6 ore e che causa vomito, nausea e
crampi addominali per circa 8-10 ore, quindi un periodo breve, in cui il trattamento
sintomatico è sufficiente per una guarigione. La forma diarroica deriva dal consumo
di carne, vegetali e salse contaminate, il periodo di incubazione è più lungo e anche i
sintomi durano di più e comprendono diarrea, nausea e crampi addominali e come
detto è causata dalla enterotossina termolabile.
Inoltre può causare delle infezioni oculari, che si verificano dopo lesioni traumatiche
causate da penetrazione nell'occhio di un oggetto contaminato da terreno. Sono
implicate delle tossine diverse, la tossina necrotica, la cereolisina e la fosfolipasi C.
Le altre infezioni possono essere causate da catetere endovenoso, da shunt del
sistema nervoso centrale ed endocardite. Una malattia rara è una grave polmonite che
mima l'antrace nei pazienti immunocompetenti, ma ne sono stati descritti solo 4 casi,
peraltro tutti nel Texas, in persone che lavoravano il metallo.
Il trattamento dell'infezione oculare è quello che necessita di più attenzione e
rapidità, di un'aggressione antibiotica più pronunciata e quindi viene usata la
vancomicina, la ciprofloxacina, la gentamicina e la clindamicina, mentre le penicilline
e le cefalosporine sono inefficaci.
Microbiologia Preston
67
Listeria ed Erysipelothrix
Si tratta di un genere di incerta classificazione, ma sono dei bacilli gram-positivi,
aerobi, non sporigeni. Il più importanti di questo tipo sono sicuramente Listeria ed
Erysipelothrix. Nel genere Listeria il più importante è sicuramente Listeria
monocyotogenes, mentre per il secondo genere è Erysipelothrix Rhusiopathiae.
Listeria monocytogenes
Così chiamato perché estratti della membrana stimolano la produzione di monociti
nei conigli, ma ciò non è stato dimostrato anche nell'uomo; Listeria deriva dal nome
del chirurgo inglese Lister. E' un bacillo corto, gram-positivo, senza ramificazioni,
anaerobio facoltativo, che cresce ad una grande concentrazione di sali; appaiono
singoli o in corte catene e possono essere confusi con S.pneumoniae e possono
entrambi causare meningite, quindi va fatta molta attenzione. Sono mobili a T°
ambiente e presentano una debole β-emolisi. E' ampiamente diffuso in natura e la
malattia è ristretta a popolazioni definite, come neonati, anziani, donne in gravidanza
e pazienti con difetti dell'immunità cellulo-mediata. E' un patogeno facoltativo
intracellulare che, dopo l'ingestione di cibo contaminato, riesce a sopravvivere agli
enzimi proteolitici, sali biliari e acidi gastrici. L'infezione inizia negli enterociti o
nelle cellule M delle placche di Peyer. Quando penetrano, il pH del fagolisosoma
attiva un'esotossina, o listeriolisina O, e due fosfolipasi C, che causano il rilascio dei
batteri nel citosol della cellula, dove i batteri si replicano e si muovono verso la
membrana cellulare. Il batterio viene fagocitato dalla cellula adiacente per
ricominciare nuovamente questo ciclo di lisi del fagolisosoma, replicazione batterica
e movimento verso la membrana. L'ingresso dei macrofagi causa il trasporto dei
batteri al fegato e alla milza, causano la diffusione della malattia. L'immunità umorale
non è così attiva, in quanto questi batteri possono replicarsi all'interno delle cellule,
evitando così l'attacco degli anticorpi e di conseguenza, quei pazienti che hanno un
deficit della risposta cellulo-mediata, sono particolarmente sensibili a infezioni gravi.
I fattori di virulenza più importanti sono l'emolisina tiol-dipendente, la cui azione
emolitica è ben evidenziabile in piastre di agar-sangue, ma non sembra rilevante per
l'attività patogena in vivo; inoltre i lipidi della parete cellulare sono in grado di
alterare il metabolismo dei carboidrati, determinando una riduzione della
gluconeogenesi e un diminuito tasso di glucosio circolante, sia nelle proteine,
probabilmente antagonizzando l'azione degli ormoni adrenocorticali.
Microbiologia Preston
68
Il gliceride A, sembra inoltre responsabile dell'intensa risposta monocitica presente
in tutte le infezioni da Listeria. L.monocytogenes può essere isolata da vari fonti
ambientali, come feci di animali, uccelli, insetti, suolo e materiale vegetale in
decomposizione, è ubiquitario. Può provocare nel 50% dei casi delle infezioni
perinatali, che si verificano in donne portatrici vaginali di Listeria, durante l'ultimo
periodo di gravidanza, a seguito di un notevole tropismo del batterio per il feto e gli
annessi fetali. Le infezioni intrauterine si traducono nell'interruzione della
gravidanza per una forma setticemica granulomatosa generalizzata, ma a volte
possono evidenziarsi clinicamente dopo il termine regolare della gravidanza con la
comparsa di meningite purulente. Le malattie neonatali sono a esordio precoce se
sono acquisite in utero per via transplacentare, oppure ad esordio tardivo se acquisita
all'atto della nascita o dopo. Negli adulti può essere asintomatica o lievemente similinfluenzale, ma la più comune negli adulti è sicuramente la meningite la forma più
comune di infezione da Listeria. Questi microrganismi vengono identificati nei
materiali patologici mediante isolamento colturale in terreni comuni, facendo
precedere la semina del materiale in esame da un periodo di preincubazione in
brodo a 4°C, talora anche per alcune settimane. E' importante effettuare la diagnosi
differenziale con i corinebatteri pseudodifterici e gli enterococchi: i primi sono
immobili, mentre gli enterococchi sono catalasi negativi. Il trattamento prevede la
combinazione di gentamicina con penicillina oppure ampicillina.
Erysipelothrix Rhusiopathiae
E' un bastoncino gram-positivo, asporigeno, diffuso negli animali che hanno
tendenza a formare dei filamenti lunghi 60 μm, sili a capelli. Per questo motivo viene
chiamato thrix, da capello; un microrganismo sottile, simile a un capello che produce
un eritema o una lesione cutanea infiammatoria. E' un batterio ubiquitario del tubo
digerente o nelle tonsille degli animali, che sono responsabili di zoonosi, quindi di
diffusione dagli animali all'uomo; i contagi avvengono principalmente in popolazioni
specifiche, ad esempio veterinari, macellai, comunque persone a stretto contatto con
animali, che li lavorano. Le infezioni cutanee si sviluppano dopo che il batterio è
stato inoculato sottocute attraverso un'abrasione. Può essere confusa con l'erispela
streptococcica, ma da questa si differenzia per il fatto che non è suppurativa; talvolta
può diffondersi ed avere manifestazioni sistemiche. Può causare endocardite. E'
sensibile alla penicillina, antibiotico di elezione, ma anche cefalosporine.
Microbiologia Preston
69
Corynebacterium e altri bacilli gram-positivi
La famiglia Mycobacteriaceae comprende quattro diversi generi di batteri, che sono
Corynebacterium, Nocardia, Rhodococcus e Mycobacterium.
Il genere Corynebacterium comprende microrganismi ubiquitari, che colonizzano
normalmente vari distretti del corpo umano, tra cui nasofaringe e cute. Tutte le specie
possono essere considerate come patogeni opportunistici, mentre poche specie sono
associate a malattie nell'uomo. La specie più importante è sicuramente il
C.diphtheriae, che causa difterite respiratoria e difterite cutanea. Il C.diphtheriae è un
bastoncino pleomorfo di dimensioni che variano tra 0,3-0,8x 1,0-8,0 μm; il singolo
batterio è un bacillo a forma di clava. E' gram-positivo, con tipica disposizione a
"ideogrammi cinesi", immobile, acapsulato e catalasi positivo. Hanno una parete
cellulare contenente arabinosio, galattosio e acido meso-diaminopimelico (mesoDAP). Inoltre può essere presente un 6,6'-diestere del trealosio, contenente acidi
corynemicolico e corynemicolenico. La maggior parte delle specie fermenta i
carboidrati con produzione di acido lattico come sottoprodotto. I ceppi tossigenici
producono una potente esotossina.
La patogenesi consiste principalmente nel blocco della sintesi proteica provocata
dall'esotossina, ma anche dalla produzione di fosfolipasi D, produzione di ureasi,
produzione di neuraminidasi e dallo sviluppo di resistenza agli antibiotici. La tossina
difterica è il principale fattore di virulenza e viene prodotta a livello del sito di
infezione e poi si diffonde al circolo ematico per provocare i segni sistemici di
difterite; il batterio non ha bisogno di entrare nel circolo ematico per provocare
difterite. La patogenesi è basata su due eventi primari, la capacità di colonizzare la
cavità nasofaringea e/o la cute e successivamente di produrre la tossina difterica. I
meccanismi implicati nella colonizzazione sono poco chiari, anche se è dimostrato
che questo batterio produce neuraminidasi e che sulla superficie è presente il
"fattore cordale" (6,6'-di-O-mycolul-a,a'-D-trealosio). Il gene strutturale che codifica
per la tossina difterica, o gene "tox", è portato da una famiglia di fagi lisogenici, tra
cui il "corynebatteriofago β" è quello più studiato. Pertanto un ceppo avirulento di
C.diphteriae può essere convertito al fenotipo virulento in seguito ad infezione e
lisogenizzazione da parte di un fago. La tossina difterica ha peso molecolare di 58,3
kDa ed è formata inizialmente da una singola catena polipeptidica di 535 aminoacidi.
Sono necessari due stadi perché il prodotto del gene enga secreto, prima la rottura
proteolitica della sequenza principale della proteina tox durante la secrezione della
Microbiologia Preston
70
cellula batterica, e poi per seconda, la rottura della
molecola della tossina in due polipeptidi, A e B, che
rimangono attaccati tramite un ponte disolfuro. La
tossina difterica è estremamente tossica: nell'uomo e
nelle altre epscie suscettibili, come scimmia e coniglio,
una dose di 100-150 ng/kg può essere letale. Agisce
catalizzando la ADP-ribosilazione del fattore di
elongazione-2 (EF-2), bloccando la sintesi proteica
della cellula ospite. La tossina difterica presenta tre
regioni distinte: una regione che lega il recettore, una
regione di traslocazione sulla subunità B e una
regione catalitica sulla subunità A. Il recettore per la tossina è il fattore di crescita
epidermico che lega l'eparina, presente sulle cellule cardiache e nervose, perciò la
difterite causa sintomi cardiaci e neurologici. La produzione di tossina difterica è
inversamente proporzionale alla concentrazione di ferro nel mezzo di coltura. Ciò è
dovuto al fatto che la regolazione dell'espressione del gene tox è mediata da un
repressore attivato dal ferro, DtxR, che è codificato nel genoma di C.diphteriae.
L'espressione di tox dipende dallo stato fisiologico di C.diphteriae. Il repressore si
attiva in presenza di un'alta concentrazione di ferro e così può legarsi all'operone del
gene per la tossina e prevenire la produzione della tossina. Quando la tossina si va ad
attaccare alle cellule dell'ospite, la regione di traslocazione è inserita nella membrana
endosomiale facilitando il movimento della regione catalitica nel citoplasma.La
subunità A successivamente arresta la
sintesi di proteine della cellula ospite
inattivando EF-2. Il meccanismo di
azione vede quindi 4 fasi, 1) il legame
della tossina al recettore, 2)
l'internalizzazione per endocitosi, 3)
dopo l'acidificazione dell'endosoma, la
regione di traslocazione si inserisce
nella membrana della vescicola ed
infine 4) la regione catalitica A passa
nel citosol, provocando inibizione
della sintesi proteica.
Microbiologia Preston
71
La difterite è una malattia diffusa in tutto il mondo, ed è considerata una malattia
pediatrica. Colpisce gli adulti che da bambini non hanno eseguito una vaccinazione
completa. E' presente nella popolazione perché esistono dei portatori asintomatici,
che lo albergano nell'orofaringe. In altri casi, il C.diphtheriae si ritrova sulla pelle di
persone immuni; si trasmette da persona a persona attraverso goccioline di saliva o
per contatto cutaneo. L'essere umano è la sola riserva nota per questo
microrganismo.
- Difterite respiratoria I sintomi si sviluppano dopo circa 2-4 giorni di incubazione. E'
di solito un'infezione del tratto respiratorio superiore ed è
caratterizzata da febbre, gola infiammata, senso di malessere e
faringite essudativa. L'essudato evolve in uno spesso strato di
fibrina, plasmacellule, batteri, linfociti e cellule morte di colore
grigio-verdastro, detto pseudomembrana, che si forma sul sito
di infezione ed è la risultante degli effetti combinati della
moltiplicazione batterica, della produzione della esotossina,
della necrosi del tessuto sottostante e della risposta immune
dell'ospite. L'essudato che forma la pseudomembrana ricopre
le tonsille, l'ugola, il palato, il nasofaringe e la laringe; questa
aderisce tenacemente ai tessuti del tratto respiratorio ed è
difficile da eliminare senza far sanguinare il tessuto sottostante,
provoca emorragie il distacco. Le porzioni che si distaccano
vengono espettorate. Le complicanze coinvolgono il cuore ed il
sistema nervoso. Un'evidenza clinica è la miocardite, che si
trova nella maggioranza dei pazienti con difterite ed i sintomi si
presentano dopo 1 o 2 settimane. La nurotossicità è
proporzionale alla gravità della malattia primitiva, comunque la
neuropatia inizia a partire dal palato molle e alla faringe, per
poi comprendere paralisi della motilità oculare e ciliare, con
progressione verso neurite periferica.
Microbiologia Preston
72
- Difterite cutanea Si trasmette per contatto cutaneo con altre
persone infette. C.diphtheriae colonizza la
superficie cutanea, quindi penetra nel tessuto
sottocutaneo attraverso lesioni della pelle. Si
sviluppa una papula che evolve in ulcera, che si
ricopre di una membrana grigia. Possono
verificarsi segni sistemici dovuti all'esotossina.
Colonizzano spesso le ferite anche Staphylococcus
Aureus e Streptococcus Pyogenes.
Le persone a rischio di contrarre le infezioni da questo batterio sono ovviamente le
persone non vaccinate, persone che vivono in aree urbane affollate e povere, dove il
livello protettivo di immunità indotta dal vaccino è bassa, e bambini e adulti con
scarsa immunità. Per effettuare una diagnosi di laboratorio si prendono dei campioni
biologici, quali i tamponi nasofaringei e gola; poiché le lesioni sono spesso ricoperte
dalla pseudomembrana, è necessario esporre accuratamente la superficie prima di
effettuare il tampone. Per l'esame microscopico viene impiegata la colorazione di
Gram e quella, specifica, di Gins e Albert. Per l'isolamento primario vengono
impiegati terreni di coltura come il terreno di Loeffler, il terreno di Pergola, l'agartellurito di Mueller-Miller o l'agar Tinsalde; le colonie sono grigio-nere; molti ceppi
richiedono acido nicotinico e pantotenico; per la produzione in vitro, il terrendo deve
essere privo di ferro. C.diphtheriae può essere identificato come biotipo mitis,
intermedius o gravis, sulla base della fermentazione dei carboidrati, della morfologia
della colonia e del tipo di emolisi in agar-sangue (gravis e mitis sono quelle
patogene). Tutti i ceppi sono saggiati per la produzione di esotossina, mediante il "test
di Elk", un test di immunodiffusione. L'immunizzazione con il tossoide difterico è
molto efficace (circa il 97% di protezione). Il tossoide difterico si ottiene inattivando
la tossina con formaldeide a 37°C in ambiente leggermente alcalino. La corretta
vaccinazione rpevede 3 dosi, a partire dal secondo mese di vita, distanziate di 4-8
settimane, seguite dalla quarta dose dopo un anno dalla terza. Il tossoide difterico è
uno dei componenti del vaccino DPT (difterite, pertosse, tetano). Il trattamento
rilevante è la somministrazione dell'antitossina difterica, che impedisce che
l'esotossina si leghi alle cellule dell'ospite, evento letale. Si può prescrivere anche
terapia a base di penicillina o eritromicina, per eliminare i batteri e l'eventuale
produzione di tossine.
Microbiologia Preston
73
Esistono altre forme di Corynebacter, quali Corynebacterium Jeikeium, che è un
opportunista, particolarmente importante per i pazienti con disordini ematologici e
cateteri intravascolari, quindi pazienti che sono stati ricoverati per molto tempo,
anche per pazienti che hanno subito una terapia antibiotica o chemioterapica; la sua
presenza non è comune sulla cute di persone sane, più presente in pazienti
opedalizzati, sono molto resistenti agli antibiotici, causano setticemia ed infezioni
opportunistiche. Un'altra specie è Corynebacterium Urealyticum, che può infettare il
tratto urinario, è un potente produttore di ureasi, tale da rendere alcaline le urine,
cosa che può portare alla formazione di calcoli renali e più in generale infezioni del
tratto urinario, più infezioni opportunistiche. Ancora di rilevanza è la specie
Corynebacterium ulcerans, strettamente correlato al C.diphtheriae, infatti causante la
difterite.
Nocardia
Sono batteri Gram positivi, aerobi obbligati, che
formano filamenti ramificati in coltura, simili a
muffe, per questo anticamente classificati come
un fungo, ma sono Gram positivi, anche se si
colorano debolmente con la colorazione di Gram,
tali da apparire Gram negativi; questa
catratteristica è dovuta al fatto che hanno una
parete cellulare simile ai Micobatteri, con acido
10-metilstearico (acido tubercolostearico), acido meso-diaminopimelico (meso-DAP),
arabinosio, galattosio e acidi micolici, anche se la lunghezza degli acidi micolici in
questi batteri è più breve rispetto ai Micobatteri, motivo per cui, Nocardia a
differenza di questi, è descritto come debolmente acido-resistente, caratteristica
utilissima per distinguere questo batterio. Nocardia inoltre possiede il trealosio legato
a due molecole di acido micolico, o fattore cordale, un importante fattore di
virulenza. Sono catalasi-positive, ossidano i carboidrati e l'isolamento può richiedere
anche 5 giorni per formare le prime colonie in coltura.
Il principale fattore di virulenza è la capacità di questi batteri di evitare il killing
fagocitico; quando i fagociti entrano in contatto con il batterio, rilasciano intermedi
dell'ossigeno tossici, ma il batterio si protegge attraverso la secrezione di catalasi e
superossido dismutasi. Ancora, possono addirittura sopravvivere e replicarsi
Microbiologia Preston
74
all'interno di macrofagi in tre modi diversi: 1) riescono a prevenire la formazione del
fagolisosoma, 2) prevenire l'acidificazione del fagosoma e 3) evitare l'eliminazione
dalla fosfatasi acida mediante la metabolizzazione dell'enzima come fonte di carbonio.
Le infezioni causate da questo batterio sono di tipo esogeno, quindi causate da
microrganismi che non fanno parte della normale flora microbatterica dell'uomo, e la
loro presenza è ubiquitaria. Causa malattie broncopolmonari, nei pazienti
immunocompromessi, con spiccata tendenza a diffondersi per via ematica fino a
sistema nervoso centrale o cute. La malattia si sviluppa dopo una prima
colonizzazione del tratto respiratorio superiore per inalazione e poi per aspirazione
delle secrezioni orali nelle vie aeree inferiori. Le infezioni broncopolmonari non
sono distinguibili da quelle provocate da altri
batteri piogeni, se non che si sviluppano più
lentamente e che avvengano quasi sempre in
pazienti immunocompromessi; i sintomi
sono dispnea, tosse, febbre ed anche
formazione di ascessi e diffusione alla pleura
sono comuni. In pazienti immunocompetenti
causa delle infezioni cutanee, che può avere
quattro presentazioni cliniche, quali il
micetoma, infezioi linfocutanee superficiali
con formazione di ascessi e cellulite. Si
verifica per via della penetrazione di questi batteri nei tessuti sottocutanei a seguito
di un trauma. Il micetoma è un'infezione cutanea cronica non dolorosa a carico dei
piedi (principalmente), con gonfiore, suppurazione e formazione di fistole multiple.
Le infezioni linfocutanee riguardano noduli cutanei e ulcerazioni lungo il decorso
dei vasi linfatici. Possono riscontrarsi ascessi cerebrali, con deficit in rapporto alla
localizzazione dell'ascesso che si sviluppa.
Non è difficile prelevare dei campioni nelle infezioni, perché normalmente sono
distribuite negli ascessi, ma possono essere confuse con microrganismi del genere
Actinomyces, ma si differenziano per l'acido-resistenza. L'isolamento delle Nocardie,
può essere effettuato con terreni usati per l'isolamento dei batteri del genere
Legionella (agar tamponato con estratto di lievito e carbone); inoltre se si sospetta
nocardiosi, è bene segnalarlo al laboratorio, in quanto le colonie possono formarsi
anche dopo una settimana, mentre nei campioni normalmente si formano colonie
dopo 3 giorni.
Microbiologia Preston
75
Per il trattamento serve la combinazione di antibiotici in pazienti gravi, come
amikacina più un carbapenemico o cafalosporine ad ampio spettro, comunque i test
di sensibilità devono essere da guida per la scelta dell'antibiotico adeguato. Per le
infezioni localizzate si usa il trimetoprimsulfametossazolo.
Poiché sono microrganismi ubiquitari, è impossibile evitare l'esposizione.
Rhodococcus (correlato a Nocardia)
E' un genere di batteri gram positivi, debolmente acido-resistenti, che inizialmente
sembrano bacilliformi, ma tornano cocchi successivamente, e non si osservano le
"ife" caratteristiche nelle nocardie (somiglianza alle muffe). Rhodococcus equi è il più
rilevante, patogeno veterinario, che colpiva sostanzialmente gli erbivori, ma causa una
malattia a veterinari ed allevatori e in pazienti immunocompromessi. E' un
microrganismo intracellulare facoltativo, che sopravvive all'interno dei macrofagi e
provoca un'infiammazione granulomatosa con formazione di ascessi. I pazienti
immunocompromessi presentano una malattia polmonare invasiva (polmonite e
ascessi polmonari), con disseminazione osservata nei siti ematici e distali (linfonodi,
meningi, pericardio e cute); nei pazienti immunocompetenti sono causa di infezioni
opportunistiche. Le lesioni da Rhodococcus sono difficili da curare, ma si
raccomandano antibiotici per via orale, come eritromicina; per le infezioni
disseminate e nei pazienti immunodeficienti, devono essere utilizzate combinazioni
di antibiotici endovenosi, come vancomicina, impenem, ciprofloxacina,
aminoglicosidi e rifampicina/eritromicina. L'efficacia deve essere confermata in vitro.
Gordonia e Tsukamurella
Sono classificati nel genere Rhodococcus, per somiglianza morfologica, acidi micolici e
parziale acido-resistenza. Presenti nel suolo e sono rari patogeni opportunisti per
l'uomo. Gordonia è associato ad infezioni polmonari, cutanee e nosocomiali (cateteri
intravascolari), mentre Tsukamurella è associato a infezioni da catetere.
Microbiologia Preston
76
Mycobacterium
Il genere Mycobacterium comprende bacilli immobili,
asporigeni, aerobi stretti, del diametro di 0,2-0,6x1-10
μm. La parete cellulare è ricca di lipidi, che rendono la
superficie idrofobica e i micobatteri resistenti a molti
disinfettanti e a comuni colorazioni di laboratorio. Una
volta colorati, questi bacilli non possono essere
decolorati con soluzioni acide, quindi vengono chiamati
batteri acido-resistenti. I batteri appartenenti a questo genere si classificano in base
a: acido-resistenza; presenza di acidi micolici contenenti 60-90 atomi di carbonio;
elevata concentrazione di G:C (61-71%) nel loro DNA. Crescono molto lentamente e
siccome impiegano 12-24 ore per ogni divisione, bisogna aspettare molto tempo per
notare una crescita, anche 8 settimane prima che venga rilevata la loro crescita.
Mycobacterium Tuberculosis
Hanno una parete cellulare ricca di lipidi e,
come detto un tempo di generazione di
12-24h, quindi le colonie sono visibili dopo 40
giorni. La loro parete ha una struttura
complessa, di natura polisaccaridica e
proteica, i cui lipidi complessati con le cere
formate da acidi grassi a catena lunga (acidi
micolici), hanno una potente azione adiuvante
la patogenicità. Lipidi con acidi micolici sono
presenti anche in Nocardia e Corynebacterium.
I lipidi conferiscono diverse proprietà, come
già detto, l'acido-resistenza, la lenta crescita, la resistenza ai detergenti, ai comuni
antibiotici, alle colorazioni tradizionali (utilizzata la colorazione con carbolfucsina,
metodo di Zihel-Neelsen) e l'antigenicità. I lipidi costituiscono il 60% del peso secco
della parete cellulare e il 30% del peso secco del corpo batterico. Le proteine di
trasporto e le porine sono disseminate nei vari strati della parete e costituiscono il
15% del peso secco della parete. Questa struttura della parete batterica non è unica
del M.tuberculosis, ma è condivisa anche dagli altri micobatteri, quali M.leprae,
M.bovis e MOTT o micobatteri non tubercolari (M.avium complex). Il fattore cordale è
un particolare derivato degli acidi micolici, importante fattore di virulenza del
Microbiologia Preston
77
M.tuberculosis. Il Liparabinomannano (LAM), correlato all'antigene
lipopolisaccaridico O, è una molecola della parete che facilita la sopravvivenza del
mycobacterium all'interno dei macrofagi.
Il M.tuberculosis possiede solamente due classi di antigeni, gli antigeni
lipopolisaccaridici e gli antigeni proteici. I lipidi e le cere formate dagli acidi micolici,
legate a glicolipidi fenolici, hanno una potente azione sull'immunogenicità delle
porzioni polisaccaridiche e proteiche della membrana.
I lipidi di superficie (peptidoglicolipidi e oligopolisaccaridi, fosfoglicolipidi e il fattore
cordale, sono altamente antigenici e sono i responsabili della risposta cellulo-mediata
dell'ospite. Il M.tuberculosis non produce esotossine, solo alcune emolisine e lipasi,
non è provvisto di endotossina e non sintetizza la capsula.
I fattori di virulenza sono i componenti cellulari, dotati di azione tossica nei confronti
dei macrofagi, inibendo il killing macrofagico attraverso la mancata fusione del
fagosoma-lisosoma (bloccando la molecola ponte specifica, l'antigene endosomico
precoce 1 o EEA1), ma nel frattempo il fagosoma è comunque in grado di fondersi
con altre vescicole intracellulari, fattore che favorisce la crescita e la replicazione
grazie a questo rifornimento di nutrienti; un secondo meccanismo è la mancata
acidificazione del fagolisosoma; l'inibizione del killing premette la crescita
intracellulare in macrofagi alveolari inattivati. Quindi osserviamo ad un'infiltrazione
di macrofagi e linfociti T. La tubercolosi sebbene possa coinvolgere qualsiasi organo,
la maggior parte delle infezioni nei pazienti immunocompetenti è limitata ai polmoni;
troviamo una tubercolosi primaria ed una tubercolosi post-primaria (o secondaria; ne
parlerò nell'epidemiologia della malattia); il contagio può avvenire per l'inalazione di
aerosol infetti, per ingestione da parte dei macrofagi alveolari inattivi, blocco fusione
lisosoma-fagosoma (fattore cordale) e acidificazione del fagosoma e moltiplicazione di
patogenii intracellulari.
Il contagio avviene per via aerogena, attraverso le goccioline di saliva, particelle di
1-5μ di diametro, che contengono il bacillo di Koch e sono in grado di arrivare agli
alveoli. La carica infettante è bassa, infatti alcune decine di microorganismi sono
sufficienti per provocare l'infezione. Le particelle vengono emesse con lo starnuto,
tosse, catarro o semplicemente respirando e parlando; altri casi possono essere
durante l'aerosol o bronco lavaggi. Altre modalità meno frequenti sono l'ingestione
di latte non pastorizzato contaminato col M.bovis o incidenti di laboratorio. I fattori
Microbiologia Preston
78
che determinano la possibilità di contrarre la TBC sono il numero di organismi
espulsi, la concentrazione degli organismi nell'aria, determinata dal volume dello
spazio e dalla ventilazione, oppure il tempo di esposizione all'aria contaminata ed
infine l'immunità individuale (HIV+ hanno maggiore probabilità di contrarre TBC).
Ogni paziente contagioso infetta 10-15 contatti l'anno.
(breve riassunto di ciò che accade quando il batterio viene inalato) Il Mycobacterium
Tuberculosis quando viene inalato può andare incontro a due vie. La maggior parte dei
bacilli vengono intrappolati nelle alte vie respiratorie ed espulsi dalle cellula mucose
provviste di ciglia e quindi il processo si ferma. Non è finita qui, perché una piccola
frazione (<10%) raggiunge gli alveoli, dove i macrofagi attivati in modo aspecifico,
inglobano i bacilli; a questo punto, una parte dei batteri vengono uccisi, con la
conseguente presentazione di diversi materiali antigenici ai linfociti Th e l'innesco
della risposta immunitaria, ma ancora, una parte dei batteri riesce a sopravvivere e a
moltiplicarsi, così da poter uccidere i macrofagi e i batteri si liberano nell'ambiente
esterno, danneggiando così i tessuti circostanti. Con l'immunità cellulo-mediata,
vediamo la comparsa di macrofagi attivati e di linfociti TCD8 citotossici, e si verifica
un contenimento dell'infezione con l'attivazione di un processo infiammatorio
granulomatoso, quale il tubercolo, che è ricco di linfociti e macrofagi attivati, così
come di cellule giganti ed epitelioidi. Nel soggetto resistente il processo
infiammatorio rimane localizzato con la formazione del complesso primario che può
andare incontro a sterilizzazione, oppure può causare un'infezione cronica
paucibacilare, asintomatica, con persistenza dei micobatteri. L'infezione cronica può
subire una sorveglianza immunologica ottimale, oppure può mancare di questa
sorveglianza, così da riattivare il complesso primario, riprendere la moltiplicazione
dei batteri, formare lesioni granulomatose multiple, liquefazione della porzione
centrale e diffusione dell'infezione. L'equilibrio tra l'attività battericida dei
macrofagi e virulenza del batterio determinano gli eventi successivi, infatti la
virulenza del batterio è associata alla sua capacità di resistere al killing intracellulare.
La replicazione intracellulare nei macrofagi alveolari inattivi, genera nuovi bacilli,
detriti cellulari e batterici, che inducono fattori chemiotattici dell'ospite (C5a), e
richiamano i macrofagi e i linfociti circolanti. I primi a migrare, in 4 ore, sono i
neutrofili, che vengono poi sostituiti entro 12 ore dai monociti-macrofagi e linfociti T
(linfociti TCD4+ e CD8+). Un ruolo centrale è rivestito dai linfociti T-helper e in
particolare la sottoclasse Th1, che produce IFN-γ e IL-2, e la sottoclasse Th2 che
Microbiologia Preston
79
produce IL-4, IL-5, IL-6, IL-10 e IL-12. Queste citochine sono in grado di attivare i
macrofagi, ora in grado di contrastare i micobattteri e limitare l'infezione primaria.
L'attivazione dei linfociti T-helper porta anche alla produzione di anticorpi, risposta
inefficace nel controllo della malattia, perché i micobatteri sono protetti dalla loro
localizzazione intracellulare. Le cellule Th-1 attivate rilasciano IFN-γ e IL-2, che
attivano i macrofagi; questo meccanismo amplifica la risposta dei macrofagi, che
adesso hanno una capacità aumentata di produrre intermedi metabolici dell'ossigeno
e così possono uccidere i micobatteri; i linfociti Th-1 hanno un ruolo cruciale nelle
difese antibatteriche e antifungine, nei confronti di quei patogeni che permangono
all'interno dei macrofagi. I linfociti T citotossici possono anche lisare cellule
fagocitiche contententi micobatteri in replicazione, permettendo così la fagocitosi e
l'uccisione dei micobatteri da parte dei fagociti attivati. Se esiste uno stimolo
antigenico, quando i macrofagi sono attivati, i bacilli possono essere limitati nella
crescita, con minimo danno tissutale. Se invece sono presenti molti bacilli, la risposta
immunitaria cellulo-mediata, provoca necrosi tissutale. Non si conoscono tossine o
enzimi batterici coinvolti nel danno tissutale. Lo sviluppo della risposta cellulomediata riesce a contenere l'infezione attraverso l'attivazione di un caratteristico
processo infiammatorio di tipo granulomatoso, che si manifesta istologicamente
mediante la delimitazione dei batteri da parte di cellule epitelioidi e cellule giganti
multinucleate, derivanti dalla fusione di più macrofagi. Macrofagi alveolari, cellule
epitelioidi e cellule giganti di Langhans (cellule epitelioidi fuse) con i micobatteri
intracellulari, formano il nucleo centrale di una massa necrotica che è circondata da
una spessa parete di cellule T CD4+, CD8+, NK e macrofagi. Questa struttura,
chiamata granuloma, impedisce l'ulteriore diffusione dei batteri. Se il granuloma è di
piccole dimensioni, i batteri intracellulari vengono efficacemente uccisi; granulomi di
grandi dimensioni o caseosi vengono incapsulati da fibrina che protegge
efficacemente i batteri dal killing macrofagico. Il granuloma ha dei pro e dei contro:
infatti riesce a delimitare l'infezione lasciando il batterio in uno stato di quiescenza
per molto tempo, tuttavia questo potrebbe riuscire a liberarsi qualora il sistema
immunitario è deficitario o comunque compromesso; possono essere riattivati a
distanza di anni, quando la risposta del paziente cala come esito di età avanzata, di
una malattia immunosoppressiva o anche di una terapia. Questo processo è la
ragione per cui, nei pazienti di M.tuberculosis, la patologia può non svilupparsi fino a
tarda età. Il tubercolo, è un denso infiltrato di cellule giganti polinucleate
(c.Langhans), cellule epitelioidi (macrofagi stipati a raggiera) e strato di fibroblasti che
Microbiologia Preston
80
producono grosse quantità di collagene. I tubercoli vanno poi incontro a fibrosi o
calcificazione. Nella zona centrale, il granuloma tubercolare, si instaura una necrosi di
tipo caseosa. Si definisce complesso primario la presenza, nel contesto delle vie
respiratorie, di un granuloma tubercolare, associato ad infiammazione dei linfonodi
corrispondenti e delle vie linfatiche che collegano il granuloma ai linfonodi (quindi
complesso primario=granuloma+linfoadenite+linfangite). La necrosi caseosa nel
granuloma tubercolare data dalla morte dei macrofagi che, fagocitati i batteri, non
riuscendo a ucciderli con i loro lisosomi, muoiono, per eccessiva produzione di
intermedi reattivi dell'ossigeno ROS e nitrossidi; questo materiale necrotico viene
circondato da cellule giganti di Langhans, cellule epitelioidi e linfociti, è
avascolarizzato, con assenza di O2 (ambiente anaerobio) e ricco di ioni calcio, che
determina in alcuni casi la morte del batterio o per ipossia o per intrappolamento in
depositi di calcio. Queste lesioni quindi possono andare incontro a calcificazione o
fibrosi, e tenere "incarcerati" i bacilli tubercolari attivi anche per tutta la vita,
un'infezione latente. nel corso della vita i bacilli in queste lesioni possono andare
incontro ad una riattivazione ed allora si parlerà di Tubercolosi Secondaria o PostPrimaria. Le lesioni tubercolari, che vanno incontro a fibrosi e calcificazione,
all'indagine radiologica, costituiscono il cosiddetto complesso di Ghon, lesione+stria
linfangitica+adenopatia ilare caldificate. Nel complesso primario (tubercolosi
primaria) possono persistere dei micobatteri, che rimangono vitali per lunghi periodi,
anche decenni, in una sorta di letargo metabolico. Il persistente contenimento
dell'infezione richiede una continua sorveglianza immunologica ad opera di
macrofagi attivati e specifici linfociti CD4 e CD8 di memoria.
Microbiologia Preston
81
Il M.tuberculosis è più virulento in pazienti infetti da HIV, rispetto a pazienti HIVnegativi, perché in soggetti normoresponsivi, attivata l'immunità cellulare, la
replicazione batterica diminuisce o cessa nel giro di 3-6 settimane. Il 5% di soggetti
esposti svilupperò la malattia entro 2 anni e un altro 5-10%
tardivaementetardivamente nella vita. Circa il 10% dei pazienti HIV positivi sviluppa
la malattia attiva entro un anno dall'esposizione. Nei pazienti HIV positivi l'infezione
(non controllata dall'immunità cellulo-mediata) diffonde rapidamente a sedi
polmonari ed extrapolmonari (midollo osseo, milza, reni e SNC) con esito fatale.
Pazienti AIDS in latenza clinica, le cellule CD4+ sono meno di 100 cellule per mm
cubico (valori normali 1000-1100 cellule per mm cubico); tutte le alterazioni
dell'immunità cellulo-mediata, in sostanza, sono dei fattori predisponenti. Nel caso in
cui il complesso primario non venga completamente sterilizzato, si può assistere,
anche a distanza di parecchi anni, con l'insorgere di immunodeficienze, ad una
riattivazione del complesso primario (tubercolosi secondaria) con ripresa della
moltiplicazione batterica, la formazione di lesioni granulomatose multiple confluenti
e la possibilità che i micobatteri passino n circolo, determinando la diffusione
dell'infezione in altre sedi polmonari o extrapolmonari (tubercolosi miliare,
meningea, renale, ossea).
- MANIFESTAZIONI CLINICHE
L'infezione latente è un'infezione subclinica con bacilli tubercolari senza segni
clinici, batteriologici o radiologici di malattia manifesta. La malattia polmonare è
clinicamente manifesta, primaria e post.primaria. La malattia extra-polmonare è
invece la diffusione dei bacilli tubercolari per via ematogena o linfonodale in altri
organi da focolai tubercolari primari e post-primari. Le manifestazioni possono
interessare un solo organo senza malattia attiva a livello polmonare, o possono essere
associate a quelle polmonari o possono coinvolgere più organi, quindi TBC miliare o
disseminata.
La tubercolosi polmonare ha come sintomatologia, nelle fasi precoci, dei sintomi
sistemici, come febbre (basso grado e intermittente), sudorazione notturna, perdita di
peso e anoressia, malessere generale e astenia; nelle fasi successive si osservano tosse
(inizialmente non produttiva, poi con essudato purulento), emottisi (bronchiectasie,
rottura di aneurismi), dolore toracico (se ci sono lesioni subpleuriche). L'esame di
Microbiologia Preston
82
laboratorio denota una lieve anemia e leucocitosi linfociica, lieve monocitosi ed
eosinofilia, a volte iponatriemia (per siadh).
La Tubercolosi polmonare primaria è il risultato dell'iniziale infezione che
progredisce come malattia clinicamente manifesta; è comune nei bambini negli
immunodepressi ed è frequente la disseminazione ematogena extra-polmonare, dove
si producono lesioni granulomatose (tubercolosi primaria). Nei quadri morbosi
polmonari si può osservare opacità polmonare nei lobi medi e inferiori,
ingrandimento ilare omolaterale e strie linfangitiche; adenopatia ilare isolata con
atelectasie (frequente nei bambini); escavazione con formazione di caverne; Miliare
acuta del periodo primario; possiamo osservare delle complicanze comuni, come
versamento pleurico, eritema nodoso e cheratocongiuntivite flittenulare.
La Tubercolosi post-primaria è una riattivazione endogena di un'infezione latente o
più raramente reinfezione esogena; è comune nei pazienti HIV+ che hanno un
rischio del 10% ogni anno di sviluppare la malattia; in pazienti con altre condizioni
morbose associate ad immunosoppressione; per diffusione ematogena si può andare
incontro a localizzazioni extra polmonari della malattia tubercolare. Nei quadri
morbosi polmonari possiamo osservare un focolaio infiammatorio localizzato nei lobi
superiori (infiltrato precoce di Assmann), che può andare incontro a remissione o
escavazione; lobite; broncopolmonite TBC a focolai disseminati; pleurite e
versamento pleurico; Tubercolosi miliare (diffusa o circoscritta, acuta o cronica) per
disseminazione ematogena di un focolaio riattivato.
La Tubercolosi Miliare (disseminata) è una forma progressiva e disseminata di
tubercolosi, dovuta a diffusione ematogena dei bacilli qualora il sistema immune non
sia in grado di contenere la tubercolosi (più comune nei bambini e nei pazienti HIV/
AIDS). Può seguire una forma primaria o una forma post-primaria. Presenta lesioni
tipiche che si formano negli organi, come dei granulomi giallognoli di 1-2 mm di
diametro, simili ai semi di miglio. Le caratteristiche cliniche dipendono dagli organi
coinvolti. 1)L'RX torace può essere normale nelle fasi precoci e nei pazienti HIV, ma
tipicamente si hanno quadri di infiltrato micronodulare, tubercolosi polmonare
miliare. 2) I sintomi sistemici sono febbre di origine sconosciuta, sudorazioni
notturne, anoressia e perdita di peso. 3) Tubercoli corioidei all'oftalmoscopia sono un
segno patognomico presente fino al 30% dei casi. 4) Epatomegalia, splenomegalia e
linfoadenopatia.
Microbiologia Preston
83
La Tubercolosi linfonodale: scrofula. (25% delle extra-polmonari) E' una tumefazione
non dolente dei linfonodi, più spesso laterocervicali e sovracervicali. All'inizio i
linfonodi sono ben delimitati e di consistenza parenchimatosa, successivamente però,
vanno incontro a rammollimento e si formano tramiti fistolosi. In genere sono assenti
i sintomi sistemici (presenti al contrario negli HIV+). L'RX del torace è normale o
presenta le classiche lesioni calcificate o malattia polmonare. La diagnosi viene
effettuata tramite BAAR e esame colturale, più agoaspirato, biopsia e granulomi
all'istologico.
La Tubercolosi genitourinaria (15%) si verifica per disseminazione ematogena dei
bacilli tubercolari, in cui nell'apparato urinario, i reni sono l'organo maggiormente
colpito, ma anche vescica ed ureteri. nel 75%dei casi è monolaterale e vi è una
spiccata tendenza all'escavazione con eliminazione urinaria dei micobatteri e
successivo interessamento della vescica e dei genitali nell'uomo. I sintomi sono
disuria, dolore al fianco ed ematuria, ma anche asintomatici. Per quanto riguarda
l'apparato genitale nell'uomo, nella maggior parte dei casi accompagna o segue il
coinvolgimento renale, con sedi nell'epididimo, prostata e testicolo, dove si evidenzia
una massa scrotale; nella donna è ematogena, senza coinvolgimento renale, con sedi
salpingite nel 94% dei casi e spesso bilaterale, con dolore pelvico, irregolarità
mestruali ed infertilità. Il coinvolgimento polmonare è presente dal 40 al 75% dei
casi.
La Tubercolosi scheletrica vede la colonna vertebrale il sito anatomico più colpito.
Colpisce uno o più corpi vertebrali, in genere nella parte anteriore, con
interessamento anche dei dischi adiacenti (spondilodiscite), comune la formazione di
ascessi paravertebrali ed epidurali. La localizzazione toracica è quella più frequente,
soprattutto nei bambini, a seguire lombare e cervicale. All'esordio della patologia
vediamo dolore e febbricola, mentre nella fase avanzata, la triade di Pott
(gibbo,doloreme paraplegia).
La Tubercolosi Gastrointestinale si contrae per diffusione ematogena, deglutizione
di bacilli, ingestione di latte (M.bovis) o diffusione locale da linfonodi interessati
dall'infezione. Qualsiasi parte dell'apparato gastrointestinale può essere colpita, ma il
90% colpisce ileo terminale e cieco, con ispessimento concentrico della parete
intestinale e fibrosi con formazione di stenosi, più adenopatia mesenterica. I sintomi
solo dolore addominale (addome acuto), diarrea, ematochezia, massa palpabile e
ascite; nel 20% i casi è presente infezione polmonare.
Microbiologia Preston
84
La Tubercolosi del SNC (5%) avviene per diffusione ematogena dei bacilli tubercolari
a livello dello spazio subependimale, dove si formano dei piccoli tubercoli: dalla
localizzazione di questi e la capacità dell'organismo di contenere l'infezione dipende
dalla forma di TBC che si svilupperà. La più comune è la meningite tubercolare.
Avviene più spesso nei bambini piccoli e sieropositivi associato a disseminazione
miliare. I sintomi sono sistemici, più sintomi respiratori; per il SNC, l'esordio dei
sintomi è insidioso, con stato confusionale, cefalea, meningismo e paralisi dei nervi
cranici.
-DIAGNOSI
La diagnosi può essere effettuata in varie fasi. Vediamo un'anamnesi che dovrà essere
dettagliata, con l'individuazione di pazienti a rischio, come immigrati provenenti da
paesi ad elevata endemia, oppure individui con disagio sociale, carcerati e personale
sanitario; i sintomi e segni della malattia sistemici o organo specifici possono
indirizzare verso la tubercolosi; la storia delle malattie, infezioni o esposizione alla
tubercolosi. Ancora mediante il test della tubercolina, una intradermoreazione, o test
di Mantoux; la reattività ad un'iniezione intradermica di antigeni micobatterici può
distinguere le persone infettate da quelle non infettate, con una reazione positiva al
PPD che si sviluppa da 3 a 4 settimane dopo l'esposizione a M.tuberculosis. Le prove
di infezione ai micobatteri sono una reazione
cutanea positiva che perdura per tutta la vita e
un'evidenza radiografica di calcificazione di un
granuloma nei polmoni o in altri organi.
L'antigene tubercolinico attualmente
raccomandato è un derivato proteico purificato
dalla parete cellulare micobatterica (PPD). In
questo test una quantità specifica di antigene (5
unità tubercoliniche di PPD) viene inoculato nello
strato intradermico della cute del paziente. La reattività al test cutaneo, definita dal
diametro dell'area di indurimento, viene misurata dopo 48h; i normoresponsivi
positivi hanno un diametro di indurimento superiore a 15 mm; è una reazione di
ipersensibilità di tipo IV o ritardata. La radiografia del torace, con le lesioni
calcifiche o fibrotiche nei lobi inferiori o medi, classici della TBC primaria, oppure
anormalità, spesso nei segmenti apicali o superiori, della TBC post-primaria.
Microbiologia Preston
85
L'esame microscopico si effettua con una colorazione attraverso il metodo di ZiehlNeelsen o dell'acido resistenza. L'esame colturale prevede la raccolta dell'escreato di
primo mattino per tre giorni consecutivi; la crescita in vitro è complicata, come già
detto, per via del fatto che hanno una crescita lenta e può essere oscurata dai batteri a
rapida crescita che colonizzano normalmente determinati siti anatomici; quindi
l'escreato viene trattato con un agente contaminante (ad esempio idrossido di sodio)
per rimuovere i microrganismi che possono confondere. Per i batteri a crescita lenta,
gli attuali terreni arricchiti favoriscono la crescita dei micobatteri. Tanto che il tempo
medio di crescita è passato dalle 3-4 settimane a 10-14 giorni. Vengono effettuate
sonde di acidi nucleici, un sistema di identificazione delle specie micobatteriche
tramite l'amplificazione di sequenze geniche specifiche, codificanti per l'RNA
ribosomale 16S seguita dall'analisi di sequenza; il metodo è rapido, impiega circa 2
giorni.
Il trattamento per i micobatteri è complesso. I micobatteri sono resistenti alla
maggior parte degli antibiotici che neutralizzano gli altri batteri. Le infezioni
micobatteriche devono essere trattate per più di 6 mesi, fino a 9, affinché non si
formino dei ceppi antibiotico-resistenti. E' una terapia combinata con farmaci attivi
sulla parete (isoniazide, etionammide, etambutanolo e cicloserina) e sulla sintesi di
acidi nucleici (rifampicina e chinoloni come levofloxacina); isoniazide ed
etionammide influenzano la sintesi dell'acido micolico; etanbutanolo interferisce con
la sintesi dell'arabinogalattano; la cicloserina inibisce due enzimi, la D-alanina
sintetasi e l'alanina racemasi, che catalizzano la sintesi della parete.
Il vaccino con M.bovis attenuato è comunemente usato in paesi dove la tubercolosi è
endemica e responsabile di significative morbilità e mortalità. La vaccinazione con
M.bovis (bacillo di Calmette-Guerin, BCG) è costituita da bacilli tubercolari di tipo
bovino, vivi e attenuati. E'somministrato o per via intradermica nel braccio, o per
punture multiple della pelle. Può portare a notevole riduzione dell'incidenza se
Microbiologia Preston
86
somministrato in età giovanile; tuttavia, non può essere utilizzata in pazienti
immunocompromessi.
Asia
Resto del mondo
Africa
Dal momento che circa 1/3 della popolazione mondiale è infettata dal M.tuberculosis, è
altamente improbabile che la tubercolosi venga eliminata. India, Cina, Indonesia,
Nigeria e Sud-Africa sono le 5 nazioni con il numero di casi più elevato. Nel 2007, nel
mondo vi sono stati 9.270.000 nuovi casi di TBC (attiva): tra questi il 14,8% (1.370.000)
è a carico di individui HIV positivi (80% dei quali in Africa). La prevalenza
dell'infezione è di 13.700.000 individui. La mortalità è stata di 1.32 milioni di persone
nell'anno 2007, tra HIV negativi e 456.000 tra gli HIV+. In Italia invece dal 1995 al
2007 c'è stato un decremento del 19% nell'incidenza della TBC; attualmente
l'incidenza è di 7,7 su 100.00, quindi un paese a bassa prevalenza; la classe di età
prevalente è quella di ultra 65enni.
Isoniazide per 9 mesi è la terapia ottimale per la profilassi, che previene l'insorgenza
della tubercolosi per 20 anni nel 54-88% dei casi; oppure Rifampicina per 4 mesi
negli adulti e 6 mesi nei bambini.
Mycobacterium Avium Complex
E', al momento, la più comune micobatteriosi nei pazienti affetti da AIDS.
L'infezione è la conseguenza dell'ingestione di bacilli (cibi e acque contaminate). I
micobatteri, dopo l'esposizione, colonizzano in via asintomatica l'intestino e si
Microbiologia Preston
87
riproducono nei linfonodi loco-regionali, dove diffondono per via sistemica. E'
tipicamente disseminata senza che nessun organo sia risparmiato. Le manifestazioni
cliniche della patologia non sono osservate finché la massa dei batteri in replicazione
non compromette la normale funzione degli organi.
Mycobacterium Leprae
La lebbra, o malattia di Hansen, è causata da questo micobatterio; i batteri si
moltiplicano molto lentamente, il periodo di incubazione è prolungato, con sintomi
che si sviluppano anche 20 anni dopo l'infezione. Le manifestazioni cliniche
dipendono dalla risposta immunitaria dell'ospite. La lebbra si presenta clinicamente
in due forme: forma tubercoloide e la forma lepromatosa. La lebbra tubercoloide
varia da persona a persona mediante inalazione; i pazienti hanno una forte reazione
cellulo-mediata, con molti linfociti e granulomi presenti nei tessuti e relativamente
pochi batteri, mentre hanno una debole risposta anticorpale. In pazienti
immunocompetenti, i batteri inducono la produzione di citochine (IFN-γ, IL-2), che
mediano l'attivazione dei macrofagi, la fagocitosi e l'eliminazione dei bacilli. Si
osserva un'infiltrazione di linfociti attorno alle cellule epiteliali, la presenza di cellule
di Langhans; ha una bassa infettività. I pazienti presentano macule cutanee
ipopigmentate. I pazienti con la forma lepromatosa hanno una forte risposta
anticorpale, ma un difetto specifico nella risposta cellulo-mediata verso gli antigeni
M.leprae; è altamente contagiosa attraverso contatto con lesioni. Si osserva
un'abbondanza dei batteri nei macrofagi del derma e nelle cellule di Schwann dei
nervi periferici. Questa forma presenta macule eritematose, papule, noduli, facies
leonina, ha una distribuzione tissutale e in alcuni casi è si osservano complicanze
neurologiche per i nervi con perdita di zone sensorialiNegli USA la lebbra è rara,
circa 100 casi riportati annualmente; la maggior parte dei casi si verifica in Texas, dove
è endemica negli armadilli e produce una patologia simile alla forma lepromatosa,
altamente infettiva degli umani. La lebbra si diffonde per contatto interpersonale; si
crede che si diffonda tramite inalazione di aerosol infetti o tramite contatto cutaneo,
con secrezioni respiratorie ed essudati di ferite; numerosi bacilli di questo batterio si
riscontrano nelle secrezioni nasali di pazienti con lebbra lepromatosa. La lebbra è
un'infezione cronica che colpisce la cute e i nervi periferici. Lo spettro del
coinvolgimento tissutale è influenzato dallo stato immune del paziente.
Microbiologia Preston
88
Neisseria e batteri correlati
Della famiglia Neisseriaceae sono importanti tre generi, Neisseria, Eikenella e Kingella.
Neisseria generalità
I batteri appartenenti a questa specie sono gram negativi, aerobi, di forma coccoide
(06-1 μ di diametro) e disposti in diplococchi, immobili, asporigeni, catalasi positivi e
ossidasi positivi. Producono acido dall'ossidazione dei carboidrati, dove per
N.gonorrhoeae deriva dal glucosio, mentre per N.meningitidis non solo glucosio, ma
anche maltosio.
N.meningitidis cresce su agar nutriente, mentre N.gonohrroeae necessita di terreni
complessi, con cisteina, una fonte di energia come glucosio, un'atmosfera umida con
CO2 al 5% e una temperatura compresa tra 35 e 37 °C.
La struttura è tipica dei gram negativi, quindi con un sottile strato di peptidoglicano
compreso tra la membrana esterna e la membrana citoplasmatica interna. In
N.meningitidis, la capsula polisaccaridica è un importante fattore di virulenza, mentre
N.gonorrhoeae non presenta una vera capsula di carboidrati, ma ha una carica
negativa simil-capsulare.
Possiedono i pili, importanti nella patogenesi, che si estendono dalla membrana
citoplasmatica attraverso la membrana esterna; sono costituiti da piline, codificate da
un gruppo di geni pil.
Sono presenti le porine, che sono codificate da due geni, porA e porB, ma in
N.gonohorreae il gene porA è silente e questa proteina codificata da B rappresenta il
60% delle proteine della membrana, in N.memingitidis sono espressi entrambi. La
porina porB è estremamente variabile, quindi è un cattivo bersaglio per gli
antibiotici; nella forma gonorrhoeae è un importante fattore di virulenza, perché
interferisce con la degranulazione dei neutrofili e proteggono il batterio dalla risposta
infiammatoria dell'ospite; in più facilita l'espressione batterica delle cellule epiteliali
e rende il batterio resistente al complemento.
Sono presenti altre proteine, come Opa, o proteine di opacità e le proteine Rmp, o
proteine modificabili per riduzione. Le Opa mediano lo stretto legame con cellule
epiteliali e fagociti, e sono importanti per la segnalazione cellulare; le seconde, le
Microbiologia Preston
89
Rmp stimolano anticorpi che bloccano l'attività battericida sierica contro le neisserie.
Il ferro è essenziale per la crescita ed il metabolismo di questi batteri e questi batteri
hanno dei recettori che legano le transferrine dell'ospite, in modo tale da competere
per il ferro, motivo per il quale sono altamente patogeni.
E' presente ancora LOS o lipo-oligosaccaride, un antigene composto dal lipide A e
un oligosaccaride centrale, ma privo del polisaccaride O-antigenico dell'LPS. La
porzione A possiede attività endotossinica; le due forme di neisseria rilasciano delle
vescicole contenenti LOS e proteine di superficie, che potenziano la endotossicità e
proteggono i batteri in replicazione legando anticorpi diretti verso le proteine.
Producono anche IgA1 proteasi, che scinde la regione cerniera delle IgA1.
I gonococchi aderiscono alle mucose, penetrando all'interno delle cellule e
moltiplicandosi, passando nello spazio sub-epiteliale, ove si stabilirà l'infezione
(operazione mediata dalle Piline, porB e Opa). LOS stimola il rilascio di TNFα che
determina i sintomi della patologia. IgG3 sarà l'Ab predominante contro questa
infezione e quelli contro LOS possono attivare il complemento rilasciando così C5a,
che richiama i neutrofili.
I meningococchi scaturiscono patologia quando non sono presenti anticorpi diretti
contro la capsula polisaccaridica e altri antigeni batterici. Per questo motivo bambini
sopra i 6 mesi di vita, quando l'immunità della madre è passata, hanno una
probabilità di contrarre questa patologia, che ha un'incidenza massima nei bambini
di età al di sotto dei 2 anni. I pazienti con deficit in C5,6, 7,8 del complemento siano
6000 volte più esposti alla meningite. I meningococchi sono endocitati e sono in
grado di evitare la morte endocellulare, replicandosi e migrare nello spazio subepiteliale.
N.gonorrhoeae causa la patologia gonorrea, mentre N.meningitidis meningite. La
gonorrea si sviluppa solo nell'uomo e si trasmette principalmente per contatto
sessuale (seconda solamente a Chlamydia), con un picco di incidenza negli individui
di età compresa tra 15 e 24 anni. Il maggiore serbatoio per i gonococchi sono gli
individui asintomatici, più comune nelle donne che negli uomini, dove fino a metà
delle donne infette ha infezioni lievi o asintomatiche. La patologia meningococcica
endemica è diffusa in tutto il mondo e le epidemie sono più comuni nei paesi in via
di sviluppo. Viene trasmessa tramite gocce di Flugge tra individui a contatto stretto
prolungato, come familiari e soldati. L'uomo è l'unico portatore naturale di questo
batterio.
Microbiologia Preston
90
Neisseria Gonorrhoeae
Causa la gonorrea, un'infezione genitale che negli
uomini è confinata principalmente all'uretra, mentre
nelle donne è la cervice (poiché i batteri infettano le
cellule epiteliali colonnari endocervicali). Dopo un
periodo di incubazione di 2-5 giorni si sviluppa
(uomo) una secrezione uretrale purulenta e disuria; le
complicanze sono rare e comprendono prostatiti,
epididimiti e ascessi periuretrali. Nelle donne infettano la cervice, perché non
possono essere infettate le cellule epiteliali squamose che ricoprono la vagina; le
pazienti sintomatiche lamentano secrezioni vaginali, disuria e dolore addominale; in
più nel 20% delle pazienti troviamo infezioni genitali ascendenti, salpingiti, ascessi
tubo-ovarici e malattia infiammatoria pelvica. Le infezioni disseminate con setticemia
e infezione di cute e articolazioni si verificano nell' 1-3% delle donne infettate e negli
uomini ancora di meno. Le manifestazioni cliniche della patologia disseminata
includono febbre, artrite migrante, artrite suppurativa in polsi, ginocchia e caviglie e
un rash pustoloso su base eritematosa alle estremità ma
non su capo e tronco. N.gonorrhoeae è una delle cause
maggiori negli adulti di artrite purulenta.
Oltre a gonorrea può causare periepatite, congiuntivite
purulenta (neonati durante il parto vaginale), faringite e
gonorrea anorettale nei maschi omosessuali.
La diagnosi viene effettuata mediante microscopia con
la colorazione di Gram, che ha elevata sensibilità 90% e specificità 98% per i maschi
con uretrite purulenta, tuttavia è notevolmente minore nei maschi asintomatici,
mentre è insensibile nel riscontrare la cervicite gonococcica nelle donne.
La penicillina era storicamente l'antibiotico per il trattamento della gonorrea, ma
non viene più usata, perché è necessaria una grande quantità di farmaco e perché
sono insorte delle resistenze. Attualmente si usa il ceftriaxone. Non esiste un vaccino.
Unicamente utili l'educazione sessuale e la tempestiva e adeguata terapia.
Neisseria Meningitidis
Causa Meningite. Si accusano cefalea, rigidità nucale sepsi meningea, febbre, nausea,
confusione acuta, brividi e vomito); la mortalità raggiunge il 100% nei pazienti non
Microbiologia Preston
91
trattati, ma si riduce al 10% nei pazienti trattati. Sequele della meningite possono
trovarsi nel 10% dei casi, come alterazioni dell'udito fino a sordità (15-30%), paresi dei
nervi cranici (facciale e oculomotore), difficoltà di apprendimento (5-20%), deficit
neurologici focali (5-10%), ernie cerebrali (3-20%), Idrocefalo (3%), alterazioni della
vista (<5%) e convulsioni (<5%).
La setticemia, o meningococcemia, è potenzialmente letale, con trombosi dei piccoli
vasi sanguigni e il coinvolgimento multiorgano come caratteristiche peculiari;
possono osservarsi petecchie su tronco e arti inferiori, e possono formare lesioni più
estese; può essere causa di coagulazione intravascolare disseminata non controllata
con shock, con distruzione bilaterale delle ghiandole surrenali (sindrome di
Waterhouse Friderichsen).
Può causare polmonite (preceduta da un'infiammazione respiratoria) , artrite ed
uretrite.
Diagnosi
N.meningitidis può essere facilmente osservato nel liquido cefalorachidiano (CSF) dei
pazienti con meningite, se il paziente non ha precedentemente ricevuto terapia
antibiotica. N.meningitidis è sensibile alla penicillina, ma per i pazienti che non
possono assumerla si utilizza ceftriaxone o cloramfenicolo. Attenzione a reazioni
allergiche ed ai sulfamidici (riescono a raggiungere elevate concentrazioni liquorali,
mentre la penicillina ottiene lo stesso risultato solo quando i processi infiammatori
sono particolarmente estesi). Sono stati sviluppati vaccini diretti contro polisaccaridi
capsulari gruppo-specifici per l'immunoprofilassi anticorpo-mediata. Un vaccino
coniugato polivalente polisaccaride-proteina efficace contro i sierogruppi A,C,Y e
W135 è stato approvato negli USA nel 2005; è efficace a 2-3 settimane
dall'inoculazione, ma valevole solo per 2-3 anni.
La meningite è definita come un'infiammazione delle meningi che si caratterizza per
un numero abnorme di globuli bianchi nel liquido cerebrospinale. La sindrome
meningitica può essere causata da un'ampia varietà di agenti infettivi ed essere anche
una manifestazione di malattie non infettive. La meningite batterica è l'infezione più
comune e rilevante del SNC, che può progredire rapidamente e portare a morte o
debilitazione permanente, per questo motivo tale infezione provoca giustificabili
risposte emotive molto forti e intervento immediato, tanto che la diagnosi è la vera
forse unica urgenza in microbiologia. A seconda del decorso, la meningite può essere:
Microbiologia Preston
92
1) Fulminante, con evoluzione rapida in coma e stato di shock quasi sempre
irreversibile.
2) Acuta, esordio e sviluppo nel corso di ore o di pochi giorni.
3) Subacuta, decorso lento e insidioso, più prolungato con segni meningei sfumati,
che talora non richiamano l'attenzione del medico (solitamente causata da bacillo
tubercolare oppure dai miceti).
4) Ricorrente, ripetuti episodi anche a distanza che sono espressione generalmente
di un difetto dell'ospite, o dell'anatomia locale, oppure delle difese antibatteriche
immunologiche (esempio un trauma cranico, pazienti HIV+, etc.).
5) Decapitata, forma il cui decorso è attenuato per il precoce intervento con terapia
antibiotica. Per esempio la N.meningitidis è molto sensibile agli antibiotici, per cui
la sintomatologia è attenuata ed è alta la frequenza di falsi negativi nelle indagini
culturali del microrganismo.
La meningite è un'infiammazione delle meningi (Pia Madre, Aracnoide e Dura
Madre), tre sottili membrane che rivestono intimamente l'Encefalo e il Midollo
Spinale. In particolare, la meninge nasce all'interno dello spazio subaracnoideo, che
si trova tra la media e la più interna delle lamine, L'Aracnoide e la Pia Madre. I villi
estremamente vascolarizzati della Pia Madre si proiettano in 4 ventricoli all'interno
dell'Encefalo e sono rivestiti da cellule epiteliali ependimali. Queste proiezioni sono
conosciute come Plessi corioidei e sono i siti nei quali la componente fluida del
sangue è modificata attraverso la secrezione e assorbimento di certi soluti e convoglia
all'interno dei ventricoli sotto forma di liquido cefalorachidiano o liquor.
Il liquor circola nei ventricoli e nello spazio subaracnoidale, attorno all'Encefalo e
alla Corda spinale e ritorna al sistema circolatorio sanguigno attraverso i villi
subaracnoidali che proiettano nel Seno Sagittale Superiore nella volta interna del
cranio. Negli adulti viene prodotto da 400 a 600 ml di liquor che ricircola ogni giorno.
Il normale volume di liquor è tra i 40 e i 60 ml nei neonati e i 100 e i 160 ml negli
adulti. Le meningi delimitano con il rachide tre spazi di siti di infezioni batteriche
distinte: lo spazio epidurale tra il tavolato osseo e la Dura Madre (pachimeningite), lo
spazio subdurale tra la Dura Madre e l'Aracnoide, e lo spazio subcranoidale tra
l'Aracnoide e la Pia Madre (leptomeningite) che è la sede specifica dell'esordio della
memingite.
Microbiologia Preston
93
Eziologia. In base all'aspetto del liquor, le meningiti si dividono in due grandi gruppi,
che sono le meningiti a liquor torbido e le meningiti a liquor limpido. Per il gruppo
torbido vediamo dei batteri quali N.meningitidis, H.influenzae, S.pneumoniae, S.aureus,
S.epidermidis ed E.coli, per i miceti troviamo Candida e Mucor, mentre per i Protozoi
Naegleria e Acanthamoeba. Per il gruppo a liquor limpido batteri come M.tuberculosis,
Brucella spp., Tr.pallidum, L.monocytogenes e Leptospire, per i parassiti Toxoplasma e
Tripanosoma, per i virus Echovirus, Coxsackievirus, Poliovirus, Virus della parotite
epidemica, Virus herpes simplex di tipo 1 e 2, Cytomegalovirus, Virus della varicella-zoster,
Virus di Epstein-Barr, HIV e Parvovirus.
Gli agenti eziologici più comuni hanno delle prevalenze nelle fasce di età. Nei
bambini da 0-1 mese prevalgono E.Coli, Streptococchi di tipo B e L.monocytogenes; per
i bambini da 1-3 mesi vediamo oltre a quelli appena citati, H.influenzae e
S.pneumoniae; per i bambini da 3-mesi a 7 anni H.Influenzae (meno di 2 anni),
N.meningitidis, S.pneumoniae e virus; per i pazienti da 7 a 18 anni N.meningitidis
(maggiormente), S.pneumoniae e virus; per i pazienti da 18 a 50 anni S.pneumoniae
(maggiormente) e N.meningitidis; per i pazienti con più di 50 anni S.pneumoniae,
L.monocytogenes e Pseudomonas spp.
Diversi fattori, sia del germe patogeno, che dell'ospite, concorrono nella patogenesi
della meningite batterica. Per quanto riguarda il patogeno, presenta una capsula
polisaccaridica, un importante fattore di virulenza, che rende il batterio relativamente
resistente alle difese immuni "naturali" e ritarda l'instaurazione di una risposta
immune specifica. La sconfitta del batterio capsulato avviene grazie alla produzione
di anticorpi diretti contro i suoi agenti di superficie, che ricoprono il batterio
(opsonizzazione) e lo rendono suscettibile a difesa immune. La risposta dell'ospite è
variabile, in considerazione dell'età dell'individuo. Nel bambino al di sotto dei 2-3
anni, la risposta anticorpale verso antigeni polisaccaridici è deficitaria (a meno che
non si provveda a presentare gli stessi in associazione con antigeni proteici
fortemente immunogeni, come viene fatto nei vaccini combinati). Questo è il motivo
per cui i primi anni di vita sono un'età di maggior rischio di vulnerabilità da parte di
questi batteri. Si tratta in questo caso per lo più di casi sporadici, o piccole epidemie.
In età adulta, per lo più, la presenza di una difesa specifica contro antigeni capsulati
di diversi ceppi rende minore il rischio di meningite. In alcuni casi però il batterio va
incontro a mutazioni, che rendono i suoi antigeni di superficie del tutto nuovi: la
risposta antibiotica si sviluppa troppo lentamente rispetto alla capacità di invasione
del patogeno, che può dar luogo a meningite fulminante. Questi sono ceppi
Microbiologia Preston
94
responsabili della classica meningite epidemica. La carica infettante è un altro fattore
che influenza la patogenesi. Ci si può trovare nella condizione in cui non è
dimostrabile un processo infettivo localizzato o a distanza dalle meningi, cui
attribuire la responsabilità primaria dell'infezione (non c'è concomitante batteriemia
o viremia sistemica); oppure è evidenziabile una estensione secondaria di
un'infezione contigua parameningea (otite, mastoidite,etc.) o in alternativa, la
localizzazione "metastatica", tramite il torrente circolatorio, di una qualsiasi altra
infezione (endocardite, pleuropolmonite, nefrite, etc.). I batteri quindi possono
raggiungere le meningi attraverso varie vie:
a) Batteriemia sistemica (la più frequente).
b) Ingresso diretto dal tratto respiratorio superiore o dalla cute attraverso un difetto
anatomico (frattura cranica, meningocele, etc.).
c) Passaggio intracranico attraverso una venula dal nasofaringe (l'adesione faringea è
favorita, come nel caso dello S.pneumoniae dalla capacitò di produrre proteasi delle
IgA; oppure endocitosi come nel caso dei meningococchi; oppure per via
intercellulare, con separazione delle giunzioni serrate apicali tra le cellule epiteliali
colonnari, come nel caso dell'H.influenzae).
d) Diffusione da focus contiguo di infezione (infezione dei seni paranasali,
trasudazione da un ascesso cerebrale).
La patogenesi avviene in diverse tappe, che cominciano con l'adesione dell'agente
patogeno alla mucosa oro- o naso-faringea (N.meningitidis: pili su recettori della
mucosa; H.influenzae: giunzioni gap intercellulari), seguita poi dal superamento della
barriera mucosa, poi ancora batteriemia, penetrazione della barriera ematoliquorale
ed infine malattia meningea.
Colonizzazione e Attacco: Alcuno batteri, che provocano meningiti, hanno
"pili" (organi specifici per l'adesione), che permettono loro di attaccarsi a specifiche
cellule mucose e, successivamente, di colonizzare la superficie mucosa del
nasofaringe. La distribuzione di specifici recettori di cellule mucose ed epiteliali
probabilmente determina i siti della colonizzazione, fatto comprovato per quanto
riguarda l'H.influenzae e la N.meningitidis.
Passaggio delle Barriere mucose: La porta di entrata per i batteri in grado di
provocare meningiti, e i meccanismi attraverso i quali è ottenuta, non sono ben
conosciuti. L'ingresso è probabilmente costituito da siti attraverso cui i batteri,
Microbiologia Preston
95
attivamente (mediante invasione diretta con o senza danneggiamento della cellula
ospite) o passivamente (attraverso fagocitosi) penetrano i tessuti sub-epiteliali e
successivamente entrano nel circolo ematico. E' noto per esempio che N.meningitidis
viene fagocitata dalle cellule epiteliali del nasofaringe.
Entrata nel Liquido Cefalorachidiano: Mentre sono nel circolo ematico, i batteri che
causano meningite devono evitare di essere fagocitati dai leucociti polimorfonucleati
e dalle cellule reticoloendoteliali e devono evitare di essere lisati dal complemento e
dagli anticorpi specifici. Una volta evitato l'attacco, i batteri si riversano nello spazio
subaracnoidale e, quindi, nel liquor. Le vie di ingresso preferenziali verso questo
spazio sono aree di resistenza minima, come i plessi coronoidei, i seni venosi durali,
la lamina cribrosa, i capillari cerebrali, siti di ferite chirurgiche, traumatiche o
congenite del SNC o siti di infezione parameningee (esempio un accesso epidurale).
Lo spazio subaracnoidale e il suo liquor sono relativamente senza difese nel fermare
l'invasione di batteri piogeni a causa della povertà nel liquor di cellule fagocitiche e
basse concentrazioni del complemento e di Ig. Un'invasione a moltiplicazione
incontrollata di batteri nel liquor porta a meningite. L'infiammazione delle meningi
prende origine dalla presenza del lipopolisaccaride batterico, che pare conferisca
qualche particolare tropismo meningeo, probabilmente mediante recettori di
superficie. Gli antigeni batterici stimolano i monociti a produrre la citochina "IL-1" e
stimolano i macrofagi, gli astrociti, cellule della microglia, cellule ependimali e cellule
endoteliali nel SNC a produrre la citochina "Tumor Necrosis Factor" (o catechina). Il
TNF e l'IL-1 probabilmente agiscono sinergicamente per provocare le risposte
infiammatorie che si manifestano clinicamente come meningite.
Sintomatologia
Indipendentemente dall'eziologia, tutte le meningite presentano la stessa clinica.
L'esordio della malattia, almeno nelle forme purulente è improvviso, con:
• Febbre elevata, con brividi
• Cefalea e modesto rigor nucalis (questo nei primi mesi specie nei lattanti è
sostituito dalla nuca molle o ciondolante)
• Fotofobia
• Iperestesia cutanea con dermografismo rosso di Trosseau
Microbiologia Preston
96
• Agitazione psicomotoria e talora precoce compromissione del sensorio con
obnubilamento e torpore
I segni di una sindrome meningea sono:
1) Segni di ipertensione endocranica
2) Segni ipertonico-antalgici
3) Alterazioni psichiche
4) Segni motori
5) Sintomi sensitivi e sensoriali
6) Segni neurovegetativi
Per la diagnosi effettuare sempre una rachicentesi, qualora esista un dubbio di
meningite (escludere papilledema o deficit focali). Effettuare un TC encefalo
d'urgenza (ipertensione endocranica). Se questa non è disponibile, procedere alla
rachicentesi e iniziare sempre la terapia prima di ottenere i dati colturali.
L'Ipertensione endocranica prevede una:
• Cefalea costante: violenta, diffusa, a tratti lancinante, esacerbata dalla percussione
del cranio o dallo sfioramento del cuoio capelluto.
• Vomito cerebrale a getto: improvviso, non accompagnato da nausea o dolori
addominali ed indipendentemente dall'assunzione di alimenti.
• Bradicardia relativa.
• Papilla da stasi, solo nei casi di ipertensione che dura da diversi giorni.
I Segni ipertonico-antalgici prevedono:
• Rigidità nucale e del tronco marcata, per
contrattura altalgica dei muscoli nucali e
paravertebrali, il paziente è rigido, incapace
di ruotare la testa indipendentemente dal
tronco.
• Rachialgia e segno di Lasegue (a paziente
supino si afferra il collo del piede e si solleva
passivamente l'arto mantenuto esteso al
Microbiologia Preston
97
ginocchio; è positivo quando evoca dolore a distribuzione sciatica, indice di
sofferenza radicolare a livello della 4a e 5a lombare), spesso accompagnata ad
iperestesia cutanea lungo il rachide.
• La flessione del capo sul tronco causa dolore ed è spesso impossibile, ne deriva
come atteggiamento antalgico una
iperestensione obbligata dal capo: Opistotono.
• Posizione a "cane da fucile" con decubito
laterale, addome contratto, iperestensione della
testa e a volte anche del tronco, gambe flesse
sulle cosce e cosce flesse sul bacino. (spasmo
della muscolatura del collo, dorso e arti)
• Segno di kering: a paziente supino con coscia
flessa sulla gamba a 90°, c'è l'impossibilità di
estendere la gamba.
• Segno di Brudzinski: a paziente supino,
flettendo passivamente la nuca in avanti o alla
pressione sulla sinfisi pubica, si flettono le
cosce sul bacino e le gambe sulle cosce.
• Segno di Binda: alla rotazione passiva della
testa si ha sollevamento della spalla
controlaterale.
Le Alterazioni psichiche prevedono:
• Compromissione variabile dello stato di coscienza, come crisi d'agitazione
psicomotoria che si alternano a momenti di torpore, nei casi gravi stati subcomatosi
o fenomeni deliranti, confusionali ed allucinatori.
• Crisi epilettiche.
I Segni motori comprendono:
• Segni irritativi
• Tremori distali, clonie
• Accessi convulsivi
Microbiologia Preston
98
• Deficit
• Paresi dei nervi cranici o spinali
I Sintomi sensitivi e sensoriali comprendono:
• Iperalgesia superficiale (sfioramento cute, sollevamento coperte)
• Iperalgesia profonda (pressione anello degli adduttori, emergenze dei nervi cranici,
ventri muscolari degli arti)
• Fotofobia
• Iperacusia
I Segni neurovegetativi comprendono:
• Dermografismo Rosso di Trousseau: persistenza di una striatura rossa quando si
strofina la cute con oggetti a punta smussa.
• Turbe della frequenza cardiaca e del respiro (respiro di Biot)
• Bradicardia e stipsi per interessamento del nervo Vago
• Ritenzione urinaria
DIAGNOSI:
Segni clinici patognomonici, Esame chimico o microbiologico del liquor, Eventuali
segni e sintomi extrameningei, Epidemiologia ed Esami sierologici. Il liquor ha
determinate caratteristiche, che possono variare a seconda della condizione del pz.
Esame del Liquor:
Liquor torbido, esame diretto dopo colorazione di Gram, test al latex per evidenziare
gli antigeni, esame colturale ed identificazione di funghi o protozoi all-esame diretto
o con prove di isolamento.
Liquor limpido, esame diretto e colturale per BK, amplificazione del genoma
mediante PCR per BK, ricerca di anticorpi specifici anti/virus, isolamento del virus
dal liquor, PCR per virus ed identificazione di funghi o protozoi all-esame diretto con
prove di isolamento.
Microbiologia Preston
99
Sano
Batterica
Virale
Tubercolare
Aspetto
Limpido incolore
Smerigliato,
Lattescente,
Purulento
Limpido o
lievemente
opalescente
Solitamente limpido,
talvolta giallino,
raramente smerigliato
(solo in fase
inizialissima reticolo
di maya)
Pressione
In decubito
laterale: 10-20
cmH2O Seduto:
20-40 cmH2O
Nettamente
aumentata
Aumentate
Nettamente
aumentata
Glucosio
50-60 mm%
Riduzione netta,
talvolta sino quasi
alla scomparsa totale,
ma di breve durata
Normale o
modestamente
aumentato
Nettamente
diminuita (<30 mg
%= m.tubercolare)
Proteine
20-40 mg%
Nettamente
aumentate
Lievemente
aumentate
Nettamente
aumentate 100mg%
Cellule
3-5 elementi,
linfociti T
neutrofili
monociti
linfociti
Altri dati di laboratorio
Ricerca di endotossina: positiva per meningiti da Gram-negativi, ma non per grampositivi.
Proteina C reattiva: aumentata il circa il 95% dei soggetti con meningite batterica e
non è aumentata nella maggior parte dei pazienti con meningite virale.
Ricerca LDH: l'isoforma LDH5 è presente solo nelle meningiti batteriche.
Studi radiologici: esecuzione di TAC per documentare edema cerebrale, allargamento
degli spazi subaracnoidei, aree focali di aumentata densità a causa dell'infiammazione
cerebrale o della necrosi associata, ascessi subdurali. Comunque i pazienti con
meningite raramente presentano reperti TAC significativi in assenza di reperti
neurologici focali.
EEG: risulta alterata anche precocemente per la comparsa di onde lente molo o
polimorfe, diffuse o lateralizzate, prevalentemente nelle regioni temporo-occipitali.
Microbiologia Preston
100
Metodi rapidi
Microscopia: Una quota di tutti i campioni di liquor viene colorata con la colorazione
di Gram (o altre colorazioni comparative) e esaminata microscopicamente. Per il fatto
che l'utilità diagnostica delle procedure di colorazione dipenda dalla concentrazione
batterica nel liquor (da 10 a 10^9 CFU/ml), tutti i campioni di liquor di quantità
sufficiente vengono trattati per concentrare i patogeni prima dell'osservazione al
microscopio e della coltura.
Colorazione di Gram: Una percentuale tra il 75 e il 90% di colture liquorali positive
trovano conferma nella colorazione di Gram, le percentuali diminuiscono tra il 40 e il
60% in pazienti che hanno ricevuto la terapia antibiotica prima della puntura
lombare. La colorazione di Gram è generalmente considerata più attendibile per la
determinazione di batteri in concentrazione maggiore o uguale a 10^5 per ml
dell'intero fluido. La presenza, il numero e la morfologia dei batteri, cellule
infiammatorie, ed eritrociti vengono riportati immediatamente. L'utilità clinica della
colorazione di Gram apparentemente dipende dal batterio patogeno.
PROFILASSI E TERAPIA
Chemioprofilassi della meningite batterica (Meningococco, Pneumococco) da
eseguirsi entro 24h dalla presunta esposizione:
Rifampicina: Adulti 600 mg ogni 12 ore per 2 giorni; bambini 10mg/kg; neonati 5mg/
kg.
Ciprofloxacina: Solo adulti 500-750 mg in dose unica.
Kingella Kingae
Piccoli coccobacilli gram- che risiedono nell'orofaringe umano; anaerobi facoltativi,
fermentano carboidrati e sono responsabili di artriti settiche in bambini ed
endocarditi in tutte le età. Sensibili alla penicillina e altri β-lattamici.
Eikenella Corrodens
Di medie dimensioni, gram-, immobile, asporigeno, anaerobio facoltativo, è un
normale commensale dell'orofaringe umano. Opportunista che causa infezioni in
pazienti immunocompromessi o affetti da patologie della cavità orale. Viene isolato
nelle ferite da morso e traumi da combattimento. Suscettibile a penicillina, ma
resistente a molti antibiotici, come eritromicina e oxacillina.
Microbiologia Preston
101
Enterobacteriaceae
La famiglia Enterobacteriaceae o Enterobatteri, è
costituita da 30 generi, 120 specie e 8 gruppi enterici,
classificati in base ad Omologia genetica del DNA,
Proprietà biochimiche, sierologiche, Betteriofagi
specifici, Sensibilità agli antibiotici, Resistenza ai sali
biliari e Presenza di capsula.
Sono dei microrganismi ubiquitari, presenti nel terreno,
acqua e vegetazione di tutto il mondo e fanno parte anche della flora intestinale .
Alcuni sono sempre patogeni per l'uomo (come Salmonella Thypi, Shigella e Yersinia),
mentre altri fanno parte della flora commensale e possono causare infezioni
opportunistiche (E.Coli).
Gli enterobatteri sono gram negativi, di dimensioni che variano da 0,3-1 x 6μm, sono
sia mobili (flagelli peritrichi) che immobili, sono asporigeni, sono aerobi o anaerobi
facoltativi, fermentano il glucosio, hanno la capacità di ridurre i nitrati a nitriti, sono
catalasi positivi ed ossidasi negativi. La capacità di fermentare il lattosio consente di
discriminare tra i ceppi, infatti Escherichia,
Klebisella, Enterobacter fermentano il
lattosio, mentre Salmonella, Shigella e
Yersinia no. Alcune specie sono capsulate,
come Klebisella.
Il lipopolisaccaride è il principale antigene
della parete e come sappiamo è formato da
tre componenti, il polisaccaride somatico O
più esterno, un nucleo polisaccaridico
comune a tutti gli enterobatteri ed il lipide A
responsabile dell'attività endotossica.
La maggior parte degli enterobatteri è mobile
(eccezion fatta per Klebisella, Shigella e Yersinia), grazie a flagelli peritrichi; molti
batteri hanno fimbrie o pili che possono essere o comuni, che conferiscono la
capacità adesiva, oppure sono pili sessuali, che consentono il trasferimento genetico
tra batteri.
Microbiologia Preston
102
- Patogenesi e Immunità
Sono molti i fattori di virulenza:
• Endotossina: è comune dei gram-, e la sua attività dipende dal Lipide A, la
componente dell'LPS che viene rilasciata dalla lisi della cellula batterica. Provoca
inattivazione del complemento, rilascio di citochine, leucocitosi, trombocitopenia,
coagulazione intravascolare disseminata, shock e morte.
• Capsula: protegge da fagocitosi, grazie agli antigeni capsulari idrofili, che quindi
hanno un effetto repulsivo nei confronti della superficie idrofobica dei fagociti;
interferisce con il legame degli anticorpi ai batteri.
• Variazione di fase antigenica: la proteina flagellare H e l'antigene capsulare K sono
due importanti antigeni, che possono espressi o non espressi, sono controllati dal
genoma batterico, per proteggere il batterio dall'effetto citotossico degli anticorpi.
• Sistemi di secrezione di tipo III: è simile ad una siringa molecolare, di circa 20
proteine, che facilita la secrezione di fattori di virulenza quando il batterio entra in
contatto con la cellula ospite; in sua assenza i batteri sono avirulenti.
• Sequestro di fattori di crescita: il ferro è essenziale per la crescita del batterio, ma è
legato al gruppo -eme delle proteine e alle proteine ferro-chelanti (transferrina e
lattoferrina); i batteri producono siderofori competendo con queste proteine, inoltre
le emolisine fanno rilasciare il ferro dalle cellule dell'ospite.
• Resistenza a killing sierico: possiedono resistenza a complemento e leucociti.
• Resistenza agli antibiotici: viene veicolata da plasmidi trasferibili tra specie e anche
famiglie batteriche diverse.
Microbiologia Preston
103
Escherichia Coli
Causa una varietà di malattie, come gastroenterite,
infezioni extraintestinali, infezioni urinarie (UTI),
meningiti e sepsi. Questo batterio possiede
un'ampia varietà di fattori di virulenza, infatti
oltre ai fattori comuni agli enterobatteri possiede
le adesine e le esotossine.
E' un normale commensale del tratto
gastroenterico. Può diventare un patogeno
opportunista in seguito a perforazione intestinale,
con l'ingresso dei batteri nella cavità peritoneale.
Tuttavia, la maggior parte diventa patogena in
seguito all'acquisizione di fattori di virulenza
veicolati da plasmidi, isole di patogenicità e
gatteriofagi. Il grado di patogenicità di questo
batterio è evidenziato dal fatto che sia il gram
negativo più comune in caso di sepsi (con il 45%), che responsabile di più dell'80%
delle infezioni urinarie e che sia uno dei principali motivi di gastroenterite nei paesi
in via di sviluppo.
- Sindromi Cliniche
Gastroenterite: i ceppi di E.Coli sono suddivisi in cinque gruppi diversi
1) ETEC : sono i ceppi enterotossigeni di E.Coli, le cui infezioni colpiscono
maggiormente i bambini che vivono nei paesi in via di sviluppo e i viaggiatori
diretti in queste zone. L'infezione si acquisisce attraverso l'ingestione di alimenti o
acqua contaminati da materiale fecale. Non si trasmette da persona a persone. I
sintomi sono diarrea acquosa e crampi addominali (associati a volte a nausee a e
vomito) e non si osservano alterazioni istologiche né infiammazione della mucosa
intestinale. Questo ceppo produce due gruppi di enterotossine, le enterotossine
termolabili LT-I e LT-II, e le enterotossine termostabili STa e STb. LT-II non è
patogena per l'uomo e la II è simile alla tossina colerica, associata a malattia
Microbiologia Preston
104
nell'uomo. Questa tossina è formata da una subunità A e cinque subunità B, che si
legano allo stesso recettore della tossina colerica, o ganglioside GM1, e ad altre
glicoproteine dell'epitelio dell'intestino tenue. Dopo che è stata endocitata, la
subunità A trasloca attraverso la membrana del vacuolo; questa subunità ha attività
ADP-ribosiltransferasica ed interagisce con Gs (proteina di membrana) che regola
l'adenilato ciclasi e portando così ad un aumento dei livelli di cAMP, che stimola la
secrezione di cloro e riduce l'assorbimento di sodio e cloro, causando la diarrea
acquosa; inoltre questa tossina induce la produzione di prostaglandine e citochine
infiammatorie, che aumentano ancora la perdita di liquidi. La tossina STb non è
patogena, mentre la STa è patogena; è un piccolo peptide monomerico, che si lega
ai recettori transmembrana con attività guanilato-ciclasica, inducendo aumento
del GMP ciclico, con ipersecrezione di fluidi. Sono importanti anche le adesine dei
fattori di colonizzazione CFA (I,II,III), delle fimbrie che riconoscono recettori
glicoproteici dell'ospite.
2) EPEC : sono i ceppi enteropatogeni di E.Coli, la causa principale di diarrea
infantile nei paesi poveri, mentre è poco comune nei paesi sviluppati, ad eccezione
di epidemie negli asili. A differenza delle ETEC, queste sono altamente
contagiose, e quindi la dose infettiva è bassa. La patologia è caratterizzata da
diarrea acquosa, associata anche a febbre e vomito. L'infezione comincia con
l'adesione alle cellule epiteliali dell'intestino tenue grazie a pili formanti fasci BFP,
cui segue la distruzione dei microvilli, causata dall'iniezione attiva di proteine
nelle cellule ospiti attraverso il sistema di secrezione III; in particolare viene
inserito il recettore traslocato dell'intimina (Tir), che funge da recettore per
Microbiologia Preston
105
l'intimina, un'adesina della membrana batterica, che induce la polimerizzazione
dell'actina e l'accumulo di proteine citoscheletriche, che causano la distruzione
della membrana cellulare e la morte della cellula epiteliale. In un'isola di
patogenicità di circa 40 geni sono contenuti i geni che codificano per BFP e i geni
per la distruzione degli enterociti o LEE.
3) EAEC : sono i ceppi enteroaggreganti di E.Coli, che causano diarrea acquosa
persistente e disidratazione per infanti e viaggiatori nei paesi in via di sviluppo.
Sono caratterizzati da "agglutinazione a pila di mattoni", mediata da fimbrie di
adesione aggreganti di tipo I o AAFI, simili a BFP. L'adesione porta a secrezione
di muco, formando un biofilm che avvolge i batteri aggregati e li protegge da
antibiotici e fagociti. Producono due tipi di tossine: la tossina termostabile
enteroaggregante (EAST) e la tossina plasmidica (PET), che stimolano la
secrezione di fluidi.
4) EHEC : sono i ceppi enteroemorragici di E.Coli, i patogeni più diffusi nei paesi
sviluppati; la loro infezione è più comune nei paesi caldi e nei bambini al di sotto
dei 5 anni. La maggior parte è dovuta al consumo di carne di manzo macinata,
poco cotta o prodotti sempre di carne bovina, ma anche consumo di acqua, latte
non pastorizzato, frutta, succhi di frutta, vegetali crudi e frutta contaminata. Il
contagio si trasmette da persona a persona. La gravità è variabile, si può osservare
una lieve diarrea, ma anche una colite emorragica, con dolori addominali e diarrea
emorragica, che si manifesta dopo 3-4 giorni di incubazione. Nei pazienti non
trattati la scomparsa dei sintomi avviene dopo 6,5 giorni. Possiamo osservare HUS,
o sindrome emolitico-uremica, con insufficienza renale acuta, trombocitopenia e
anemia emolitica, che guarisce spontaneamente nella gran parte dei casi, ma nel
3-5% può portare a morte e nel 30% a disturbi neurologici. Il ceppo O157:H7 è il
ceppo più comune e possiede attività di attacco-distruzione, perché hanno
acquisito le tossine di Shiga, prodotte da Shigella. Sono formate da una subunità
A e cinque subunità B, che legano un glicolipide della cellula ospite o
globotriaosilceramide o GB3, in alte concentrazioni nei villi intestinali e
nell'endotelio renale; la subunità A viene internalizzata, scissa in due molecole ed
il frammento A1, che lega l'RNA ribosomale 28S, blocca la sintesi proteica. La
HUS distrugge le cellule endoteliali del glomerulo renale, che causano attivazione
piastrinica e deposizione di trombina, che a loro volta riducono la filtrazione
glomerulare, causando insufficienza renale acuta.
Microbiologia Preston
106
5) EIEC : sono i ceppi enteroinvasivi di E.Coli, molto rari. Simili a Shigella, invadono
e distruggono l'epitelio del colon, causando diarrea acquosa; alcuni pazienti vanno
incontro a dissenteria, febbre, crampi addominali e feci emorragiche e purulente.
L'invasione del colon è mediata da geni pInv presenti su un plasmide. Questi
batteri lisano i vacuoli fagocitici e si replicano nel citoplasma delle cellule ospiti.
Infezioni extraintestinali, comprendono infezioni urinarie, meningiti neonatali e
setticemia. La maggior parte dei bacilli gram negativi responsabili di UTI deriva dal
colon, contamina l'uretra, ascende nella vescica e può colonizzare il rene e la
prostata; questi ceppi producono adesine che aderiscono all'epitelio vescicale e delle
vie urinarie superiori, ed emolisine HlyA, che lisa eritrociti. La maggioranza delle
infezioni neonatali del SNC nel 1° mese di vita sono causate da E.Coli. La setticemia
invece, deriva da infezioni urinarie o intestinali, come peritonite da perforazione
intestinale.
La Diagnosi di E.Coli responsabili di gastroenterite è la più comune dei laboratori di
riferimento. La diagnosi di EHEC è rara e si usano due approcci, un esame colturale
e la ricerca della tossina. La maggioranza degli E.Coli fermenta il sorbitolo, ma non
EHEC; quindi si usa l'agar MacConkey al sorbitolo per isolare dai campioni fecali i
batteri gram negativi sorbitolo-negativi, che vengono poi identificati come E.Coli
O157, mediante test sierologici e biochimici.
Per la terapia antibiotica è consigliato un antibiogramma e su esperienza clinica.
E.Coli è resistente a molti antibiotici e non si consiglia la terapia antibiotica nei
pazienti con gastroenterite emorragica, perché gli antibiotici possono prolungare la
Microbiologia Preston
107
persistenza dei batteri nelle feci e aumentare il rischio di complicanze secondarie,
quindi si raccomanda il trattamento sintomatico.
E' difficile prevenire le infezioni da enterobatteri, poiché essi fanno part della flora
batterica endogena, però possono essere evitati fattori di rischio, come l'uso
indiscriminato di antibiotici e l'uso di cateteri urinari, se non sono necessari.
Shigella
Sono state individuate quattro specie di
questo genere, come S.sonnei, S.dysenteriae,
S.boydii e S.flexneri, che causano dissenteria e
shigelliosi. La patogenicità delle Shigelle è
dovuta all'invasione dell'epitelio intestinale
del colon. Aderiscono alle cellule M delle
placche di Peyer e le invadono; il sistema di
secrezione di tipo III media l'iniezione nelle
cellule epiteliali e nei macrofagi di quattro
proteine Ipa A,B,C,D che promuovono
l'increspamento della membrana della cellula bersaglio, favorendo l'internalizzazione
del batterio. Le Shigelle lisano i vacuoli fagocitici e si replicano nel citoplasma (a
differenza della Salmonella); grazie al riarrangiamento dei filamenti di actina nella
cellula ospite, i batteri sono spinti attraverso il citoplasma nelle cellule adiacenti e
l'infezione così passa da una cellula all'altra, proteggendo anche le Shigelle dal
sistema immunitario. Sopravvivono a fagocitori ed inducono apoptosi. Producono la
tossina di Shiga, formata da una subunità A e cinque B, che interagiscono con G3,
promuovendo l'internalizzazione nella cellula ospite della subunità A, che taglia
rRNA 28S della 60S, bloccando la sintesi proteica. A livello istologico vediamo
distruzione dell'epitelio intestinale.
L'uomo è l'unico serbatoio di questo batterio; la shigellosi è una malattia a
prevalenza pediatrica (60%) in bambini al di sotto dei 10 anni, e si osservano
epidemie negli asili, nidi e orfanotrofi; si trasmette per contagio diretto da una
persona all'altra per via oro-fecale soprattutto attraverso mani contaminate. La
shigellosi è caratterizzata da crampi addominali, diarrea, febbre e feci emorragiche; i
segni e sintomi clinici appaiono dopo 1-3 giorni dopo ingestione dei bacilli, con
Microbiologia Preston
108
questi che inizialmente colonizzano l'intestino tenue e nelle prime 12 ore si
replicano; i primi sintomi, come diarrea acquosa profusa, sono causati
dall'enterotossina. I segni caratteristici della patologia sono i crampi al basso ventre e
il tenesmo (urgenza di defecare) con emissione di feci emorragiche e purulente,
dovute all'invasione della mucosa del colon da parte dei batteri. La terapia antibiotica
è consigliata per ridurre il rischio di contagio ai conviventi e ai contatti del paziente.
Si può iniziare con una terapia empirica con fluorochinolone.
Salmonella
Presenta le caratteristiche degli enterobatteri per
quanto riguarda la struttura. Esistono 2000 tipi
sierotipi, riassumibili in una singola specie,
Salmonella Enterica, di cui i più importanti sono
S.thypi, S.enteritidis e S.cholerae-suis. Di S.anteriditis
esistono molti sierotipi ed è la più comune causa
di infezione da salmonella; i serbatoi sono pollame
e uova, mentre non esiste un serbatoio umano;
causa gastroenterite. La salmonella, dopo
l'ingestione e il passaggio attraverso lo stomaco,
attacca la mucosa dell'intestino tenue, invadendo
le cellule M delle placche di Peyer e gli enterociti. I
batteri, confinati nei vacuoli endocitosi, si replicano e possono essere trasportati
attraverso il citoplasma e rilasciati nei vasi sanguigni e linfatici. Troviamo due isole di
patogenicità PA1 che codifica le proteine di invasione e un sistema di secrezione di
tipo III, la PA2 codifica per l'evasione della sorveglianza immunitaria dell'ospite . Le
Salmonelle colonizzano tutti gli animali e l'uomo. I serbatoi animali sono alimentati
dal contagio diretto. Salmonella Typhi si è adattato all'uomo e non è patogeno per gli
animali, e possono sopravvivere nell'uomo all'interno della colecisti. La maggior
parte delle infezioni deriva dall'ingestione di alimenti contaminati e dalla
trasmissione diretta oro-fecale. Le più comuni fonti di infezione della Salmonella
sono. pollame, uova, prodotti caseari e alimenti preparati su superfici contaminate.
Derivano anche dall'ingestione di acqua contaminata e di alimenti manipolati da
mani contaminate. La dose infettiva è bassa e pertanto il contagio diretto da persona
a persona è frequente.
Microbiologia Preston
109
Esistono quattro forme di salmonellosi, gastroenterite, setticemia, febbre tifoide e
colonizzazione asintomatica.
Gastroenterite:
E' la forma più comune di salmonellosi negli USA; i sintomi si manifestano a
distanza di 6-48 ore dal consumo dell'alimento contaminato e inizialmente
osserviamo nausea, vomito e diarrea non emorragica. Nelle forme acute è cinvolto il
colon. I sintomi persistono fino a 7 giorni fino a che non si risolvono
autonomamente.
Setticemia:
Tutte le salmonelle possono causare batteriemia, ed il rischio è maggiore in età
pediatrica e geriatrica e nei pazienti immunodepressi.
Febbre Enterica:
Salmonella Typhi causa la febbre tifoide, mentre S.Parathypi di tipo A causa una forma
più lieve detta febbre paratifoide.I batteri attraversano l'epitelio intestinale e vengono
fagocitati dai macrofagi, che li trasportano al fegato , alla milza e al midollo osseo,
dove si replicano. Dopo 10-14 giorni dall'ingestione dei batteri, i pazienti sviluppano
una febbre ingravescente, con sintomi aspecifici (cefalea, mialgia, malessere e
anoressia) che persistono per una settimana o più. Questa fase iniziale è seguita da
colonizzazione della colecisti ed infine reinfezione dell'intestino. La febbre enterica è
una malattia grave e va sospettata in quei pazienti febrili con una storia recente di
viaggi nei Paesi in via di sviluppo dove la malattia è endemica.
Colonizzazione Asintomatica:
I ceppi di Salmonella responsabili della febbre tifoide e paratifoide persistono nei
serbatoi umani. Il sito di persistenza è la colecisti. Per quanto riguarda la febbre
tifoide un vaccino è inefficace, mentre la terapia antibiotica, essenziale. Sono presenti
due vaccini, uno orale attenuato ed un secondo vaccino con il polisaccaride capsulare
Vi. L'antibiotico viene scelto in base ai test di sensibilità in vitro, si possono usare
flurochinoloni come ciprofloxacina, il cloramfenicolo e le cefalosporine ad ampio
spettro.
Microbiologia Preston
110
Yersinia
I più noti sono Yersinia Pestis, Y.enterocolitica e Y.pseudotuberculosis. Una caratteristica
comune di questa specie è la resistenza al killing fagocitario, mediato dal sistema di
secrezione di tipo III. Al contatto con i fagociti, i batteri iniettano in queste cellule
una proteina che defosforila varie proteine necessarie alla fagocitosi, una proteina
citotossica che distrugge i filamenti di actina e una proteina che induce l'apoptosi dei
macrofagi; inoltre questo sistema sopprime la produzione di citochine, attenuando
così la risposta. Y.pestis possiede due plasmidi contenenti i geni di virulenza, uno che
codifica per la capsula proteinca e l'altro per l'enzima proteasi attivatore del
plasminogeno, che degrada C3 e C5a impedendo opsonizzazione, chemiotassi e
fagocitosi.
Tutte le infezioni da Yersinia sono zoonosi, in cui l'uomo è un ospite accidentale.
Esistono due forme di infezione di Y.pestis, la peste urbana (serbatoio i ratti) e la peste
selvatica (scoiattoli, conigli, ratti di campagna e gatti domestici). La peste è stata una
delle malattie più devastanti della storia, con tre pandemie, una nel 500 d.C., nel 1320
e in Cina nel 1860, causando un tasso di mortalità impressionante, quasi un terzo
della popolazione. I serbatoi di peste urbana sono i ratti e si trasmette all'uomo
attraverso le pulci infette, che succhiano il sangue dei ratti e i batteri si replicano
nell'intestino delle pulci, così da essere trasferiti all'uomo. La peste urbana è stata
eliminata, controllando la diffusione dei ratti, mentre la peste selvatica è impossibile
da limitare. Y.entercolitica è agente eziologico di enterocolite, il 90% dei quali è dovuto
a consumo di carne, latte o acqua contaminati.
L'infezione da Y.pestis causa due tipi di malattia: la peste bubbonica e la peste
polmonare. La peste bubbonica, ha un'incubazione di 7 giorni dal morso della pulce;
i pazienti presentano febbre elevata e tumefazioni (bubboni) dolorose inguinali o
ascellari; nei casi non trattati si sviluppa batteriemia ed il paziente muore nel 75% dei
casi. La peste polmonare ha un periodo di incubazione di 2-3 giorni e inizialmente
arriva febbre e malessere, fino a segni polmonari dopo 24 ore; è molto contagiosa e si
trasmette per via inalatoria, con un tasso di mortalità nei casi non trattati del 90%.
Y.enterocolitica causa enterocolite, a causa di ingestione di acqua o alimenti
contaminati. Il periodo di incubazione è di 1-10 giorni e il paziente manifesta diarrea,
febbre e crampi addominali che durano 1-2 settimane. La malattia interessa l'ileo
terminale e in caso di tumefazione dei linfonodi mesenterici, può assomigliare ad
Microbiologia Preston
111
un'appendice acuta. E' riscontrabile nela Scandinavia e nelle regioni fredde degli
USA.
I batteri crescono nella maggior parte dei terreni di coltura; la conservazione
prolungata a 4°C può favorire l'isolamento selettivo.
Le infezioni da Y.pestis si trattano con streptomicina, in alternativa si possono usare le
tetracicline e il cloramfenicolo. Le enteriti sono in genere autolimitanti, se è indicata
la terapia allora è sensibile a cefalosporine ad ampio spettro.
Altre specie di Enterobacteriaceae
Klebisella
Ha una capsula prominente, può causare polmonite lobare primaria, che spesso causa
necrosi degli spazi alveolari, con cavitazione e produzione di escreato striato di
sangue; causano anche infezioni delle ferite, dei tessuti molli e dell'apparato urinario.
K.granulomatis causa granuloma inguinale, malattia granulomatosa che interessa i
genitali e l'area inguinale. E' endemica in alcuni stati, come Caraibi e nNuova
Guinea. Si contrae in seguito a ripetute esposizioni attraverso rapporti sessuali o
trauma genitale. Dopo un'incubazione di mesi, appaiono noduli sottocutanei sui
genitali e area inguinale, che in seguito si rompono, rivelando una o più lesioni
granulomatose indolenti, che possono estendersi e diventare confluenti.
Proteus
Le infezioni delle vie urinarie sono le patologie causate da questo batterio. Produce
elevate quantità di ureasi, che scinde l'urea in anidride carbonica ed ammoniaca.
Questo processo innalza il pH delle urine e induce la precipitazione dei sali di
magnesio e potassio, sotto forma di cristalli di apatite, con formazione di calcoli
renali. L'alcalinizzazione delle urine è anche tossica per l'urotelio.
Microbiologia Preston
112
Vibrio
Sono un importante gruppo di bacilli ricurvi gram-negativi fermentanti, anaerobi
facoltativi, che vengono distinti dagli Enterobatteri in base alla loro positività alla
reazione dell'ossidasi e alla presenza di flagelli polari, che conferisce a questo genere
la mobilità. I più importanti sono Vibrio Cholerae, V.parahaemolyticus e V.vulnificus.
Vibrio Cholerae
Sono dei bacilli gram negativi, ossidasi positivi,
anaerobi facoltativi, asporigeni, acapsulati,
responsabili del Colera. Sono in grado di crescere in
diversi terreni semplici ed in un ampio spettro di
temperatura che va da 14 a 40°C. V.cholerae può
sopravvivere anche ad alte concentrazioni di sale, e la
maggior parte dei Vibrioni necessita di NaCl per
potersi sviluppare. Hanno un ampio range di pH (6,5 a
9), ma sono sensibili agli acidi gastrici. Sono dotati di un flagello polare, sono
monotrichi, un pilo co-regolato con la tossina, importante per la virulenza. La parete
cellulare è quella tipica dei gram negativi ed la variabilità immunogenica del
polisaccaride O dell'LPS determina diversi sierogruppi, che sono 140. Di rilevanza
sono il sierogruppo O1 e O139, che producono la tossina colerica e sviluppano il
colera classico, mentre gli altri sierogruppi non sono capaci di produrla e non
causano il colera.
Il sierogruppo O1 viene ancora suddiviso in tre sierotipi e due biotipi. I tre sierotipi
sono Ogawa (A,B), Inaba (A,C) e Hikojima (A,B,C); i ceppi sono in grado di mutare
tra i primi due sierotipi, mentre il terzo è uno stato di transizione, in cui gli antigeni
di Inaba e Ogawa vengono co-espressi. I biotipi sono El tor e il Vibrio classico,
distinti in base a caratteristiche fenotipiche e morfologiche.
Il batteriofago CTXφ codifica i geni per le due subunità della tossina colera, che
sono ctxA e ctxB; questo batterio si lega al pilo co-regolato con la tossina (tcp) e si
sposta all'interno della cellula batterica, integrandosi nel genoma di V.cholerae; il
locus cromosomico contiene fattori di virulenza, come il gene ace per l'enterotossina
accessoria, acf per i fattori di colonizzazione, hap per l'emoagglutinazione/proteasi e
il gene zot per le tossine della zonula occludens. La tossina colerica è formata quindi
Microbiologia Preston
113
dalle due subunità A e B, come per l'Escherichia Coli, così le 5 subunità B
riconoscono il recettore GM1 sull'epitelio intestinale e la subunità A viene
internalizzata, interagendo con proteine G, che porteranno alla multipla conversione
di ATP in cAMP, che come conseguenza dell'eccesso intracellulare ha
l'ipersecrezione di acqua ed elettroliti. Nelle infezioni più gravi, i pazienti possono
perdere anche 1 litro di acqua all'ora. Questo batterio inoltre possiede anche
siderofori, che sequestrano ferro importante per la propria crescita. V.cholerae
aderisce alla mucosa intestinale tramite i pili co-regolati con la tossina (gene tcp) e
grazie anche a proteine chemiotattiche (geni cep), e quei vibrioni che non possiedono
uno di questi due fattori di adesione non può provocare un'infezione rilevabile. Se la
tossina colerica non viene prodotta, O1 può causare diarrea grazie all'azione della
tossina della zonula occludens (che le rallenta e provoca aumento di permeabilità
intestinale) e della tossina accessoria del colera (che incrementa la secrezione di
liquidi). Il ceppo O1 condivide lo stesso complesso di virulenza con O139.
I Vibrioni si ritrovano in natura negli ambienti acquatici marini di tutto il mondo.
Sono in grado di sopravvivere e moltiplicarsi in acque contaminate e con un alto
grado di salinità; i vibrioni patogeni possono anche proliferare nelle acque
normalmente popolate da molluschi a guscio (ostriche, vongole e cozze); da qui
l'associazione tra vibrioni e consumo di frutti di mare. Il colera si diffonde attraverso
l'acqua e i cibi contaminati, mentre il contatto diretto è molto difficile, a causa
dell'alto inoculo necessario perché si abbia un'infezione in persone con attività
gastriche normali (più di 10^8 cellule batteriche); tuttavia questo numero può
diminuire in persone con ridotta acidità gastrica (ipocloridria o acloridria) a 10^3. E'
una malattia inoltre riscontrabile nelle comunità in cui prevalgono scarse condizioni
igenico-sanitarie.
Clinica: La maggior parte dei pazienti va incontro a infezioni asintomatiche o a eventi
diarroici autolimitanti, ma alcuni soggetti sviluppano una diarrea severa, fino ad
essere fatale. Le manifestazioni cliniche del colera iniziano tra il 2° e 3° giorno
dall'ingestione di batteri, con diarrea acquosa, nausea e vomito a insorgenza
improvvisa. Con l'incremento della perdita di liquidi, il materiale fecale diviene
progressivamente inodore e incolore, prive di proteine e mucose, o "feci risiformi".
Si può arrivare a disidratazione, con dolori muscolari crampiformi, acidosi
metabolica (perdita di bicarbonati), ipokalemia e shock ipovolemico, aritmie
cardiache e insufficienza renale. Il tasso di mortalità nei pazienti non trattati può
Microbiologia Preston
114
arrivare al 60%, ma nei pazienti trattati è men dell'1% (terapia sostitutiva
idroelettrolitica).
Diagnosi: I Vibrioni sono specie di piccole dimensioni (0,5-1,5x3μm), gram negativi,
curvati, osservabili in campo oscuro. I vibrioni mostrano scarsa capacità di
sopravvivere in ambiente acido o asciutto, e devono essere prelevati nella fase
precoce della malattia. Crescono sulla maggior parte dei terreni per coprocoltura, e
su agar-sangue e agar MacConkey. Gli isolati vengono identificato con test biochimici
e sierotipizzati utilizzando antisieri polivalenti.
Trattamento, prevenzione e controllo: I pazienti affetti da colera devono essere trattati
tempestivamente con terapia sostitutiva a base di liquidi ed elettroliti, prima che la
massiva perdita di liquidi stessi possa causare shock ipovolemico; la terapia
antibiotica, è di importanza secondaria e può comunque ridurre la produzione di
tossina e contribuire ad una più rapida eliminazione dei microrganismi, riducendo il
carico batterico. Il farmaco di elezione sia per i bambini, che per gli adulti è
l'Azitromicina, ma viene usato Furazolidone per le donne in gravidanza e
Doxiciclina. Un controllo efficace della malattia può essere ottenuto solamente
attraverso il miglioramento delle condizioni igieniche e attraverso la purificazione
dell'acqua contaminata, o meglio prevenire che la contaminazione, installando
sistemi di purificazione. I vaccini sviluppati non hanno portato ad un'azione
protettiva a lungo termine; è stata effettuata la profilassi con tetracicline, al fine di
ridurre il rischio di infezione per le persone in viaggio verso le aree di endemia, ma
non è stata sufficiente.
Vibrio Parahaemolyticus
Sono bacilli ricurvi, gram-negativi, che per crescere hanno bisogno di sale.
Producono una emolisina diretta termostabile, TDH, che induce secrezione di ioni
cloro a livello delle cellule epiteliali, tramite incremento della concentrazione
intracellulare di calcio. La maggior parte delle infezioni si manifesta con diarrea
acquosa esplosiva, autolimitante, dove il paziente guarisce solitamente senza
conseguenze. Sono reperibili in ambiente acquatico marino, in associazione con i
frutti di mare e sono la causa più comune di gastroenterite associata al consumo di
prodotti ittici negli USA. Deve essere effettuato l'esame culturale e la malattia può
essere prevenuta mediante cottura dei frutti di mare.
Microbiologia Preston
115
Vibrio Vulnificus
Bacilli gram-negativi, ricurvi, che hanno le stesse caratteristiche dei vibrioni
precedenti, ma la sua virulenza è associata alla capsula, come la maggior parte dei
Vibrio Cholerae, ad eccezione di O1 (motivo che spiega il perché non si diffonda oltre
l'apparato gastroenterico). E' una specie particolarmente virulenta dei Vibrioni, che
causa setticemia primaria, dovuta all'ingestione di ostriche crude contaminate e
infezioni di ferite dopo esposizione all'acqua di mare contaminata. i effettua
emocoltura e coltura dei campioni prelevati dalla ferita. La malattia è mortale, e deve
essere trattata immediatamente con antibiotici; il trattamento a scelta è la
minociclina in combinazione con un fluorochinolone o con cefotaxime. No Vaccino.
Aeromonas
E' un bacillo gram-negativo fermentante, anaerobio facoltativo. Sono presenti 16
specie di cui 11 patogene per l'uomo. Sono ubiquitari nelle acque dolci e salmastre e
le malattie associate sono gastroenterite e le infezioni di ferite. La gastroenterite si
presenta dopo ingestione di acqua e di cibo contaminato, mentre le infezioni delle
ferite sono causate dall'esposizione di queste ad acqua contaminata. I fattori di
virulenza sono endotossina, emolisine, enterotossine, proteasi, siderofori e fattori di
adesione (ma il ruolo non è ancora ben spiegato). Le specie di Aeromonas causano
una malattia sistemica opportunista in pazienti immunocompromessi, diarrea nelle
persone sane e infezioni da ferite. La gastroenterite nei bambini è acuta e grave,
mentre gli adulti tendono a presentare diarrea cronica. Nelle feci dei pazienti con
gastroenterite grave sono present sangue e leucociti. La diarrea acuta ha una
risuluzione spontanea, tuttavia, la terapia antibiotica si rende necessaria in pazienti
con diarrea cronica, nelle infezioni di ferite cutanee e nel caso di malattia sistemica.
Sono resistenti alle penicilline. La terapia nelle diarree croniche sono gentamicina,
cloramfenicolo. La ciprofloxacina è attiva.
Plesiomonas
Bacilli gram-negativi, anaerobi facoltativi, ossidasi positivi, flagelli polari multipli che
si differenziano dall'Aeromonas per reazioni biochimiche. Vivono in acque dolci ed il
contagio avviene per ingestione di acqua, pesce o contatto con rettili e anfibi. Causa
gastroenterite e risoluzione spontanea che si manifesta entro 48h dall'esposizione al
microrganismo. E' sensibile al cloramfenicolo, alle cefalosporine, all'impinem, al
Bactrim e ai fluorochinoloni.
Microbiologia Preston
116
Campylobacter
Questo genere è formato da piccoli bacilli
gram-negativi a virgola di dimensioni
0,2-0,5μm di lunghezza x 0,5-5μm di
larghezza, che sono mobili grazie ad un
flagello polare. Sono microaerobi, cioè
crescono in un'atmosfera più povera di O2
e ricca di H e CO2. Troviamo 25 specie di
cui solo 4 rilevanti: C.jejuni, C.coli,
C.upsaliensis e C.fetus. Le principali malattie
che causano sono la gastroenterite e la
setticemia.
C.jejuni è la specie più studiata e produce adesine, enzimi citotossici ed enterotossine,
ma il ruolo di queste non è chiaro. Gli acidi gastrici uccidono i batteri e le condizioni
che riducono o neutralizzano l'acidità gastrica favoriscono l'insorgenza della malattia;
anche lo stato immune del paziente influisce. l'enterite di jejuni è caratterizzata da
lesioni istologiche della mucosa digiunale, ileale e colica. La mucosa si presenta
ulcerata, edematosa ed emorragica, con ascessi delle ghiandole intraepiteliali e la
lamina propria è infiltrata da neutrofili, c.mononucleate ed eosinofili; l'infiammazione
è una conseguenza dell'invasione intestinale da parte dei batteri, tuttavia non si
conosce il ruolo delle tossine.
Le infezioni da Campylobacter sono zoonosi e i serbatoi animali sono vari; l'uomo si
infetta consumando cibi, latte o acqua contaminati e, nei paesi sviluppati, oltre la
metà di queste infezioni è causata da pollame contaminato. Le infezioni di
C.upsaliensis sono trasmesse da cani domestici. Il contagio diretto da persona a
persona è possibile per via oro-fecale, ma è raro che gli addetti alla preparazione
degli alimenti siano fonte di infezione. La massima incidenza di infezioni da
Campylobacter si osserva nella prima infanzia e un secondo picco interessa gli adulti
da 20 a 40 anni, con frequenza elevata nei paesi in via di sviluppo.
Le gastroenteriti da C.jejuni, C.coli e C.upsaliensis si presentano come enteriti acute,
con diarrea, febbre e dolori addominali. Nella fase acuta, i pazienti possono avere
molte scariche diarroiche al giorno e le feci possono essere emorragiche.
Microbiologia Preston
117
E' autolimitante, ma può durare per più di una settimana. Negli immunodepressi si
può sviluppare enterite cronica, difficile da trattare.
La sindrome di Guillain-Barré è una complicanza di infezioni da Campylobacter; sono
jejuni e upsaliensis a provocarla, una polinevrite autoimmne caratterizzata dalla paralisi
simmetrica progressiva degli arti, che si manifesta dopo alcuni giorni e può rimanere
per anni. La patogenesi di questa malattia è legata alla reattività antigenica crociata
dei LPS di membrana con i gangliosidi dei nervi periferici.
Un'altra complicanza è l'artrite reattiva, caratterizzata da una tumefazione dolorosa
delle articolazioni.
C.fetus si distingue dalle altre specie, perché è più comunemente associato a infezioni
sistemiche (batteriemie); ha tendenza a diffondersi dal tratto gastroenterico al circolo
sistemico (nei pazienti immunodepressi soprattutto). E' resistente all'uccisione in
circolo mediata da anticorpi e complemento, mentre gli altri sono uccisi velocemente;
questo perché è rivestito da una proteina termostabile, o proteina S, che forma una
struttura simile ad una capsula, impedendo la lisi in circolo; quando viene rimossa la
proteina S, diventa avirulento.
Diagnosi
Sono sottili e difficilmente visibili con la colorazione di Gram, comunque sono "a
forma di S" o "a virgola". Possono essere isolati per filtrazione dai campioni fecali,
poiché passano attraverso i filtri da 0,45μm, mentre gli altri batteri vengono
trattenuti. L'isolamento richiede terreni speciali, con atmosfera microaerofila e
temperature elevate (C.fetus, invece, non è termofilo e non cresce a 42°C). Hanno una
crescita lenta e generalmente vanno incubati per 48-72 ore e più.
Trattamento e Profilassi
La gastroenterite è un'infezione autolimitante e va trattata con la somministrazione di
fluidi ed elettroliti per ripristinare le perdite. La gastroenterite grave e la setticemia
vanno trattate con eritromicina o azitromicina.
Per la profilassi è necessario fare attenzione alla preparazione degli alimenti e
consumare solo latte pasorizzato; va inoltre evitata la contaminazione delle fonti
idriche.
Microbiologia Preston
118
Helicobacter
Nel 1982, ricercatori australiani dimostrarono
che un microrganismo gram-negativo è la causa
dell'ulcera peptica. La scoperta di un batterio
stanziale nello stomaco (un distretto
"impossibile" da colonizzare) ha suscitato un
notevole interesse verso i meccanismi che
permettono questa particolare infezione.
Inizialmente, per la somiglianza morfologica e la
forma a spirale, è stato classificato nel genere Campylobacter;solamente nel 1989 è
stato creato un genere autonomo per varie peculiarità di tipo ultrastrutturale,
biochimico e genomico. E' gram-negativo, microaerofilo, catalasi, ureasi (in grande
quantità) e ossidasi positivo, elicoidale e/o vibroide, nella forma di resistenza è
coccoide, mentre in coltura pleiomorfo. Possiede da 2 a 7 flagelli terminanti a clava o
a bulbo, che consente ad HP un'elevata mobilità, proprietà importante per
sopravvivere nell'ambiente acido dello stomaco e per spostarsi rapidamente,
attraverso lo strato viscoso di muco, verso ambienti a pH neutro; uno strato di
glicocalice riveste tutto il soma ed i flagelli, ed ha parete liscia. Sono state identificate
venti specie: nello stomaco dell'uomo H.pylori e H.Heilmannii (Gastrospirillum hominis)
quest'ultimo associato a carcinoma gastrico; altre specie colonizzano il retto e
provocano rettocolite acuta, batteriemia, cellulite ed artrite in pazienti
immunodepressi, mentre altre specie sono state isolate in topi di laboratorio, cani,
gatti e scimmie.
L'infezione è diffusa in tutto il mondo ed è variabile in rapporto ad età, condizione
socio-economica ed abitudini alimentari, con prevalenza maggiore in paesi in via di
sviluppo. Negli USA colpisce la popolazione ispanica e nera con una percentuale
dell' 80%, mentre la popolazione caucasica 30%; tale differenza è da mettere in
relazione con diverse condizioni igieniche nell'infanzia. In Europa la popolazione
adulta è la più colpita, e la percentuale varia; non troviamo nessuna differenza in
relazione al sesso, al gruppo sanguigno o all'abitudine di fumo.
Trasmissione dell'infezione
E' una delle infezioni più diffuse in tutto il mondo e l'uomo è una riserva primaria e
la sua nicchia è lo stomaco; H.pylori è un parassita ben adattato all'ambiente gastrico,
producendo elevate concentrazioni di ureasi, di ammoniaca, possedendo flagelli
Microbiologia Preston
119
polari ed essendo rivestito da una guaina di difesa, possedendo adesine, fissazione su
recettori cellulari specifici. La trasmissione può avvenire in quattro modalità
differenti.
• Oro-fecale: preferenziale per i batteri gastroenterici (pylori viene eliminato
attraverso le feci); per la scarsa igiene ambientale e la carenza di acqua;
malnutrizione e da concomitanti patologie infettive; permanenza nell'ambiente di
forme coccoidi, non coltivabili, ma che mantengano inalterata la virulenza;
contaminazione dell'acqua potabile, latte crudo e pastorizzato (mucca e pecora)
• Oro-orale: a partire dal succo gastrico, pylori può contaminare la cavità orale
(reflusso gastro-esofageo, rigurgito e vomito); è stata dimostrata la presenza di
questo batterio nella placca dentaria e nella saliva; reservoir naturale di pylori (forse
transitorio).
• Attraverso materiali sanitari: medici ed infermieri sono personale a rischio; uso di
endoscopio e di sondini naso-gastrici; disinfezione e uso di materiali mono-uso
riduce al minimo il rischio di infezione.
• Zoonosi: H.helmannii o Gastrospirillum homini nello stomaco dei gatti, cani, scimmie
e maiali; prevalenza dell'infezione è alta nel personale dei mattatoi, veterinari e
pastori; durante la macellazione, il batterio, potrebbe contaminare la carne ed
essere quindi presente nelle preparazioni crude (salsiccia, salame, etc.) e quindi
infettare l'uomo.
Patogenesi
Helicobacter Pylori penetra nel lume gastrico grazie ai flagelli e alle ureasi; le ureasi
tamponano il pH acido, o neutralizzazione dell'acidità gastrica. L'adesione alle cellule
gastriche è mediata dal riconoscimento di fosfolipidi e gangliosidi dell'ospite.
L'instaurarsi della colonizzazione è favorito dall'inibizione della secrezione acida
gastrica da parte di una proteina batterica inibitoria e soprattutto dalla
neutralizzazione dell'acidità gastrica da parte dell'ammonio prodotto dall'ureasi
batterica.
CagA, provoca la formazione di un piedistallo per Helicobacter pylori, ed il rilascio di
citochine pro-infiammatorie; CagA iniettato nelle cellule epiteliali da un sistema di
secrezione di tipo IV, induce alterazioni citoscheletriche. L'adesione determina
l'esposizione delle cellule della mucosa ai cataboliti. L'LPS di pylori induce la
risposta infiammatoria dell'ospite, che però non determina l'eradicazione di pylori
Microbiologia Preston
120
(questo produce superossido dismutasi e catalasi per
proteggersi dalla fagocitosi dei neutrofili). Le lesioni
mucose localizzate sono mediate dai sottoprodotti
dell'ureasi, dalla mucinasi, dalle fosfolipasi e dalla
citotossina vacuolante A (VacA). HP è uno dei patogeni
più diffusi nel mondo, infatti si stima che 2x10^9
individui siano positivi a questo batterio e la maggior
parte però non sviluppi sintomi clinici. In circa il 2% dei
pazienti HP positivi si sviluppa un'ulcera peptica e
nell'1% un carcinoma o un linfoma. Questi dati suscitano
due domande:
90
Silenti
Ulcera
Tumori
67,5
45
22,5
1) Perché questa infezione è asintomatica nella
0
maggioranza degli individui HP positivi? - Risposta: La
Individui
risposta sta nella natura dell'LPS di HP, la cui frazione
polisaccaridica ha una forte somiglianza con l'antigene di Lewis presente sulle
cellule umane; HP "mima" le cellule umane e quindi, contrariamente ad altri
batteri Gram-negativi, non evoca una risposta infiammatoria importante. Questo
adattamento all'ospite spiega come mai nella maggior parte di questi individui
colonizzati non si arrivi allo sviluppo di patologie sintomatiche.
2) Cosa succede in quei pochi casi in cui l'infezione si fa evidente e l'infiammazione
pericolosa? - Risposta - Sono state proposte diverse ipotesi legate alla rottura
dell'equilibrio ospite-batterio che potrebbe essere causata, in modo sinergico, da
più fattori, sia dal batterio che dall'ospite, quindi predisposizione dell'ospite (le
persone che si ammalano reagirebbero in maniera anomala all'LPS di HP,
nonostante la somiglianza all'antigene di Lewis) e fattori batterici (ceppi
particolarmente virulenti, producono "Vac-A", una tossina vacuolizzante che
uccide le cellule gastriche; il numero dei microrganismi influenza, perché quando
è in alte concentrazioni, anche l'LPS di HP potrebbe evocare una risposta
importante da parte dell'ospite; è possibile che i ceppi che provocano l'ulcera
siano capaci di riprodursi più velocemente degli altri).
Il rapporto tra HP e l'ospite è mediato da un fattore chiamato Cag-A, espresso dal
60% dei ceppi; è localizzato, nel genoma, in una isola id patogenicità. Molti dei geni
dell'isola CAG codificano un sistema di secrezione (simile al pilo coniugativo F di
E.Coli) che permette a HP di inserire i suoi prodotti nelle cellule epiteliali dell'ospite.
Tra i prodotti traslocati c'è Cag-A, che determina il rilascio da parte delle cellule della
Microbiologia Preston
121
mucosa di sostanze che provocano vasodilatazione e richiamano i polimorfonucleati
(PMN). I PMN tentano di uccidere i batteri, rilasciando nell'ambiente gli enzimi
lisosomiali; gli enzimi danneggiano le cellule mucipare che muoiono e non
producono più il muco necessario a proteggere lo stomaco, quindi le pareti dello
stomaco, oramai prive di muco, vengono attaccate dai succhi gastrici e si forma
l'ulcera. L'adesione e l'azione patogena sono specifiche per le cellule gastriche.
La localizzazione di H.pylori causa gastrite, con
infiltrazione di neutrofili e mononucleati nella mucosa
gastrica. La fase acuta è caratterizzata da senso di
pienezza, nausea, vomito e ipocloridria (riduzione della
secrezione acida gastrica). Il 10-15% dei pazienti
sviluppa gastrite cronica, con ulcere peptiche. che si
creano nei punti dove l'infiammazione è intensa,
generalmente alla giunzione tra corpo e antro (ulcera
gastrica), o nella porzione prossimale del duodeno
(ulcera duodenale - HP è implicato nell'eziologia di
ulcere duodenali solo quando esistono aree ectopiche
di cellule gastriche nel duodeno). La gastrite cronica porta a sostituzione della
normale mucosa gastrica con tessuto fibrotico e proliferazione di un epitelio di tipo
intestinale. L'infezione da HP causa anche l'infiltrazione linfoide della mucosa, che
dà origine a un linfoma MALT.
Diagnosi
• Endoscopia digestiva
1) Esame istologico e presenza di
HP e stato della mucosa
2) Test dell'ureasi, in associazione
con test al respiro o con ricerca di
antigeni HP si materiale fecale
3) Test colturale, non
raccomandabile come routine di
diagnosi
4) Test per PCR, non ancora disponibile per la clinica
Microbiologia Preston
122
• Metodi diagnostici non invasivi (quando non è necessaria endoscopia)
1) Test del respiro (Breath test) con urea marcata con carbonio radioattivo (13/14^C);
emissione di CO2 dopo somministrazione di un pasto contenente urea marcata
con Carbonio 14
2) Ricerca dell'antigene HP (HpSA) nelle feci
3) Ricerca di IgG specifiche nel siero del paziente
Terapia, Profilassi e Vaccini
Regimi multipli sono stati messi a punto per la terapia delle infezioni da H.Pylori. la
terapia con tetraciclina, metrodinazolo, bismuto ed omoprazolo per due settimane
si è dimostrata molto efficace.
La profilassi di individui colonizzati non è stata utile e può avere effetti collaterali
importanti quali la predisposizione dei pazienti all'adenocarcinoma del basso
esofageo.
Per l'uomo non ci sono vaccini.
Microbiologia Preston
123
Pseudomonas
Così chiamato perché tipicamente disposti a
coppie di cellule che assomigliano ad una
singola cellula. Pseudomonas Aeruginosa è la
specie più importante. E' un batterio
ubiquitario, che si trova nel suolo, nella materia
organica in decomposizione, nella vegetazione,
nell'acqua e molto diffusi nell'ambiente
ospedaliero (riserve umide come alimenti, fiori
recisi, lavandini, servizi igenici, attrezzature per
la terapia respiratoria e dialisi. La loro facilità di sopravvivenza deriva dal fatto che
necessitano di semplici requisiti per la propria crescita. Possiedono molti fattori
strutturali, enzimi e tossine che ne rafforzano la virulenza e li rendono resistenti agli
antibiotici. Sono dei patogeni per piante, animali e uomo. Le infezioni sono
principalmente opportunistiche, in soggetti con difese organiche compromesse e
nell'ospite immunocompetente; inoltre sono una causa frequente di infezioni
nosocomiali.
Sono dei bacilli gram-negativi (0,5-1,0x1,5-4μm), generalmente mobili, dritti o
leggermente curvati, tipicamente disposti a coppie. Utilizzano carboidrati attraverso
respirazione aerobia, con l'ossigeno come ultimo accettore di elettroni, ma posono
anche crescere in anaerobiosi utilizzando nitrati o arginina come accettori terminali
di elettroni. La presenza di citocromo ossidasi li differenzia dal genere
Enterobacteriaceae. Alcuni ceppi appaiono mucoidi, per la presenza di un'ampia
capsula polisaccaridica, comuni nei pazienti affetti da fibrosi cistica. Alcuni ceppi
presentano attività emolitica e alcune specie producono pigmenti diffusibili, che
conferiscono loro un aspetto caratteristico in coltura, come piocianina (blu),
pioverdina (verde), fluorescina (giallo), piorubina (rosso-marrone) e piomelanina
(nero).
Causano patologia in caso di lesioni traumatiche, ustioni, impianti prostetici,
interventi esplorativi o chirurgici, utilizzazione di droghe per via endovenosa ed
immunocompromissione dell'ospite.
I fattori di virulenza sono molti, come componenti strutturali (adesine e capsula),
tossine (endotossina, esotossina A ed esotossina S) ed enzimi (elastasi, fosfolipasi C e
piocianina). La virulenza di Pseudomonas aeruginosa è multifattoriale.
Microbiologia Preston
124
• Componenti strutturali
1) Adesine: l'adesione è mediata da pili e da adesine non piliari. Pseudomonas
produce neuramminidasi che rimuove i residui di acido sialico dai recettori dei
pili aumentando l'adesione delle cellule epiteliali.
2) Capsula Polisaccaridica: Costituita prevalentemente da alginato, un
esopolisaccaride che permette l'adesione alle cellule (fibrosi cistica ed altre
malattie respiratorie) ed impedisce la fagocitosi e l'attività degli antibiotici; inoltre
favorisce l'adesività alla superficie di protesi vascolari favorendo la formazione di
biofilm; viene persa durante la crescita in vitro.
• Tossine
1) Endotossina: è il principale antigene della parete cellulare. Il lipide A media
diversi effetti biologici della sindrome setticemica.
2) Esotossina A: E' tra i
principali fattori di
virulenza rilasciati in
ambiente extracellulare
da ceppi patogeni di
Pseudomonas
Aeruginosa. Contiene
tre regioni, una che si
lega al recettore delle
cellule bersaglio, una
che serve al trasporto
attraverso la membrana della cellula bersaglio ed una che costituisce il
componente tossico. (immagine=Meccanismo del trasporto dell'esotossina A e sua
attivazione nella cellula) Dapprima la cellula si lega al recettore cellulare ed è
trasportata all'interno del citoplasma dentro una vescicola; in seguito il lisosoma si
fonde con la vescicola contenente la tossina, e l'attività lisosomiale stimola la
tossina; in ultima fase, la tossina attivata è rilasciata nel citoplasma, dove inibisce la
sintesi proteica cellulare, interagendo con il fattore di elongazione EF2. Infatti,
all'interno del citoplasma della cellula bersaglio la tossina blocca la sintesi
proteica nelle cellule eucariotiche per ADP-ribosilazione del fattore 2 di
allungamento della catena proteica (EF2) con azione simile a quella della tossina
difterica, sebbene la struttura delle due tossine sia diversa. E' responsabile della
Microbiologia Preston
125
necrosi tissutale delle ustioni e dell'insufficienza respiratoria nelle infezioni
polmonari.
3) Esoenzima S: tossina extracellulare prodotta da 1/3 degli isolato clinici di
P.aeruginosa, inibisce la sintesi proteica ADP ribosilando alcune proteine del
citoscheletro tra cui la vimentina. E' una adenosina difosfato-ribosil-trasferasi,
come l'esotossina A, ma stabile al calore, che probabilmente interagisce con la
fagocitosi.
• Enzimi
1) Elastasi: è un'endopeptidasi che può digerire numerose proteine umane, tra cui,
elastina, collagene, fibrina, IgA, IgG, componenti del complemento e transferrina.
LasA (proteasi serinica) e LasB (zinco-proteasi) sono due enzimi che
sinergicamente degradano l'elastina, causando danni al parenchima polmonare e
lesioni emorragiche. Nelle lesioni croniche, si riscontrano anticorpi diretti contro
LasA e LasB, con deposizione di immunocomplessi nei tessuti infetti.
2) Fosfolipasi C: Enzima termolabile, che degrada lipidi e lecitina, facilitando il
danno tissutale.
3) Piocianina: pigmento blu che catalizza la produzione di superossido e perossido
d'idrogeno (forme tossiche dell'ossigeno); possiede attività antibatterica nei
confronti di Staphylococcus Aureus ed E.coli.
Patogenesi:
P.aeruginosa è patogena solamente quando viene indotta in zone prive di normali
difese per: alterazione della cute e delle mucose per danno tissutale diretto (ustioni),
uso di cateteri urinari ed endovenosi, neutropenia in corso di terapie antitumorali e
soggetti affetti da fibrosi cistica.
Epidemiologia:
Sono patogeni opportunisti, che hanno richieste nutrizionali minime. Tollerano
temperature tra 4 e 42°C e sono resistenti ad antibiotici e disinfettanti. Sono una
causa frequente di infezioni nosocomiali, sono commensali nelle prime vie
respiratorie e nel materiale fecale.
Microbiologia Preston
126
Sindromi cliniche:
1) Infezioni polmonari: Le infezioni del tratto respiratorio possono variare per
gravità, da una colonizzazione asintomatica (tracheobronchite benigna) fino ad una
grave broncopolmonite necrotizzante (soprattutto in pazienti che fanno uso di
respiratori). Esistono dei fattori che predispongono un'infezione, quali una terapia
antibiotica ad ampio spettro, che eliminano la normale flora batterica protettiva, e
l'uso di apparecchiature per ventilazione meccanica, che può far penetrare il
microrganismo nelle basse vie respiratorie. Sono frequenti in pazienti affetti da
fibrosi cistica e da malattie polmonari croniche. Nel paziente neutropenico od
immunocompromesso la contaminazione deriva dall'uso di apparecchiature
utilizzate per la respirazione assistita.
2) Infezioni della cute: Le più riscontrate sono quelle delle ferite da ustione; la
colonizzazione di una ferita da ustione, seguita da danno vascolare localizzato,
necrosi tissutale e, infine, batteriemia, è comune nei pazienti con gravi ustioni. La
superficie umida dell'ustione e l'incapacità dei neutrofili di penetrare nelle ferite
predispone i pazienti a tali infezioni. Il trattamento della ferita con creme
antibiotiche topiche mostra un successo limitato. La follicolite deriva
dall'immersione in acque contaminate (vasche idromassaggio, piscine e saune), ma
anche in persone che si depilano le gambe e affette da acne. Si possono verificare
infezioni alle unghie in soggetti frequentemente esposti all'acqua.
3) Infezioni delle vie urinarie: Si riscontrano principalmente in pazienti portatori di
catetere urinario a lungo termine.
4) Infezioni dell'orecchio: L'otite dell'orecchio esterno è spesso causata da
P.aeruginosa e il nuoto è un fattore di rischio importante; questa infezione viene
gestita con antibiotici topici e agenti essiccanti. L'otite dell'orecchio esterno
maligna è una forma di malattia aggressiva, osservata soprattutto in persone con
diabete e in pazienti anziani. Può invadere tessuti sottostanti, danneggiare nervi
cranici e le ossa, mettendo in pericolo la vita. Per i pazienti con tale malattia è
necessario un trattamento aggressivo, antimicrobico e chirurgico. E' associato
anche a otite media cronica.
5) Infezioni dell'occhio: Si sviluppano in seguito a esposizione ad acqua contaminata
da parte di soggetti con abrasioni corneali, interventi chirurgici e abrasioni
corneali in portatori di lenti a contatto. Può evolvere in malattia grave.
Microbiologia Preston
127
6) Batteriemia ed endocardite: E' clinicamente indistinguibile da quella causata da
altri batteri gram-negativi, anche se il tasso di mortalità è più elevato in quelle
causate da Pseudomonas. Batteriemia e sepsi si verificano prevalentemente in
soggetti affetti da diabete, in pazienti affetti da leucemie e linfomi in trattamento
con chemio o radioterapia, in pazienti immunocompromessi ed in pazienti
gravemente ustionati. Può manifestarsi con lesioni della cute costituite da
vescicole eritematose, che diventano emorragiche, necrotiche e ulcerose (ectima
gangrenoso) L'esame microscopico mostra la presenza di abbondando
microrganismi nella lesione, distruzione vascolare e assenza di neutrofili.
L'endocardite può manifestarsi in soggetti che fanno uso di droghe per via
endovenosa.
7) Meningite: Se il microrganismo viene introdotto in corso di rachiocentesi.
Terapia:
Sono resistenti alla maggior parte degli antibiotici; è necessaria la valutazione della
sensibilità in vitro e l'impiego di associazioni di più farmaci (amminoglicosidi+βlattamici). E' utile la somministrazione di Ig.
La resistenza agli antibiotici può essere dovuta a vari motivi: l'alterazione delle
proteine che costituiscono le porine, in modo tale viene ridotto il flusso di ingresso
del farmaco nella cellula batterica; la produzione di β-lattamasi e aminoglicosidasi
ancora; l'alterazione dei bersagli specifici di alcuni farmaci; infine meccanismi di
espulsione di farmaci penetrati all'interno della cellula batterica.
Diagnosi di Laboratorio:
Per un esame culturale le esigenze di questa specie sono semplici, infatti cresce nei
terreni di coltura comuni, come agar-sangue in ambiente aerobio. L'identificazione
viene fatta in base alla morfologia, la grandezza, l'attività emoloitica, la pigmentazione
e l'odore delle colonie, oltre ai test biochimici, quali la positività all'ossidasi.
Pseudomonas ha come capacità quella di produrre biofilm. Esistono dei requisiti
perché si formino biofilm, come la presenza di interfacie tra fasi fisiche differenti
Microbiologia Preston
128
(solido-liquido, solido-gas, liquido-gas, liquido-liquido tra sostanze non miscibili),
come quantità sufficienti di nutrienti
e quantità sufficiente di acqua. Il
biofilm può essere osservato tramite
miscroscopia ottica, elettronica e
confocale a scansione laser
(rappresentazione tridimensionale di
un biofilm). Il biofilm è formato da
microcolonie, aggregati di cellule
batteriche che rappresentano meno
di 1/3 del materiale costituente del
biofilm, e da matrice di polisaccaridi
extracellulari (EPS) attraversata da
piccoli canali, che permettono il
passaggio dell'acqua in cui i batteri
sono immersi. EPS è formato da
svariate sostanze, come glucosio, fucosio, mannosio, galattosio, fruttosio, piruvato,
acido mannuronico e complessi acido-base dell'acido glucuronico; ancora da
polisaccaridi come levani, polimannani, destrani, cellulosa, amilopectina, glicogeno e
alignato. EPS ha specifiche caratteristiche, come la presenza di canali che permettono
l'apporto di acqua e di sostanze nutritive disciolte e la rimozione di sostanze di
rifiuto, e solamente le cellule situate all'esterno di una microcolonia sono
adeguatamente servite da questo sistema idraulico, infatti le cellule della parte
centrale della microcolonia, possono utilizzare solo le sostanze che diffondono con
l'acqua. In microcolonie di Pseudomonas Aeruginosa la concentrazione di ossigeno
varia tra la porzione superficiale e gli strati più profondi, dove le cellule sono vive, ma
quiescenti. I batteri resistono all'interno del biofilm, alle naturali difese dell'ospite,
come fagocitosi, anticorpi, complemento e così via; alle sostanze antibatteriche
naturali, come lattoferrina e peptidi ricchi di istidina, ed infine agli antibiotici (550x
rispetto alla forma libera dello stesso batterio). La matrice polisaccaridica svolge
un'azione di barriera alla penetrazione del farmaco, mentre le cellule
metabolicamente non attive delle microcolonie sono scarsamente sensibili;
l'eterogeneità del biofilm comporta cellule batteriche in differenti fasi replicative, con
conseguente diversa sensibilità ai farmaci. Il biofilm può originare diverse patologie,
come l'evoluzione della placca dentaria in parodontite, la polmonite da Pseudomonas
in pazienti con fibrosi cistica, la colonizzazione di endoprotesi artificiali, la
Microbiologia Preston
129
colonizzazione di cateteri temporanei, la colonizzazione di impianti endossei, la
contaminazione di endoscopi, di lenti a contatto ed infine la contaminazione di
condizionatori d'aria, desalinizzatori marini, e ancora altro. Pseudomonas Aeruginosa,
come ampiamente detto, è ubiquitario, patogeno solamente per l'ospite
immunocompromesso; microcolonie rilasciano antigeni che inducono la sintesi di
anticorpi ad alto titolo e questi anticorpi si legano all'antigene, ma non proteggono il
soggetto; l'elevato titolo anticorpale correla infatti con un negativo andamento clinico
dell'infezione. Le cellule del biofilm attivano geni che non risultano espressi in
cellule libere, il "segnale" viene dato da molecole di lattoni acilati dell'omoserina,
che ciascuna cellula produce a basso livello e che molte cellule producono in
quantità elevate. Questo meccanismo di
aumentata concentrazione di fattori, che
inducono cambiamenti nell'attività di decine di
geni, viene definito "individuazione del
quorum". Esistono dei possibili approcci
terapeutici (per biofilm su protesi). Ricoprire le
protesi con sostanze capaci di neutralizzare
l'adesione delle cellule al substrato; rivestire la
protesi con sostanze chimiche capaci di inattivare
i geni che regolano la sintesi della matrice
polisaccaridica extracellulare del biofilm; inibire
la sintesi di molecole che servono da "segnale"
per la comunicazione intercellulare; inibire la
produzione di tossine.
Burkhoderia
Precedentemente classificati come Pseudomonas, oggi formano un nuovo genere,
formato da diverse specie di cui B.cepacia complex, B.gladioli e B.psudomallei, sono le
più conosciute, in quanto patogeni per l'uomo. Sono in grado di colonizzare una
varietà di superfici ambientali umide e sono patogeni opportunisti. I pazienti affetti
da fibrosi cistica sono suscettibili ad infezione da parte di Bukhoderia. La
colonizzazione in questi pazienti ha una prognosi scarsa, tale da rappresentare una
controindicazione per il trapianto polmonare. E' responsabile anche di infezioni
urinarie in pazienti cateterizzati, di setticemia ed altre infezioni opportunistiche.
Microbiologia Preston
130
Pseudomallei è un saprofita, riscontrabile nel suolo, nell'acqua e nella vegetazione,
comune nel Sud-Est asiatico, Africa e Australia. Le infezioni sono chiamate
melioidosi. L'infezione per via percutanea si presenta come infezione cutanea
suppurativa localizzata, accompagnata da febbre e malessere; può risolversi senza
complicanze o portare a sepsi; causa anche malattia polmonare. L'isolamento di
questo batterio deve essere effettuato con molta cautela, in quanto altamente
infettivo. Sono sensibili al trimetoprim-sulfametossazolo.
Stenotrophomonas Maltophilia
Inizialmente classificato come Pseudomonas anche lui, è responsabile di infezioni in
pazienti debilitati, con meccanismi di difesa deficitari. E' resistente ai β-lattamici e
aminoglicosidici più comunemente utilizzati; i pazienti che portano avanti una terapia
a base di questi antibiotici per lungo tempo sono soggetti a rischio per acquisire tali
infezioni. Possono causare batteriemia e polmonite, con alta incidenza di complicanze
e morte. Le infezioni ospedaliere sono riconducibili a contaminazione di cateteri
endovenosi, soluzioni disinfettanti, apparecchiature per la ventilazione meccanica e
refrigeratori. La terapia antibiotica è complicata e sono resistenti a carbapenemi,
come impenem; Trimetoprim-sulfametassazolo è l'agente maggiormente indicato.
Acinetobacter
Grossi coccobacilli gram-negativi, strettamente aerobi, ossidasi negativi. Sono
ubiquitari, in natura, in ospedale e sopravvivono su superfici umide, come apparecchi
e cute umana. Sono parte della flora oro-faringea in persone sane. Sono patogeni
opportunisti, che causano infezioni del tratto respiratorio, delle vie urinarie e delle
ferite; possono causare setticemia. Pazienti con cure antibiotiche sono a rischio, come
quelli reduci da intervento chirurgico o ventilazione respiratoria. Il trattamento è
difficile, perché spesso resistenti; necessita di test di suscettibilità.
Moraxella
Diplococchi, gram-negativi, aerobi, ossidasi positivi. Sono causa comune di bronchite
e broncopolmonite (anziani con m.polmonare cronica) e sinusite e otite. Producono
β-lattamasi ed è resistente alle penicilline; tuttavia sono sensibili alla maggior parte
degli altri antibiotici, come cefalosporine, eritromicina, tetracicline e trimetoptimsulfametossazolo.
Microbiologia Preston
131
Pasteurellaceae
Di questa famiglia fanno parte Haemophilus, Actinobacillus, Aggregatibacter e
Pasteurella. Fanno parte di questa famiglia per le dimensioni, infatti sono piccoli
(0,2-0,3x1,0-2,0μm) bastoncelli anaerobi facoltativi, gram-negativi.
Haemophilus
Sono piccoli bastoncelli gram-negativi presenti sulle mucose dell'uomo. Haemophilus
influenzae è la specie più comunemente associata a malattia, con diametro 0,2-2 μm,
asporigeno, immobile, anaerobio facoltativo. Presenti sulle membrane mucose
dell'uomo e di varie specie animali. Richiedono terreni arricchiti da uno o da
entrambi i seguenti i fattori: il fattore X (gruppo eme) coenzima termostabile,
trasportatore di idrogeno e di elettroni, presente anche nell'emoglobina (necessario
per la sintesi di enzimi, quali citocromi, citocromi-ossidasi, catalasi e perossidasi) e
fattore V (NAD o NADP) coenzima termolabile trasportatore di idrogeno e di elettroni
(utilizzato dalle deidrogenasi nei processi bioenergetici). Il sangue contiene entrambi
questi fattori, ma deve essere leggermente riscaldato (agar-cioccolato) per rilasciarli e
per inattivare gli inibitori del fattore V. La struttura della parete è quella dei batteri
gram-negativi, quindi LPS con attività endotossica, mentre nella membrana esterna
ci sono antigeni ceppo-specifici e specie-specifici. La superficie è ricoperta da una
capsula polisaccaridica e in base al polisaccaride capsulare (M.W>150.000) sono stati
identificati 6 sierotipi antigenici (da a a f), più di un gruppo di stipiti non tipizzabili
(NT) in quanto sprovvisti di capsula. La maggior parte delle malattie sistemiche
dell'infanzia (95%), prima della vaccinazione, erano dovute ad emofili con capsula di
tipo "b", la sola che contiene uno zucchero pentoso: PRP, o poliribosio-ribitolofosfato. La specie H.influenzae è suddivisa in 9 biotipi (dal I all' VIII e aegyptius) sulla
base di tre reazioni biochimiche, come la produzione di indolo, l'attività ureasica e
l'attività ornitin-decarbossilasica. Il biotipo aegyptius ed H.influenzae di biotipo III
sono identici sotto il profilo biochimico, ma causano patologie diverse, presentano
diversa capacità di crescita in vitro e diverso profilo proteico della membrana esterna.
I fattori di virulenza sono la capsula, i lipooligosaccaridi, antigeni proteici, pili e
proteasi per IgA.
• Capsula: costituita da un polisaccaride (S.S.S.= soluble specific substance) solubile
nelle piastre di coltura o nei liquidi organici degli individui infetti. E' responsabile
dell'attività antifagocitaria. Gli isolati da materiale patologico sono provvisti di
Microbiologia Preston
132
capsula e formano colonie lisce (colonie S). In coltura possono perdere la capsula e
formare colonie rugose (colonie R). H.influenzae è presente nella normale flora
microbica delle prime vie aeree, sono privi di capsula.
• Lipooligosaccaride: la parete contiene un LPS chiamato LOS; questo,
danneggiando l'attività delle cilia, permettono la traslocazione dei batteri attraverso
le cellule dell'epitelio respiratorio nel circolo sanguigno. LOS aumenta la
permeabilità della barriera emato.encefalica.
• Antigeni proteici: tutti i tipi di H.influenzae presentano due antigeni proteici,
denominati M e P, localizzati sulla superficie della membrana esterna.
• Pili: favoriscono l'adesione alle cellule epiteliali; nella malattia sistemica, la cellula
batterica perde i pili.
• Proteasi per le IgA: produce proteasi IgA1-specifiche che facilitano la
colonizzazione delle mucose.
Patogenesi dell'H.influenzae di tipo b: Viene trasmesso attraverso la via respiratoria.
Aderisce alla mucosa nasale attraverso i pili e forse attraverso le proteine della
membrana esterna. Passa attraverso le cellule epiteliali all'endotelio ed entra in
circolo. Se ha una capsula di tipo "b" dissemina. Rilascia nell'ambiente esterno circa
la metà del materiale capsulare che sintetizza, al quale si legano gli anticorpi antiPRP. Nei primi 5 mesi di vita il neonato è protetto da anticorpi materni, ma la
protezione non è assoluta e la meningite può comparire a partire dai 2 mesi di età.
Quando diminuisce il titolo anticorpale materno, i bambini diventano suscettibili
all'infezione e rimangono tali fino a quando non sintetizzano propri anticorpi antiPRP. I ceppi acapsulati (non tipizzabili NT) di H.influenzae sono patogeni opportunisti
e possono causare nel bambino otiti medie, sinusiti, bronchite cronica, congiuntiviti e
raramente causano malattia disseminata. I ceppi capsulati di H.influenzae (soprattutto
il sierotipo b) sono poco frequenti nelle vie respiratorie superiori e causano nel
bambino meningite, epiglottidite, bronchiolite e polmonite.
La meningite non è differenziabile clinicamente dalle altre meningiti di origine
batterica (E.coli, Streptococchi di gruppo B e Neisserie). Di solito viene preceduta da
un'infezione respiratoria o da otite media (1-3 gg); il microrganismo diffonde dal
nasofaringe o dall'orecchio medio e attraverso il sangue raggiunge il sistema nervoso
Microbiologia Preston
133
centrale a livello del plesso corioideo altamente vascolarizzato. Nello spazio
subaracnoideo i microrganismi si moltiplicano rapidamente, in quanto isolati dal
sistema immunitario. La meningite può manifestarsi in ragazzi e adulti che abbiano
subito un trauma cranico o che siano affetti da otite media cronica; in questi soggetti
la diffusione dell'infezione può avvenire direttamente, senza che ci sia batteriemia. La
mortalità nei pazienti trattati è inferiore al 10%. Il rischio di meningite è massimo nei
pazienti che non possiedono anticorpi anti-PRP, che presentano deplezioni di fattori
del complemento, o che hanno subito splenectomia.
La cellulite inizia come infezione della mucosa buccale e diffonde alla faccia e al
collo, dove causa gonfiore, macchie rosso-bluastre sulle guance e nella regione
periorbitale e febbre. Si rende necessaria una diagnosi differenziale da erispela
(streptococchi), per escluderla come plausibile causa. La diffusione dai tessuti al
sangue può causare sepsi e morte; l'incidenza è notevolmente ridotta
dall'introduzione del vaccino.
L'epiglottite si manifesta col mal di gola, febbre, raucedine e forte tosse, seguita da
gonfiore ed indurimento della glottide, che può progredire verso la completa
ostruzione delle vie aeree. Può avere esito fatale. L'incidenza è notevolmente ridotta
grazie all'introduzione del vaccino.
Ceppi acapsulati di H.influenzae possono essere causa di otite e sinusite acuta e
cronica. Infezioni dell'orecchio e dei seni sono principalmente malattie pediatriche,
ma possono presentarsi anche nell'adulto. La polmonite primaria è poco comune in
bambini ed adulti con normali difese immunitarie.
Epidemiologia: Il 50% degli adulti è portatore di H.influenzae non tipizzabile nelle
alte vie respiratorie, ma solo il 2-4% è portatore di emofilia di tipo "b". Il 60-90% dei
bambini è portatore di H.influenzae e il 5% portatore del tipo "b". Il 60% dei bambini
ospedalizzati sono portatori di H.influenzae di tipo "b". H.parainfluenzae costituisce il
10% della flora batterica nella saliva ed è presente anche nella placca dentale e nelle
malattie periodontali. Specie di Haemophilus possono essere presenti anche nel tratto
gastro-enterico e genito-urinario. Epidemiologia drasticamente cambiata nell'ultima
decade. La malattia causata dai sierotipi a ed f è attualmente più diffusa rispetto a
quella da sierotipo b. Bambini di età inferiore ai 18 mesi (fascia di età a più alto
rischio di infezione) vaccinati per H.influenzae di tipo b, non risultavano protetti in
virtù del naturale ritardo nella maturazione della risposta immunitaria agli antigeni
polisaccaridici. L'introduzione di vaccini contenenti gli antigeni PRP coniugati a
Microbiologia Preston
134
proteine carrier ha ridotto del 95% l'incidenza della malattia sistemica nei bambini di
età inferiore a 5 anni. Il primo fattore di rischio per la malattia invasiva è l'assenza di
anticorpi protettivi diretti contro la capsula polisaccaridica. La maggior parte delle
infezioni da H.influenzae di tipo b avviene in bambini non immuni (vaccinazione
incompleta o scarsa risposta al vaccino) e in anziani con sistema immunitario
deficitario.
Haemophilus Ducrey
Scoperto da Ducrey nel 1889, è l'agente eziologico dell'ulcera molle (cancroide)
localizzata sulla mucosa degli organi genitali. E' una malattia venerea caratterizzata da
una papula molle, con base eritematosa, che compare 5-7 giorni dopo il contatto.
Successivamente, compare un'ulcera dolente, con adenopatia inguinale, spesso
suppurativa. ' principalmente diffusa in Asia e in Africa, scarsamente in Europa. La
diagnosi viene effettuata mediante isolamento culturale. Diagnosi differenziale con
sifilide, Herpes simplex tipo 2 e linfogranuloma venereo. La terapia antibiotica è
sulfamidica.
Haemophilus Aegyptius
Chiamato in passato bacillo di Koch-Weeks, è l'agente eziologico di congiuntivite
purulenta; un ceppo è agente eziologico della febbre purulenta purpurea brasiliana.
La malattia è pediatrica fulminante, con iniziale congiuntivite, seguita da febbre alta,
vomito, dolori addominali, porpora emorragica (24h dall'inizio della sintomatologia)
ed elevata mortalità.
Terapia: Le infezioni gravi, come meningite ed epiglottite, vengono trattate con
ampicillina o cefalosporine per via parenterale (identificati ceppi produttori di βlattamasi a codificazione plasmidica). Le infezioni meno gravi, come sinusiti e otiti,
vengono trattate con ampicillina. E' utile la somministrazione di Ig iperimmuni
contro H.influenzae di tipo "b" in bambini a rischio.
Diagnosi: La meningite viene diagnosticata su campioni di sangue, in cui si ricerca
materiale capsulare, e su liquor. La diagnosi delle affezioni del tratto respiratorio
viene eseguita su tamponi nasofaringei. Per la diagnosi dell'epiglottite, cellulite e
polmonite, devono essere allestite emocolture. Per la diagnosi di infezione delle vie
respiratorie si aggiunge bacitracina per inibire la crescita di altri microrganismi
contaminanti, provenienti dalle vie respiratorie. Per la diagnosi di cancroide, si
esegue tampone in corrispondenza della base o del margine dell'ulcera. Le colture
Microbiologia Preston
135
vengono allestite su terreni agar-cioccolato preparati con sangue di cavallo
defibrinato.
Profilassi: Nella chemioprofilassi antibiotica in bambini di età inferiore ai 2 anni, che
vivono in ambiente con documentata malattia sistemica, viene utilizzata la
rifampicina. Sono disponibili tre vaccini contro H.influenzae di tipo b:
1) Vaccino PRP-D, in cui il materiale capsulare PRP è coniugato al tossoide difterico
2) Vaccino HbOC, in cui il materiale capsulare PRP è coniugato ad un frammento
non tossico della tossina difterica
3) Vaccino PRP-OMP, in cui il materiale capsulare PRP è coniugato ad una proteina
di membrana esterna di Neisseria meningitidis.
Il vaccino PRP-D può essere somministrato solo a bambini di almeno 15 mesi di età.
I vaccini HbOC e PRP-OMP dovrebbero essere somministrati a 2,4 e 6 mesi di età.
Actinobacillus
Sono piccoli bastoncelli gram-negativi, anaerobi facoltativi a crescita lenta.
Colonizzano l'orofaringe di esseri umani e animali e sono cause rare di periodontite,
endocardite, infezioni da morso ed infezioni opportuniste.
Aggregatibacter
Colonizza il cavo orale dell'uomo e possono propagarsi al sangue, quindi attaccarsi ad
una valvola cardiaca precedentemente danneggiata, o artificiale, portando
endocardite. E' difficile da diagnosticare, perché i sintomi si sviluppano lentamente e
i batteri crescono lentamente nelle colture. La terapia è il ceftriaxone.
Pasteurella
Piccoli coccobacilli fermentanti anaerobi facoltativi, commensali dell'orofaringe di
animali sani. Le infezioni derivano dal contatto con animali (morsi o graffi).
P.multocida e P.canis sono i patogeni per l'uomo. Si riferiscono cellulite e linfoadenite,
dopo un morso o graffio di un animale, poi una malattia respiratoria cronica in
pazienti don disfunzione polmonare e un'infezione sistemica in pazienti
immunocompromessi. La penicillina è l'antibiotico di scelta.
Microbiologia Preston
136
Bordetella
Di questo genere sono presenti quattro specie patogene
per l'uomo, Bordetella Pertussis, che causa pertosse,
Bordetella Parapertussis, che causa una forma lieve di
pertosse, Bordetella Bronchioseptica, che causa malattie
respiratorie occasionali nell'uomo, e Bordetella Holmesii,
una rara causa di sepsi.
Bordetella Pertussis
E' un coccobacillo gram-negativo, estremamente piccolo, di diametro 0,2-0,5μm,
strettamente aerobio, immobili, asporigeni, crescono lenamente in terreni arricchiti
con sangue, albumina e amido, perché suscettibili a sostanze tossiche e metaboliti
presenti nei comuni terreni di laboratorio.
Patogenesi: L'infezione richiede il contatto con il microrganismo, l'adesione di
questo all'epitelio ciliato del tratto respiratorio, la proliferazione dei batteri e la
produzione di danno tissutale localizzato e tossicità sistemica. L'adesione è mediata
da proteine di adesione. Ad esempio la pertactina e l'emoagglutinina filamentosa
contengono una sequenza Arg-Gly-Asp, o motivo RGD, che lega glicolipidi solforati
presenti sulle membrane delle cellule
respiratorie. Queste legano anche CR3, un
recettore dei macrofagi, che avvia la
fagocitosi, e permette ai batteri di evitare la
reazione ossidativa, che è importante per la
sopravvivenza e la replicazione cellulare dei
batteri, protegge questi dagli anticorpi. La
tossina della pertosse è una tossina A-B,
costituita da una subunità tossica S1 e da
cinque subunità di legame; la S2 lega un
lattosilceramide, mentre la S3 lega i recettori sui fagociti, inducendo un'aumento di
espressione di CR3. B.pertussis produce diverse tossine. La porzione S1 ha attività
ADP-ribosilante per le proteine G della membrana superficiale, che regolano
l'attività adenilato ciclasica, così inattiva Gα, frazione che controlla questa attività;
l'espressione incontrollata dell'enzima porta ad un aumento di cAMP e ad un
successivo aumento delle secrezioni respiratorie e della produzione di muco.
Microbiologia Preston
137
L'adenilato ciclasi/emolisina è una tossina bifunzionale, attivata dalla calmodulina,
che catalizza la conversione di ATP in cAMP, inoltre inibisce la chemiotassi dei
leucociti. La tossina dermonecrotica è una tossina termolabile, che provoca
vasocostrizione dei vasi sanguigni periferici, con ischemia localizzata ed emorragia; a
dosi elevate è fatale nei topi, probabilmente responsabile della distruzione tissutale.
La citotossina tracheale, è un monomero del peptidoglicano, che ha affinità per le
cellule epiteliali ciliate, che a basse provocazioni inibisce il movimento ciliare
(ciliostasi), ma ad alte concentrazioni provoca la perdita delle cellule ciliate; inoltre
interferisce con la sintesi di DNA, impedendo la rigenerazione delle cellule
danneggiate. B.pertussis infine produce due distinti lipopolisaccaridi, A ed X, che
attivano la via alternativa del complemento.
Epidemiologia: Ha un'alta infettività. E' una malattia umana, con nessun serbatoio
animale. L'incidenza si è ridotta grazie al vaccino, era considerata una malattia
pediatrica, ma si riscontrano oggi anche in adolescenti e adulti. Colpisce i bambini di
età inferiore ad 1 anno. Le persone a rischio di contrarre l'infezione sono quei
bambini non vaccinati o vaccinati in maniera inadeguata, e adulti con immunità
scarsa, esposti a pazienti sintomatici.
Clinica: L'infezione inizia con l'inalazione di aerosol infetti, o per goccioline di
Flugge, e l'adesione dei batteri alle cellule ciliate. Dopo un periodo di incubazione di
7-10 giorni, vediamo i sintomi della pertosse, con le tre fasi classiche, fase catarrale,
fase pasossistica e fase di convalescenza.
• Fase catarrale:
Somiglia ad un comune raffreddore, con sintomi di freddo, rinorrea sierosa, starnuti,
malessere, anoressia e febbre. Questa è la fase maggiormente contagiosa
dell'infezione, con la più alta carica batterica e dopo 1-2 settimane comincia la
seconda fase.
• Fase parossistica:
Durante questo periodo, le cellule epiteliali ciliate del tratto respiratorio vendono
distrutte, e la clearance del muco viene indebolita. La produzione di muco nelle vie
aeree è comune ed è responsabile dell'ostruzione di queste. I pazienti presentano
colpi di tosse fino a 40-50 al giorno per 2-4 settimane, i classici parossismi, o tosse
canina. Il parossismo termina con vomito e sfinimento. Osserviamo linfocitosi
marcata (40.000/ mm3). La morte giunge nello 0,04-3% dei casi.
Microbiologia Preston
138
• Fase di convalescenza:
Dopo 2-4 settimane i parossismi diminuiscono in frequenza e gravità.
Diagnosi: Sono estremamente sensibili all'essiccamento. Il campione ottimale è
l'aspirato nasofaringeo. Devono essere utilizzati tamponi sintetici, alginato di calcio,
Dacron, perché i tamponi di cotone contengono acidi grassi, che sono tossici per
B.pertussis. Non sono usati tamponi orofaringei, perché presentano un numero
insufficiente di cellule epiteliali ciliate. Il terreno di Bordet-Gengou viene incubato
per 7 giorni a temperatura di 35°C, in aerobiosi e camera umidificata. La coltura
viene fatta in quei laboratori in cui non è possibile fare test sugli acidi nucleici.
Infatti è consigliabile fare PCR, perché i test più sensibili per la pertosse. L'esame
microscopico è l'immunofluorescenza, diretta su strisci fissati e colorati, dove
vengono utilizzati anticorpi monoclonali colorati con fluorescina e diretti contro
B.pertussis.
Trattamento, prevenzione: Il trattamento è principalmente di supporto, con
supervisione infermieristica durante la fase più acuta, quella parossistica e di
convalescenza della malattia. L'antibiotico può essere utile nella prima fase, tuttavia
non viene riconosciuta molto spesso, e quindi nelle fasi successive può solamente
aiutare a eradicare i microrganismi, e a ridurre la durata dell'infettività. La
convalescenza dipende dalla rapidità del decorso clinico e dalla velocità con cui si
rigenera l'epitelio ciliato. La terapia viene effettuata con Eritromicina,
Cloramfenicolo ed Ampicillina. Sono presenti due vaccini acellulari, somministrati
in combinazione con vaccini per difterite e tetano, che contengono la tossina della
pertosse inattivata, l'emoagglutinina filamentosa e la pertactina (DPT- Difterite,
Pertosse e Tetano).
Microbiologia Preston
139
Francisella e Brucella
Sono agenti patogeni zoonotici, che possono causare malattia nell'uomo e sono
potenziali agenti di bioterrorismo. Sono coccobacilli molto piccoli, a crescita lenta e
sono sempre patogeni nell'uomo.
Francisella
Troviamo due specie, F.tularensis, l'agente eziologico della tularemia negli animali e
nell'uomo, e F.philomiragia, rarissimo opportunista associato all'esposizione di acqua
salata. Della specie Tularensis esistono due sottospecie, il tipo A, limitato al NordAmerica ed il tipo B (holarctica), endemica in tutto l'emisfero boreale. Le infezioni del
tipo A sono associate all'esposizione di conigli, lepri e gatti, mentre la B è associata
all'esposizione di roditori e gatti.
F.tularensis è un coccobacillo gram-negativo molto piccolo (0,2x0,2-0,7μm), immobile,
ha una sottile capsula lipidica e, oltre a richiedere 3 giorni di incubazione, richiede
cisteina per la propria crescita, infine, è strettamente anaerobio. E' un patogeno
intracellulare, quindi possiede la capacità di potersi replicare all'interno dei
macrofagi per lunghi periodi, impedendo la fusione dei fagosomi coi lisosomi.
Possiedono una capsula di polisaccaridi, la cui perdita porta ad avirulenza; questa
protegge i batteri dall'uccisione complemento-mediata. L'LPS è meno attivo rispetto
agli altri gram-negativi. Per controllare questo batterio è necessaria un'importante
risposta innata con produzione di IFN-γ e TNF, nonché dell'attivazione dei linfociti T
nell'adattativa, che intensificano l'attività dei macrofagi.
L'incidenza della malattia è bassa, e la maggior parte si verifica nei mesi estivi ed
invernali. Le persone a maggiore rischio sono i cacciatori, il personale di laboratorio
e gli individui esposti alle zecche ed ad altri artropodi
che pungono. La malattia si presenta in varie forme,
come ulceroghiandolare (ulcera cutanea e
ingrossamento dei linfonodi - è la manifestazione più
comune, che inizia come papula dolente, che si
sviluppa nel sito del morso della zecca, e che diventa
ulcerosa), oculoghiandolare (coinvolgimento degli
occhi e ingrossamento dei linfonodi cervicali),
ghiandolare (ingrossamento dei linfonodi senza altri
Microbiologia Preston
140
sintomi localizzati), tifoidea (segni sistemici di sepsi), polmonare (sintomi polmonari dovuto ad inalazione del batterio da aerosol infetti, con alta mortalità), orofaringea e
gastrointestinale a seguito dell'ingestione del batterio.
Diagnosi: L'isolamento è pericoloso. Il microrganismo per le sue ridotte dimensioni,
può penetrare la pelle intatta e le mucose, durante la raccolta del campione, infatti
anche se la tularemia è rara, nei laboratori è causa di infezione comune, infatti è bene
utilizzare al meglio gli indumenti profilattici. L'individuazione da noduli infetti e
ulcere è fallimentare, infatti è estremamente piccolo e scarsamente colorabile, quindi
è meglio marcare con fluorescina anticorpi diretti contro il campione. Non sonno
disponibili test su DNA. Cresce su agar-cioccolato e terreni integrati con cisteina. La
crescita è lenta. La tularemia è diagnosticata attraverso l'aumento di 4 volte o più del
titolo di anticorpi.
Trattamento: La gentamicina è l'antibiotico di scelta. Per prevenire le persone
dovrebbero evitare i serbatoi e vettori di infezione, ed evitare il contatto con animali
presumibilmente infetti. Il microrganismo è presente nelle feci delle zecche e non
nella saliva, quindi queste dovrebbero nutrirsi per molto tempo affinché si trasmetta
l'infezione, quindi rimuovendo immediatamente la zecca, può essere prevenuta
l'infezione. Le persone a rischio di contagio devono essere trattate con antibiotici in
via profilattica. I vaccini vivi attenuati possono ridurre la gravità dell'infezione.
Brucella
Ci sono sei specie, di cui quattro patogene per l'uomo, B.abortus, B.melitensis, B.canis e
B.suis. Studi d'ibridazione degli acidi nucleici hanno dimostrato che esiste solo una
specie, la melitensis, mentre le altre sono variazioni sieroloiche. Causano febbre
ondulante o febbre maltese.
Struttura: Sono di piccole dimensioni (0,5x0,6-1,5μm), immobili, non capsulati, che
crescono lentamente ed in un ambiente strettamente aerobio, alcuni ceppi
richiedono CO2 e non fermentano i carboidrati. Sono catalasi e ossidasi positivi, e
riducono i nitrati a nitriti. Presentano due antigeni superficiali A ed M, che risiedono
nella catena del polisaccaride O dell'LPS. Non producono un'esotossina e
l'endotossima è meno tossica. E' un parassita intracellulare del sistema
reticoloendoteliale. Dopo l'esposizione iniziale, i microrganismi vengono fagocitati da
macrofagi e sopravvivono al loro interno, prevenendo la formazione dei fagolisosomi
Microbiologia Preston
141
e la produzione di enzimi tossici, sopprimendo la produzione di TNF (che sarebbe di
richiamo per i neutrofili) e inattivando perossido di idrogeno e superossido
dismutasi. A questo punto i batteri vengono condotti alla milza, al fegato, al midollo
osseo, ai linfonodi e ai reni, dove secerneranno proteine che formano in queste sedi
granulomi e alterazioni distruttive.
Le infezioni da brucella hanno una distribuzione mondiale, dove in America Latina,
Africa, Asia occidentale, Medio Oriente e bacino del Mediterraneo è endemica. La
malattia nei bovini, suini, ovini e caprini è stata efficacemente eliminata attraverso la
distruzione degli animali infetti e la
vaccinazione degli animali domestici.
Nell'uomo può essere acquisita attraverso il
contatto diretto col microrganismo
(esposizione in laboratorio) oppure
inalazione ed ingestione (consumo di
prodotti contaminati). Causa malattia lieve o
asintomatica nell'ospite naturale. Infettano
bovini, bisonti, capre, pecore, suini, renne,
caribù, cani, volpi e coyote. In questi animali
prevalentemente i tessuti ricchi di eritritolo,
zucchero metabolizzato in preferenza
rispetto al glucosio, presente nella
mammella, utero, placenta, epididimo. I microrganismi sono localizzati in serbatoi
non umani. Le brucelle sono eliminate nel latte, nelle urine e nei prodotti del
concepimento. Il personale di laboratorio è a rischio significativo di infezione, così
come anche veterinari e stallieri.
Dopo un periodo di incubazione di 2-4 settimane si verificano i primi sintomi. Ha un
esordio simil-influenzale, febbre a 38/40°C, dolori muscolari e articolari, prostrazione,
splenomegalia, conta leucocitaria normale o ridotta con linfocitosi relativa. In assenza
di trattamento, i sintomi perdurano per 2-4 settimane, dopo le quali una parte dei
pazienti va incontro a guarigione spontanea, mentre gli altri vanno incontro a
ricadute a distanza di circa 10 giorni che producono la caratteristica febbre ondulante
(febbre intermittente). Possono osservarsi delle complicazioni, quali artriti, meningiti,
uveiti ed orchiti. Nel 70% dei pazienti vediamo sintomi gastrointestinali, lesioni
osteolitiche nel 20-60%, sintomi respiratori nel 25% e manifestazioni cutanee.
Microbiologia Preston
142
Diagnosi: Devono essere raccolti diversi campioni di sangue, ma anche colture di
midollo osseo e tessuti infetti. I microrganismi si colorano con tecniche
convenzionali, ma le dimensioni rendono difficile l'individuazione. Non sono
disponibili test con anticorpi. Crescono lentamente e le emocolture devono essere
incubate per 2 settimane, su agar-sangue e CO2. Le forme di brucellosi si possono
identificare mediante una specifica risposta anticorpale nel paziente infetto; gli
anticorpi vengono rilevati virtualmente in quasi tutti i pazienti. Prima si osservano
IgM, poi IgG e IgA, che possono persistere per mesi o anni.
Trattamento: Le tetracicline sono attive, ma la doxiciclina è la molecola preferita.
L'organizzazione mondiale della Sanità raccomanda la combinazione di doxiciclina
con rifampicina. Il controllo si realizza attraverso il controllo della malattia nel
bestiame, come negli USA, che richiede l'identificazione e l'eliminazione delle
mandrie infette, nonché della vaccinazione degli animali (ceppo rugoso di B.abortus
RB51). Evitare anche il consumo di latte non pastorizzato.
Microbiologia Preston
143
Legionella
La famiglia Legionellaceae è costituita da un solo genere, la Legionella, che è un sottile
bacillo gram-negativo, pleomorfo, che misura 0,3-0,9x2,0μm, fino a 20μm sui terreni
di coltura. Sono aerobi obbligati, non sono fermentanti e ricavano energia dal
metabolismo degli aminoacidi.
Causa patologie del tratto respiratorio in individui suscettibili che inalano aerosol
infetti. Sono parassiti intracellulari, che si moltiplicano nella natura all'interno di
amebe, e all'interno dell'uomo in macrofagi alveolari, monociti e cellule epiteliali
degli alveoli. I batteri legano il recettore C3 del complemento sui fagociti
mononucleati e poi migrano al loro interno per fagocitosi, inibiscono la formazione
del fagolisosoma (grazie alla loro citotossina). Le chemochine e citochine prodotte dai
macrofagi scatenano una grande risposta infiammatoria, caratteristica di queste
infezioni. I microrganismi proliferano all'interno del loro vacuolo producendo enzimi
proteolitici, fosfatasi, lipasi e nucleasi, che alla fine uccidono la cellula ospite quando
il vacuolo va incontro a lisi. I batteri non vengono uccisi finché la produzione di IFNγ, da parte degli Th1 attivati, intensifica la capacità microbicida dei macrofagi che li
hanno fagocitati.
Hanno una distribuzione mondiale, presenti in specchi d'acqua naturali, come laghi e
corsi d'acqua, quindi ambienti caratterizzati dalla presenza di acqua dolce, ma in
alcune circostanze mediante la contaminazione dell'acqua di umidificazione degli
impianti di condizionamento, o di quella usata a scopo industriale e domestico,
possono trasmettersi, per via inalatoria, all'uomo. I batteri possono sopravvivere a
lungo in ambienti umidi, a temperature relativamente elevate e in presenza di
disinfettanti, quali il cloro.
Le infezioni sintomatiche colpiscono principalmente i polmoni e si possono
verificare due di queste situazioni: febbre di Pontiac e febbre dei legionari.
1) La febbre di Pontiac ha un quadro simil-influenzale, con tendenza spontanea alla
guarigione. Febbre, brividi, mialgia, malessere e cefalea sono i sintomi, che si
hanno nel giro di 12 ore e durano dai 2 ai 5 giorni.
2) La febbre dei legionari è una grave forma di polmonite, spesso associata a lesioni
renali ed epatiche. Le legionelle sono responsabili di circa il 5% di tutti i casi di
polmonite, e di queste, il 70-90% è causata da L.pneumophila. Si verifica dopo un
periodo di incubazione di 2-10 giorni, dove compaiono i primi sintomi, febbre,
Microbiologia Preston
144
brividi, cefalea, tosse secca e non produttiva, che come già detto, può coinvolgere
più organi, come reni e fegato.
Diagnosi: Si colorano poco con la colorazione di Gram, si colorano meglio però con
colorazioni non specifiche, come l'impregnazione argentica. Il metodo sicuramente
più sensibile è l'utilizzo di immunofluorescenza diretta. I test per l'amplificazione di
acido nucleico sono molto specifici e sensibili. La colticazione è difficile, comunque
per la propria crescita necessitano di ferro e di L-cisteina (presenti nell'emoglobina e
nel pirofosfato ferrico). Il terreno più utilizzato è l'agar characoal yeast extract
tamponato (BCYE); crescono in atmosfera normale a 35°C in 3-5 giorni.
Trattamento: Per curare le infezioni da Legionella bisogna usare i macrolidi
(azitromicina, claritromicina) o i fluorochinoloni (ciprofloxacina, levofloxacina). Le
penicilline sono inefficaci, perché producono β-lattamasi. Per quanto riguarda la
febbre di Pontiac non è necessario un trattamento, perché autolimitante. La
prevenzione richiede l'identificazione della fonte ambientale dei microrganismi e la
riduzione della carica microbica. L'iperclorazione degli impianti idrici e il
mantenimento di temperature dell'acqua elevate hanno dimostrato discreto successo.
L'eliminazione completa della Legionella è impossibile.
Miscellanea di bacilli gram-negativi
Da fare!
Bartonella
Presenta 19 specie, di cui 3 sono patogeni importanti per l'uomo, B.bacilliformis,
B.quintana e B.henselae. Sono gram-negativi, aerobi, corti, esigenti dal punto di vista
metabolico, crescono su agar-sangue arricchito a temperature di 37°C. Si ritrovano in
serbatoi animali e l'infezione causata da questi batteri si trasmette agli esseri umani
tramite contatto diretto o tramite insetti vettori, come pulci, flebotomi e pulci, per
causare sostanzialmente febbre ricorrente.
Bacilliformis è l'esemplare tipico del genere, che causa una patologia febbrile acuta
con grave anemia, seguita da una forma cutanea cronica (verruca peruviana). La
malattia è confinata alle regioni montagnose andine di Perù, Ecuador e Colombia.
E'causata da flebotomi che mordendo infettano il sangue, bartonella nel sangue si
Microbiologia Preston
145
moltiplica ed entra negli eritrociti, causando anemia. In seguito compaiono noduli
cutanei di 1-2 cm infiltrati di sangue, o lesioni angioproliferative, che possono
perdurare per anni.
Bartonella quintana causa la febbre delle trincee, causata dal morso dei pidocchi. Non
causa morte, ma la malattia può essere molto grave. Malattia molto diffusa nella prima
guerra mondiale, che causa febbre, cefalea, astenia e dolore delle ossa lunghe. E'
associata anche a molte patologie in pazienti immunocompromessi, come
sieropositivi, che si manifesta sotto forma di febbri ricorrenti con batteriemia e
angiomatosi bacillare. La trasmissione dei batteri riguarda principalmente i
senzatetto.
Bartonella henselae causa angiomatosi bacillare che riguarda cute, linfonodi, fegato e
milza, ed è trasmessa dal morso di pulci.Gli animali come i gatti costituiscono quindi
una riserva per questi insetti, che sono trasportati in maniera asintomatica
nell'orofaringe del gatto o possono causare batteriemia transitoria in questi gatti.
Questo batterio è anche responsabile di malattia da graffio di gatto, infezione
pediatrica benigna, con adenopatia localizzata cronica del linfonodi.
Terapia: La doxiciclina o l'eritromicina per via orale appaiono le terapie più usate.
Cardiobacterium
Cardiobacterium hominis, come dice il nome, causa endocardite nell'uomo. Sono
bastoncelli gram-negativi, piccoli, pleomorfi, immobili e aerobi facoltativi. Sono
presenti nel tratto respiratorio nel 70% di individui sani. La maggior parte delle
infezioni sono causate da cardiopatie pre-esistenti o patologie del cavo orale, infatti
questi batteri sono in grado di entrare nel sangue dall'orofaringe, di aderire al tessuto
caridaco e di moltiplicarsi, dando origine a malessere, febbricola. E' comune la
completa guarigione dopo un'adeguata terapia antibiotica, basata su penicillina ed
ampicillina per 2-6 settimane; sono eritromicina-resistenti.
Capnocytophaga
Bastoncelli filamentosi gram-negativi aerobi facoltativi, che colonizzano oro-faringe
umana (associati a periodontite e setticemie). Crescono lentamente, e servono due
Microbiologia Preston
146
giorni per osservare le colonie su agar-sangue. La terapia si basa su β-lattimina
assieme ad un inibitore di β-lattamasi (ad esempio amoxicillina più acido cluvanico).
Streptobacillus
Streptobacillus moniliformis è l'agente responsabile della
febbre da morso di ratto, lungo sottile bacillo, gramnegativo, che può formare rigonfiamenti bulbosi e lunghi
filamenti. Si trova nel nasofarige di ratti e piccoli roditori;
le infezioni originano da morsi e molto meno
frequentemente a seguito di consumo di acqua o cibo
contaminati. Dopo un periodo di incubazione di 2-3
giorni, e compare febbre, cefalea, brividi, dolori muscolari
ed articolari; in seguito anche petecchie e rash cutaneo. E'
sensibile a numerosi antibiotici, compresi penicillina e tetraciclina.
Microbiologia Preston
147
Clostridium
Della famiglia Bacillaceae fanno parte il genere Bacillus e Clostridium. I clostridi sono
gram-positivi (ma anche gram-negativi), ubiquitari, anaerobi stretti, sporigeni e
presenti nel suolo, acqua, tratto gastrointestinale dell'uomo e degli animali. Il potere
patogeno dei clostridi è attribuito a fattori come la capacità di sopravvivere in
condizioni ambientali avverse, mediante la formazione di spore, la rapidità di crescita
in ambienti ricchi di nutrienti e privi di ossigeno, ed infine, la capacità di produrre
numerose tossine istolitiche, enterotossine e neurotossine. Del genere clostridium
fanno parte quattro specie particolarmente importanti per l'uomo, che sono
C.perfringens, C.tetani, C.botulinum e C.difficile.
Clostridium Perfringens
Sono bacilli di grandi dimensioni
(0,6-2,4x1,3-19,0 μm), rettangolari, gram-positivi
ed immobili nonostante la notevole rapidità di
crescita. E' distinto in 5 tipi, da A ad E, di cui il
tipo A è quello responsabile della maggior parte
delle infezioni nell'uomo. Può essere
responsabile solo di colonizzazione, oppure di
varie malattie che vanno da gastroenterite a
distruzione devastante dei tessuti (mionecrosi).
Questa differenza di patogenicità viene attribuita al grande numero di tossine che
questo batterio riesce a produrre. Può produrre 4 tossine letali (α,β,υ,ι), 6 tossine
minori, una enterotossina e una neuraminidasi.
- La tossina α viene prodotta da tutti i ceppi di Clostridium perfringens ed è una
fosfolipasi C (lecitinasi), che lisa eritrociti, leucociti, piastrine e cellule endoteliali.
Ciò provoca un aumento della permeabilità vascolare, emolisi, sanguinamento e
distruzione dei tessuti (come avviene nella mionecrosi) tossicità epatica e disfunzioni
cardiache (bradicardia e ipotensione).
- La tossina β è responsabile di lesioni necrotiche (enteriti necrotizzanti).
- La tossina ε è una protossina attivata dalla tripsina e provoca aumento della
permeabilità vascolare della parete gastroenterica.
- La tossina ι è responsabile di attività necrotica ed aumentata permeabilità vascolare.
Microbiologia Preston
148
- L'enterotossina può inserirsi nella membrana cellulare e modificare la permeabilità
(citotossica ed enterotossica); gli effetti enterotossici sono dovuti ad ingestione di un
numero elevato di microrganismi. E' termolabile e la contemporanea presenza di
tripsina ne aumenta di circa tre volte la tossicità.
Questa viene prodotta durante la trasformazione in spora e rilasciata durante la
sporulazione; l'ambiente alcalino dell'intestino tenue stimola la sporulazione. Una
volta liberata, l'enterotossina, si lega a recettori sull'orletto a spazzola dell'ileo e del
digiuno, alterando la permeabilità di membrana, provocando ipersecrezione di fluidi
ed elettroliti; inoltre funge da superantigene.
Epidemiologia:
Clostridium perfringens A è presente nel normale tratto GI dell'uomo e degli animali
ed è assai diffuso in natura, soprattutto nel suolo ed acqua contaminati da materiale
fecale. In condizioni avverse forma spore. E' responsabile di infezione dei tessuti
molli, di tossinfezioni alimentari e setticemia; il tipo C è causa di enterite
necrotizzante.
Clinica:
• Infezione dei tessuti molli: si dividono in
1) Cellulite (con formazione di gas nei tessuti molli)
2) Fascite o Miosite suppurativa (la cellulite può progredire fino a fascite,
caratterizzata da accumulo di pus nei tessuti muscolari, senza necrosi muscolare o
sintomi sistemici)
3) Mionecrosi o Gangrena gassosa: l'inizio della malattia, caratterizzato da intenso
dolore, si sviluppa dopo che i clostridi penetrano nella cute attraverso un trauma.
La mancanza di ossigenazione determina abbassamento del potenziale di
ossidoriduzione permettendo la crescita dei clostridi anaerobi. Dopo circa una
settimana si manifestano necrosi muscolare, danno renale, shock e spesso morte
del paziente. L'esame macroscopico dei muscoli rivela la presenza di tessuto
necrotico devitalizzato e di gas nei tessuti. L'attività metabolica del clostridio è la
causa della necrosi, associata a produzione di gas, donde il nome gangrena
gassosa. All'esame microscopico si osservano bacilli gram-positivi retangolari,
mentre sono assenti cellule della risposta infiammatoria. Le tossine dei clostridi
provocano un'estesa emolisi e sanguinamento.
Microbiologia Preston
149
• Tossinfezione alimentare:
E' caratterizzata da un breve periodo d'incubazione (8-24 ore) e da manifestazioni
cliniche che comprendono crampi addominali e diarrea acquosa in assenza di
febbre, nausea e vomito, ed infine da un decorso clinico inferiore a 24h. La malattia
deriva dall'ingestione di prodotti a base di carne contaminata da un gran numero di
perfringens di tipo A (10^8/9). Il raffreddamento del cibo dopo la preparazione
previene la produzione di enterotossina; alternativamente il riscaldamento del cibo
può distruggere l'enterotossina, in quanto termolabile.
• Enterite necrotizzante:
E' un processo di necrosi acuto, raro, che si verifica nel digiuno, caratterizzato da
dolori addominali, diarrea sanguinolenta, shock e peritonite. La mortalità nei pazienti
raggiunge il 50%. Responsabile è il perfringens di tipo C, produttore della tossina β;
Papuasia e Nuova Guinea sono le zone dove è più comune l'enterite. Fattori di rischio
sono l'ingestione di carne poco cotta di maiale contaminato insieme a patate dolci,
che contengono un inibitore, resistente al calore, della tripsina, e la malnutrizione
(con perdita dell'attività proteolitica della tripsina che inattiva l'enterotossina).
• Setticemia
Diagnosi di Laboratorio:
La diagnosi di laboratorio serve solo come conferma. Al microscopio sono bacilli
gram-positivi, in assenza di polimorfonucleati. Viene effettuato un esame colturale in
anaerobiosi e Test immunologici per l'dentificazione della enterotossina in campioni
fecali.
Trattamento, prevenzione e controllo:
Le infezioni dei tessuti molli devono essere trattate chirurgicamente in modo
aggressivo e con terapia antimicrobica a base di penicilline ad alte dosi. La mortalità
varia tra il 40-100%, quindi prognosi infausta. Non è necessaria la terapia antibiotica
per la tossinfezione alimentare, perché autolimitante. La prevenzione ed il controllo è
difficile, perché ubiquitario.
Microbiologia Preston
150
Clostridium Tetani
E'un bacillo di piccole dimensioni, mobile,
che produce spore rotonde che si
localizzano all'estremità, conferendogli un
aspetto a bacchetta di tamburo. E' grampositivo, acapsulato; a differenza di altri
clostridi, cresce difficilmente in laboratorio,
anche perché, come stretto anaerobio, non
tollera la presenza di O2. Producendo delle
spore, riesce a sopravvivere a condizioni ambientali avverse. Produce due tossine
importanti, che sono la tetanolisina e la tetanospasmina. La tetanolisina è una
emolisina ossigeno-labile analoga alla streptolisina O. La tetanospasmina è una
neurotossina, responsabile delle manifestazioni cliniche del tetano, prodotta durante
la fase stazionaria. La tetanospasmina è codificata da un plasmide, prodotta come
singola molecola di 150 kDa, che viene scissa da proteasi in due subunità peptidiche:
una subunità leggera o catena A e una subunità pesante o subunità B, tenute insieme
da un ponte disolfuro; la catena B si lega con l'estremità carbossi-terminale ad un
recettore sulla superficie dei neuroni motori, un ganglioside GM2 e anche ad acido
sialico. Le molecole di tossina intatte si localizzano poi all'interno degli endosomi e
vengono trasportate attraverso l'assone al soma del neurone motore nel midollo
spinale; qui l'endosoma viene acidificato, quindi la porzione N-terminale cambia
nella catena pesante, e si lega alla membrana endosomiale e la catena leggera della
tossina passa nel citoplasma cellulare. La catena leggera è una zinco-peptidasi, che
viene internalizzata e risale dalle terminazioni periferiche al SNC tramite il trasporto
assonale retrogrado. La tetanospasmina inattiva le proteine che regolano il rilascio
dei neurotrasmiettitori inibitori come glicina e GABA, che porta così ad una sregolata
attività delle sinapsi eccitatorie dei neuroni motori, con conseguente paralisi
spastica. Il legame della tossina è irreversibile, per cui il recupero dipende dalla
formazione di nuove terminazioni assoniche.
La trasmissione nervosa è regolata dall'equilibrio tra neurotrasmettitori eccitatori ed
inibitori. I neurotrasmettitori inibitori, GABA e glicina, prevengono la
depolarizzazione della membrana post-sinaptica e la conduzione del segnale elettrico.
La tetanospasmina non interferisce con la produzione del GABA o della glicina, ma
Microbiologia Preston
151
con il loro rilascio (attività presinaptica). In assenza di neurotrasmettitori inibitori,
l'eccitazione degli assoni non viene contrastato.
C.tetani ha una distribuzione ubiquitaria. Nel terreno e colonizza il GI di animali e
esseri umani. Sono sensibili all'ossigeno atmosferico, ma sopperiscono a questo
problema mediante la sporulazione. Il tetano è raro nei paesi sviluppati grazie al
vaccino, ma è ancora responsabile di numerosi decessi nei paesi in via di sviluppo.
L'evento iniziale del tetano è rappresentato da un trauma, seguito dalla
contaminazione accidentale della ferita con C.tetani. Il danno tissutale è
indispensabile perché provoca un abbassamento del potenziale di ossido-riduzione
fornendo un ambiente adatto per la crescita in anaerobiosi. Dopo la germinazione, il
microrganismo non è invasivo e resta confinato nel tessuto necrotico, dove la cellula
vegetativa elabora la tossina letale. Il periodo di incubazione dalla ferita alla comparsa
dei sintomi varia da alcuni giorni a
diverse settimane (a seconda della dose
infettante e del sito di infezione). Il tetano
può essere di due tipi:
1) Tetano generalizzato: (detto anche
discendente) La tossina prodotta non
può essere assorbita dalle terminazioni
nervose locali e quindi passa nel
sangue e nella linfa ed è assorbito
successivamente dai nervi motori. I
centro più suscettibili sono a livello di
testa e collo, ed i primi sintomi sono rappresentati
dal trisma con spasmo muscolare discendente dal
collo al tronco ed agli arti. Le vie respiratorie
superiori possono ostruirsi provocando difficoltà
respiratorie. Segni di malattia: trisma (o
serramascelle - contrazione dei muscoli masseteri),
risus sardonicus (2a immagine, contrazione dei
muscoli facciali), opistotono (1a immagine, spasmo
dorsale persistente), sudorazione, irritabilità, aritmia
cardiaca e disidratazione. Stimoli ambientali
possono iniziare lo spasmo.
Microbiologia Preston
152
2) Tetano localizzato: (detto anche ascendente) La tossina viaggia lungo la via
neuronale (nervi periferici) e le manifestazioni sono limitate alle aree di danno
primario. Il tetano localizzato si manifesta spesso in persone vaccinate in modo
inadeguato e, di solito, di risolve spontameamente.
3) Altre forme di tetano sono la forma cefalica (interessa la testa ed implica i nervi
cranici) e la forma neonatale (si deve al tagli del cordone ombelicale con bisturi
infetti)
Diagnosi: Avviene principalmente su base clinica; né la tossina, né gli anticorpi
diretti contro la tossina sono rilevabili nel paziente, in quanto la tossina si lega
rapidamente ai neuroni motori e si localizza poi all'interno di essi. L'esame
microscopico non è praticabile sul campione biologico. La coltura in anaerobiosi è
lenta e difficile. La dimostrazione della presenza della tossina nelle feci o nel siero
può essere effettuata mediante prova biologica nel topolino, o test di neutralizzazione
in vivo.
Trattamento, prevenzione e controllo: Il trattamento richiede la rimozione chirurgica
del tessuto necrotico della ferita, l'uso di penicillina e metronidazolo,
l'immunizzazione passiva con immunoglobuline antitetaniche umane e la
vaccinazione con antitossina tetanica. La penicillina, come la tetanospasmina,
tuttavia, inibisce l'attività del GABA, quindi è sconsigliato l'utilizzo. Gli anticorpi
invece impediscono il legame della tossina alle terminazioni nervose. La vaccinazione
con una serie di tre dosi di anatossina tetanica, seguita da dosi di richiamo ogni 10
anni, è altamente efficace nel prevenire il tetano.
Clostridium Botulinum
E' l'agente eziologico del botulismo e rappresenta un gruppo eterogeneo di bacilli
sporigeni, anaerobi, di grandi dimensioni.
E' suddiviso in 4 gruppi (I e IV) sulla base del tipo di tossina prodotta e della sua
attività proteolitica. I ceppi I e II sono responsabili della maggior parte della
patologia nell'uomo. Esistono 7 tossine distinte antigenicamente (A,B,C,α,D,E,F,G); i
tipi A,B,E,F sono associati alla patologia nell'uomo. La tossina botulinica è simile alla
tossina tetanica. La proteina intera ha un peso molecolare di 150 kDa ed è formata da
2 o più subunità (A-B). La subunità A è una zinco-endopeptidasi con attività
Microbiologia Preston
153
neurotossica, che è complessata con delle parti B, non tossiche, che proteggono la
neurotossina dall'inattivazione da parte degli acidi dallo stomaco. La parte Cterminale della catena pesante si legano ai recettori di glicoproteine e acido sialico
sulla superficie dei neuroni motori e stimola l'endocitosi della molecola tossica. La
tossina botulinica rimane a livello della giunzione neuromuscolare; l'acidificazione
dell'endosoma stimola il rilascio N-terminale della catena leggera. La tossina blocca
la neurotrasmissione a livello delle sinapsi colinergiche, prevenendo il rilascio del
neurotrasmettitore acetilcolina (paralisi flaccida); produce una endopeptidasi che
blocca il rilascio di acetilcolina a livello della giunzione neuromuscolare, e come
risultato si ha paralisi muscolare. La tossina botulinica, come quella tetanica, scinde
la sinaptobrevina interferendo così con la formazione delle vescicole sinaptiche.
Inoltre esiste anche una tossina dimerica che altera la permeabilità vascolare.
Tossina Botulinica
Botulismo
Intossicazione Botulinica
La dose letale per via endovenosa o intramuscolare della tossina botulinica è di
0,09-0,15 μg; per via inalatoria è di 0,7-0,9 μg e per via orale è di 70 μg.
Epidemiologia: E' comunemente isolato in campioni di terreno e di acqua in tutto il
mondo. Sono state trovate 4 forme di botulismo: botulismo alimentare, infantile, da
ferita e da inalazione. Il botulismo alimentare lo riscontriamo con una frequenza di
circa 50 casi all'anno, dovuto a cibi inscatolati in casa (tossine di tipo A e B) e
consumo di pesce surgelato (tipo E). Il botulismo infantile lo riscontriamo con circa
100 casi l'anno, ed è stato associato al consumo di cibo in particolare miele
contaminato con le spore del botulino.
Il botulismo alimentare presenta tipicamente debolezza e vertigini da 1 a 3 giorni
dopo il consumo degli alimenti. I primi sintomi comprendono visione doppia, pupille
dilatate (effetti anticolinergici della tossina), bocca secca, costipazione, dolori
Microbiologia Preston
154
addominali, debolezza dei muscoli periferici e la morte arriva in genere per paralisi
respiratoria. La morte si è ridotta dal 70 al 10% mediante l'impiego di cure di
complicazioni respiratorie.
Il botulismo da ferite vede la produzione di tossine nelle ferite contaminate; i
sintomi sono identici a quelli del botulismo alimentare, ma il periodo di incubazione
è leggermente più lungo (4 o più giorni).
Il botulismo infantile è la forma più comune di botulismo negli USA, causata da una
neurotossina prodotta in vivo dal clostridio, che colonizza il tratto GI dei lattanti.
Colpisce bambini da 1-6 mesi ed i sintomi iniziali sono non-specifici (costipazione,
pianto flebile e ritardo di crescita). La malattia può portare a paralisi flaccida e
l'arresto respiratorio. Il tasso di mortalità è molto basso 1-2%.
Diagnosi: La diagnosi clinica è confermata dall'isolamento colturale o dalla
dimostrazione della presenza di tossina. Per isolare clostridium botulinum in campioni
contaminati, occorre riscaldare il materiale per 10' ad 80°C per uccidere le forme
vegetative. La dimostrazione della presenza della tossina nelle feci o nel siero può
essere effettuata mediante prova biologica nel topolino (neutralizzazione in vivo).
Trattamento: I pazienti richiedono adeguata assistenza respiratoria, eliminazione del
microrganismo dal tratto GI attraverso lavanda gastrica e di una terapia con
penicillina o metronidazolo ,ed infine l'uso di un'antitossina botulinica trivalente,
contro le tossine A, B ed E per neutralizzare la tossina circolante nel sangue.
L'assistenza respiratoria è fondamentale. Non dare miele a bambini con meno di un
anno.
Clostridium Difficile
E' responsabile di infezioni dell'apparato GI, associate all'uso di antibiotici, che
vanno dalla diarrea benigna e autolimitante, ad una colite pseudomembranosa
pericolosa per la vita. Le infezioni endogene hanno origine dopo trattamento con
antibiotici che provoca alterazione della popolazione microbica gastrointestinale
residente, con prevalere di C.difficile. Le infezioni esogene si trasmettono da persona
a persona soprattutto negli ospedali. Le spore possono rimanere infettive per più
settimane o mesi. I soggetti più a rischio sono pazienti ricoverati ,che ricevono
trattamento antibiotico (β-lattamici e clindamicina), ed i soggetti non ospedalizzati in
Microbiologia Preston
155
cui la somministrazione prolungata di antibiotici provoca alterazione della
popolazione microbica gastrointestinale, con conseguente abbondante
moltiplicazione di C.difficile.
Produce due tossine, un'enterotossina (tossina A) ed una citotossina (tossina B),
inoltre possiede ialuronidasi, fattodi d'adesione e forma spore.
La tossina A, o enterotossina, è chemiotattica per i polimorfonucleati nell'ileo e
provoca il rilascio di citochine, l'ipesecrezione dei fluidi e necrosi emorragica; infine
produce un effetto citopatico aumentando la permeabilità della parete intestinale e
diarrea.
La tossina B, o citotossina, provoca depolimerizzazione dell'actina, distruzione del
citoscheletro cellulare.
Le SLP, o proteine dello strato superficiale del batterio, sono importanti per ol
legame del batterio all'epitelio intestinale. Le ialuronidasi hanno attività citolicita. La
spora permette la sopravvivenza per mesi nell'ambiente ospedaliero.
Clinica: Fa parte della flora normale intestinale in un piccolo numero di individui
sani e di pazienti ricoverati. La malattia insorge nei pazienti trattati con antibiotici
poiché questi agenti alterano la normale flora commensale, permettendo la crescita di
questi germi resistenti, o rendendo i pazienti più suscettibili all'acquisizione esogena
di C.difficile. La malattia insorge se il microrganismo prolifera nel colon e produce in
questa sede le sue tossine.
Diagnosi: In campioni di feci viene dimostrata la presenza dell' enterotossina
attraverso test immunologici (ELISA) e della citotossina su colture cellulari in vitro
(saggio di citotossicità).
Trattamento: L'Ampicillina, Metronidazolo e Vancomicina sono il trattamento di
elezione. Nel 20-30% dei pazienti possono verificarsi recidive dopo il completamento
della terapia antibiotica. La malattia è difficile da prevenire, perché presente negli
ospedali, soprattutto nelle zone frequentate da pazienti infetti (letti e bagni); la
maggiore prevenzione deve essere fatta in aree ospedaliere, con le spore come
sorgente di infezione.
Microbiologia Preston
156
Batteri anaerobi gram-positivi asporigeni
Cocchi gram-positivi anaerobi
Colonizzano il cavo orale, il tratto gastrointestinale, il sistema urogenitale e la cute.
Causano infezioni quando si propagano da questi siti ad altri normalmente sterili.
Sono sensibili alla penicillina e ai carbapenemici.
Bacilli gram-positivi asporigeni anaerobi
Sono un gruppo eterogeneo di batteri che colonizzano la cute e le superfici mucose.
Sono opportunisti noti, quali, Actinomyces, Mobiluncus, Lactobacillus e
Proprionibacterium.
Actinomyces
Sono bacilli gram-positivi facoltativi e obbligati, che crescono lentamente in coltura,
e tendono a determinare infezioni croniche a sviluppo lento, sviluppando forme
filamentose o ife. Colonizzano il tratto respiratorio superiore, gastrointestinale e
quello genitale femminile. Non sono presenti sulla superficie cutanea ed hanno
scarsa virulenza e causano malattie solo quando le normali barriere delle mucose
vengono interrotte a causa di traumi, interventi chirurgici o infezioni in genere. La
patologia classica è detta actinomicosi, caratterizzata da lesioni granulomatose
croniche. Sono visibili negli ascessi colonie macroscopiche di questi organismi, simili
a granelli di sabbia, perché sono formati da ammassi di strutture filamentose legate
insieme da fosfato di calcio, chiamati granuli di zolfo. L'actinomicosi è poco
frequente, mentre Actinomyces è responsabile, per lo più, di infezioni del cavo orale,
ascessi dentali ed infezioni associate ad impianti. Le infezioni sono endogene e non è
vi è trasmissione da persona a persona. Le maggior parte delle infezioni sono quelle
cervicofacciali, compaiono in pazienti con scarsa igiene orale o che hanno subìto un
trauma o un intervento odontoiatrico, invadendo il tessuto danneggiato e avviando il
processo infettivo. L'infezione può essere piogenica acuta o indolore. L'actinomicosi
può essere ancora toracica, con sintomi aspecifici, addominale, che invade tutti gli
organi, ed infine pelvica, con forma relativamente benigna di vaginite oppure con
distruzione del tessuto. L'actinomicosi può anche riguardare il SNC, in cui si
osservano ascessi cerebrali. La terapia può essere drenaggio di un ascesso localizzato,
o rimozione chirurgica dei tessuti coinvolti oppure ancora una terapia prolungata di
antibiotici quali penicillina, macrolidi o carbapenemici.
Microbiologia Preston
157
Propionibacterium
Sono bastoncelli gram-positivi di piccole dimensioni disposti in aggregati . Si
riscontrano su cute, congiuntiva, orecchio esterno, orofaringe e tratto genitale
femminile. Sono anaerobi, immobili, catalasi positivi e in grado di fermentare i
carboidrati, ed il principale prodotto della fermentazione è l'acido propionico, da cui
deriva il nome di questo genere. Propionibacterium Acnes è responsabile di acne
vulgaris (giovani) e infezioni opportunistiche nei pazienti con protesi o cateteri/shunt;
il ruolo di questo batterio è quello di scatenare una risposta infiammatoria.
Propiobacterium Propionicum invece è associato ad ascessi dentali e canaliculite
lacrimale. L'acne non è riferibile ad un a mancata efficacia della detersione cutanea,
perché la lesione ha origine all'interno delle ghiandole sebacee; viene gestita con
antibiotici ad azione topica.
Mobiluncus
Sono bacilli gram-variabili, ricurvi, con estremità affusolate e anaerobi obbligati.
Sono sensibili alla vancomicina, eritromicina ed ampicillina. Crescono su terreni
arricchiti da siero di coniglio e di cavallo. Si ritrovano raramente nella vagina di
donne sane e abbondano in quelle affette da vaginosi batterica.
Lactobacillus
Sono anaerobi facoltativi o anaerobi obbligati. Parte della flora batterica normale del
cavo orale, stomaco, intestino e tratto urogenitale. Sono i batteri più comuni
dell'uretra e sono incapaci di moltiplicarsi nelle urine. Il passaggio nel sangue si
verifica in batteriemia transitoria da una fonte urogenitale, endocardite e setticemia
opportunistica. Trattamento di elezione è la combinazione tra una penicillina e un
aminoglicoside.
Microbiologia Preston
158
Batteri gram-negativi anaerobi
Gli anaerobi gram-negativi li possiamo riscontrare nelle vie aeree superiori, nel tratto
gastrointestinale e quello urogenitale. Troviamo generi quali Bacterioides,
Fusobacterium, Parabacterioides, Porphyromonas, Prevotella e Veillonella. Bacterioides
fragilis è la specie più importante ed ha dimensioni e morfologia variabile, che si
colora debolmente con Gram e cresce in coltura velocemente in campi addizionati
con bile. Hanno una struttura classica dei Gram negativi, con una capsula
polisaccaridica che ha LPS privo di attività endotossica (dovuto al fato che il lipide A
non si lega tramite i gruppi fosfato ai radicali disaccaridici della glucosamina e risulta
ridotto quindi il numero di acidi grassi a catena lunga legati ad amino zuccheri).
Nonostante fragilis non sia il batterio predominante (tra i gram-negativi anaerobi) nel
tratto gastrointestinale, la maggior parte delle infezioni intraddominali è associata a
questo batterio. E' in grado di aderire alle cellule epiteliali e alle molecole
extracellulari tramite fimbrie, e la capsula i oppone alla fagocitosi; gli acidi grassi a
catena corta (acido succinico) prodotti durante il metabolismo inibiscono la
fagocitosi; possono tollerare l'esposizione all'ossigeno, perché possiedono catalasi e
superossido-dismutasi, che inattivano il perossido d'idrogeno e i radicali liberi
dell'ossigeno. Producono una tossina termo-labile, consistente in una metalloproteasi
zinco-dipendente (BFT), che cambia l'epitelio intestinale tramite riorganizzazione di
actina F, con uscita di cloruri e perdita di liquidi (patologie diarroiche); contribuisce
al danno infiammatorio inducendo secrezione di IL-8. Normalmente sono presenti
con un ruolo protettivo, ma se vengono a ritrovarsi in luoghi sterili possono causare
patologia endogena. Le patologie del cavo orale e del cervello sono sostenute da
Prevotella, Porphyromonas, Fusobacterium e Bacterioides (non cervello); le infezioni
intra-addominali sono dominate da B.fragilis, come anche le infezioni ginecologiche,
le infezioni cutanee, gastroenteriti e le setticemie (1-3% delle totali). I campioni
devono essere trasportati in laboratorio con cura ed in ambiente anaerobio. Le
colonie sono visibili entro due giorni e per l'identificazione si effettua colorazione di
Gram, resistenza a vancomicina e crescita in presenza di bile al 20%. Il trattamento
migliore è la terapia antibiotica a base di metronidazolo, carbapenemici e β-lattamine
associate ad inibitori delle β-lattamasi.
Microbiologia Preston
159
Spirochetales
Sono raggruppati dei batteri per le loro caratteristiche morfologiche, batteri gramnegativi sottili, elicoidali, che presentano tre famiglie importanti, quali Treponema,
Borrelia e Leptospira. Sono batteri di forma allungata con corpo avvolto a spirale, non
visibili al microscopio in campo chiaro, visibili in campo scuro, a contrasto di fase e
dopo la colorazione con sostanze fluorescenti o impregnazione argentica. Sono molto
labili, non sopravvivono all'essiccamento o ai disinfettanti. Hanno una parete simile a
quella dei gram-negativi, ma flessibile ed esternamente alla membrana è presente
uno strato di muco- L'apparato locomotore comprende endoflagelli, uno o più fasci
di fibrille (ciascuna organizzata come un flagello batterico) ancorati ad un polo della
cellula ed inseriti longitudinalmente nello spazio periplasmatico. Le leptospire hanno
1-2 filamenti assiali, i treponemi virulenti ne hanno 3 e le borrelie da 7 a 20. Un tempo
erano considerati come anaerobi obbligati, oggi si sa che possono ossidare il glucosio
Treponema
Sono due le specie che causano malattie infettive nell'uomo, Treponema pallidum (con
tre sottospecie) e Treponema carateum. Il treponema pallidum presenta tre sottospecie,
1) pallidum, che causa sifilide a trasmissione sessuale, 2) endemicum, che causa la
sifilide endemica e 3) pertenue che causa lo yaws o framboesia; il Treponema carateum
causa la pinta o mal di Pinto.
I treponemi sono spirochete sottili e spiralizzate (0,2x5-15μm), con tre flagelli
periplasmatici su ogni estremità. Non crescono in vitro e la loro crescita viene
ottenuta su colture di cellule epiteliali di coniglio, ma ogni divisione è di circa 30 ore,
quindi molto lenta; il difetto di crescita in vitro è dovuto alla mancanza di acido
tricarbossilico nei batteri che dipendono dalle cellule ospiti per la sintesi di tutte le
purine, pirimidine e aminoacidi. Sono anaerobie ed estremamente sensibili ai
radicali tossici dell'ossigeno, infatti il DNA manca di geni per catalasi e superossidodismutasi. Sono troppo sottili per essere osservate al microscopio ottico, da campioni
clinici colorati con Gram. Le forme mobili si osservano mediante microscopia in
campo oscuro o dopo la colorazione con anticorpi specifici anti-treponema marcati
con fluorescenti.
Il fatto che cresca lentamente e ce in vitro non sia coltivabile, ha reso difficile
l'individuazione dei meccanismi di patogenicità. Però l'analisi del genoma ed alcune
caratteristiche strutturali hanno rivelato qualcosa. Ad esempio la membrana
Microbiologia Preston
160
citoplasmatica, sul suo versante esterno non possiede lipoproteina, quindi le
spirochete eludono il sistema immunitario in questo modo. Nello strato esterno
troviamo la presenza di glicosaminoglicani, che interferiscono con l'attivazione della
via classica del complemento, e di acido sialico, che interferisce con la via alternativa.
Sono in grado di legare la fibronectina delle cellule ospidi, meccanismo che permette
di eludere la fagocitosi e di aumentare il legame alle cellule endoteliali. Producono
ialuronidasi, che facilita la penetrazione tra le giunzioni intracellulari. La distruzione
dei tessuti e la comparsa delle lesioni sono dovute, in buona sostanza, alla risposta
immunitaria dell'ospite. Le lesioni primarie sono rappresentate dal "sifiloma" o
"cancroide" che si sviluppa in corrispondenza della penetrazione del batterio. Le
spirochete diffondono precocemente per via ematica, ma il cancroide rappresenta la
sede principale di replicazione del batterio. Le lesioni sono caratterizzate da
infiltrazione di leucociti polimorfonucleati e mcarofagi. Le spirochete sono fagocitate
dalle cellule fagocitiche, ma spesso riescono a sopravvivere al loro interno in virtù
della presenza dello strato mucoso che si trova nella porzione esterna del batterio.
La Sifilide è una malattia diffusa in tutto il mondo, ed è la terza più comune causa di
malattia batterica a trasmissione sessuale negli USA. E' una malattia infettiva che
riguarda esclusivamente l'uomo e non sono noti altri ospiti naturali. Il Treponema
pallidum è estremamente labile e non in grado di sopravvivere ad essiccamento o
disinfettanti, quindi questa patologia non può essere trasmessa attraverso il contatto
con oggetti, ma solo attraverso contatto sessuale diretto. La malattia può essere
acquisita anche per via congenita o a trasfusioni con sangue infetto. Non è altamente
contagiosa, infatti il rischio di contrarre la malattia dopo un solo contatto sessuale è
valutato essere attorno al 30%; la contagiosità tuttavia è in funzione dello stadio della
malattia. Il rischio di trasmissione dipende dallo stadio dell'infezione della madre nel
caso della trasmissione transplacentare; se l'infezione è primaria, il feto corre il 100%
del rischio di contrarla, se secondaria il 90%, se latente iniziale 30%, mentre se è nello
stato latente tardivo o terziaria, non ci sono rischi per il feto. La trasmissione
congenita può avvenire poco dopo l'infezione materna, poiché la batteriemia è molto
precoce. Una donna con malattia non trattata può trasmettere l'infezione al feto per
almeno otto anni. Trascorso questo tempo, la malattia può rimanere attiva, ma si
ritiene che la batteriemia non sia più presente.
La Sifilide è una malattia comparsa in Europa nel Medioevo e conosciuta come
"grande ulcerazione", da distinguersi dalla "piccola ulcerazione" che era il vaiolo.
Personaggi famosi come Baudelaire, Oscar Wilde, Casanova, Dostoyevsky, Nietzsche,
Microbiologia Preston
161
Manet, Gaugin, Schopenhauer ed Ivan "il terribile", sono morti per sifilide. Solo nel
XVIII secolo fu riconosciuta come malattia a trasmissione sessuale, e nel 1905 August
Paul von Wassermann mise a punto il test per la diagnosi di sifilide.
E' una malattia cronica a trasmissione sessuale, differenziabile in diversi stadi:
primaria, secondaria, latente e terziaria.
• Sifilide Primaria
La prima manifestazione è un'ulcera (sifiloma) che si
sviluppa nel punto di ingresso delle spirochete.
Sebbene le spirochete diffondano nel sangue subito
dopo l'infezione, l'ulcera rappresenta il sito primario
di moltiplicazione iniziale. La lesione si sviluppa da
10 a 90 giorni dopo l'infezione iniziale e comincia
come una papula che poi si erode per diventare un'ulcera
indolore, con i bordi sollevati. Nella maggior parte dei pazienti
c'è un interessamento linfoghiandolare, che è il focolaio dove i
batteri si replicano. Nell'ulcera si trovano numerose spirochete,
che si diffondono in tutto il corpo attraverso il sistema linfatico
ed ematico. L'ulcera va incontro a cicatrizzazione spontanea in
due mesi, quindi il paziente si genera la falsa illusione di essere
guarito.
• Sifilide Secondaria
Dopo 6-8 settimane dalla comparsa del sifiloma, si ha
comparsa di una sindrome simil-influenzale, con:
malessere, tosse produttiva, mal di testa, febbre,
mialgia, anoressia e linfoadenopatia, seguita dalla
comparsa di lesioni cutanee e mucocutanee tipo
macula, papula, pustola, altamente infettivi (rush) che
possono comparire anche nei palmi delle mani e sulle
piante dei piedi. Sono altamente contagiose e
regrediscono spontaneamente nel giro di qualche
settimana ed il paziente entra quindi nella fase latente o clinicamente silente della
malattia.
Microbiologia Preston
162
• Sifilide Latente
Inizia 2-3 settimane dall'inizio dello stadio secondario e può rimanere latente per
anni. I batteri si sviluppano in siti ectopici ed il sistema immunitario cerca di
distruggerli.
• Sifilide Terziaria
Si sviluppa in circa 1/3 dei pazienti non trattati. Il paziente non è più infettivo, ma
presenta i danni della risposta immunitaria. Può presentarsi in varie forme, come
Sifilide benigna tardiva o "gomma", Sifilide cardiovascolare, Neurosifilide e Sifilide
meningovascolare.
La sifilide benigna tardiva o "gomma", si presenta nel 15% dei pazienti non trattati, in
un periodo compreso tra 1-10 anni. Le lesioni granulomatose, o gomme, possono
trovarsi in pelle, cartilagine o ossa.
La sifilide cardiovascolare si sviluppa nel 10% dei pazienti non trattati, in cui c'è
sostituzione del tessuto elastico dell'aorta con tessuto fibroso, auneurisma dell'aorta e
ostruzione delle coronarie. Compare circa 10 anni dopo la sifilide primaria.
La neurosifilide si manifesta nell'8% dei pazienti non trattati e consiste nel
danneggiamento del parenchima cerebrale e della sua vascolarizzazione,
determinando paresi generalizzata (debolezza muscolare, demenza, paralisi, disturbi
nell'articolazione della parola e delirio di grandezza o "insania sifilitica") e tabe
dorsale (sclerotizzazione delle radici spinali posteriori e dei nervi periferici con
perdita dell'orientamento, perdita della sensibilità motoria, dolori acuti e lancinanti,
atrofia muscolare, atrofia del nervo ottico, cecità, impotenza e disturbi vescicali).
La sifilide meningovascolare è un danno alla vascolarizzazione meningea. Studi
recenti hanno evidenziato che individui affetti contemporaneamente da sifilide e da
HIV sviluppano neurosifilide entro 6 mesi dalla comparsa del sifiloma primario.
Nella sifilide congenita, il Treponema pallidum può essere trasmesso dalla madre al
feto per via transplacentare; le infezioni in utero possono causare una malattia fetale
grave che determina morte del feto, malformazioni gravi e infezioni latenti. Alla
nascita la maggior parte dei neonati non presenta segni clinici di malattia. In seguito
compare rinite con sangue e muco (altamente infettivi), "rush" cutaneo anche sul
palmo della mano e sulla pianta del piede. Se non trattati, il 25% dei neonati muore
durante il primo anno di vita. Tra i sopravvissuti, alcuni sviluppano neurosifilide ed il
Microbiologia Preston
163
40% presenta segni permanenti di sifilide, quali incisivi a forma di cacciavite, denti di
Moon (primi molari con cuspidi suprannumerarie), tibia a sciabola, naso a sella e
ispessimento unilaterale della clavicola.
Diagnosi: E' troppo sottile per essere visto al microscopio, si
deve così ricorrere al microscopio ottico in campo oscuro o
a speciali coloranti fluorescenti. Inoltre non possono essere
coltivati in laboratorio. Sono coltivabili in modelli animali,
ma come detto impiegano parecchio tempo per ogni
divisione. L'esame istologico viene effettuato su campioni
colorati con sali d'argento. Sono disponibili test per
l'amplificazione degli acidi nucleici, come PCR. Per la
maggior parte dei pazienti, la diagnosi di sifilide, si basa sull'esecuzione di test e
ricerche immunologiche. Si possono utilizzare due tipi di test: test non specifici (nontreponemici) e test specifici (treponemici). I test non treponemici sono utilizzati per
determinare i livelli di anticorpi IgM e IgG sviluppati contro i lipidi liberati dalle
cellule danneggiate durante le fasi inziali della malattia e presenti sulla superficie
cellulare dei treponemi. L'antigene utilizzato per i test di questo genere è
rappresentato dalla cardiolipina, derivante da cuore bovino. La cardiolipina , o
aptene di Wassermann, è formata da 3 molecole di glicerolo unite da 2 radicali
fosforici ed esterificate con 4 molecole di acidi grassi insaturi a 18 atomi di carbonio.
E' presente in vari organi animali, tra cui il miocardio ed in particolare nei
mitocondri alterati per vari processi morbosi. Gli anticorpi che si sviluppano a
seguito dell'infezione luteica potrebbero essere una risposta nei confronti della
cardiolipina, che viene liberata dagli organi che nell'ospite sono stati danneggiati
dalla presenza del treponema. I test utilizzati per verificare l'agglutinazione
dell'antigene cardiolipina da parte del siero del paziente sono il testi VDRL (Venereal
Diseases Research Laboratory) ed il test RPR (test plasmatico rapido reaginico). Tutti
i sieri positivi vengono ulteriormente testati nei confronti di antigeni treponemici.I
test treponemici utilizzano il treponema stesso come antigene ed individuano
anticorpi anti-treponema specifici. I test specifici per rilevare gli anticorpi diretti
contro i treponemi sono: FTA-ABS (fluorescent treponemal antibody-adsorption test),
TPHA (Treponema pallidum haemoagglutination) e TPI (Treponema pallidum
immobilization). FTA-ABS è un test di immunofluorescenza indiretta, dove l'antigene
è costituito da una sospensione di treponemi uccisi che si mettono a contatto con il
siero del paziente in esame, e successivamente si aggiunge un secondo anticorpo
Microbiologia Preston
164
anti-immunoglobuline umane coniugato con fluorescina. TPHA, è una reazione di
emoagglutinazione passiva nella quale l'antigene è costituito da globuli rossi alla cui
superficie sono adsorbiti antigeni treponemici. TPI impiega come antigene una
sospensione di treponemi mantenuti vitali in apposito terreno che viene messa a
contatto con il siero del paziente in esame, in presenza di complemento, immobilizza
i treponemi. La valutazione viene fatta al microscopio in campo oscuro, valutando la
percentuale di treponemi immobilizzati rispetto al siero di controllo.
Trattamento: La penicillina è il farmaco di scelta per il trattamento delle infezioni da
T.pallidum. La penicillina G benzatina è utilizzata nella fasi iniziali della sifilide e la
penicillina è raccomandata per la terapia della lide congenita e tardiva. In alternativa
alla penicillina (per i soggetti allergici) vengono usate Tetraciclina e doxiciclina. Non
sono disponibili vaccini, quindi è bene usare modalità sicure per rapporti sessuali.
Gli altri treponemi importanti causano come detto sifilide endemica, yaws e la pinta.
Treponema pallidum endemicum causa la sifilide endemica o bejel. E' diffusa
prevalentemente in Egitto, Medio Oriente e Australie. Si trasmette attraverso
abrasioni soprattutto da cucina o l'utilizzo promiscuo di oggetti contaminati. E'
principalmente una malattia pediatrica. Si osservano raramente lesioni primarie nel
cavo orale, ma invece troviamo lesioni secondarie come papule nel cavo orale ed
erosioni delle mucose.
Treponema pallidum pertenue è agente eziologico della
frambesia, detta anche vaiolo dei tropici. E' diffuso
prevalentemente in Africa, India, America Meridionale,
Indonesia ed Isole del Pacifico. E' simile alla sifilide e si
trasmette per contatto non sessuale o attraverso il morso
di insetti. Dopo 3-4 settimane, nel sito di penetrazione,
compare una papula circondata da eritema. La papula si
ulcera, formando una crosta e poi cicatrizza in circa 3-6
mesi. Successivamente il paziente sviluppa lesioni
secondarie papillomatose deturpanti (simili a possi) diffuse in tutto il corpo (anche
palmo della mano e pianta del piede), che vanno incontro a rottura ed ulcerazione.
Treponema carateum è responsabile della pinta. Diffusa in America centrale e
Meridionale, si diffonde per contatto diretto con lesioni infette e si manifesta sotto
forma di papula che lascia la pelle depigmentata. E' una malattia a decorso molto
lungo e per il trattamento serve la penicillina.
Microbiologia Preston
165
Borrelia
Sono spirochete gram-negative debolmente colorabili, che tendono ad essere più
grandi delle altre spirochete, si colorano bene con Giemsa e sono facilmente visibili
al microscopio ottico in strisci si sangue periferico in pazienti con febbre ricorrente,
ma non in quelli con la Lyme. Sono mobili, possedendo da 7 a 20 flagelli contenuti
nello spazio periplasmatico tra la parete e la membrana esterna. Il corpo è avvolto in
una spirale molto lassa. Hanno esigenze nutrizionali complesse e hanno tempi lunghi
di moltiplicazione (18h), quindi la coltivazione è spesso infruttuosa. Sono parassiti di
artropodi e possono causare patologia nell'uomo. Possono causare febbre ricorrente
o la malattia di Lyme. Non producono tossine e vengono eliminati a seguito di una
specifica risposta anticorpale. Sviluppano infatti un'attiva risposta IgM, che elimina
rapidamente la borrelia dal circolo dopo essersi diffusi attraverso il circolo ematico.
Le borrelie sono presenti negli organi interni e vanno incontro a riarrangiamento
genico che determina nuova antigenicità. Questi microrganismi trasportano un gran
numero di geni, ma ogni volta viene espresso un solo gene. Quando si formano
anticorpi specifici, si verifica l'agglutinazione con lisi complemento-mediata, e le
borrelie sono rapidamente eliminate dal sangue. Tuttavia, una nuova popolazione di
spiroche, fornite di un nuovo rivestimento lipoproteico, apparirà nel sangue,
annunciando un nuovo episodio febbrile. La risposta immune nei confronti di questi
microrganismi diminuisce nel momento in cui si manifestano le lesioni cutanee, ma
gli anticorpi continuano ad essere prodotti per mesi.
• Malattia di Lyme
E' la principale malattia trasmessa da vettori negli USA.
Le zecche a guscio duro sono i principali vettori di
questa patologia. I principali serbatoi animali sono il
topo dai piedi bianchi e il cervo dalla coda bianca. Il
topo è serbatoio delle larve e delle ninfe, mentre il cervo
delle zecche adulte. L larve infettano quando si nutrono
del topo, che è il serbatoio animale. Le larve si
trasformano in ninfe in tarda primavera ed assumono un
secondo pasto ematico, che può anche essere l'uomo
accidentalmente. Le sono trasmesse dalla saliva per il tempo in cui si nutre, ed i
pazienti non ricordano di aver subito punture, in quanto sono molto piccole queste
ninfe; a fine estate si trasformano in adulte e assumono un terzo pasto (cervi).
Microbiologia Preston
166
La clinica è complicata dalle diverse
manifestazioni della malattia, come pure dalla
mancanza di esami diagnostici affidabili. Sono
differenti la frequenza delle lesioni cutanee e
le manifestazioni tardive della malattia. Inizia
come una prima infezione localizzata, poi passa
a una prima fase di diffusione e, se non trattata,
può progredire a uno stadio di manifestazioni
tardive. Dopo un periodo di incubazione di
3-30 giorni, sul sito della puntura della zecca si
sviluppano tipicamente una o più lesioni
cutanee. La lesione, o eritema migrante, inizia come una piccola macula o papula e
poi si allarga nel corso delle settimane successive, coprendo alla fine una superficie
che va da 5 cm a più di 50 cmdi diametro. La lesione ha tipicamente un bordo piatto
e rosso, e man mano che si estende, si presenta più chiara al centro; tuttavia si
possono anche notare eritema, formazioni di vescicole e necrosi centrale. La lesione
si riduce o scompare nel giro di qualche settimana.
Nell'arco di pochi giorni o settimane dall'infezione
primaria, se i pazienti non vengono trattati, si ha la
diffusione ematogena, caratterizzata da sintomi
sistemici della malattia, come cefalea, affaticamento,
artrite e artralgie, mialgie, lesioni eritematose cutanee,
alterazioni cardiologiche e neurologiche. Nel 60% dei
pazienti con malattia di Lyme si sviluppa un'artrite
che coinvolge tipicamente il ginocchio.
• Febbre ricorrente
Può essere di due forme: la febbre ricorrente epidemica (pidocchio) e la febbre
ricorrente endemica (zecca a guscio molle). L'agente eziologico della febbre
ricorrente epidemica è il pidocchio, di cui l'uomo è l'unico serbatoio. I pidocchi si
infettano dopo essersi nutriti da un individuo infetto, quindi i microrganismi sono
ingeriti, passano attraverso la parete intestinale e si moltiplicano nell'emolinfa. Si ha
infezione nell'uomo quando i pidocchi sono schiacciati mentre si nutrono. I pidocchi
infetti non sopravvivono per più di pochi mesi, quindi le condizioni che rendono
endemica la malattia sono promiscuità e mancanza di requisiti igienici minimi
(guerre, catastrofi, senzatetto), che rendono possibile questo contatto. Dopo un
Microbiologia Preston
167
periodo di incubazione di una settimana, la malattia è preannunciata dall'esordio
improvviso di brividi squassanti, febbre dolori muscolari e cefalea. Si risolvono in 3-7
giorni, quando le borrelie sono eliminate dal sangue.
La febbre ricorrente endemica è causata da zecche, che presentano un'infezione
disseminata (a differenza delle pulci). Sono principalmente mangiatori notturni e
rimangono attaccati per pochi minuti, quindi i pazienti non riferiscono di questa
puntura. Le zecche contaminano il sito della puntura con le borrelie presenti nella
saliva e nelle feci. Si manifesta in tutto il mondo. Il decorso è più grave nella malattia
endemica rispetto all'epidemica, con esiti della febbre più gravi, concomitante allo
stato di salute del paziente.
Le borrelie possono essere osservate su preparati di sangue con Giemsa per febbre
ricorrente, mentre non è consigliato l'esame microscopico di sangue con pazienti
affetti da Lyme. Possono essere coltivati in vitro su terreni specifici, ma questi non
sono prontamente disponibili, quindi raramente sono effettuati. Le tecniche di
amplificazione dell'acido nucleico sono limitanti. I test sierologici non sono utili per
la diagnosi. La ricerca degli anticorpi rappresenta il test diagnostico di scelta per il
paziente con Lyme. Utilizzare immunofluorescenza e test immunoenzimatici sono
usati comunemente. Come tutti i test sierologici, sono relativamente non sensibili
durante la prima fase acuta della malattia. Le IgM compaiono da due a quattro
settimane dopo l'insorgenza dell'eritema migrante in pazienti non trattati. I livelli
raggiungono i valori massimi dopo sei/otto settimane di malattia e quindi si
abbassano ad un valore normale da quattro a sei mesi dopo.
La febbre ricorrente è trattata in modo molto efficace con tetracicline o penicilline.
Le prime manifestazioni della Lyme sono controllate efficacemente da amoxicillina,
doxiciclina o cefuroxime per via orale, riducendo il rischio e la gravità delle
complicanze tardive. Per prevenire le infezioni da borrelia bisogna quindi evitare
zecche e loro habitat naturali. Non sono disponibili vaccini.
Leptospira
Sono spirochete sottili e incurvate a uncino su una o entrambe le estremità
affusolate; il corpo è avvolto a spirale molto stretta e a sua volta ripiegato. La motilità
si realizza attraverso due flagelli periplasmatici che si estendono per la lunghezza dei
batteri e sono ancorati alle estremità opposte. Sono aerobi obbligati e possono essere
coltivati in vitro in terreno arricchito di siero di coniglio o BSA.
Microbiologia Preston
168
Le leptospire possono causare una modesta malattia febbrile simil-influenzale o una
malattia sistemica (sindrome di Weil), con
insufficienza epatica e renale, vasculite
generalizzata, miocardite e morte. Causa queste
patologie a seconda della carica infettante, delle
difese immunologiche dell'ospite e della
virulenza del ceppo infettante. Possono
attraversare le mucose sane o la pelle a seguito di
abrasioni o piccoli tagli. Diffondono per via
ematica fino anche al SNC. Si moltiplica
velocemente e danneggia l'endotelio dei capillari,
determinando le principali manifestazioni cliniche della malattia. Hanno una
distribuzione ubiquitaria. Le leptospire infettano due tipi di ospiti: gli ospiti serbatoio
e gli ospiti occasionali. Le infezioni croniche ed endemiche si verificano nell'ospite
serbatoio, che funge da serbatoio permanente per il mantenimento dei batteri. I più
comuni serbatoio sono i ratti, causando infezioni asintomatiche e colonizzando i
tubuli renali, poi riversate nelle urine. Torrenti, fiumi, acqua stagnante e terreno
umido possono essere contaminati con urina di animali infetti, e in questi habitat,
possono sopravvivere fino a sei settimane. L'acqua contaminata o i contatto diretto
con animali infetti possono servire come fonte d'infezione per gli ospiti occasionali,
come uomo, cani e gatti. Le infezioni umane derivano da riproduzione in acqua
contaminata, o contatto professionale con animali infetti. Non esiste trasmissione da
uomo a uomo.
La maggior parte delle infezioni è asintomatica e vengono individuate solamente con
anticorpi specifici. Dopo essere entrate nell'organismo, le leptospire hanno un periodo
di incubazione di circa 1-2 settimane. La fase iniziale è una sindrome similinfluenzale, dove le leptospire determinano batteriemia ed è possibile isolarle nel
liquor. Dopo una settimana, o si ha remissione, oppure l'infezione può progredire alla
seconda fase, con brividi, dolori addominali, mialgia, cefalea e interessamento delle
congiuntive. La malattia può progredire fino a collasso vascolare, trombocitopenia,
emorragia e disfunzione epatica e renale. La leptospirosi del SNC può essere
scambiata per meningite asettica. La diagnosi è effettuata su preparazione di
anticorpi fluorescenti, e possono essere coltivate in terreni speciali, con crescita lenta,
in incubazione a 28-30°C. Sono riscontrabili nel liquor o sangue. Non è fatale, ma i
pazienti sono trattati con penicillina o doxiciclina per via endovenosa.
Microbiologia Preston
169
Mycoplasmi
Fanno parte della classe dei Mollicutes (5 famiglie con 200 specie). La famiglia
Mycoplasmataceae colonizza l'uomo e sono riconosciute cinque specie patogene.
Mycoplasma pneumoniae è sicuramente il più importante, ma troviamo anche
M.genitalium, M.hominis e Ureaplasma ureatlyticum.
I Mycoplasmi sono i più piccoli organismi capaci di vita autonoma. Sono unici perché
non hanno una parete batterica e perché la loro membrana non contiene steroli.
L'assenza della parete rende questi batteri resistenti alla penicillina e a tutti quegli
antibiotici che hanno come bersaglio la parete cellulare. Presentano pleomorfismo ed
hanno dimensioni che possono variare da 0,2 a 0,3μm della forma coccoide, ma
anche 0,1-0,2μm di larghezza e 1-2μm di lunghezza nella forma bastoncellare. Molti
attraversano pori di 0,45μm, quindi un tempo si immaginava fossero dei virus. Sono
batteri a tutti gli effetti, perché si dividono per scissione binaria (tipica di tutti i
batteri); raramente si dividono per gemmazione, nel qual caso la "gemma" può non
ricevere un genoma completo e la replicazione del genoma e la divisione del
citoplasma possono non essere sincronizzate; crescono su terreni artificiali abiotici e
contengono sia DNA, che RNA. Sono gram-negativi ed anaerobi facoltativi, ma
pneumoniae è aerobio obbligato. Hanno capacità di crescere molo lentamente
esclusivamente su terreni arricchiti di vitamine, di precursori degli acidi nucleici,
lipidi (steroli) che vengono forniti genrealmente dall'aggiunta di siero animale; in
coltura formano colonie particolarmente piccole. Le colonie sono a forma di "uovo
fritto", formate da una zona centrale opaca e granulare, corrispondente alla zona di
crescita del microrganismo, e da una zona periferica, di aspetto piatto e trasparente,
in cui avviene la moltiplicazione in superficie del microrganismi.
Sono dei patogeni extracellulari, che aderiscono all'epitelio respiratorio mediante un
complesso di proteine di adesione, di cui l'adesina P1 è la più importante; questa ha
peso molecolare di 169 kDa, ed è presente sulla membrana dei mycoplasmi dove
funge da adesina. Le adesine interagiscono specificamente con i recettori
sialoglicoproteici alla base delle ciglia sulla membrana esterna delle cellule epiteliali
(e su eritrociti9. Si verifica ciliostasi, che causa distruzione di ciglia e poi della cellula
stessa. La perdita impedisce la normale clearance delle vie aeree superiori e consente
l0irritazione meccanica del tratto respiratorio. Inoltre, scatena anche il processo
flogistico con infiltrazione di cellule mononucleate e rilascio di citochine (tipico
dell'infiammazione), come TNF, IL-1 e IL-6. Il danno sembra essere indotto
Microbiologia Preston
170
dall'acqua ossigenata prodotta dal microrganismo. In vitro è capace di agglutinare i
globuli rossi di cavia; produce una tossina citolitica (emolisina), capace di causare un
alone di β-emolisi visibile in piastre di terreno agrarizzato ricoperte di emazie di
cavia. E' capace di indurre fenomeni di autoimmunità (glicolipidi di membrana,
contenenti glucosio e galattosio, con caratteristiche antigeniche comuni a cellule
somatiche).
M.pneumoniae è un patogeno umano obbligato; le infezioni delle vie aeree
(tracheobronchite, polmonite) si presentano in tutto il mondo in ogni periodo
dell'anno, senza incrementi stagionali significativi. E' più comune nei bambini in età
scolare e nei giovani adulti, probabilmente perché gli adulti hanno acquisito una
parziale immunità. Colonizza il naso, la gola, la trachea e le vie respiratorie inferiori
degli individui infetti ed è diffusa da goccioline di Flugge di grandi dimensioni
durante gli episodi di tosse. Il periodo di incubazione e il tempo in cui si manifesta
l'infezione sono abbastanza prolungati, quindi il processo infettivo può persistere per
mesi. In vivo si moltiplicano sulla superficie delle cellule degli epiteli mucosi, senza
penetrare all'interno delle cellule. Si riscontra la loro presenza in uomini, mammiferi,
rettili, uccelli, insetti, piante, acqua e suolo e possono comportarsi in questi ospiti
come commensali, parassiti o patogeni.
Nell'uomo sono state riscontrate 6 specie di Mycoplasma, pneumoniae, salivarum,
hominis, genitalium, orale e incognitus. Mycoplasma pneumoniae è l'agente eziolocigo
della polmonite atipica primaria. Mycoplasma salivarum è l'agente eziologico di
infezioni periodontali ed è presente nelle tasche gengivali. Mycoplasma hominis è
comune commensale dell'aparto genito-urinario; è associato ad alcune patologie
dell'apparato genitale dell'adulto e del tratto respiratorio del neonato, e può essere
trasmesso dalla madre al feto durante la gravidanza o al momento della nascita.
Mycoplasma genitalium è un normale commensale dell'apparato genito-urinario.
Mycoplasma orale non è un patogeno ed è presente nella normale flora microbica
delle prime vie aeree. Mycoplasma incognitus viene isolato da reperti autoptici di
pazienti affetti da AIDS a rapida progressione.
Mycoplasma pneumoniae tipicamente dà luogo ad una colonizzazione asintomatica. La
più comune manifestazione clinica dell'infezione è la tracheobronchite, con febbre
moderata, malessere, cefalea e tosse secca non produttiva, che insorgono
generalmente dopo 2-3 settimane dal contatto col microrganismo; può presentarsi
faringite acuta e i sintomi peggiorano e possono persistere per 2 settimane o più. I
Microbiologia Preston
171
bronchi vengono infiltrati da linfociti e plasmacellule. Può svilupparsi polmonite
atipica primaria. Questa è una delle più comuni cause di malattia a carico del tratto
respiratorio, con presenza di vistosi infiltrati e addensamenti polmonari evidenti dagli
esami radiografici del torace; questa è trasmessa mediante la formazione di aerosol, è
frequentemente asintomatica, raramente causa broncopolmonite e colpisce
soprattutto neonati e bambini. I sintomi iniziali sono febbre superiore a 39°, senso di
freddo, malessere generale, congestione nasale, tosse non produttiva. Sintomi
polmonari sono l'escreato mucoide o mucopurolento, frequente otalgia, RX toracica
tipica; questa malattia è generalmente autolimitante, con risoluzione della
sintomatologia dopo 3-10 giorni. La risoluzione del quadro radiologico è più lenta
rispetto alla risoluzione clinica della malattia. Possono riscontrarsi rare complicazioni,
quali, anemia emolitica, diarrea, epatite, mialgia, artralgia, artrite, miocardite,
pericardite, eritemi, meningo-encefalite, neuropatie e deficit motori. Le complicanze
neurologiche possono essere determinate dall'invasione del SNC da parte del
microrganismo, ma anche dalla presenza di anticorpi circolanti verso il tessuto
cerebrale (analogia tra glicolipidi di membrana del mycoplasma e delle cellule
nervose). Alcuni stati di immunodeficienza (ipogammaglobulinemia) predispongono
ad un decorso più serio le infezioni da mycoplasmi. Rare sono le infezioni fulminanti.
La risposta immunitaria nei confronti dei mycoplasmi sono una produzione di IgM e
successiva produzione di IgG, titolabili mediante fissazione del complemento, tuttavia
è scarsa l'attività protettiva da parte di tali anticorpi. Si osserva la presenza di IgA
nelle secrezioni respiratorie (con attività protettiva).
L'identificazione di M.pneumoniae avviene da liquido di lavaggio bronchiale in
terreno arricchito con siero per fornire steroli, estratto di lievito per i precursori degli
acidi nucleici, glucosio e penicillina per inibire gli altri batteri. Crescono lentamente
in coltura. Per l'identificazione biochimica, utilizzo di glucosio, arginina ed urea. Si
ricercano antigeni specifici attraverso ELISA e si effettua PCR per l'identificazione
della sequenza del genoma batterico.
Tutti i mycoplasmi sono insensibili a trattamenti antimicrobici attivi sulla parete ed il
farmaco di elezione nella polmonite da M.pneumoniae è l'eritromicina oppure le
tetracicline, dove la comparsa dei sintomi non si accompagna all'eradicazione del
microrganismo.
Microbiologia Preston
172
Mycoplasma hominis viene isolato da apparati genitali maschili e più frequentemente
in femminili asintomatici. La percentuale di colonizzazione varia in rapporto all'età,
razza, abitudini sessuali e livello socio-economico. Le percentuali di colonizzazione
sia del sesso maschile che di quello femminile sono correlate all'attività sessuale
(partners diversi). Le infezioni da mycoplasmi sono trasmissibili sessualmente. Questo
batterio è responsabile di endometriti, infezioni corion-amniotiche, rottura precoce
delle membrane, scarso sviluppo del neonato ed infertilità. La patogenicità dei
mycoplasmi è controversa; infatti sono quasi sempre isolati insieme ad altri patogeni
dell'apparato genitale, come Chlamydia trachomatis, Neisseria gonorrhoeae e
Streptococchi di gruppo B. Può essere isolato dal sangue di donne che hanno
partorito, sia con parto fisiologico che cesareo, in seguito alla risalita del
microrganismo dal sito di colonizzazione, la vagina, alle membrane placentari e al
liquido amniotico. Le infezioni amniotiche silenti possono essere evidenziate sia dalla
risposta anticorpale, che dall'isolamento del batterio dal circolo. L'isolamento di
questo mycoplasma e il titolo anticorpale elevato risulta associato a riduzione del peso
del neonato alla nascita.
Ureaplasma è un genere che comprende 5 specie, di cui solo U.urealyticum può essere
ritrovato nell'apparato respiratorio. Questa specie è associato ad aborto spontaneo,
parto prematuro e mortalità neonatale. E' forse causa di uretriti gonococciche e non
clamidiali. E' raro l'isolamento di mycoplasmi tra bambini nati da madri che
presentavano colonizzazione genitale. Può essere isolato dal SNC, dove causa
meningiti silenti o sintomatiche nel neonato. Produce fosfolipasi, enzima capace di
idrolizzare fosfolipidi con rilascio di acido arachidonico. E' ipotizzabile che
l'infezione dell'apparato genitale femminile possa indurre il rilascio di acido
arachidonico dalle membrane amniotiche, con conseguente produzione di
prostaglandine, che potrebbero indurre un travaglio prematuro.
Microbiologia Preston
173
Rickettsia
E' un gruppo di batteri suddiviso in due generi, Rickettsia e Orientia. Sono di
dimensioni inferiori ai comuni batteri, pleomorfi, gram-negativi, immobili, acapsulati
e si colorano bene con Giemsa. Crescono solamente nel citoplasma della cellula
eucariote, e sono mantenute in serbatoi animali e artropodi e sono trasmesse da
artropodi, come zecche, acari, pidocchi e pulci. Gli uomini sono ospiti accidentali. I
batteri di questo genere sono suddivisi in due gruppi principali: gruppo della febbre
maculosa e gruppo del tifo. Del primo gruppo fanno parte Rickettsia ricketsii, che
causa febbre maculosa delle Montagne Rocciose, e Rickettsia akari, che causa
rickettsiosi vesciolare, e sono curate con Doxiciclina. Del secondo gruppo fanno
parte Rickettsia prowazekii e Rickettsia typhi curate con Tetracicline. Solamente una
specie appartiene al genere Orientia, Orientia tsutsugamushi. I batteri di questa
famiglia sono mantenuti in roditori ed artropodi, che fungono sia da vettori, che da
ospiti. L'azione patogena di questa famiglia si esplica principalmente mediante il
danno vascolare prodotto, in quanto tali batteri si moltiplicano all'interno delle
cellule endoteliali di arteriole e capillari, danneggiandole e determinando
l'insorgenza di processi vasculitici con conseguente trombosi, rottura vascolare e
necrosi tissutale. le lesioni vascolari sono particolarmente evidenti a livello cutaneo,
ma non risparmiano numerosi altri organi. A livello cerebrale e cardiaco, è possibile
osservare la comparsa, in corrispondenza dei piccoli vasi, di noduli caratteristici
costituiti da aggregati di linfociti, polimorfonucleati e macrofagi. Hanno una struttura
esterna tipica dei bacilli gram-negativi, con peptidoglicano sottile e membrana
esterna con LPS, che però non ha grande attività. Non hanno flagelli. Sono patogeni
intracellulari obbligati.
Rickettsia rickettsii
E' la più comune causa del genere Rickettsia. E' l'agente eziologico della febbre
macuolsa delle Montagne Rocciose. La patogenicità sta nella capacità di questo
batterio di aderire alle cellule endoteliali grazie alla proteina A della membrana
esterna. Questi penetrano nelle cellule endoteliali, si moltiplicano liberamente nel
citoplasma e nel nucleo delle cellule infettate, e si spostano da una cellula a quella
adiacente. Il danno cellulare è conseguente a questo meccanismo, così come anche
l'aumento di permeabilità vascolare. L'ipovolemia e l'ipoproteinemia, causate
dall'efflusso di plasma nei tessuti, possono condurre a ridotta perfusione dei vari
Microbiologia Preston
174
organi e quindi ad insufficienza d'organo. L'infezione è causata dalle zecche dure
(cane) e zecche del legno. Una persona deve contrarre la zecca per un lungo periodo
(6 ore o più). I primi sintomi della patologia si sviluppano dopo 7 giorni dalla puntura
della zecca ed il paziente può non sapere della puntura, perché indolore. L'esordio
della malattia è annunciato da febbre alta, cefalea, associate a malessere, mialgia,
nausea, vomito, dolore addominale e diarrea. Si sviluppa un'esantema maculare nel
90% dei pazienti, prima periferico, che poi si dirige sul tronco. Le complicazioni sono
insufficienza polmonare e renale, più alterazioni cardiache. La mortalità se non viene
curata la malattia è del 20%. Le rickettsie si colorano scarsamente con Gram, e bene
con Giemsa o Gimenez. L'immunofluorescenza indiretta è il metodo migliore, che
permette di rilevare gli anticorpi diretti contro le proteine della membrana esterna di
questi batteri. Si usa anche PCR. Il trattamento è Doxiciclina.
Rickettsia akari
E' l'agente responsabile della rickettsiosi vescicolare, trasmessa da acari infetti.
Queste infezioni sono mantenute dai roditori attraverso la puntura da parte dei loro
parassiti e negli acari a trasmissione transovarica. L'uomo è ospite accidentale con
acari infetti. La malattia è bifasica. Prima vediamo una papula nel punto del morso,
seguita velocemente da un ulcera, per formare infine l'escara. In questo periodo il
batterio si diffonde a livello sistemico e dopo un periodo di incubazione di 7-24
giorni si passa alla seconda fase della malattia, con febbre alta, cefalea, brividi,
sudorazione, mialgia e fotofobia. In 2-3 giorni si sviluppa esantema papulovescicolare
generalizzato, che va incontro, con progressione simile a quella del vaiolo, vescicole e
poi croste. La presenza dell'esantema distingue questa patologia dal carbonchio. La
rickettsiosi vescicolare è di solito lieve, e la guarigione compare dopo 2-3 settimane. Il
trattamento antibiotico è Doxiciclina.
Rickettsia prowazekii
Appartiene al gruppo del tifo ed è l'agente eziologico del tifo esantematico o tifo
epidemico. L'uomo è il serbatoio principale di questa malattia ed il vettore è il
pidocchio del corpo umano. Il tifo epidemico si verifica tra le persone che vivono in
situazioni di promiscuità e scarse condizioni igienico-sanitarie. Tutto ciò favorisce la
diffusione dei pidocchi, che dopo 2-3 settimane dalla loro infezione muoiono. E'
presente in America Centrale, Africa e America Meridionale. Le sindromi si
sviluppano in media 8 giorni dopo il contatto, con sintomi aspecifici, ma in seguito
Microbiologia Preston
175
(1-3 giorni), si presenta febbre alta, cefalea e mialgie. Gli altri sintomi possono essere
polmonite, artralgia e coinvolgimento neurologico. Si può sviluppare esantema
petecchiale, con tasso di mortalità fino al 30% (senza antibiotici). La temperatura
corporea torna normale in 2 settimane. Il metodo diagnostico migliore è sicuramente
l'immunofluorescenza indiretta e le Tetracicline sono molto efficaci. E' disponibile
un vaccino per il tifo esantematico, o vaccino di Cox, preparato con batteri uccisi da
formaldeide, e il suo impiego viene raccomandato nelle popolazioni ad alto rischio.
Rickettsia typhi
E' l'agente eziologico del tifo endemico o murino. La malattia è ubiquitaria,
soprattutto nelle zone calde ed umide. I roditori rappresentano il serbatoio principale
e la pulce del ratto è il vettore principale. Anche la pulce del gatto è un importante
vettore. Il periodo di incubazione è di 7-14 giorni, con sintomi che compaiono
improvvisamente, come febbre, cefalea, brividi, mialgie e nausea. Si può sviluppare
esantema su torace e addome. Il decorso dura meno di 3 settimane anche nei pazienti
non trattati con antibioticoterapia. L'esame effettuato è l'immunofluorescenza
indiretta, specifico per questo batterio. Le tetracicline sono efficaci nel trattamento.
Orientia tsutsugamushi
E' l'agente eziologico del tifo fluviale giapponese, malattia trasmessa dagli uomini
agli acari. Il serbatoio è la popolazione di acari, nella quale i batteri sono trasmessi
per via transovarica. La malattia è presente anche nei roditori. La patologia si
sviluppa improvvisamente dopo un periodo di incubazione di 6-8 giorni, con cefalea,
febbre e mialgie. Nei pazienti non trattati, la patologia scompare dopo 2-3 settimane,
mentre nei pazienti trattati con antibiotici, scompare velocemente. Non è disponibile
un vaccino. La terapia antibiotica è la Doxiciclina.
Microbiologia Preston
176
Ehrlichia, Anaplasma e Coxiella
I batteri della famiglia Anaplasmataceae sono raggruppati in due generi, Ehrlichia e
Anaplasma. Sono intracellulari obbligati che sopravvivono nei vacuoli citoplasmatici
delle cellule emopoietiche di mammifero.
Ehrlichia e Anaplasma
Infettano granulociti, monociti, eritrociti e piastrine. Restano nel vacuolo fagocitario
dopo l'ingresso nella cellula ospite. La fusione coi lisosomi viene impedita poiché
viene interrotta l'espressione degli appositi recettori sulla superficie del vacuolo
fagocitario. I batteri si replicano per scissione binaria nel fagosoma, senza che
vengano esposti agli enzimi lisosomali. Alcuni giorni dopo che la cellula infettata, i
batteri in replicazione si assemblano in masserelle chiamate morule. L'infezione
porta a lisi cellulare e al rilascio dei batteri e alla successiva infezione di nuove
cellule. L'osservazione si può effettuare con colorazione di Giemsa. Questi batteri
non possiedono i geni per la sintesi del peptidoglicano e dell'LPS. Sono
intracellulari e questo fatto li protegge dalla risposta anticorpale. La trasmissione
dell'infezione avviene attraverso le zecche. Le zecche infettano ad uno stadio
immaturo (larve o ninfe) ingeriscono sangue da un animale colonizzato da questi
batteri che, successivamente, li trasmettono ad un altro mammifero, che può essere
occasionalmente l'uomo. L'ehrlichiosi umana monocitotropica è causata da
E.chaffeensis in seguito ad infezione dei monociti del sangue e dei fagociti dei vari
tessuti e organi. Dopo 1-3 settimane dalla puntura di zecca, si manifesta malattia
simil-influenzale con febbre alta, cefalea, malessere e mialgia. Nel 40% si manifesta
esantema e si presentano leucocitopenia, trombocitopenia e valori alti delle
transaminasi sieriche. La mortalità è bassa, anche se si rende necessario il ricovero.
L'ehrlichiosi granulocitaria del cane è causata da E.ewingii e raramente causa
patologia nell'uomo, con febbre, mialgia e cefalee, ma anche leucocitopenia,
trombocitopenia e valori elevati delle transaminasi sieriche. L'anaplasmosi umana è
causata da Anaplasma phagocytophilum. Colpiti principalmente i granulociti, con
malattia che si presenta da 5 a 11 giorni dopo l'esposizione come una malattia similinfluenzale, più esantema (10%), leucocitopenia, trombocitopenia e elevati livelli di
transaminasi sieriche; necessario ricovero ospedaliero. La diagnostica viene effettuata
con colorazione di Giemsa, PCR e ricerca di anticorpi. Il trattamento è con
Doxiciclina, ma Rifampicina per trattare gli intolleranti alla Doxiciclina.
Microbiologia Preston
177
Coxiella Brunetii
Si differenzia dalle Rickettsie per la capacità di moltiplicarsi nei fagolisosomi
intracitoplasmatici, in cui pH acido sembra favorire le attività metaboliche del
batterio. Sono cocco-bacilli o bacilli, sprovvisti di capsula e flagelli; a differenza delle
altre Rickettsie, la trasmissione del patogeno non richiede l'intervento di un
artropode vettore. L'uomo contrae l'infezione da animali domestici e da fattoria
(capre, pecore e mucche) per via aerea o attraverso l'ingestione di alimenti
provenienti da animali infetti (latte e carne). La capacità di andare incontro a
variazioni nell'espressione dell'antigene LPS è una caratteristica importante. La
forma altamente infettante dei batteri presenta il LPS son un carboidrato complesso
o antigene di fase I, che blocca l'interazione degli anticorpi con le proteine di
superficie. Dopo il gene subisce una mutazione per delezione, producendo l'antigene
di fase II. E'importante perché serve a diagnosticare la fase dell'infezione. Questo
batterio è stabile in condizioni ambientali sfavorevoli e può sopravvivere nel suolo
per anni. La maggior parte delle infezioni umane sono asintomatiche, oppure le
infezioni sono lievi, con sintomi simil-influenzali aspecifici. La manifestazione acuta è
grave, con polmonite, epatite, che richiedono ricovero ospedaliero. Si possono
riscontrare granulomi diffusi e la malattia si può sviluppare a mesi o anni di distanza
dal contatto iniziale. L'endocardite subacuta è la manifestazione più comune, ma
difficile da diagnosticare. La febbre Q cronica è una malattia infettiva grave con tasso
di mortalità che si aggira attorno al 65% nei pazienti non trattati. E' caratterizzata da
esordio improvviso, febbre elevata, brividi, cefalea frontale, mialgie e malessere
generale. Dopo una breve fase batteriemica, il batterio può localizzarsi a livello di
apparato respiratorio (polmonite interstiziale con dolore toracico, tosse secca e
rantoli), reni (nefrite), apparato urogenitale (orchiepididimiti, uretriti), sistema
nervoso (neuriti, meningiti), placenta (aborti, malformazioni fetali) e apparato
cardiovascolare (endocarditi). Può essere diagnosticata mediante coltivazione, ricerca
di anticorpi e PCR. La ricerca degli anticorpi nel siero è la tecnica più comunemente
usata. La terapia d'elezione per la febbre Q si basa sull'impiego di macrolidi,
cloramfenicolo e tetracicline.
Microbiologia Preston
178
Chlamydia e Chlamydophila
La famiglia Chlamydiaceae è rappresentata da Chlamydia e
Chlamydiophila. Tre specie di queste due sono patogene
per l'uomo: Chmalydia trachomatis, Chlamydophila
pneumoniae e Chlamydophila psittaci. Questi sono dei
parassiti intracellulari obbligati, che, data la loro
dimensione ridotta, venivano considerati virus. Però
hanno le caratteristiche dei batteri, quali la struttura di
gram-negativi, con membrana interna ed esterna, DNA e
RNA, possiedono ribosomi e sintetizzano proteine, acidi
nucleici e lipidi. Sono di forma rotondeggiante con
proiezioni a carico di un solo emisfero, di cui non se ne conosce il motivo. I batteri
sono resistenti in condizioni ambientali sfavorevoli, e sebbene non possiedano lo
strato di peptidoglicano, la zona centrale nucleare è circondata da una membrana
citoplasmatica e da una membrana esterna a doppio strato. La parete cellulare
contiene LPS con scarsa attività endotossica; importanti invece sono MOMP e OMP2.
MOMP è la proteina maggiore della membrana esterna, una componente strutturale
importante e caratteristica di ciascuna specie, con probabile funzione di "porina".
OMP2 invece è condivisa da tutti i generi ed è ricca di cisteina; questa proteina è
responsabile dei legami crociati disolfurici che stabilizzano i corpi elementari. Non
producono ATP, ma utilizzano quello della cellula parassitata. Il genoma è di
660x10^6 Da.
Hanno un ciclo di sviluppo particolare, che si verifica all'interno delle cellule ospiti
parassitate, e che dà luogo a forme infettive, metabolicamente inerti, i corpi
elementari o CE per la sopravvivenza extracellulare, e a forme non infettive, ma
metabolicamente attive, i corpi reticolari o CR per la moltiplicazione intracellulare.
Inizia tutto con i corpi elementari. Sono piccoli, rotondeggianti e densi; si legano ai
recettori presenti sulla superficie delle cellule dell'epitelio mucoso (microvilli),
mediante legame delle MOMP, poi penetrano con un processo detto "endocitosi
selettiva per il parassita". Una volta penetrati, rimangono nel fagosoma; a questo
punto, se la membrana esterna del CE è integra, inibiscono la fusione del fagosoma
con i lisosomi cellulari, impedendo il killing intracellulare; se la membrana invece è
danneggiata, o i batteri sono inattivati dal calore o neutralizzati dagli anticorpi, si
forma il fagolisosoma ed il killing non può essere inattivato.
Microbiologia Preston
179
In circa 6 ore dall'ingresso, i CE si idratano, si accrescono e si trasformano in corpi
più grandi, e metabolicamente attivi, o corpi reticolari CR. I CR sintetizzano DNA,
RNA e proteine, ma utilizzano l'ATP dalla cellula, per questo motivo sono considerati
"parassiti energetici". Si dividono per scissione binaria per le successive 18-24 ore. Il
fagosoma in cui si accumulano viene detto "inclusione" ed è visibile al microscopio
ottico. Dopo circa 24 ore, i corpi reticolari vanno incontro a condensazione
riformando CE più piccoli, che vengono liberati quando la cellula si rompe. I corpi
reticolari sono sprovvisti di potere infettante, mentre i CE sono capaci di infettare
altre cellule.
Non è stata identificata alcuna tossina specifica. Le malattie causate da Chlamydia
tendono a cronicizzare, in quanto non sono capaci di evocare una risposta
immunitaria del tutto efficace.
Chlamydia trachomatis
Causa solo infezioni umane. Se ne conoscono 15 di sierotipi, o varianti sierologiche o
serovar, sulla base di differenze antigeniche della proteina principale della membrana
esterna o MOMP: i sierotipi A,B,Ba e C, sono responsabili del tracoma endemico; i
sierotipi D,E,F,G,H,I,J,K sono agenti eziologici di infezioni genitali; i sierotipi
L1,L2,L3 sono agenti eziologici del linfogranuloma venereo LGV.
Cellule della mucosa del tratto respiratorio, dell'uretra, della cervice, dell'endometrio,
delle tube di Falloppio, del retto e della congiuntiva possiedono i recettori per i CE. I
Microbiologia Preston
180
sierotipi LGV, sono invece più invasivi, perché si replicano nei fagociti. Le Chlamydie
si guadagnano l'accesso attraverso minuscole abrasioni o lacerazioni. Nel LGV, le
lesioni si formano nei linfonodi, che drenano il sito dell'infezione primaria; le lesioni
possono diventare necrotiche ed attirare i polimorfonucleati e causare diffusione del
processo infiammatorio ai tessuti circostanti; la rottura del linfonodo porta a formare
ascessi. Le risposte nei sierotipi diversi da LGV, viene stimolata una risposta
infiammatoria vistosa, interessando leucociti, neutrofili e plasmacellule.
Le manifestazioni cliniche delle infezioni di questi batteri sono la distruzione diretta
delle cellule a seguito della moltiplicazione e la stimolazione di una risposta
proinfiammatoria mediante le citochine.
L'infezione non conferisce immunità duratura, ma si osservano reinfezioni e recidive,
con vigorosa risposta infiammatoria.
C.trachomatis è ubiquitario e causa tracoma (cheratocongiuntivite cronica), infezioni
oculo-genitali, polmonite e linfogranuloma venereo LGV. Circa 500 milioni di
persone nel mondo sono state infettate dal tracoma e circa 9 milioni sono diventate
cieche. Il tracoma è endemico in Medio Oriente, Nord Africa ed India ed il principale
serbatoio di infezione sono i bambini. Il tracoma si trasmette prevalentemente
attraverso le lacrime, mani, indumenti contaminati e le mosche, che si poggiano sugli
occhi e trasmettono le secrezioni oculari dagli occhi del bambino infetto a quelli del
bambino sano. Nelle aree endemiche C.trachomatis si riscontra anche a livello
respiratorio e gastrointestinale, quindi il patogeno può essere trasmesso anche per
aerosol respiratorio e contaminazione fecale. Risulta endemico dove sono scarse le
norme igieniche. E' una malattia cronica causata dai sierotipi A,B,Ba e C.
Inizialmente i pazienti hanno una congiuntivite follicolare, con infiammazione diffusa
che coinvolge tutta la congiuntiva. Con la progressione della malattia, le congiuntive
vengono segnate da cicatrici, che causano il ribaltamento verso l'interno delle
palpebre del paziente (retrazione interna della rima palpebrale), che causa lesioni
corneali traumatiche dovute allo sfregamento delle ciglia, che infine esitano in ulcera
corneale, e formazione di un "panno corneale" cicatriziale anche a seguito di
sovrapposizione di infezioni batteriche. La deformità della palpebra può svilupparsi
anche 20-30 anni dopo che è cessata la malattia attiva. Tutto ciò esita in cecità.
Le infezioni genitali nell'uomo, causate da Chlamydia trachomatis, consistono in
uretrite non gonococcica (NGU), uretrite post gonocottica (PGU) e congiuntivite da
inclusioni (o da corpi inclusi o paratracoma). L'uretrite post-gonococcica risulta da
Microbiologia Preston
181
coinfezione di N.gonorrhoeae con C.trachomatis; poiché il periodo di incubazione è più
lungo di quello di Neisseria, e perché l'utilizzo di β-lattamici per il trattamento della
gonorrea non è efficace con le Chlamydie, i sintomi dell'infezione da Chlamydia
compaiono dopo il trattamento della gonorrea. La maggior parte delle infezioni del
tratto genitale delle donne decorre in maniera asintomatica (80%), ma può diventare
sintomatica, con bartolinite, cervicite, endometrite, periepatite, salpingite ed uretrite;
in queste pazienti si osserva una secrezione mucopurulenta. Le pazienti
asintomatiche sono un importante serbatoio.
Negli adulti sessualmente attivi C.trachomatis può causare congiuntivite follicolare
acuta, caratterizzata da secrezione mucopurulenta, cheratite, infiltrati corneali e
talvolta iperemia e danni alla vascolarizzazione corneale.
Le infezioni oculari possono svilupparsi anche in neonati infettati alla nascita. Viene
contratta, al passaggio attraverso il canale del parto, da circa il 25% dei neonati con
madri con infezione genitale attiva. Hanno un periodo di incubazione di 5-12 giorni
dalla nascita, dove la rima palpebrale diventa edematosa ed iperemica, con
abbondante secrezione purulenta. I neonati non trattati sono a rischio di polmonite.
Il periodo di incubazione della polmonite nel neonato è variabile, ma l'esordio
clinico si presenta 2-3 settimane dopo la nascita. Si osserva rinite inizialmente, ma
successivamente una tosse intermittente caratteristica, senza rialzo di febbre. Viene
contratta, al passaggio attraverso il canale del parto, da circa il 10-20% dei neonati da
madri con infezione genitale attiva.
Il linfogranuloma venereo, LGV, è una patologia a trasmissione sessuale. Il batterio
si replica nei fagociti mononucleati del sistema linfatico. Dopo un'incubazione di 1-4
settimane, nel sito di infezione dei pazienti con linfogranuloma venereo , compare
una lesione primaria, papula o ulcera, piccola, non
dolente e che guarisce rapidamente. Osserviamo
un'infiammazione granulomatosa dei linfonodi
regionali. I linfonodi inguinali sono quelli più
comunemente coinvolti, diventando dolenti
bubboni mobili, che si ingrossano e possono
rompersi, formando fistole drenanti. Osserviamo
febbre, brividi, anoressia, cefalea, meningitismo,
dolori muscolari e articolari.
Microbiologia Preston
182
Diagnosi: L'infezione può essere diagnosticata con reperti citologici, sierologici o
colturali; mediante rilevazione diretta dell'antigene nei campioni clinici; mediante
l'impiego di metodiche molecolari. Poiché le Chlamydie sono batteri intracellulari
obbligati, il materiale patologico deve essere prelevato dal sito interessato, quindi
uretra, cervice, retto, orofaringe e congiuntiva. Non sono sufficienti campioni di pus o
essudati uretrali. Le Chlamydie infettano le cellule colonnari e/o squamo-colonnari
perciò dovrebbero essere raccolti campioni endocervicali e non vaginali. Il primo
metodo consiste nell'osservazione al microscopio mediante colorazione di Giemsa,
ma non è raccomandabile. La ricerca degli anticorpi con immunofluorescenza diretta
e immunoenzimatica (ELISA) è utile. I test basati su sonde di acido nucleico sono
eseguiti per mettere in evidenza la presenza di una sequenza specifica rRNA 16S, ma
sono poco sensibili nel rilevare piccole quantità di questo batterio; i test di
amplificazione dell'acido nucleico (NAAT) sono più sensibili. L'isolamento di
C.trachomatis in coltura cellulare è il metodo sicuramente più specifico per la
diagnosi, ma è relativamente poco sensibile se paragonato a NAAT (quest'ultimo ha
sensibilità 98-99%). La ricerca degli anticorpi è utile per LGV, ma non per le altre.
Trattamento: i pazienti con LGV sono trattati con Doxiciclina per 21 giorni.
Eritromicina per bambini con meno di 9 anni, donne in gravidanza e pazienti
intolleranti alle tetracicline. Le infezioni oculari sono trattate con una dose di
Azitromicina o 7 giorni di Doxaciclina. La congiuntivite e la polmonite neonatale
sono trattate con Eritromicina per 10-14 giorni. E' difficile prevenire il tracoma,
perché la popolazione endemica non ha facile accesso all'assistenza medica.
Chlamydophila pneumoniae
E' stata isolata per la prima volta in un bambino di Taiwan, ed è l'agente eziologico di
polmonite TWAR, trasmessa tramite secrezioni respiratorie e non è stato identificato
alcun serbatoio animale. E' un patogeno umano che causa sinusite, faringite,
bronchite e polmonite. La maggior parte delle infezioni sono asintomatiche o lievi e
sono autolimitanti. Le infezioni più gravi coinvolgono un solo lobo polmonare e non
sono distinguibili dalle altre polmoniti atipiche. Può risultare pericolosa per adulti
debilitati e bambini piccoli. Questo batterio infetta e successivamente si replica
all'interno delle cellule muscolari lisce, endoteliali delle coronarie e macrofagi; sono
associate a lesioni aterosclerotiche. La diagnosi è difficoltosa, è attendibile solo
immunofluorescenza (MIF). La Doxiciclina è il trattamento d'elezione.
Microbiologia Preston
183
Chlamidophila psittaci
E' l'agente eziologico della ornitosi umana o Psittacosi. Questa viene trasmessa dal
materiale fecale, anche essiccati di colombi, pappagalli, anatre o tacchini all'uomo.
L'uomo è un ospite "a vicolo cieco" cioè incapace di trasmettere l'infezione.
L'infezione si verifica tramite il tratto respiratorio, dal quale i batteri si diffondono
alle cellule reticoloendoteliali del fegato e della milza. Si moltiplicano in questi siti,
provocando necrosi locale. Si diffondono attraverso il sangue nei polmoni e negli
altri organi, causando risposta infiammatoria negli spazi interstiziali ed alveolari,
infiltrazione di macrofagi, necrosi e talvolta emorragia. I soggetti più a rischio sono i
veterinari, i lavoratori degli zoo, lavoratori dei negozi di animali domestici e gli
addetti alla manipolazione del pollame. Hanno un periodo di incubazione di 2-3
settimane e la patologia si manifesta con cefalea, febbre alta, brividi, malessere e
mialgia. Osserviamo anche tosse non produttiva, rantoli e
addensamenti,epatomegalia, splenomegalia, nausea, vomito, diarrea e frequentemente
il coinvolgimento del SNC, sotto forma di cefalea ed in casi ben più gravi, encefaliti,
convulsioni, coma e morte. La sierodiagnosi ha un valore diagnostico. Le infezioni
sono trattate con successo con Doxiciclina o Macrolidi.
Microbiologia Preston
184





![5\) batteri [modalità compatibilità]](http://s1.studylibit.com/store/data/000928299_1-28a224c15810efb654d8d9e4b207aa31-300x300.png)