Farmaci antivirali
G. Di Bonaventura
Università di Chieti-Pescara
Farmaci antivirali
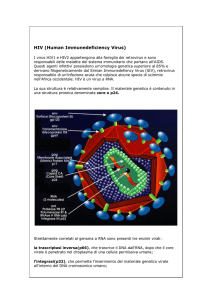
• I farmaci antivirali sono chemioterapici utilizzati per la
terapia di infezioni virali. Analogamente agli antibiotici, gli
antivirali sono caratterizzati da specie-specificità.
• Nonostante siano noti i cicli replicativi e le sequenze
genomiche di gran parte dei virus patogeni per l’uomo,
l’armamentario anti-virale è, a tutt’oggi, scarno poiché il
parassitismo endocellulare obbligato dei virus limita la
tossicità selettiva
• La maggior parte degli antivirali attualmente in
commercio è impiegata nella terapia di HIV, Herpesvirus,
Orthomyxovirus e Hepadnavirus (epatite B)
• E’ in corso un’attività di ricerca volta alla progettazione di
farmaci a spettro più ampio
Farmaci antivirali – sviluppo e princìpi
• Inizialmente, l’individuazione di molecole antivirali avveniva attraverso
blind-screening, basata sull’osservazione degli effetti prodotti dalla
molecola a carico di co-colture (cellule infettate dal virus).
• La prima molecola selezionata fu l’amantadina (Symmetrel, 1960)
molecola anti-influenzale. Per 25 anni, non se ne è conosciuto il
meccanismo di azione.
• Questo approccio, fortemente dispendioso in termini di tempo e risorse, è
stato sostituito, negli anni ’80, da un nuovo approccio (rational drug
design) basato sulla conoscenza del ciclo virale e della struttura
molecolare virale.
• Il concetto generale alla base dello sviluppo di nuove molecole antivirali è
di identificare proteine virali, o parte di esse, necessarie alla
realizzazione del ciclo biologico virale.
• Questi “targets” debbono essere: (i) il più possibile esclusivi dell’unità
virionica, al fine di ridurre la comparsa di effetti collaterali; (ii) comuni alla
maggior parte dei ceppi di un determinato virus, od a specie virali diverse
nell’ambito della stessa famiglia (farmaci ad ampio spettro)
• Una volta identificato il target, le molecole candidate possono derivare da
modificazioni di molecole note, o sono sintetizzate ex-novo a livello
molecolare con l’ausilio di un software dedicato.
• In ogni caso, si ricorre al clonaggio per produrre quantità adeguate di
ciascuna molecola perché possano essere sottoposte a screening rapido
al fine di selezionare le molecole più efficaci.
Farmaci antivirali - strategie
• Le strategie per lo sviluppo razionale di farmaci (“rational drug
design”) prevedono l’attacco ad una specifica fase del ciclo
vitale virale. Questo, sebbene possa variare in dipendenza della
specie virale considerata, è costantemente caratterizzato dalle
seguenti fasi:
–
–
–
–
–
Adesione alla cellula sensibile (adsorbimento)
Rilascio in sede intracellulare di geni virali e dei relativi prodotti (enzimi)
Replicazione dei componenti virali
Assemblaggio dei componenti virali nell’unità virionica
Rilascio di virioni neoformati infettanti
• E’ importante (efficace) interferire con il ciclo nella fase più precoce
possibile.
• Il vaccino, in maniera analoga, allerta il sistema immune
predisponendolo ad una risposta efficace e rapida. I vaccini, tuttavia,
a differenza dei farmaci antivirali sono inefficaci nel trattare i soggetti
già infettati
Interferenza con la fase di ingresso
• L’adsorbimento alla cellula sensibile prevede
l’interazione dell’antirecettore virale con il recettore di
superficie cellulare e l’ingresso nella cellula. I virus con
envelope fondono la loro envelope con la membrana o
penetrano nella cellula all’interno di una vescicola
• Questa fase può essere inibita in due modi:
– 1. Usando una molecola che simuli l’antirecettore (virusassociated protein, VAP) in grado di legarsi al recettore cellulare
(inclusi Ab anti-recettori, Ab anti-VAP e ligandi fisiologici del
recettore)
– 2. Usando una molecola che mimi il recettore cellulare e si
leghi al VAP, (inclusi Ab anti-VAP, recettori estranei e similrecettori sintetici)
• Questa strategia può richiedere costi elevati ed è
caratterizzata da scarse proprietà farmacocinetiche
Interferenza con la fase di ingresso
• Amantadina e Rimantadina sono farmaci
profilattici anti-influenzali, dotati da bassa
tossicità
– interagiscono con la proteina M2
ostacolando l’acidificazione delle vescicole
intracellulari, impedendone così la fusione
con l’involucro virale
• Pleconaril, per il trattamento di
Picornaviridae (Rhinovirus, Enterovirus)
– interagisce con l’antirecettore, a struttura
simile anche tra virus antigenicamente
diversi (teoria del canyon)
• I tentativi di bloccare l’ingresso di HIV nei
linfociti T-helper, interferendo con il legame
virale al recettore CD4 sono stati
fallimentari. Attualmente, si sta cercando di
intervenire a livello del legame virale con il
recettore CCR5.
• Sono attualmente in corso ricerche mirate
all’individuazione di molecole in grado di
bloccare l’ingresso dei virus epatici B e C.
pleconaril
Interferenza sulla replicazione
del genoma virale
•
•
•
•
Una seconda strategia ha come bersaglio la sintesi dei
componenti virali, successivamente all’ingresso nella
cellula ospite
– Analoghi strutturali dei nucleosidi: mimano la
struttura dei nucleosidi, vengono fosforilati e, grazie
alla loro elevata affinità per le polimerasi virusspecifiche, vengono incorporate nella molecola di
DNA/RNA, bloccandone la sintesi
Il primo antivirale di questo tipo è stato la 5-iodio-2’deossiuridina (IUDR) (analogo strutturale della
timidina) utilizzato per il trattamento delle lesioni
corneali causate da HSV
Altro anti-erpetico (profilassi e trattamento) è un
derivato dalla guanosina, la deossiguanosina aciclica
(aciclovir)
– deve essere attivata dalla fosforilazione mediata da
chinasi virus-specifiche presenti ad alte
concentrazioni nelle cellule infette
– altamente selettiva ed estremamente sicura
Derivato dall’aciclovir è il ganciclovir, maggiormente
efficace vs EBV e CMV
Inibitori della trascrittasi inversa
• La conoscenza dell’azione della
retrotrascrittasi (DNA-polimerasi RNAdipendente) ha permesso lo sviluppo di
analoghi nucleosidici per la terapia di HIV
• Il primo farmaco approvato per il trattamento
dell’HIV è la zidovudina (azidotimidina, AZT)
• Lamivudina (3TC), è stata approvata anche
per il trattamento di HBV che usa la
retrotrascrittasi in una fase del ciclo
replicativo
• Foscarnet, in grado di inibire l’incorporazione
di timidina 3-P nel DNA provirale
• Inibitori non nucleosidici, che inibiscono
l’enzima in maniera allosterica (lontano dal
sito attivo):
– nevirapina, efavirenz, delarvidina
Inibitori delle proteasi
• In molte circostanze, le
proteine virali vengono
sintetizzate come poliproteine
che, successivamente,
vengono tagliate da proteasi
virus-specifiche nei singoli
prodotti
• Inibitori delle proteasi
– piccoli peptidi che si legano alla
proteasi ma che non ne
subiscono l’effetto, in virtù di un
modificato legame tra aminoacidi
indinavir
saquinavir
• Inibitori della proteasi di HIV:
indinavir, saquinavir, ritonavir
ritonavir