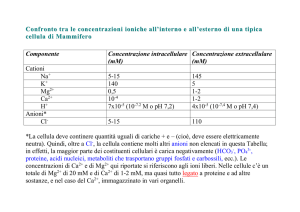
Le membrane biologiche sono
semi-permeabili
La
struttura portante della membrana cellulare è un doppio strato di (fosfo)lipidi
strettamente giustapposti, praticamente impermeabile agli ioni (es. Na+, Cl-) ed
alle molecole polari (es. zuccheri, aminoacidi)
Queste particelle possono attraversare la membrana solo con la mediazione di
speciali proteine transmembranarie, chiamate proteine di trasporto o canali di
membrana.
Le membrane biologiche
sono
semi-permeabili
A) Proteine transmembranarie che agiscono da “carriers” per gli ioni e per molte
molecole organiche.
Tra queste, alcune trasportano le particelle contro-gradiente elettrochimico
(trasporti attivi, primari o secondari).
B) Canali ionici, che consentono un rapido flusso transmembranario (sempre
secondo gradiente elettrochimico) degli ioni inorganici.
I CANALI IONICI
E‟ una famiglia eterogenea di proteine di membrana
capaci di svolgere compiti fondamentali per la vita
della cellula
Non a caso, gran parte dei veleni di serpenti, ragni, scorpioni, pesci,
usati
per difendersi dai predatori o per immobilizzare le prede (per non parlare
dei “veleni” vegetali come il curaro), impediscono la funzione di specifici
canali ionici.
Le mutazioni genetiche, che portano ad un disordine nel funzionamento di un
canale ionico,
hanno conseguenze dannose e spesso disastrose per l‟organismo (canalopatìe).
Molti scommettono che i canali ionici siano il bersaglio molecolare più
promettente per lo
sviluppo di nuovi farmaci.
I CANALI IONICI
Ogni canale ionico è costituito da un certo numero di subunità proteiche
disposte “in cerchio” in modo da delimitare un poro transmembranario
contenente acqua
La struttura dei canali ionici e le proprietà funzionali che ne derivano sono
molto diversificate.
Due aspetti (riconducibili a parti distinte della loro molecola) sono però
particolarmente importanti:
il GATING e la SELETTIVITÀ
CANALI IONICI: CARATTERISTICHE
STRUTTURALI COMUNI
Subunità a più attraversamenti di membrana
Arrangiamento
oligomerico con
simmetria
Le dimensioni del
poro dipendono dal
numero delle
subunià
•Voltage-Dependent •Ligand-Gated
(Ach, Gly, GABA,
(Na+, K+, Ca++)
5-HT)
•Glutamate Receptors
•Mechanosensitive
•Connexins
(Gap Junctions)
I CANALI IONICI: IL GATING
Il poro interno al canale, per effetto delle vibrazioni (“variazioni conformazionali
spontanee”) delle subunità, può passare ciclicamente da uno stato chiuso
(impermeabile agli ioni) ad uno stato aperto in cui gli ioni passano mediamente ad
una velocità di 106/sec [più o meno lo stesso flusso che si avrebbe nella diffusione
libera].
● Il termine GATING (“gate” = porta, cancello) indica il processo per cui un fattore
(o più fattori) privilegia la permanenza di una certa classe di canali nello stato
aperto (o nello stato chiuso).
Le tipologie posso essere:
alcuni canali (canali di “leakage”) restano sempre aperti (“canali senza gating”).
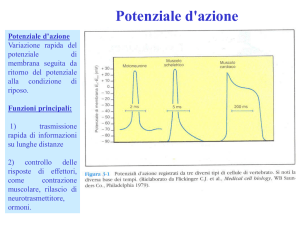
Fisiologia → potenziale di membrana in condizioni di riposo
alcuni vengono aperti dalla distensione della membrana (stretch-channels
o mechanosensitive-channels).
Fisiologia → meccano-recettori, es. corpuscoli di Pacini, cellule ciliate
dell‟orecchio interno, ….
I CANALI IONICI: IL GATING
alcuni (A) vengono aperti (o chiusi) da una variazione del
potenziale transmembranario. Si tratta dei voltage-operated
channels o VOC)
Fisiologia → es. potenziale d’azione (nervoso, muscolare,
cardiaco. ..)
alcuni (B e C) vengono aperti (o chiusi) dal legame di
“mediatori” extracellulari coi rispettivi recettori membranali.
Si tratta dei (receptor-operated [o ligand-operated] channels
o ROC)
In questo caso il “gating” del canale può essere:
• diretto (B), quando il “sito” recettoriale fa parte del
canale (“receptor-channels” o “ionotropic-receptors”)
Fisiologia → es. il recettore “nicotinico” per l‟acetilcolina
della placca neuromuscolare.
• indiretto (C), quando il “sito” recettoriale per il
messaggero extracellulare è situato altrove nella
membrana.
In questo caso il canale viene aperto (o chiuso)
dall‟azione di un
secondo messaggero (o da altri eventi biochimici da
esaminare caso per caso) che agisce sul versante
intracellulare del canale.
Fisiologia → es. i fotorecettori retinici o i recettori olfattori.
Voltage-Dependent Channels: la struttura
Voltage-Dependent Channel: relazione struttura/azione
MECCANISMO D‟ AZIONE DEI CANALI “VOLTAGEDEPENDENT”: L‟ATTIVAZIONE E L‟INATTIVAZIONE
Il canale del Na+ voltaggio dipendente ha due cancelli: di
attivazione e di inattivazione.
Al potenziale di riposo il cancello di attivazione è chiuso
Meccanismo di attivazione dei canali “voltage-dependent”
Le regioni S4 dei canali
contengono amino acidi
carichi che si “muovono” in
risposta ai cambiamenti di
voltaggio. Ciò causa
l‟apertura del canale.
I movimenti nel contesto dell‟S4
generano delle a „gating current‟
misurabili
Mutazioni nell‟S4 che riducano il
numero delle cariche riducono le
“gating current” (diminuiti incrementi
di conduttanza al variare del
voltaggio)
MECCANISMO D‟ AZIONE DEI CANALI “VOLTAGEDEPENDENT”: L‟ATTIVAZIONE E L‟INATTIVAZIONE
In depolarizzazione il
cancello di attivazione si
apre:
Na+ entra (depolarizza) fino
ad inversione della polarità
della membrana (tende al
valore del potenziale di
equilibrio
del Na+)
Il cancello di inattivazione si
chiude.
Un canale inattivato non può
aprirsi.
Inativazione dei canali
modello „ball and chain‟
Inattivazione – i canali impediscono il
passaggio di ioni anche in presenza
di una depolarizzazione. Meccanismo
di „gate‟ differente a quello in fase di
attivazione: “Ball and chain” (non
esclusivo)
Il dominio „ball‟ di trova su
un braccio flessibile del
canale.
Si muove ad occupare il
canale subito dopo la sua
apertura
Inativazione dei canali – modello „ball and chain‟ per i
canali Shaker del K+
Mutazioni che eliminano il dominio
“ball” comportano un‟inappropriata
serie di cicli di apertura del canale
LA vARIETà nei CANALI IONICI
• Permeabilità agli Ioni
Na+
“Upstroke” del potenziale d‟azione
Depolarizzazione rapida durante il potenziale d‟azione
K+
Controllo dell‟eccitabillità / intervalli “interspike”
Depolarizzazione (Ca2+ potenziale d‟azione)
Ca2+
Incrementi nel [Ca2+] intracellulare, e.g. apertura
dei canali K+ Ca2+-dependenti
Cl-
Iperpolarizzazione della cellula
I CANALI IONICI: LA SELETTIVITA‟
● La selettività indica lo ione (o gli ioni) che possono attraversare la membrana
quando il canale si trova nello stato aperto.
alcuni canali sono selettivi (≈) per un’unica specie ionica (es. Na+, K+, Ca2+, Cl-).
Fisiologia → canali di leakage, canali voltaggio-dipendenti e recettori-canale delle
sinapsi inibitorie ( queste sono selettivamente permeabili al Cl-)
alcuni sono selettivi per un gruppo di specie ioniche, tipicamente per i cationi
(o per gli anioni)
Fisiologia → praticamente tutti gli altri canali sono canali cationici (ROC
delle sinapsi eccitatorie, canali dei recettori sensoriali)
Voltage-gated K+ channels
Mediano le correnti di K+ in uscita (outward currents) durante il potenziale d‟azione.
Sono costituiti da 4 copie identiche della proteina canale, arrangiate ad anello a
formare le pareti del canale
Ciascuna subunità presenta 6 α-eliche transmembrana
Il core del canale è dato dalle eliche
5 e 6 e dall‟ansa H5 di ciascuna
delle subunità del canale.
Voltage-gated K+ channels
Le eliche 1-4 fanno da voltage-sensing domain
L‟elica 4 ha un ruolo specifico nelle risposte alla variazione
di voltaggio (assente nei canali al K+ indipendenti da
voltaggio)
Voltage-gated K+ channels: la
selettività
Sono altamente selettivi per il
K+ rispetto al Na+
La selettivita di filtro è collocata nella parte più stretta del
canale
Studi mutazionali mostrano che il segmento H5 è essenziale
per tale selettività
Nell‟H5 è presente una consensus sequence (Thr-Val-Gly-Tyr-Gly)
comune a tutti i canali del K+
Voltage-gated K+ channels: la
selettività
Sn:
visione laterale del
canale
Dx:
visione dallo
spazio extracellulare
• La consensus sequence (nero) forma il filtro selettivo nella
parte più stretta del canale.
• Gli ioni K+ vengono legati all‟interno del filtro selettivo (rosa).
• Il gate del canale si forma nella parte più interna dove le eliche delle 4 subunita si avvicinano ("teepee structure”).
Conformazione chiusa del canale!!!
Voltage-gated K+ channels: la
selettività
Quando il K entra, le molecole d‟acqua
+
che porta con sé vengono “spiazzate”
dagli atomi di ossigeno contenuti nel filtro
di selettività
4 sono i siti di legame per il K+ all‟interno
del filtro, rappresentati da atomi di
ossigeno disposti ad anello. Ciascun
anello include1ossigeno da ciascuna
subunità del canale.
Uno ione K+ interagisce con 8 atomi di
ossigeno
(compreso tra 2 +anelli contigui)
+
Il Na è più piccolo del K ed interagisce con gli atomi di ossigeno solo su
un lato del canale, ciò impedendo la corretta rimozione delle molecole
d‟acqua (necessaria per l‟ingresso nel canale).
Inoltre il K+ è necessario per stabilizzare il filtro di selettività nella sua
conformazione aperta.
La sua sostituzione con il Na+ determina un parziale collasso del canale.
Voltage-gated ca2+ channels
Il Ca2+ riveste un ruolo determinante in diversi processi
cellulari:
• Regolazione genica
• Traduzione del segnale
• Rilascio neurotrasmettitoriale
• Secrezione ormonale
• Potenziali d‟azione Ca2+-dipendenti
• Fertilizzazione
• Morte cellulare (apoptosi)
• Modulazione dell‟attività dei canali ionici
• Accoppiamento eccitazione/contrazione (muscolo)…
VOLTAGE-GATED Ca2+ CHANNELS
Tali canali sono regolati da:
• Fosforilazione (cAMP-dipendente)
• Proteine G (modulazione da complessi
• Ca2+ e complessi Ca2+/CaM
• Proteine effettrici (quali: RyR e SNARE proteins)
VOLTAGE-GATED Ca2+ CHANNELS
VOLTAGE-GATED Ca2+ CHANNELS
Il Controllo della conduzione nei
canali “L-type” per il Ca2+ dipende
dalla funzione delle regioni S5 ed s6
La funzione dei VOLTAGE-dependent ca2+
channels
Le subunità sono componenti citosoliche del canale
necessarie per la corretta collocazione ed il normale
funzionamento delle subunità .
L‟inattivazione del canale dipende da:
•L‟entrata del Ca2+ che determina un‟inattivazione Ca2+dipendente(CDI).
•CDI dipende dal legame costitutivo del canale con la
calmodulina (CaM).
•apoCaM = calmodulin non legata al Ca2+
l‟inattivazione dei VOLTAGE-dependent ca2+
channels
•“IQ motif” nel C-terminus della subunità . Agisce quale
sito effettore per il complesso Ca2+/CaM.
•“EF hand” classico dominio di legame del Ca2+.
•110 amino acidi tra IQ ed EF:
• Peptide A = 1588-1609; lega CaM in assenza di Ca2+
• Peptide C = lega CaM con una k1/2 per il Ca2+ < 90 nM
mutant
wt
l‟inattivazione dei VOLTAGE-dependent ca2+
channels
COOPERATIVITA‟ TRA CANALI IONICI
Voltage-gated Ca2+ channels e Ca2+-activated K+ channels consentono il „burst‟
dei neuroni pacemaker
COOPERATIVITA‟ TRA CANALI IONICI
La conoscenza di questo meccanismo ha aiutato a curare il diabete, una malattia in cui il
sistema di controllo della secrezione di insulina non lavora nel modo corretto. Un
approccio terapeutico (adatto per alcuni pazienti, ma non per altri) è quello di bloccare i
canali del K+ ATP-dipendenti nello stato chiuso (usando farmaci del gruppo della solfonilurea), in tal modo facilitando o promuovendo (depolarizzando la membrana delle cellule β)
il rilascio dell‟insulina.